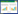文章信息
- 黄献培, 向垒, 尹倩, 赵海明, 喻乐意, 李彦文, 蔡全英, 莫测辉
- HUANG Xian-pei, XIANG Lei, YIN Qian, ZHAO Hai-ming, YU Le-yi, LI Yan-wen, CAI Quan-ying, MO Ce-hui
- 环丙沙星高低累积菜心根际土壤酶活性和微生物学特性差异研究
- Variations in rhizosphere enzymatic activities and microbiological characteristics between high and low ciprofloxacin accumulation cultivars of Brassica campestris L.
- 农业环境科学学报, 2017, 36(6): 1102-1110
- Journal of Agro-Environment Science, 2017, 36(6): 1102-1110
- http://dx.doi.org/10.11654/jaes.2017-0557
文章历史
- 收稿日期: 2017-04-13
环丙沙星(Ciprofloxacin,CIP)是典型的喹诺酮类抗生素,被广泛应用于人类医疗和畜牧业中[1],从而大量进入环境,在土壤和农产品(尤其是蔬菜)中普遍检出,检出量可达数个mg·kg-1 [2-5],严重威胁农产品质量安全和人体健康[6]。植物对抗生素的吸收累积存在显著的品种差异[4, 7-8],筛选和种植污染物低积累作物品种是有效利用污染土壤进行生产并保障农产品质量安全的重要策略,近年来受到广泛关注[9]。我们筛选获得的高、低吸收积累CIP的菜心品种,即油青四九菜心(高积累型菜心,SJ)和油绿粗苔菜心(低积累型菜心,CT),二者在不同浓度水培或土培条件下,地上部(即可食部)CIP含量差异为2.1~10倍[10-11],但这种差异的机理尚未明确。
根际是受植物根系活动影响最强烈的动态微域,也是污染物与植物相互作用的重要场所[12]。目前,针对作物不同品种根际微生态特征(如土壤酶活性、微生物丰富度、多样性等)的研究偏向于其对植物生理生化过程的影响[13-17],而对有机污染物积累差异影响的研究尚鲜见报道。土壤酶在土壤的各种生物化学过程中起着关键的作用,相应酶活的变化反映了某种物质在土壤中的转化情况。土壤微生物活性与蔗糖酶、脲酶、磷酸酶和过氧化氢酶活性息息相关,其中土壤过氧化氢酶可促进过氧化氢自由基分解,是保障生物体免受毒害的主要抗氧化酶,其活性的大小反映了土壤微生物活性被抑制程度的差异;而脲酶作为土壤中氮素循环的关键酶,其活性反映土壤有机态氮向有效态氮的转化能力[18]。环丙沙星作为含氮杂环喹啉羧酸类有机化合物被土壤微生物作为能源参与代谢,脲酶活性的大小反应了土壤中CIP被转换的差异。为此,本文以CIP高、低累积菜心为研究对象,研究二者在CIP胁迫下根际土壤中微生物数量特征(细菌、真菌)、微生物群落结构多样性特征、土壤酶活性(脲酶、过氧化氢酶)特征及其与CIP降解与吸收累积的关系,以期从根际微生态特征差异角度,初步揭示菜心不同品种吸收累积CIP差异的机理。
1 材料与方法 1.1 供试材料供试植物:CIP高、低累积菜心(即油青四九菜心和油绿粗苔菜心)均购自广东省农业科学院蔬菜研究所,发芽率均在95%以上。
供试土样:供试土壤为采自华南农业大学实验农场的玉米地土壤,风干后,过2 mm筛备用。其基本理化性质:pH 7.09,有机质、总氮、总磷含量分别为48.6、4.19、1.03 g·kg-1,未检出CIP。
实验试剂:环丙沙星,其分子式为C17H18FN3O3,分子量为331.35,在水中易溶,在甲醇中微溶,在乙醇中不溶;在25 ℃下的疏水常数实验值(lg Kow)e为-1.698 9;购自德国Dr. Ehrenstorfer公司,纯度>98%。乙腈、甲醇(色谱纯)购自Sigma公司。硝酸镁、氨水、乙酸、苯酚、丙酮、甲醇、乙醇、次氯酸钠、牛肉膏、蛋白胨、琼脂条、孟家拉红、EDTA、氯仿等其他试剂均为分析纯,购自广州化学试剂有限公司,实验用水为去离子水。
1.2 实验方法 1.2.1 盆栽实验设计将不同浓度CIP水溶液(5、20、80 mg·kg-1)加入供试土壤,采用逐步梯度稀释法对供试土样进行制备。即先将不同浓度CIP水溶液混于10%的供试土样,搅拌均匀,再将此10%的供试土样混于剩余的90%供试土样,搅拌均匀,制备获得含3个不同CIP浓度的污染土壤。在正常水分条件下(最大田间持水量的60%)平衡、老化15 d,测定其CIP浓度分别为2.94、10.84 mg·kg-1和67.11 mg·kg-1,记作低、中、高CIP污染处理,其中低污染相当于CIP一般环境浓度,中、高污染则相当于长期大量施用粪肥的重污染区浓度[19]。另以未添加CIP土壤作为空白处理。以瓦盆(底内径15 cm,顶内径23 cm,高25 cm)分别种植CIP高累积品种(SJ)和低积累品种(CT),每盆装土2 kg,种植2株菜心,以未种植菜心处理为对照(记作NP)。种植实验在暨南大学玻璃温室中进行,各浓度处理均设置4个平行,以尿素(100 mg·kg-1)、磷酸二氢钾(80 mg·kg-1)、氯化钾(100 mg·kg-1)作为基肥。种植过程中视土壤干湿情况,加入一定量去离子水。待菜心成熟后(约50 d左右),以抖落法收集根际土壤,进行各项指标测定。
1.2.2 土壤CIP含量测定及质量控制根据课题组前期建立的方法测定土壤CIP含量[20]。为保证实验质量,每间隔10个样品分别测定土壤基质加标样及其平行样各1次。CIP加标回收率在85%~110%之间,平行样标准偏差小于10%,CIP的检出限为0.02 μg·kg-1。
1.2.3 可培养细菌、真菌数量及土壤酶活性测定以系列稀释平板法培养测定高、低累积菜心根际土壤中可培养微生物(细菌和真菌)的数量,同一土壤样品接种3个连续稀释度,各处理重复3次,其中细菌采用牛肉膏蛋白胨培养基培养2 d,真菌采用马丁氏培养基(每升培养基含3.3 mL 1%孟加拉红溶液和3 mL 1%链霉素)培养4 d,培养结束后以菌落计数器计数,单位为CFU·g-1。土壤过氧化氢酶和脲酶分别采用紫外分光光度法和靛酚蓝比色法测定[21],前者以30 min内消耗0.1 mol·L-1高锰酸钾的含量(mL·g-1)表示其活性,后者以24 h内生成氨态氮的含量(NH3-N,mg·g-1)表示其活性。
1.2.4 土壤细菌群落结构DGGE及克隆测序分析采用PCR-DGGE及克隆测序方法分析土壤细菌群落结构多样性,具体方法为:以E.Z.N.A. Soil DNA Kit(USA)试剂盒提取土壤总DNA,以其为模板,并采用通用引物GC-341F(5′CGCCCGCCGCGCGCGGC-GGGGGGCGGGGGCACGGGGGGCCTACGGGAGGCA-GCAG-3′)和534R(5′ATTACCGCGGCTGCTGG-3′)(SANGON,China)进行PCR扩增,扩增反应体系(50 μL)为DNA模板8 μL;Buffer 5 μL;Mg2+ 4 μL;dNTP 4 μL;引物各1.5 μL;Taq酶0.4 μL;去离子水补足至50 μL;扩增反应程序为94 ℃变性7 min,94 ℃变性45 s,52 ℃退火45 s,72 ℃延伸45 s,35个循环,72 ℃延伸10 min,4 ℃保存。PCR反应产物长度约230 bp,采用DGGE-1B驰顺变性梯度凝胶电泳系统对其进行DGGE分析,其中聚丙烯酰胺凝胶浓度为10%,变性剂浓度为40%~60%,每孔上样量为20 μL,电泳电压为80 V,温度60 ℃,电泳时间11 h;电泳结束后,以SYBR GREEN I核酸染料染色,以Quantity one软件照相、获取凝胶图像并进行数字化分析。对特异条带进行切胶回收,以341F和534R为引物进行二次扩增,所得产物采用康为世纪克隆试剂盒进行克隆测序。测序结果在NCBI数据库中进行比对和同源性分析。由于胶孔数量限制,将同一处理的3个重复PCR扩增产物混合后再进行DGGE电泳分析。
1.3 数据分析采用Excel 2010统计数据及绘制图表,用Quantity One软件计算DGGE获得的条带强度、多样性指数等,采用SPSS 19.0进行统计分析,其中多样性指数(H′)和均匀度指数(E)的计算公式分别为:
H′=-ΣPi lnPi,式中Pi =Ni /N
E=H/Hmax
式中:Pi为样品中第i种个体的比例;H为实际观察的物种多样性指数;Hmax为最大的物种多样性指数,Hmax=lnS,S为群落中的总物种数。
实验结果以平均值±标准偏差表示,差异显著水平为P < 0.05。
2 结果与分析 2.1 土壤CIP残留浓度差异盆栽实验结束后,高、低累积菜心根际土壤中CIP浓度均低于未种植处理(表 1),表明种植菜心有利于土壤CIP的降解。高、低累积菜心在低、中污染处理土壤中CIP残留差异不显著,但在高污染时,前者显著低于后者,CIP的降解率分别为48.7%和39.4%,表明高积累菜心根际土壤CIP更易被降解。
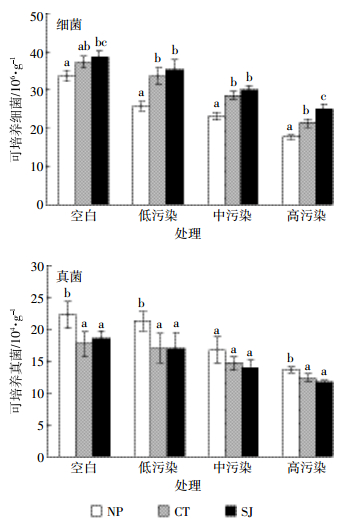
随着CIP污染水平的上升,各处理土壤可培养细菌、真菌数量呈下降趋势(图 1),这与CIP对微生物的抑制作用有关。两种菜心根际土壤中可培养细菌数量显著高于未种植菜心土壤,而可培养真菌数量则显著低于未种植菜心土壤,说明种植菜心有利于细菌生长,但不利于真菌生长。高累积菜心根际土壤可培养细菌数量在高污染水平下显著大于低累积菜心,其他处理则差异不显著。高累积菜心根际土壤真菌数量总体小于低累积菜心,但差异不显著。
|
| NP-未种植菜心,CT-低累积菜心,SJ-高累积菜心;同一处理中含有相同字母者差异不显著(P>0.05)。下同 NP-Non-planting, CT-Low accumulator, SJ-High accumulator. The same letters indicate non-significant difference at 5% level in same treatment. The same below 图 1各处理土壤可培养细菌和真菌数量 Figure 1Colony forming units of cultivable bacteria and fungi in different treatments |
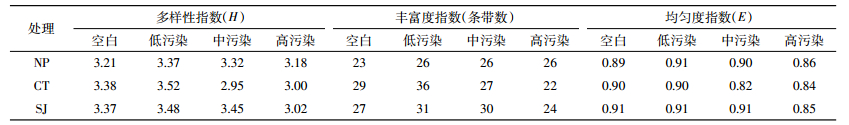
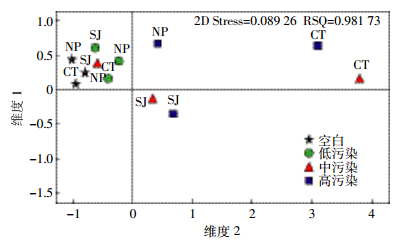
采用PCR-DGGE法研究各处理土壤细菌群落结构差异。在不同CIP处理下,高、低累积菜心根际土壤细菌群落条带均明显高于未种植菜心土壤(图 2),说明种植菜心有利于土壤细菌丰富度的提高。高、低累积菜心根际土壤细菌群落条带数均随CIP污染水平上升而明显下降(24~36条)(表 2),而未种植菜心土壤细菌群落条带数变化不大(23~26条)。低累积菜心根际土壤细菌群落条带数在CIP低污染水平时高于高累积菜心,而在CIP中、高污染水平时低于高累积菜心。应用Quantity One软件对图谱进行数字化分析,计算出各处理土壤细菌的各群落多样性指数(表 2)。各CIP污染水平下,高、低累积菜心根际土壤细菌的多样性指数和丰富度指数总体均高于未种植处理。高积累菜心根际土壤细菌多样性指数和丰富度指数在CIP低污染水平时均略低于低积累菜心,而在CIP中、高污染水平时均高于低积累菜心,说明在CIP胁迫下(尤其高污染水平胁迫下)高积累菜心根际土壤细菌群落的丰富度和多样性更高,这一结果与可培养细菌结果一致。进一步采用多维尺度分析(NMDS)发现(图 3),空白及低CIP污染水平胁迫下,各处理土壤细菌群落均落在相近区域,在中、高污染水平时,各处理土壤细菌群落均分散在不同区域,说明CIP低污染水平胁迫下各处理土壤细菌群落结构差异较小,而在CIP高污染水平胁迫下,两种菜心根际土壤以及未种植菜心土壤三者之间的微生物群落结构存在显著差异。
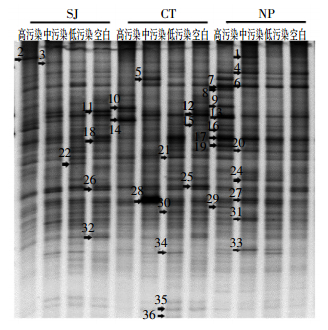
|
| 图 2各处理土壤细菌群落DGGE图谱 Figure 2Profile of DGGE for different treatments |
|
|
| 图 3各处理土壤细菌群落多维尺度分析 Figure 3Profile of NMDS for different treatments |
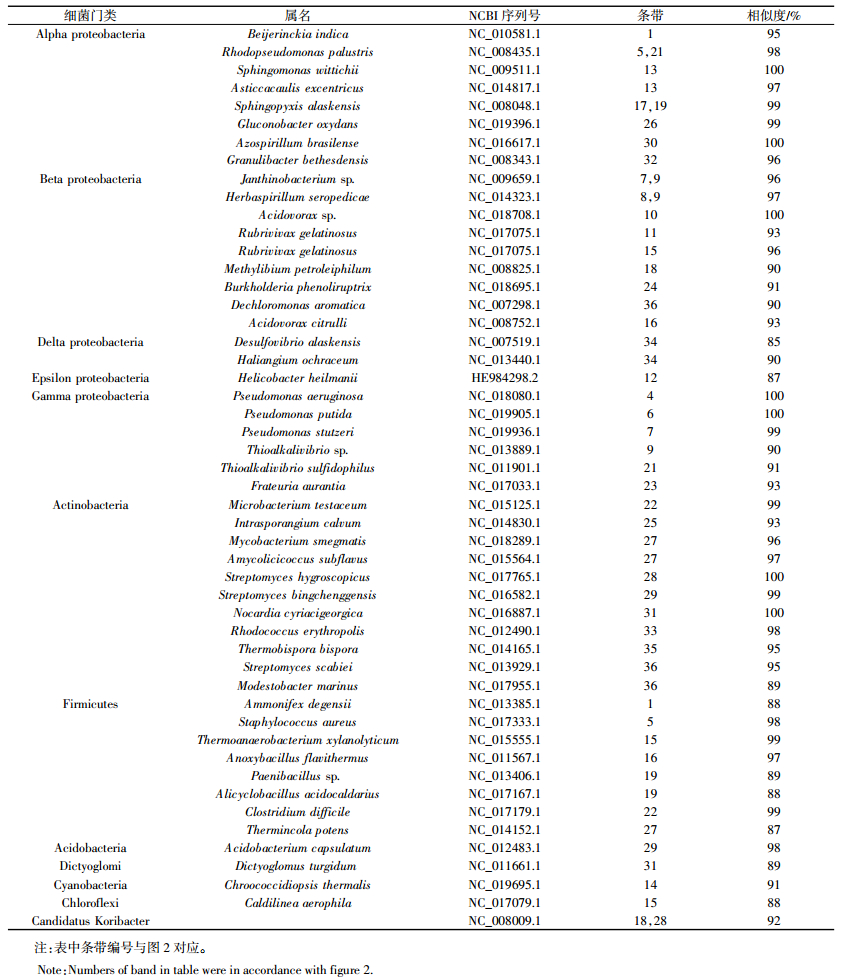
对PCR-DGGE获得的特异性条带进行克隆测序(如图 2中标记),并进行NCBI比对,根据匹配相似度(88%~100%),发现所测各处理条带主要包含于7个菌门(表 3),即变形菌门(Alpha,Beta,Gamma,Epsilon和Delta proteobacteria),放线菌门(Actinobacteria),厚壁菌门(Firmicutes),酸杆菌门(Acidobacteria),网团菌门(Dictyoglomi),蓝藻菌门(Cyanobacteria)和绿弯菌门(Chloroflexi)。其中变形菌门为第一优势菌门,其所占比例达28.6%~73.4%,其次为放线菌门(10.0%~18.0%),其他菌门含量相对较低。优势菌门(变形菌门)中Alpha proteobacteria所占比例最高(9.8%~26.6%),其次为Gamma proteobacteria(4.9%~18.1%)和Beta proteobacteria(3.4%~15.3%),Epsilon proteobacteria( < 13.5%)和Delta proteobacteria( < 2%)相对较少。值得注意的是,高、低累积菜心根际土壤中Alpha proteobacteria和Beta proteobacteria所占比例总体随CIP污染水平的上升而增加,且二者在高积累菜心根际土壤中所占比例总体高于低积累菜心(表 4)。已有报道显示,对CIP具有特异降解功能的细菌主要属于Beta proteobacteria[20]。可见,与低累积菜心相比,种植高累积菜心更有利于提高土壤CIP降解菌所占比例,从而提高其根际土壤CIP降解效率,使其根际土壤CIP浓度比低累积菜心的更低。
本文探讨了CIP胁迫下,这两种酶在各处理土壤中的活性特征(图 4)。结果显示,高、低累积菜心根际土壤脲酶在各处理下均低于未种植菜心土壤,在CIP胁迫处理下差异显著;高累积菜心根际土壤脲酶活性在各处理下均高于低累积菜心,在CIP中、高污染水平处理下差异显著(P < 0.05)。过氧化氢酶在空白和CIP低污染水平下显著低于未种植菜心土壤,而在中、高CIP污染水平处理下则高于未种植菜心土壤,其中高累积菜心处理在中污染水平下显著高于未种植菜心土壤(P < 0.05)。高累积菜心根际土壤中脲酶和过氧化氢酶活性总体上均显著高于低累积菜心根际土壤。对于CIP污染水平的响应,两种酶均存在“低促高抑”的特征。表明在CIP胁迫下,高累积菜心对土壤营养物质(氮)的利用效率高于低累积菜心,高累积菜心处理土壤抗氧化胁迫的能力强于低累积菜心。

|
| 图 4各处理中土壤脲酶和过氧化氢酶活性 Figure 4Activities of urease and catalase in different treatments |
各指标相关性分析发现,CIP污染水平与细菌数量、真菌数量、脲酶活性、过氧化氢酶活性极显著负相关(表 5),表明CIP会抑制土壤中微生物的生长和活性;脲酶活性与细菌数量、真菌数量极显著正相关,表明土壤中氮素的有效转换有利于土壤微生物的生长;脲酶活性与过氧化氢酶活性极显著正相关,表明在CIP胁迫下土壤营养物质(氮)的有效利用有利于其提高抗胁迫能力。

|
作物对污染物的吸收积累不仅存在种间差异,也存在种内差异,即品种差异。我们前期筛选获得对抗生素CIP和邻苯二甲酸脂(PAEs)具有高、低积累的菜心,并从植物生理生化层面探讨了高、低累积作物吸收差异的机理,发现高积累作物品种的抗氧化性能显著强于低积累作物品种,且前者在根系形态、生理特性和解剖结构方面也更有利于捕获CIP或PAEs,故较低积累作物品种呈现高积累的性状特征[10, 22],但针对其根际微生态在吸收累积差异过程中的作用和机理尚不清楚。进入土壤的有机污染物主要通过微生物作用降解去除。种植植物可影响微生物的群落结构,并调节其在土壤中的代谢、转化功能,从而强化其对有机污染物的降解作用;反之,微生物群落系统和功能的改变又可显著影响植物对有机污染物的吸收积累[22]。但目前有关同一作物不同品种及其微生物互作效应对抗生素去除效率的研究尚未见报道。本文发现高累积菜心根际土壤中CIP的去除效率均高于低累积菜心,即高累积菜心根际对CIP去除的效应明显强于低累积菜心。
土壤中细菌数量的增加有利于土壤养分的转化,同时细菌数量的增加在一定程度上会与真菌竞争养分,从而抑制某些病原真菌的数量,进而使根际微生物区系作用更强[24-25]。本文研究发现在CIP胁迫下,高积累菜心根际土壤细菌的数量、群落结构的多样性、丰富度以及优势菌门Alpha proteobacteria和Beta proteobacteria的丰度均高于低累积菜心,即高累积菜心具有更强的根际强化作用(图 1至图 3,表 1、表 2和表 4);虽然真菌的数量低于低累积菜心,这可能因为高累积菜心根际细菌的大量生长与真菌竞争养分,从而抑制了真菌增长;此外,作为CIP降解菌群主要组成部分的Beta proteobacteria的相对丰度的增加[20],更进一步说明高累积菜心根际中细菌对CIP的降解去除效应强于低累积菜心。根际强化作用一般是植物根际与微生物或微生物之间的间接作用[22],本文中高累积菜心根际对CIP污染土壤的微生物具有较好的强化作用,一方面可能是高累积菜心根际微生物提高植物的生理生化功能,从而提高对CIP的吸收累积,另一方面也可能是直接提高CIP降解菌群的数量和丰度,进而提高对CIP的降解消除能力。对于强化过程中起主要功能的微生物种类,特别是不可培养的微生物和功能基因有待进一步研究。
根际土壤酶活性与土壤生物活性息息相关,本文对高、低累积菜心品种根际土壤中抗胁迫酶(过氧化氢酶)和营养酶(脲酶)的分析显示,高累积菜心根际两种酶的活性均高于低累积菜心,且在高CIP污染水平中差异显著,即高累积菜心根际土壤微生物在抗胁迫和利用土壤中营养物质(氮)方面的能力均显著强于低累积菜心,这为高累积菜心高吸收累积CIP和根际土壤降解CIP能力提供了良好的环境。这与我们前期通过水培实验探讨高、低累积菜心抗氧化酶系统的研究结果基本一致[10]。
在CIP的污染水平与微生物数量(细菌和真菌)、脲酶活性、过氧化氢酶活性的相关分析中发现,虽然CIP会显著抑制其生长和活性,但无论是在微生物数量和土壤酶活,还是在细菌群落结构的稳定性方面,高累积菜心根际土壤相比于低累积菜心具有更强的微生物稳定性和生物活性,即在CIP胁迫下,高累积菜心具有更高的抗胁迫性和去除CIP能力。但需要指出的是,除此之外,根系分泌物、根脂成分与含量等也是影响不同植物品种抗胁迫,高、低吸收累积及降解有机污染物的重要因素,这些因素的作用效应和机理还待进一步研究。
4 结论(1)种植高、低累积菜心有利于土壤CIP的降解去除,且高积累菜心根际CIP的降解率高于低积累菜心。
(2)高累积菜心根际土壤细菌数量、细菌群落结构的稳定性、CIP降解优势菌群Beta proteobacteria的丰度以及土壤过氧化氢酶和脲酶的活性均高于低累积菜心,这有利于强化其根际效应,从而提高其吸收累积和根际去除CIP的效率。
| [1] | Karcı A, Balcıoğlu I A. Investigation of the tetracycline, sulfonamide, and fluoroquinolone antimicrobial compounds in animal manure and agricultural soils in Turkey[J]. Science of the Total Environment, 2009, 407(16): 4652–4664. DOI:10.1016/j.scitotenv.2009.04.047 |
| [2] | Wu X L, Xiang L, Yan Q Y, et al. Distribution and risk assessment of quinolone antibiotics in the soils from organic vegetable farms of a subtropical city, Southern China[J]. Science of the Total Environment, 2014, 487: 399–406. DOI:10.1016/j.scitotenv.2014.04.015 |
| [3] | Li X W, Xie Y F, Wang J F, et al. Influence of planting patterns on fluoroquinolone residues in the soil of an intensive vegetable cultivation area in Northern China[J]. Science of the Total Environment, 2013, 458: 63–69. |
| [4] | Li X W, Xie Y F, Li C L, et al. Investigation of residual fluoroquinolones in a soil-vegetable system in an intensive vegetable cultivation area in Northern China[J]. Science of the Total Environment, 2014, 468: 258–264. |
| [5] | 吴小莲, 向垒, 莫测辉, 等. 长期施用粪肥蔬菜基地蔬菜中典型抗生素的污染特征[J]. 环境科学, 2013, 34(6): 2442–2447. WU Xiao-lian, XIANG Lei, MO Ce-hui, et al. Concentrations of antibiotics in vegetables from manure-mended farm[J]. Environmental Science, 2013, 34(6): 2442–2447. |
| [6] | Xu Y, Yu W, Ma Q, et al. Occurrence of (fluoro)quinolones and (fluoro) quinolone resistance in soil receiving swine manure for 11 years[J]. Science of the Total Environment, 2015, 530: 191–197. |
| [7] | 尹倩, 黄献培, 李彦文, 等. 不同基因型空心菜对环丙沙星及恩诺沙星的吸收累积特征[J]. 农业环境科学学报, 2013, 32(2): 407–408. YIN Qian, HUANG Xian-pei, LI Yan-wen, et al. Accumulation features of ciprofloxacin and enrofloxacin by different genotypes of water spinach[J]. Journal of Agro-Environment Science, 2013, 32(2): 407–408. |
| [8] | 雷清毅. 菜心对四环素类抗生素吸收累积的基因型差异研究[D]. 广州: 暨南大学, 2012. LEI Qing-yi. Uptake and accumulation of tetracycline antibiotic in different genotypes brassica[D]. Guangzhou: Jinan University, 2012. |
| [9] | Cai Q Y, Mo C H, Zeng Q Y, et al. Potential of ipomoea aquatica cultivars in phytoremediation of soils contaminated with di-n-butyl phthalate[J]. Environmental and Experimental Botany, 2008, 62(3): 205–211. DOI:10.1016/j.envexpbot.2007.08.005 |
| [10] | 严青云, 向垒, 吴小莲, 等. 环丙沙星高、低累积菜心(Brassica campestris L.)抗氧化性能的差异[J]. 环境科学学报, 2216, 36(7): 2694–2700. YAN Qing-yun, XIANG Lei, WU Xiao-lian, et al. Difference of anti-oxidation activities in Chinese flowering cabbages(Brassica campestris L.) with high and low accumulation of ciprofloxacin[J]. Acta Scientiae Circumstantiae, 2216, 36(7): 2694–2700. |
| [11] | 吕旋, 向垒, 李彦文, 等. 环丙沙星-镉复合污染对高低累积型菜心种子发芽的影响[J]. 农业环境科学学报, 2014, 33(4): 819–820. LÜ Xuan, XIANG Lei, LI Yan-wen, et al. Influences of ciprofloxacin-cadmium combined pollution on seed germination and seedling growth of ciprofloxacin high-and low-acumulating Brassica parachinensis[J]. Chinese Journal of Applied Ecology, 2014, 33(4): 819–820. DOI:10.11654/jaes.2014.04.029 |
| [12] | Tejeda-Agredano M C, Gallego S, Vila J, et al. Influence of the sunflower rhizosphere on the biodegradation of PAHs in soil[J]. Soil Biology & Biochemistry, 2013, 57: 830–840. |
| [13] | Pii Y, Penn A, Terzana R, et al. Plant-microorganism-soil interactions influence the Fe availability in the rhizosphere of cucumber plants[J]. Plant Physiology and Biochemistry, 2015, 87: 45–52. DOI:10.1016/j.plaphy.2014.12.014 |
| [14] | Marques J M, da Silva T F, Vollu R E, et al. Plant age and genotype affect the bacterial community composition in the tuber rhizosphere of field-grown sweet potato plants[J]. FEMS Microbiology Ecology, 2014, 88(2): 424–435. DOI:10.1111/fem.2014.88.issue-2 |
| [15] | Rodríguez-Blanco A, Sicardi M, Frioni L. Plant genotype and nitrogen fertilization effects on abundance and diversity of diazotrophic bacteria associated with maize(Zea mays L.)[J]. Biology and Fertility of Soils, 2015, 51(3): 391–402. DOI:10.1007/s00374-014-0986-8 |
| [16] | 张世伟, 钟其顶, 孟镇, 等. 不同品种酿酒葡萄根围、叶围微生物群落结构特点解析[J]. 微生物学通报, 2016, 43(11): 2448–2455. ZHANG Shi-wei, ZHONG Qi-ding, MENG Zhen, et al. Characteristics of bacterial communities in rhizosphere and phyllosphere of wine grape plants[J]. Microbiology China, 2016, 43(11): 2448–2455. |
| [17] | 王戈, 杨焕文, 赵正雄, 等. 不同抗性烤烟品种根际微生物数量及多样性差异研究[J]. 植物营养与肥料学报, 2012, 18(2): 451–458. WANG Ge, YANG Huan-wen, ZHAO Zheng-xiong, et al. Microbe quantity and functional diversity in rhizospheres of different cultivars of flue-cured tobacco[J]. Plant Nutrition and Fertilizer Science, 2012, 18(2): 451–458. DOI:10.11674/zwyf.2012.11257 |
| [18] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986. GUAN Song-yin. Soil enzyme and its study method[M]. Beijing: Agriculture Press, 1986. |
| [19] | 王霜, 邓良伟, 王兰, 等. 猪场粪污中重金属和抗生素的研究现状[J]. 中国沼气, 2016, 34(4): 25–33. WANG Shuang, DENG Liang-wei, WANG Lan, et al. The heavy metals and antibiotics in swine manure:A review[J]. China Biogas, 2016, 34(4): 25–33. |
| [20] | 邰义萍, 莫测辉, 李彦文, 等. 长期施用粪肥土壤中喹诺酮类抗生素的含量与分布特征[J]. 中国环境科学, 2010, 30(6): 816–821. TAI Yi-ping, MO Ce-hui, LI Yan-wen, et al. Concentration and distribution of quinolone antibiotics in long-term manure-amended soils[J]. China Environmental Science, 2010, 30(6): 816–821. |
| [21] | Liao X B, Li B X, Zou R S, et al. Biodegradation of antibiotic ciprofloxacin:Pathways, influential factors, and bacterial community structure[J]. Environmental Science Pollution Research, 2016, 23(8): 7911–7918. DOI:10.1007/s11356-016-6054-1 |
| [22] | Zhao H M, Du H, Xiang L, et al. Physiological differences in response to di-n-butyl phthalate(DBP) exposure between low-and high-DBP accumulating cultivars of Chinese flowering cabbage(Brassica camp-estris L.)[J]. Environment Pollution, 2016, 208: 840–849. DOI:10.1016/j.envpol.2015.11.009 |
| [23] | 蔺中, 杨杰文, 蔡彬, 等. 根际效应对狼尾草降解土壤中阿特拉津的强化作用[J]. 农业环境科学学报, 2017, 36(3): 531–538. LIN Zhong, YANG Jie-wen, CAI Bin, et al. Enhancement of atrazine degradation in soils caused by rhizosphere effects of pennisetum[J]. Journal of Agro-Environment Science, 2017, 36(3): 531–538. DOI:10.11654/jaes.2016-1313 |
| [24] | 张云伟, 徐智, 汤利, 等. 不同有机肥对烤烟根际土壤微生物的影响[J]. 应用生态学报, 2013, 24(9): 2551–2556. ZHANG Yun-wei, XU Zhi, TANG Li, et al. Effects of different organic fertilizers on the microbes in rhizospheric soil of fluecured tobacco[J]. Chinese Journal of Applied Ecology, 2013, 24(9): 2551–2556. |
| [25] | 袁英英, 李敏清, 胡伟, 等. 生物有机肥对番茄青枯病的防效及对土壤微生物的影响[J]. 农业环境科学学报, 2011, 30(7): 1244–1350. YUAN Ying-ying, LI Min-qing, HU Wei, et al. Effect of biological organic fertilizer on tomato bacterial wilt and soil microorganism[J]. Journal of Agro-Environment Science, 2011, 30(7): 1244–1350. |
 2017, Vol. 36
2017, Vol. 36