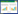文章信息
- 王晓丹, 向垒, 陈晓红, 陈学斌, 莫测辉, 蔡全英
- WANG Xiao-dan, XIANG Lei, CHEN Xiao-hong, CHEN Xue-bin, MO Ce-hui, CAI Quan-ying
- 水稻土及其提取腐植酸组分对邻苯二甲酸二丁酯(DBP)的吸附解吸研究
- Sorption and desorption of Di-n-butyl phthalate(DBP) on paddy soils and humic acid
- 农业环境科学学报, 2017, 36(6): 1111-1117
- Journal of Agro-Environment Science, 2017, 36(6): 1111-1117
- http://dx.doi.org/10.11654/jaes.2017-0224
文章历史
- 收稿日期: 2017-02-26
2. 广东省环境污染控制与修复材料工程中心, 广州 510632
2. Guangdong Provincial Research Center for Environment Pollution Control and Remediation Materials, Guangzhou 510632, China
邻苯二甲酸酯(PAEs)是一类常见的塑料增塑剂和软化剂,被广泛应用于塑料、化妆品、润滑剂和农药等行业,从而不断进入环境。PAEs具有环境内分泌干扰效应,其中6种PAEs化合物被我国环境监测总站和美国国家环保局(USEPA)列为“优控污染物”[1-2]。我国土壤中普遍检出PAEs,其含量通常为μg·kg-1至mg·kg-1水平[1-5],部分工农业区土壤已遭受PAEs不同程度污染。其中广东省农业土壤中PAEs含量高于我国其他省市(福建和新疆除外)[1],而且广东省不同土地利用类型中6种“优控”PAEs总含量依次为水田 > 香蕉地 > 菜地 > 甘蔗地 > 果园地[5]。6种“优控”PAEs化合物中,邻苯二甲酸二丁酯(DBP)和邻苯二甲酸双(2-乙基己基)酯(DEHP)含量较高,普遍高于其他PAE化合物含量,并超过美国环保局控制标准[1, 5]。土壤中的PAEs可显著影响微生物群落结构与功能[6],并被农作物(蔬菜、水稻)吸收积累[7-9],进而通过食物链威胁人体健康[9]。
污染物在土壤中的吸附和解吸行为显著影响其在土壤中的迁移性、降解性及生物有效性[10-11]。国内外在沉积物、矿物材料、活性炭及生物炭等吸附PAEs化合物方面开展了大量研究[12-17],但对土壤及其组分吸附PAEs的研究相对较少[18-19]。已有研究显示,土壤有机质是影响PAEs吸附解吸行为的关键因素[17]。腐殖质是土壤中重要的有机质成分,其含量可占土壤有机质总量的50%~90%[4]。作为土壤腐殖质的重要组分,腐植酸具有无定型的疏松结构,含有丰富的含氧官能团,对有机污染物的吸附解吸行为起重要作用[20]。因此,本文以土壤中检测频率和含量均较高的DBP为目标污染物,通过吸附-解吸批处理试验,研究水稻土及其提取腐植酸组分对DBP的吸附-解吸行为,并探讨有机质对其吸附性能的影响,以期阐明二者对DBP的吸附/解吸过程和机理。研究结果可为土壤中PAEs环境行为、生态风险评价及污染控制等提供科学依据。
1 材料与方法 1.1 实验材料邻苯二甲酸二丁酯(DBP)分子量为278.35,水溶解度为11.2 mg·L-1,购自Aladdin中国上海分公司,纯度>99%;甲醇为色谱纯,购自江苏永华化学科技有限公司。其余试剂包括盐酸、焦磷酸钠、氯化钙、叠氮化钠均为分析纯,购自天津大茂化学试剂厂。实验用水为高纯水。
供试水稻土为未受DBP污染的稻田表层土壤(0~20 cm),采自华南农业大学实验农场。土壤经风干、粉碎、过2 mm筛后于4 ℃保存备用。水稻土中腐植酸的提取参照前人方法[21],具体为:湿筛、重力沉降、离心(8000 r·min-1,10 min)获取含有腐植酸的土壤溶液,再用HCl将pH调至1~2,获得悬浊液,进一步离心(8000 r·min-1,10 min)分离后获得腐植酸。土壤及其腐植酸组分的理化性质,包括pH值、有机质含量、阳离子交换量(CEC)和全磷等参考《土壤农业化学分析方法》测定[22],结果见表 1。
参考OECD批平衡方法[23]研究水稻土及其腐植酸组分对DBP的吸附-解吸行为。分别称取供试水稻土和腐植酸0.500 g置于25 mL聚四氟乙烯离心管中,加入25 mL一定浓度的DBP甲醇储备液(甲醇含量低于0.1%),溶液含0.01 mol·L-1的CaCl2(维持离子浓度)和200 mg·L-1的NaN3(抑制微生物),进行恒温(25±1 ℃)振荡(200 r·min-1),以8000 r·min-1离心5 min,取上清液,测定其DBP浓度。研究吸附动力学特征时,DBP初始浓度设定为12 mg·L-1,温度为25 ℃,分别于5 min和0.5、1、2、4、8、16、24、48、84、120、168 h取样,测定上清液中DBP浓度,并根据吸附前后上清液DBP浓度差计算水稻土及其腐植酸组分对DBP的吸附量。研究热力学特征时,DBP初始浓度分别为1、2、4、6、8、12 mg·L-1,振荡时间分别为48 h(水稻土)和24 h(腐植酸)(动力学实验表明,该振荡时间可保证吸附达到平衡),分别研究不同温度条件下(15、25、35 ℃)供试水稻土及其腐植酸组分对DBP的吸附等温线。其中,DBP浓度(1~12 mg·L-1)主要根据其水溶解度( < 12 mg·L-1)以及参考文献中的浓度进行设置(0.97~11.69 mg·L-1或1~15 mg·L-1)[13, 24]。
解吸试验在25 ℃条件下进行,具体步骤为:土壤及其腐植酸组分在初始浓度分别为1、2、4、6、8、12 mg·L-1的DBP溶液中达到吸附平衡后,弃去上清液,加入含有0.01 mol·L-1 CaCl2和200 mg·L-1 NaN3的25 mL水溶液进行解吸,解吸时间为72 h(预试验显示该时间均满足各处理达到解吸平衡),之后离心(8000 r·min-1,5 min)取上清液,测定DBP浓度,并计算土壤及腐植酸组分中DBP的含量。以上吸附-解吸各处理均设置3个平行。同时设置不含土壤或腐植酸的DBP溶液(与吸附-解吸处理浓度一致)进行对照试验以评价试验过程中DBP因挥发、降解及瓶壁吸附等造成的损失。
1.2.2 溶液中DBP的测定方法取离心后的上清液过0.22 μm滤膜,于4 ℃下保存备测。采用液相色谱系统配二极管阵列检测器(DVD)(1100,Agilent,美国)测定溶液中DBP含量,其色谱柱为Agilent Hypersil ODS,250 mm×4 mm,流动相为甲醇和超纯水(V/V=80/20),流速为1 mL·min-1,柱温为25 ℃,检测波长为242 nm,进样量为10 μL。上述条件下,DBP的保留时间为4.8 min,最低检出浓度为0.02 mg·L-1。采用外标法定量检测DBP,各处理平行样标准偏差低于10%,样品加标回收率为88%~94%,质量平衡率为86%~91%,吸附、解吸试验中DBP因挥发、降解及瓶壁吸附等的损失率低于10%。
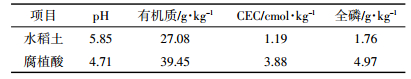
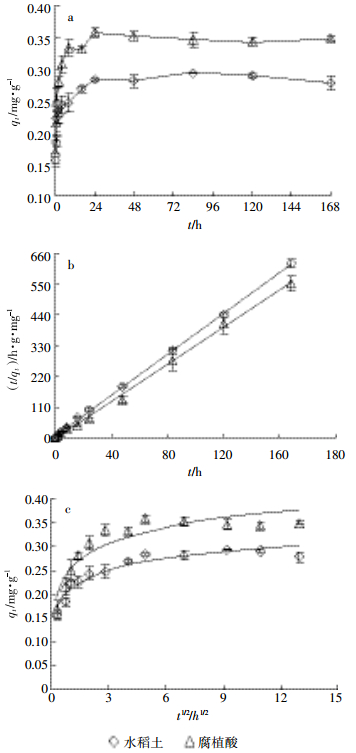
2 结果与讨论 2.1 吸附动力学研究水稻土及其腐植酸组分对DBP的吸附呈现两个阶段,即快速吸附阶段和慢速吸附阶段(图 1a)。在快速吸附阶段,水稻土(0~2 h)和腐植酸(0~8 h)对DBP的吸附速率快,吸附量在短时间内迅速增加;随着反应时间增长,水稻土(2~48 h)和腐植酸(8~24 h)对DBP的吸附速率和吸附增量均明显下降。在48 h(水稻土)和24 h(腐植酸)后,二者对DBP的吸附达到平衡状态。上述两阶段吸附过程与黏土[14]、红壤与褐土[19]、腐植酸[4]吸附DBP的动力学过程一致。拟合水稻土及腐植酸对DBP的吸附过程,发现二者均满足拟二级动力学方程(R2>0.997),见式(1):
 (1)
(1) 式中:t为反应时间,h;qt为t时刻的吸附量,mg·g-1;qe为平衡吸附量,mg·g-1;k2为拟二级动力学吸附速率常数,h·mg·g-1。拟合结果(图 1b)表明,水稻土及其腐植酸组分对DBP(12 mg·L-1)的平衡吸附量分别为0.272 mg·g-1和0.301 mg·g-1。
|
|
a.土壤吸附量随时间的变化曲线The sorption amounts of soil and humic acid with time b.拟二级动力学方程拟合曲线The fitting curves based on the pseudosecond-order kinetics equation c.颗粒内扩散方程拟合曲线The fitting curves based on the intra-particle diffusion model 图 1DBP在水稻土及其腐植酸组分中的吸附动力学特征 Figure 1Sorption kinetics of DBP in the paddy soil and humic acid |
为进一步研究DBP在水稻土及其腐植酸组分中的吸附动力学机理,采用颗粒内扩散方程(式2)进行拟合。
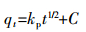 (2)
(2) 式中:kp为颗粒内扩散速率常数,mg·g-1·h-1/2;C为常数,mg·g-1。
由图 1c可知,水稻土及其腐植酸组分吸附DBP的拟合结果前段呈曲线,而后段呈直线,指示二者对DBP的吸附先以表面扩散吸附过程为主,后以颗粒内扩散吸附过程为主[16],这与DBP吸附动力学过程呈现的两阶段现象相符。反应初期,DBP分子主要在土壤表面吸附位点进行表面吸附,吸附速率快,呈现快速吸附阶段;随着吸附位点的减少,DBP吸附速率减慢,DBP分子主要通过颗粒内扩散过程吸附,吸附呈现慢速吸附阶段[4, 19]。与腐植酸相比,水稻土的吸附速率相对较慢,而平衡时间则较长,这与二者的结构和性质差异有关。一般而言,土壤含有黏土矿物成分,而腐植酸主要以有机质为主,故前者吸附DBP过程中发生颗粒内扩散的阶段长于后者(即图 1c曲线的直线)。同时DBP在土壤中进行颗粒内扩散过程时,黏土矿物的层间结构可形成空间位阻[25],减慢其吸附速率,因此,DBP在水稻土中显示出较慢的吸附速率和较长的平衡时间。
2.2 吸附热力学研究采用Freundlich方程(式3)拟合不同温度条件下(15、25、35 ℃)水稻土及其腐植酸组分对DBP的吸附等温线。
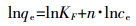 (3)
(3) 式中:KF为反映单位吸附剂吸附容量的常数,(mg·g-1)/(mg·L-1)n,其值越大,吸附能力越强;n为描述等温线线性程度的参数,若n=1,等温线为线性,若n≠1,等温线为非线性。
拟合结果(图 2和表 2)显示,不同温度条件下,土壤及其腐植酸组分吸附DBP的等温线均满足Freundlich方程,相关系数(R2)为0.901~0.998。其中腐植酸组分吸附DBP的KF值为0.081~0.176(mg·g-1)/(mg·L-1)n,是其对应水稻土KF值的3~4倍。可见,腐植酸吸附DBP的能力显著强于水稻土,其是水稻土中吸附DBP的重要成分。值得注意的是,二者吸附DBP的KF值均随温度升高而增大,指示温度升高有利于水稻土及其腐植酸组分吸附DBP。根据Freundlich拟合方程并由式(4)~(6)计算吉布斯自由能(ΔG)、焓变(ΔH)及熵变(ΔS)。
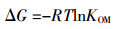 (4)
(4) 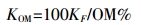 (5)
(5) 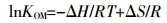 (6)
(6) 式中:R为摩尔气体常数,8.314 J·mol-1·k-1;T为绝对温度,K;OM%为土壤有机质含量。

|
| 图 2DBP在水稻土及其腐植酸组分中Freundlich方程拟合等温线 Figure 2Freundlich sorption isotherms of DBP in the paddy soil and humic acid under different temperature |

|
不同温度下水稻土及其腐植酸组分吸附DBP的ΔG值均小于零,且ΔS和ΔH值均大于零,指示二者对DBP的吸附均为熵增的自发吸热过程[26],这就解释了二者吸附DBP能力随温度增加而升高的原因。同时,除ΔH外,腐植酸组分吸附DBP的ΔG、ΔS值均高于原水稻土,这就从热力学角度解释了腐植酸组分吸附DBP的能力大于水稻土的原因。此外,由于ΔH绝对值介于8~40 kJ·mol-1,表明水稻土及腐植酸对DBP的吸附为氢键作用力介导的物理吸附过程[4]。为进一步验证水稻土及其腐植酸组分吸附DBP的类型,采用Dubinin-Radushkevich方程(D-R方程)拟合吸附等温线数据,并计算平均吸附能(E),当0 < E < 8 kJ·mol-1时,吸附为物理吸附,当8 < E < 16 kJ·mol-1时,吸附为化学吸附[27]。D-R方程及E值的计算公式见式(7)和式(8):
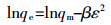 (7)
(7) 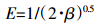 (8)
(8) 式中:qe为平衡吸附量,mg·g-1;qm为最大吸附量,mg·g-1;β是与E有关的活度系数,mol2·J-2;ε为Polanyi系数,ε=RTln(1+1/Ce)。
D-R方程的拟合结果显示水稻土及其腐植酸组分吸附DBP的R2为0.705~0.950。虽然其相关系数低于Freundlich方程,但用于计算E值仍是可以接受的[27]。计算结果显示,水稻土及其腐植酸组分吸附DBP的E值为1.291~2.236 kJ·mol-1,低于8 kJ·mol-1,这进一步证明了二者对DBP的吸附为物理吸附。需要说明的是,一般而言,有机物在土壤中的吸附是一个自发、放热、熵减的物理过程,但本文实验结果与此相反,这可能与吸附过程涉及的颗粒内扩散作用有关。在吸附过程中DBP通过颗粒内扩散作用增加了其分子的自由度,而扩散过程中则需要消耗能量以克服空间位阻等,所以其吸附过程呈现熵增和吸热,这与前人研究改性XAD-4树脂[28]以及活性炭[15, 29]对DBP吸附的结果一致。
2.3 水稻土及其腐植酸组分对DBP吸附性能比较土壤有机碳分配系数(Koc)是衡量土壤吸附污染物能力的重要指标,其值越大,土壤对污染物的吸附能力越强[30]。可通过式(9)计算Koc值[10, 31]:
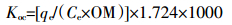 (9)
(9) 式中:Koc为土壤有机碳分配系数,mL·g-1;OM为有机质含量,g·g-1;1.724为土壤有机碳与其有机质的转换系数,1000为体积单位转换系数。
取平衡浓度Ce分别为1、12 mg·L-1(分别相当于DBP的环境浓度及其溶解浓度)计算不同温度条件下水稻土及其腐植酸组分吸附DBP的Koc值。计算结果显示(表 3),不同温度及平衡浓度下,水稻土吸附DBP的Koc值(524~3565 mL·g-1)均小于其腐植酸组分(925~7691 mL·g-1),这进一步说明前者对DBP的吸附性能低于后者。土壤理化性质尤其是有机质含量是影响其对有机污染物吸附的重要因素,一般而言,当土壤有机碳含量大于0.1%时,土壤有机质在吸附有机污染物中占主导作用[32]。供试水稻土及其腐植酸组分有机质含量(1.57%~2.29%)均大于0.1%,二者对DBP的吸附均以有机质吸附为主,故有机质含量更高的腐植酸组分吸附性能更强,这与前人研究结果一致[11, 13]。另外,DBP自身的结构也是影响其吸附性能的重要因素。DBP为含有两个酯基及一个苯环的酯类化合物,其可通过π-π键、氢键以及疏水力等与土壤有机质相互作用,并发生吸附。因此,富含多种有机官能团(如醇羟基、酚羟基、酮类等)的腐植酸可为DBP提供较多的作用位点[4],并显示出更大的吸附容量。目前尚缺乏DBP的环境评价标准,故本文依据《化学农药环境安全评价试验准则》[33]中的方法对DBP的吸附能力做出评价。该准则按Koc(mL·g-1)的大小将污染物的吸附性能分为五个等级:易吸附型(Koc > 20 000),较易吸附型(5000 < Koc≤20 000),中等吸附型(1000 < Koc≤5000),较难吸附型(200 < Koc≤1000)和难吸附型(Koc≤200)。因此,在环境浓度条件下(1 mg·L-1),DBP在水稻土及其腐植酸组分中为中等吸附型和较易吸附型污染物,随着浓度增加,在饱和浓度条件下(12 mg·L-1),DBP在二者中为较难吸附型和中等吸附型污染物。
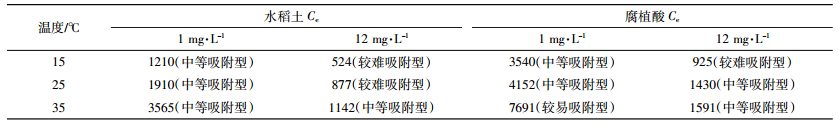
|
为探讨DBP在水稻土及其腐植酸组分中的解吸行为,研究了25 ℃条件下二者对DBP的解吸等温线,发现二者解吸过程也均符合Freundlich方程(R2>0.87),见图 3。采用滞后系数HI[34]评价水稻土及其腐植酸组分解吸DBP过程的滞后程度。HI的计算方程见式(10)。
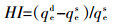 (10)
(10) 式中:qes、qed分别为在一定温度和平衡浓度条件下,吸附和解吸过程中吸附在固相上的吸附质浓度。

|
| 图 3DBP在水稻土及其腐植酸组分中的Freundlich方程拟合解吸等温线(25 ℃) Figure 3Freundlich desorption isotherm of DBP in the paddy soil and humic acid(25 ℃) |
一般而言,当HI≤0时,解吸滞后现象不显著,当HI > 0,解吸滞后现象显著。25 ℃条件下,不同平衡浓度时(1~12 mg·L-1)水稻土及其腐植酸组分对DBP的HI值分别为-0.17~1.54及0.14~-0.45(表 4)。对水稻土而言,除1 mg·L-1浓度下HI值小于0外,其余浓度条件下HI值均大于0;而腐植酸的HI值则相反,几乎所有浓度条件下HI值均小于0,且在相同浓度下,水稻土的HI值普遍高于腐植酸组分,说明DBP在水稻土中的解吸存在明显的滞后现象,而在腐植酸组分中解吸滞后不显著,显示DBP在腐植酸组分中的吸附较不稳定,更易于释放到外界环境中,造成风险。水稻土对DBP的解吸过程存在滞后现象,则可能与其所含黏土矿物层间结构对DBP解吸造成空间位阻有关[25]。
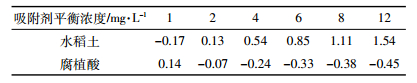
|
(1)水稻土及其腐植酸组分对DBP的吸附分别在48 h和24 h内达到吸附平衡,吸附动力学均符合拟二级动力学方程,控速过程涉及表面扩散和颗粒内扩散过程。
(2)水稻土及其腐植酸组分对DBP的吸附符合Freundlich方程,属于熵增的自发吸热物理吸附过程,其中腐植酸组分对DBP的吸附性能强于水稻土,这与其有机质含量高有关。
(3)25 ℃时二者对DBP的解吸也符合Freundlich方程,其中水稻土对DBP的解吸存在明显滞后现象,但其腐植酸组分滞后现象不显著,其吸附的DBP较易再次释放。
| [1] | Niu L L, Xu Y, Xu C, et al. Status of phthalate esters contamination in agricultural soils across China and associated health risks[J]. Enviro-nmental Pollution, 2014, 195: 16–23. DOI:10.1016/j.envpol.2014.08.014 |
| [2] | 鲁磊安, 陈学斌, 赵海明, 等. 珠三角地区稻田土壤和谷粒中邻苯二甲酸酯(PAEs)的分布特征及人体健康暴露风险[J]. 农业环境科学学报, 2016, 35(7): 1242–1248. LU Lei-an, CHEN Xue-bin, ZHAO Hai-ming, et al. Distribution of phthalic acid esters(PAEs) in paddy soil and grains of rice in the Pearl River Delta region and the health risk assessment[J]. Journal of Agro-Environment Science, 2016, 35(7): 1242–1248. DOI:10.11654/jaes.2016.07.003 |
| [3] | 蔡全英, 莫测辉, 李云辉, 等. 广州、深圳地区蔬菜生产基地土壤中邻苯二甲酸酯(PAEs)研究[J]. 生态学报, 2005, 25(2): 284–287. CAI Quan-ying, MO Ce-hui, LI Yun-hui, et al. The study of PAEs in soils from typical vegetable fields in areas of Guangzhou and Shenzhen, South China[J]. Acta Ecologica Sinica, 2005, 25(2): 284–287. |
| [4] | Gao M L, Gong X L, Lü M T, et al. Effect of temperature and pH on the sorption of dibutyl phthalate on humic acid[J]. Water, Air, & Soil Pollution, 2016, 227(2): 1–12. |
| [5] | 杨国义, 张天彬, 高淑涛, 等. 广东省典型区域农业土壤中邻苯二甲酸酯含量的分布特征[J]. 应用生态学报, 2007, 18(10): 2308–2312. YANG Guo-yi, ZHANG Tian-bin, GAO Shu-tao, et al. Distribution of phthalic acid esters in agricultural soils in typical of Guangdong Province[J]. Chinese Journal of Applied Ecology, 2007, 18(10): 2308–2312. |
| [6] | Wang Z G, Liu S, Xu W H, et al. The microbiome and functions of black soils are altered by dibutyl phthalate contamination[J]. Applied Soil Ecology, 2016, 99: 51–61. DOI:10.1016/j.apsoil.2015.11.024 |
| [7] | Zhao H M, Du H, Xiang L, et al. Variations in phthalate ester(PAE) accumulation and their formation mechanism in Chinese flowering cabbage(Brassica parachinensis L.) cultivars grown on PAE-contaminated soils[J]. Environmental Pollution, 2015, 206: 95–103. DOI:10.1016/j.envpol.2015.06.008 |
| [8] | Zhao H M, Du H, Xiang L, et al. Physiological differences in response to di-n-butyl phthalate(DBP) exposure between low-andhigh-DBP accumulating cultivars of Chinese flowering cabbage(Brassica parachinensis L.)[J]. Environmental Pollution, 2016, 208: 840–849. DOI:10.1016/j.envpol.2015.11.009 |
| [9] | Cai Q Y, Xiao P Y, Chen T, et al. Genotypic variation in the uptake, accumulation, and translocation of di-(2-ethylhexyl) phthalate by twenty cultivars of rice(Oryza sativa L.)[J]. Ecotoxicology and Environmental Safety, 2015, 116: 50–58. DOI:10.1016/j.ecoenv.2015.02.038 |
| [10] | 邓哲深, 向垒, 莫测辉, 等. 微囊藻毒素MC-RR在农田土壤中吸附行为研究[J]. 环境科学学报, 2016, 36(12): 4482–4489. DENG Zhe-shen, XIANG Lei, MO Ce-hui, et al. Sorption of microcystin-RR in agricultural soils[J]. Acta Scientiae Circumstaniae, 2016, 36(12): 4482–4489. |
| [11] | Yang F, Wang M, Wang Z Y. Sorption behavior of 17 phthalic acid esters on three soils:Effects of pH and dissolved organic matter, sorption coefficient measurement and QSPR study[J]. Chemosphere, 2013, 93(1): 82–89. DOI:10.1016/j.chemosphere.2013.04.081 |
| [12] | Xu X R, Li X Y. Adsorption behavior of dibutyl phthalate on marine sediments[J]. Marine Pollution Bulletin, 2008, 57(6): 403–408. |
| [13] | Wu Y H, Si Y B, Zhou D M, et al. Adsorption of diethyl phthalate ester to clay minerals[J]. Chemosphere, 2015, 119: 690–696. DOI:10.1016/j.chemosphere.2014.07.063 |
| [14] | Liu H, Zhang D, Li M J, et al. Competitive adsorption and transport of phthalate esters in the clay layer of Jianghan Plain, China[J]. Chemosphere, 2013, 92(11): 1542–1549. DOI:10.1016/j.chemosphere.2013.04.026 |
| [15] | Fang Z Q, Huang H J. Adsorption of di-n-butyl phthalate onto nutshell-based activated carbon. Equilibrium, kinetics and thermodynamics[J]. Adsorption Science & Technology, 2009, 27(7): 685–700. |
| [16] | Mohan S V, Shailaja S, Krishna M R, et al. Adsorptive removal of phthalate ester(Di-ethyl phthalate) from aqueous phase by activated carbon:A kinetic study[J]. Journal of Hazardous Materials, 2007, 146(1): 278–282. |
| [17] | Sun K, Jin J, Keiluweit M, et al. Polar and aliphatic domains regulate sorption of phthalic acid esters(PAEs) to biochars[J]. Bioresource Technology, 2012, 118(8): 120–127. |
| [18] | 张楚, 李阳, 宋娇艳, 等. 黄壤对邻苯二甲酸二丁酯的吸附解吸特征及影响因素研究[J]. 西南大学学报:自然科学版, 2014, 36(1): 103–110. ZHANG Chu, LI Yang, SONG Jiao-yan, et al. Adsorption and desorption of dibutyl-phthalate in yellow soil and their influencing factors[J]. Journal of Southwest University(Natural Science Edition), 2014, 36(1): 103–110. |
| [19] | Minling G, Xiaojun M, Wenhua S, et al. Adsorption mechanism of di-n-butyl phthalate easter on brown soil and red soil[J]. International Journal of Environmental Research, 2015, 9(2): 605–612. |
| [20] | 罗雪梅, 杨志峰, 何孟常, 等. 土壤/沉积物中天然有机质对疏水性有机污染物的吸附作用[J]. 土壤, 2005, 37(1): 25–31. LUO Xue-mei, YANG Zhi-feng, HE Meng-chang, et al. Sorption of hydrophobic organic contaminants by natural organic matter in soils and sediments[J]. Soils, 2005, 37(1): 25–31. |
| [21] | Sun K, Ran Y, Yang Y, et al. Sorption of phenanthrene by nonhydrolyzable organic matter from different size sediments[J]. Environmental Science & Technology, 2008, 42(6): 1961–1966. |
| [22] | 鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Analytical methods for soil agricultural chemistry[M]. Beijing: Chinese Agricultural Science and Technology Press, 2000. |
| [23] | OE CD. OECD guidelines for testing of chemicals, test guideline 106:adsorption/desorption using a batch equilibrium method[M]. Paris: Revised Draft Document OECD, 2000: 1-45. |
| [24] | Lu T T, Xue C, Shao J H, et al. Adsorption of dibutyl phthalate on Burkholderia cepacia, minerals, and their mixtures:Behaviors and mechanisms[J]. International Biodeterioration & Biodegradation, 2016, 114: 1–7. |
| [25] | 郭丽, 王淑平, 周志强, 等. 环丙沙星在深浅两层潮土层中吸附-解吸特性研究[J]. 农业环境科学学报, 2014, 33(12): 2359–2367. GUO Li, WANG Shu-ping, ZHOU Zhi-qiang, et al. Adsorption and desorption of ciprofloxacin by surface and subsurface soils of ustic cambosols in China[J]. Journal of Agro-Environment Science, 2014, 33(12): 2359–2367. DOI:10.11654/jaes.2014.12.012 |
| [26] | Lei C, Hu Y Y, He M Z. Adsorption characteristics of triclosan from aqueous solution onto cetylpyridinium bromide(CPB) modified zeolites[J]. Chemical Engineering Journal, 2013, 219(3): 361–370. |
| [27] | Xiang L, Sun T F, Zheng M J, et al. Sorption of dodecyltrimethylammonium chloride(DTAC) to agricultural soils[J]. Science of the Total Environment, 2016, 560: 197–203. |
| [28] | Qureshi U A, Solangi A R, Memon S Q, et al. Ionic Liquid Modified Resin for the adsorptive removal of dibutylphthalate:equilibrium, kinetic, and thermodynamic studies[J]. Clean-Soil Air Water, 2012, 40(6): 630–639. DOI:10.1002/clen.v40.6 |
| [29] | Wang Z. Efficient adsorption of dibutyl phthalate from aqueous solution by activated carbon developed from phoenix leaves[J]. International Journal of Environmental Science and Technology, 2015, 12(6): 1923–1932. DOI:10.1007/s13762-014-0554-7 |
| [30] | Kim Y K, Lim S J, Han M H, et al. Sorption characteristics of oxytetracycline, amoxicillin, and sulfathiazole in two different soil types[J]. Geoderma, 2012, 185(3): 97–101. |
| [31] | 王雄科, 向垒, 郑美洁, 等. 季胺盐化合物在水稻土中的吸附与淋溶行为[J]. 农业环境科学学报, 2015, 34(6): 1115–1120. WANG Xiong-ke, XIANG Lei, ZHENG Mei-jie, et al. Sorption and leaching behaviors of quaternary ammonium compounds in paddy soil[J]. Journal of Agro-Environment Science, 2015, 34(6): 1115–1120. DOI:10.11654/jaes.2015.06.014 |
| [32] | 崔学慧, 李炳华, 陈鸿汉, 等. 中国土壤与沉积物中邻苯二甲酸酯污染水平及其吸附研究进展[J]. 生态环境学报, 2010, 19(2): 472–479. CUI Xue-hui, LI Bing-hua, CHEN Hong-han, et al. A review of phthalic acid esters contamination and sorption in soil and sediment, China[J]. Ecology and Environmental Sciences, 2010, 19(2): 472–479. |
| [33] | 国家农业部农药检定所. GB/T 31270. 4-2014化学农药环境安全评价试验准则: 第4部分: 土壤吸附/解吸试验[S]. 北京: 国家质量监督检验检疫总局, 2014. China's Institute for the Control of Agrochemicals GB/T 31270.4-2014 Test guidelines on environmental safety assessment for chemicals pesticides:Part 4:Adsorption/desorption in soils[S]. Beijing:China's General Administration of Quality Supervision, Inspection and Quarantine, 2014. |
| [34] | Huang W, Weber W J. A distributed reactivity model for sorption by soils and sediments. 10. Relationships between desorption, hysteresis, and the chemical characteristics of organic domains[J]. Environmental Science & Technology, 1997, 31(9): 2562–2569. |
 2017, Vol. 36
2017, Vol. 36