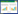文章信息
- 王俊, 王青清, 魏世强
- WANG Jun, WANG Qing-qing, WEI Shi-qiang
- 腐植酸对土壤砷化学形态及生物可给性的影响
- Chemical speciation and bioaccessibility of arsenate in soil as influenced by humic acids
- 农业环境科学学报, 2017, 36(6): 1124-1132
- Journal of Agro-Environment Science, 2017, 36(6): 1124-1132
- http://dx.doi.org/10.11654/jaes.2017-0056
文章历史
- 收稿日期: 2017-01-10
2. 重庆市农业资源与环境研究重点实验室, 重庆 400716;
3. 三峡库区生态环境教育部重点实验室, 重庆 400716
2. Chongqing Key Laboratory of Agricultural Resources and Environment, Chongqing 400716, China;
3. Key Laboratory of the Eco-environments in Three Gorges Reservoir Region, Ministry of Education, Chongqing 400716, China
As(砷)作为一种典型的类重金属污染物,其污染状况越来越受到人们的关注,我国是受As污染最为严重的国家之一[1-2]。食物链传递是土壤重金属进入人体的主要途径[3],由于人类对食物链途径的有效控制,无意经口部直接摄入的土壤重金属的比例越来越高,城市或场地污染土壤甚至可能成为主要来源[4-5],即使是农田土壤,农事活动也会导致人类对重金属污染土壤的直接暴露。因此,研究并阐明土壤重金属对人群的直接暴露风险具有重要意义。土壤重金属直接暴露对人群的健康风险不仅与其总量有关,更重要的是取决于其在胃肠环境中的溶出能力,这部分可溶出的重金属常用生物可给性表征[6]。目前,用于土壤重金属的生物可给性研究常用的方法有体内(活体)实验(in vivo)和体外试验(in vitro)[7-8]。In Vitro体外模拟法是指向体外模拟胃肠环境中投加一定量的试验土壤,模拟人体肠胃环境对土壤重金属的吸收,如PBET(Physiologically Based Extraction Test)、SBET(Simple Bioavailability Extraction Test)、IVG(In Vitro Gastrointestinal)等方法。由于in vitro方法具有分析结果相对准确可靠、设计简单、试验快速、费用较低、可控性强的优点,正逐步成为研究重金属生物可给性的重要方法之一[9],并被许多国家用于污染土壤的风险评价[10-11],但不同的in vitro方法得到的结果存在差异[12]。Ruby等[13]最先提出用PBET方法获取土壤重金属的生物可给性,并证明其与活体试验具有很好的相关性,该方法主要用于土壤Pb的生物可给性的预测[14]。Rodriguez等[15]建立了IVG方法,将其用于测定土壤中As的生物可给性,并对其展开了深入的研究[16-17],结果表明IVG体外模拟胃和小肠阶段的As生物可给性均与动物活体实验As的生物利用度具有显著的相关性。
土壤重金属的生物可给性与其化学形态密切相关[18-19],利用分级提取法测定重金属形态变化指标是评价土壤修复效果的重要途径[20-21]。近年来,通过施用有机物料来修复土壤重金属污染受到广泛关注。有研究表明有机质(物料)可以降低土壤重金属活性,如Covelo等[22]发现有机物可通过吸附、螯合等作用固定重金属,从而降低土壤重金属的有效性;向猛等[20]认为堆肥可以使土壤As的生物可给性降低。HAs(腐植酸)广泛存在于自然环境,同时也是有机物料的主要成分,其中的HA(胡敏酸)和FA(富里酸)是影响土壤重金属形态和活性的关键活性组分。HA和FA含量及HA/FA比因有机物料来源、腐殖化程度的不同而异[23],对土壤中As的生物有效性的影响方向和程度势必会有很大差异。HAs对土壤中As的植物有效性的影响已受到关注,考虑到As对人体的直接暴露风险,HAs对土壤As人体生物可给性的影响研究尚有待加强。本文拟探讨HAs活性组分含量和比例(HA/FA比)对As的生物可给性的影响,并分析土壤As生物可给性与As在土壤中赋存形态的关系,以期深入了解有机物料影响土壤As活性的效应和机制,为利用有机物料修复As污染土壤及对土壤As污染进行人体健康风险评价提供科学依据。
1 材料与方法 1.1 供试材料 1.1.1 供试土壤供试土壤为西南地区广泛分布的紫色土——灰棕紫泥,采自重庆市涪陵区清溪镇双龙村(107°31′37″E,29°51′30″N)。采集表层0~20 cm的土壤,去除砾石及植物残体,经自然风干后,磨细过2 mm标准筛备用。土壤基本性质见表 1。参照《土壤农化分析》[24],土壤pH值采用1:2.5的土水比,pH计测定;有机质用重铬酸钾容量法,CEC用醋酸铵淋洗法,总Fe用邻菲啰啉比色法,总Al用铝试剂比色法,总Ca用原子吸收法测定;总As用硝酸-硫酸-高氯酸消解,二乙基二硫代氨基甲酸银分光光度法(Ag-DDC法)测定。该土壤所含有机质较为匮乏,有利于分析外源HAs的作用和效应。
试验所用HAs为商品HAs。其中,HA购于天津光复精细化工研究所,样品含碳量为41.21%,灰分含量占10%,水分含量<8%;FA购于上海笛柏化学品技术有限公司,含碳量为29.29%,灰分含量占4%,水分含量≤2%。
1.2 试验方法 1.2.1 土样的制备与处理方法将供试土壤分成14份,其中8份分为两组,一组按土重0.5%、1%、3%、5%的碳含量添加FA,另一组按同样的方法添加HA,分别模拟不同FA和HA含量的影响;5份按土重1%的等碳量添加不同比例的HA和FA,设置HA/FA比例分别为0/10、3/7、5/5、7/3、10/0,模拟全FA、主要FA、HA和FA各半、主要HA、全HA处理情形的影响;剩下1份作为不添加HAs的对照。将土样与HAs充分混合后,通过称重添加去离子水的方法保持土壤含水量为20%(下同),在避光条件下培养一个月后风干磨细过2 mm筛,得到不同HAs状态的模拟土壤样品,备用。
取上述模拟土样各500 g,向其中添加Na2HAsO4溶液,使外源As添加量为80 mg·kg-1;另取添加1%C的FA和HA处理土样各5份(每份500 g),然后向两种土样中分别添加Na2HAsO4溶液,使外源As添加量为0、10、20、50、110 mg·kg-1,保持含水量为20%,充分混匀避光培养,所有处理设置两个平行,培养90 d后从两个平行中分别取土样,经风干后等质量混合,磨细过0.25 mm筛,测定土壤As的化学形态和土壤As的生物可给性,所有测定均重复三次。
1.2.2 土壤As化学形态提取方法试验采用As形态连续提取法(SEPs)[25-26],将土壤As分为5种形态,连续提取条件和方法见表 2。提取液中As的测定采用Ag-DDC比色法,该方法测定土壤As的检出限为0.5 mg·kg-1,测定过程中同一批次样品均用标准曲线控制,标准曲线吸光度与溶液As浓度的R2>0.99,样品测定时设置空白样并做三组平行,平行样品相对误差≤5%。
In Vitro人工模拟胃肠试验选用IVG方法。模拟胃液含有0.15 mol·L-1氯化钠,1%胃蛋白酶,用浓盐酸调节pH为1.8。分别将4 g前述不同HAs处理土样和600 mL模拟胃液加入到反应器中,维持37 ℃恒温水浴,100 r·min-1匀速搅动,同时通入氩气模拟胃肠的厌氧环境,反应1 h后用针筒吸取20 mL反应液,过0.45 μm的滤膜,保存在4 ℃冰箱中待测。胃液提取结束后,用NaHCO3粉末将反应液的pH调至5.5,加入3.6 g·L-1胆盐,0.36 g·L-1胰酶,继续通入氩气,100 r·min-1转速搅动。其间,每隔约20 min测定反应液的pH值,若偏离初始值,则用浓HCl和NaHCO3粉末调节,使模拟液pH值维持稳定。反应1 h后,用针筒吸取20 mL反应液,过0.45 μm滤膜,保存在4 ℃冰箱中待测。每个处理重复3次,反应液中的As采用前述同样方法测定。
1.3 数据处理与分析胃阶段或小肠阶段土壤中As的生物可给性可由下式计算:
生物可给性(%)=(CIV·VIV)/(TS·MS)×100%
式中:CIV是试验的胃阶段或小肠阶段反应液中As的浓度,mg·L-1;VIV为各反应器中反应液的体积,L;TS是土壤样品中As总量,mg·kg-1;MS为反应器中土壤样品的质量,kg。
试验数据处理及统计分析采用Excel 2003和SPSS 17.0等软件进行。
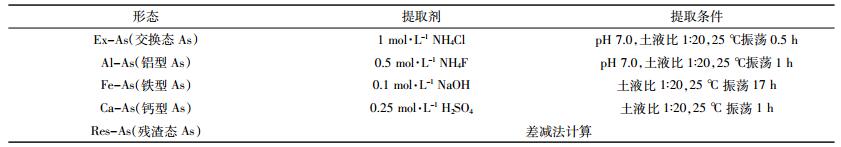
2 结果与分析 2.1 HAs对土壤As形态分布的影响 2.1.1 FA和HA含量对土壤As形态分布的影响在外源As浓度为80 mg·kg-1条件下,不同FA和HA含量处理土壤中As形态分布如图 1所示。土壤Ex-As在五种As形态中占比最低,随FA含量的增加,Ex-As的分配比例呈先增加后降低的趋势,但均显著高于对照(P < 0.05),添加量为1%C时Ex-As占比最高,为6.29%。FA具有一定降低土壤Ca-As分配比例的作用,但处理组与对照之间差异不显著,变化幅度在6.5%~8.1%之间。FA显著降低了Al-As和Fe-As的比例,随着FA添加量(x)的增加,两者占比呈线性降低,而Res-As的占比则呈线性增加:
|
| 图 1不同的FA和HA含量对土壤中As形态分布的影响 Figure 1The distribution of As species in soil at different amounts of FA and HA added |
YAl-As =-3.631 1x+29.554,R2=0.996 0
YFe-As =-5.071 6x+44.326,R2=0.949 9
YRes-As =8.968 8x+13.384,R2=0.994 0
在FA最高用量5%C情况下,Al-As和Fe-As所占的比例分别由对照的29.54%和47.99%降低至11.78%和19.61%,而Res-As则由对照的11.7%增加至58.09%,表明添加FA显著促进了Al-As和Fe-As向Res-As转化。
HA对As形态分配的影响与FA有一定差异。随HA添加量的增加Ex-As的分配比例先增加后降低,当添加量≤1%C时HA增加了Ex-As的分配比例,而添加量≥3%C时则显著降低了Ex-As的分配比例,表明HA用量较低时能增加外源As向Ex-As的分配,HA用量较高时则作用相反。HA也有一定的降低外源As向Al-As和Fe-As分配的作用,但这种作用明显低于FA的作用,HA处理使Al-As分配比例变动在22.91%~25.24%之间,显著低于对照的29.54%(P < 0.05),但并不随HA含量的增加而降低;Fe-As含量随HA含量的增加而减低,仅当HA添加量≥3%C时,分配比例才显著低于对照(47.99%)。HA对Ca-As分配的影响与Fe-As和Al-As有所不同,当HA添加量≤3%C时,降低了Ca-As的分配比例,而当HA添加量达到5%C时,则Ca-As的分配比例显著提高。HA显著提高了Res-As的分配比例,但不同HA添加量之间差异不显著。上述结果表明,随添加量的增加,FA和HA对外源As在土壤中形态分配的影响方向和程度不同,总体上FA显著促进了土壤As由Al-As和Fe-As向Res-As转化,且随FA用量的增加转化作用增强,而HA的这种作用较弱,在高量情况下甚至表现出相反的作用。
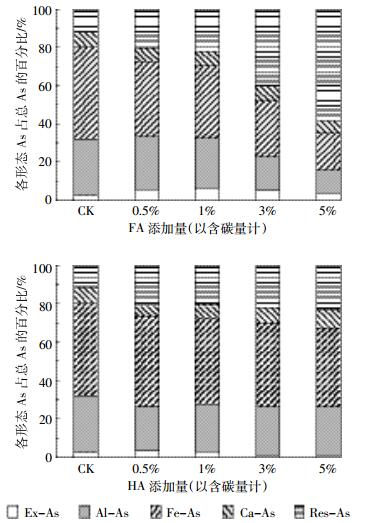
2.1.2 不同HA/FA比例对土壤As形态分布的影响在外源As浓度为80 mg·kg-1,等量HAs(1%C)条件下,不同HA/FA比例处理土壤中As的形态分布如图 2所示。当HA/FA=3/7时,HAs显著增加了Ex-As的分配比例,当HA/FA≥5/5时,HAs则降低了Ex-As的比例,HA/FA=7/3时Ex-As的占比最低为1.90%。HAs对Ca-As的作用与Ex-As相反。不同HA/FA比的HAs都降低了Al-As和Fe-As的分配比例,HA/FA=3/7时比例最低,占比分别为21.97%和42.73%。HAs显著增加了Res-As的比例,HA/FA=3/7时Res-As的比例最大为24.51%。
|
| 图 2不同HA/FA比处理对土壤中As形态分布的影响 Figure 2The distribution of As species in soil at different HA/FA ratios and constant HAs added (1%C) |
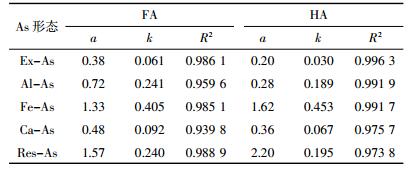
等量(1%C)FA和HA条件下,添加不同含量的外源As(0~110 mg·kg-1)后,土壤中各形态As的含量变化如图 3所示。可见土壤各形态As的含量(y,mg·kg-1)均随着外源As添加量(x,mg·kg-1)的增加呈线性增加:
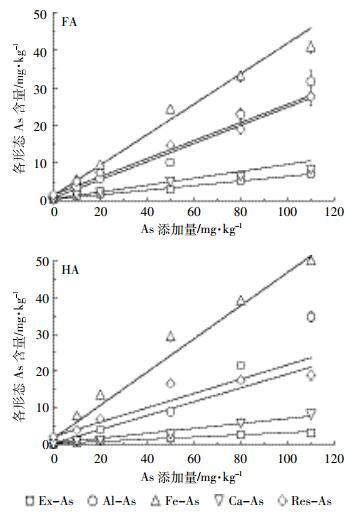
|
| 图 3不同外源As添加量对土壤As化学形态的影响 Figure 3The distribution of As species in soil at different amounts of As added |
y=a+kx,R2>0.93
式中:拟合曲线的斜率k反映了不同条件下单位外源As引起的各形态As的增加量;a则反映了未添加外源As时模拟土壤中各形态As的拟合初始含量。
拟合参数列于表 3。由表 3可见,无论是添加HA还是FA的土壤中,均为Fe-As的k值最大,Res-As和Al-As次之,而Ex-As最小,说明外源As主要向前3种形态转化,而向Ex-As分配的比例较小,这与前面分析结果一致。但随外源As的增加同一形态As分配速率在不同HAs处理土壤中差异较大。FA处理的土壤Ex-As、Al-As、Ca-As和Res-As的k值高于HA处理,而Fe-As则在HA处理的土壤中更高,表明随外源As的增加,FA处理土壤中更多的As向Ex-As、Al-As、Ca-As和Res-As形态转化,而HA处理向Fe-As形态分配的比例更高。等量As条件下,HA处理的土壤Ex-As、Al-As、Ca-As和Res-As的分配比例均低于FA处理,Fe-As的分配比例则始终高于FA处理。
|
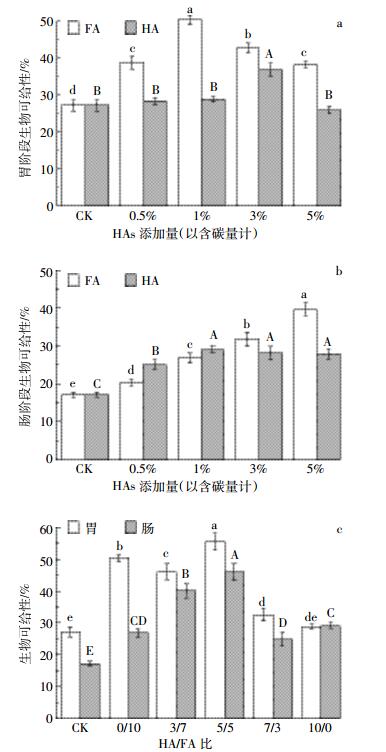
不同FA和HA添加量对土壤As的胃肠阶段生物可给性的影响结果如图 4a和图 4b所示。在胃阶段,等碳量的HAs条件下,FA处理土壤As的生物可给性均高于HA。随着HAs添加量的增加土壤As的生物可给性先增加后降低。不同添加量的FA均显著增加了土壤As的生物可给性,添加量为1%C时生物可给性最高,为50.36%。当添加量≤3%C时,HA增加了土壤As的生物可给性,添加量为3%C时生物可给性最高,与对照之间差异显著;当添加量为最高的5%C时,HA降低了土壤As的生物可给性,但与对照之间并无显著性差异。
|
| 图中相同HAs组分处理不同字母表示具有显著性差异(P < 0.05) Different letters indicates significant differences among treatments (P < 0.05) 图 4不同HAs处理对土壤As胃肠生物可给性的影响 Figure 4The bioaccessibility of As in soil at different HAs added |
小肠阶段,HAs显著增加了土壤As的生物可给性。随着HAs添加量的增加,添加FA的土壤As的生物可给性显著增加,而添加HA的土壤在添加量≤1%C时As的生物可给性显著增加,添加量为1%C时最高,为29.14%,随着HA添加量的进一步增加,生物可给性缓慢降低,但与1%C时无显著性差异。HAs添加量≤1%C时HA处理的土壤As生物可给性高于等碳量的FA,添加量≥3%C时HA的生物可给性低于等碳量的FA。
等碳量(1%C)条件下,不同HA/FA比对土壤As生物可给性的影响见图 4c。HAs提高了土壤As的胃肠阶段生物可给性。在胃阶段,HA/FA=5/5时生物可给性最高为55.41%,HA/FA=0/10时次之,当HA/FA≥5/5时生物可给性随HA/FA比的增大逐渐降低。在肠阶段,当HA/FA≤5/5时生物可给性随HA/FA比的增大逐渐增加,HA/FA=5/5时最高,为45.90%,随着HA/FA比的进一步增大,生物可给性急剧降低,HA/FA=7/3时最低,为45.90%。
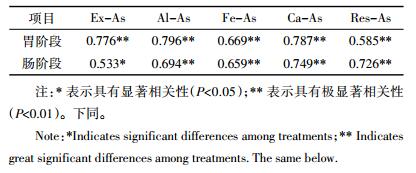
2.2.2 土壤As的生物可给性与As形态分配的关系将土壤中生物可给性As含量与As各化学形态含量进行相关性分析,结果如表 4所示。土壤中胃肠阶段生物可给性As含量与As的各形态之间都有显著正相关性,表明HAs处理后土壤中生物可给性As含量随着各形态As含量的增加均增加。土壤中的生物可给性As是各形态As共同表现的结果,为探究影响生物可给性As含量的主要形态,将土壤中胃肠阶段生物可给性As含量与各形态As含量进行逐步回归分析,结果如表 5所示。在胃阶段对土壤生物可给性As具有显著影响的形态分别是Ex-As和Ca-As,且都表现为正相关性,单位Ex-As对生物可给性As的贡献比Ca-As大。在肠阶段,对土壤生物可给性As影响显著的是Ca-As。
|

|
本研究中HAs的两种活性组分FA和HA均能对土壤As形态产生较大的影响,但两种组分的作用效果和强度有所不同,与FA和HA结构和性质特点有关。通常,HAs可通过多种复杂机理影响重金属的形态和活性,如与无机胶体组分形成有机-无机复合物或与无机组分中的结构性阳离子形成复合物,从而改变土壤的表面性质和吸持能力[27-28],也可通过络合(螯合)作用改变重金属离子本身的形态[29-30],同时HAs的酸性作用也将对土壤重金属吸持特性产生影响。本文中砷酸根离子带负电荷,难以直接被HAs所吸附,HAs对As形态分配的影响可能更主要通过其对土壤组分吸持性能的影响而实现。HAs对Fe3+、Al3+、Mn2+等离子的强烈络合能力可能是其降低Al-As和Fe-As分配比例而增加Res-As的重要原因。同时,HAs中FA较HA分子量低、酸性更高、移动性更强[31],因而能保持土壤中更高比例的Ex-As。
试验中添加HAs处理后土壤pH有不同程度的降低,与袁婉潼等[32]研究结果相同。pH能从多个方面影响As的生物可给性,但土壤pH的变化只是HAs影响土壤性质的一个方面,HAs还可以增加土壤中DOM(溶解性有机质)的含量,As与DOM络合形成的As-DOM络合物是控制As的形态、移动性和生物有效性的关键因素之一[33];同时HAs可以增加土壤微生物的生物量,改善土壤微生物群落结构等[34],微生物可以通过氧化/还原、吸附/解吸、甲基化/去甲基化、沉淀/溶解等作用对As的迁移、形态转化等过程产生重要影响,从而影响其生物有效性[35]。
不少研究表明低分子量的FA可以增加阳离子重金属的有效性,而HA则表现为抑制作用,如余贵芬等[36]研究表明FA能促进有效态Cd含量的增加,而HA对有效态Cd和Pb有一定的抑制和钝化作用。本文结果表明无论是HA还是FA均提高了土壤As的生物可给性,只有当HA含量较高时(5%C)降低了胃阶段As的生物可给性,意味着通常所说的植物有效性指标难以反映土壤重金属对人群的接触暴露危害,显然这是由于植物和人体对土壤中重金属的吸收机制存在很大差异。因此,只有深入研究土壤重金属的形态及其与生物可给性的关系,才能正确评价土壤重金属污染的人群健康效应。
HAs对土壤As生物可给性的影响是其对As形态分配综合作用的结果。本研究中FA显著促进土壤As由Al-As和Fe-As向Res-As的转化,但又显著增加了土壤As胃、肠阶段的生物可给性,其原因主要是HAs存在条件下As的各形态都对胃肠阶段的生物可给性产生影响,其中Ex-As和Ca-As的影响最大。FA能显著增加Ex-As的含量,对Ca-As没有显著影响,综合表现为增加土壤As胃、肠阶段的生物可给性。虽然HA/FA≥5/5时能降低土壤Ex-As的含量,但同时也增加了Ca-As的含量,因此在用有机物料降低土壤As的生物可给性时要综合考虑HA对Ex-As和Ca-As的影响。对于肠阶段,Ca-As虽然对生物可给性As含量影响显著,但其决定系数R2值较小,用Ca-As的变化并不能充分解释肠阶段生物可给性的变化,因此不能忽视其他形态及环境因素的变化对肠阶段生物可给性As含量的影响。相同的HA/FA比例情况下,胃阶段的生物可给性均高于肠阶段,有研究者认为是胃阶段的pH远低于肠阶段造成的[37],唐健[38]认为胃中的低pH值条件有利于As在胃液中的溶解,还有一部分原因是胃、肠模拟液成分不同,小肠阶段在胃阶段的基础上添加了胰酶和胆盐,两种成分的加入使本身溶于胃液中的As析出。
回归分析中胃阶段和肠阶段的生物可给性都与Ca-As呈显著正相关。一般认为Ca-As是难溶态的砷,其生物有效性较低,但本研究中Ca-As却对生物可给性起着重要作用,其原因可能是本研究中的生物可给性模拟人体胃、肠环境,土壤As在该环境下的溶出能力与植物吸收方式不同所致,且试验所用的IVG模拟方法的胃、肠环境均为酸性,有利于Ca-As的溶出,凸显Ca-As对生物可给性的作用。
4 结论(1)HAs会对土壤As的形态转化产生影响。在添加量≤1%C时HA和FA均可提高Ex-As的分配比例,FA可以显著促进土壤As由Al-As和Fe-As向的Res-As转化,且随用量的增加转化作用增强,而HA的这种作用强度较弱,在添加量为5%C时甚至表现出相反的作用。
(2)HAs对土壤As生物可给性的影响受其含量和组成的制约。FA和含3%C的HA处理显著增加了土壤As胃阶段生物可给性;FA和HA均显著增加了土壤As肠阶段生物可给性。HAs添加总量为1%C时,不同HA/FA比的HAs均增加了土壤As的生物可给性。HA/FA=5/5时胃肠生物可给性最大,HA/FA=7/3时肠阶段生物可给性最小。
(3)HAs通过影响土壤中As的形态分配而影响As的生物可给性。在胃阶段对土壤生物可给性As具有显著影响的是Ex-As和Ca-As,单位Ex-As对生物可给性As的贡献比Ca-As大;在肠阶段对生物可给性As影响显著的是Ca-As。
| [1] | 肖细元, 陈同斌, 廖晓勇, 等. 中国主要含As矿产资源的区域分布与As污染问题[J]. 地理研究, 2008, 27(1): 201–212. XIAO Xi-yuan, CHEN Tong-bin, LIAO Xiao-yong, et al. Regional distribution of arsenic contained minerals and arsenic pollution[J]. Geographical Research, 2008, 27(1): 201–212. |
| [2] | Rodriguez-Lado L, Sun G F, Berg M, et al. Groundwater arsenic contamination throughout China[J]. Science, 2013, 341(6148): 866–868. DOI:10.1126/science.1237484 |
| [3] | Abrahams P W. Soils:Their implications to human health[J]. Science of the Total Environment, 2002, 291(1/2/3): 1–32. |
| [4] | Agency for Toxic Substances and Disease Registry(ATSDR). Toxicological profile for lead[R]. Washington, D C:Department of Health and Human Services, 2005. |
| [5] | Agency for Toxic Substances and Disease Registry(ATSDR). Toxicological profile for arsenic[R]. Washington, D C:Department of Health and Human Services, 2005. |
| [6] | Yoon Y, Kim S, Chae Y, et al. Evaluation of bioavailable arsenic and remediation performance using a whole-cell bioreporter[J]. Science of the Total Environment, 2016, 547: 125–131. DOI:10.1016/j.scitotenv.2015.12.141 |
| [7] | Ruby M V, Davis A, Link T E, et al. Development of an in vitro screening test to evaluate the in vivo bioaccessibility of ingested mine-waste lead[J]. Environmental Science & Technology, 1993, 27(13): 2870–2877. |
| [8] | Ruby M V, Schoof R, Brattin W, et al. Advances in evaluating the oral bioavailability of inorganics in soil for use in human health risk assessment[J]. Environmental Science & Technology, 1999, 33(21): 3697–3705. |
| [9] | 崔岩山, 陈晓晨, 付瑾. 污染土壤中铅、砷的生物可给性研究进展[J]. 生态环境学报, 2010, 19(2): 480–486. CUI Yan-shan, CHEN Xiao-chen, FU Jin. Progress in study of bioaccessibility of lead and arsenic in contaminated soils[J]. Ecology and Environmental Sciences, 2010, 19(2): 480–486. |
| [10] | Wragg J, Cave M, Basta N, et al. An inter-laboratory trial of the unified BARGE bioaccessibility method for arsenic, cadmium and lead in soil[J]. Science of the Total Environment, 2011, 409(19): 4016–4030. |
| [11] | US Environmental Protection Agency(EPA). Standard operating procedure for an in vitro bioaccessibility assay for lead in soil[R]. Washington DC:US EPA, 2012. |
| [12] | Oomen A G, Hack A, Minekus M, et al. Comparison of five in vitro digestion models to study the bioaccessibility of soil contaminants[J]. Environmental Science & Technology, 2002, 36(15): 3326–3334. |
| [13] | Ruby M V, Davis A, Schoof R, et al. Estimation of lead and arsenic bioavailability using a physiologically based extraction test[J]. Environmental Science & Technology, 1996, 30(2): 422–430. |
| [14] | Basta N, Gradwohl R. Estimation of Cd, Pb, and Zn bioavailability in smelter-contaminated soils by a sequential extraction procedure[J]. Soil and Sediment Contamination, 2000, 9(2): 149–164. DOI:10.1080/10588330008984181 |
| [15] | Rodriguez R R, Basta N T, Casteel S W, et al. An in vitro gastrointestinal method to estimate bioavailable arsenic in contaminated soils and solid media[J]. Environmental Science & Technology, 1999, 33(4): 642–649. |
| [16] | Beak D G, Basta N T, Scheckel K G, et al. Bioaccessibility of arsenic(Ⅴ) bound to ferrihydrite using a simulated gastrointestinal system[J]. Environment Science & Technology, 2006, 40(4): 1364–1370. |
| [17] | Beak D G, Basta N T, Scheckel K G, et al. Bioaccessibility of arsenic bound to corundum using a simulated gastrointestinal system[J]. Environmental Chemistry, 2006, 3(3): 208–214. DOI:10.1071/EN05067 |
| [18] | 韩春梅, 王林山, 巩宗强, 等. 土壤中重金属形态分析及其环境学意义[J]. 生态学杂志, 2005, 24(12): 1499–1502. HAN Chun-mei, WANG Lin-shan, GONG Zong-qiang, et al. Chemical forms of soil heavy metals and their environmental significance[J]. Chinese Journal of Ecology, 2005, 24(12): 1499–1502. |
| [19] | 李季, 黄益宗, 保琼莉, 等. 几种改良剂对矿区土壤As化学形态和生物可给性的影响[J]. 环境化学, 2015, 34(12): 2198–2203. LI Ji, HUANG Yi-zong, BAO Qiong-li, et al. Effect of several amendments on the speciation and bio-accessibility of arsenic polluted soils in adjacent areas of mine[J]. Environmental Chemistry, 2015, 34(12): 2198–2203. |
| [20] | 向猛, 黄益宗, 蔡立群, 等. 改良剂对土壤As钝化作用及生物可给性的影响[J]. 环境化学, 2016, 35(2): 317–322. XIANG Meng, HUANG Yi-zong, CAI Li-qun, et al. Influence of amendments on inactivation and bio-accessibility of arsenic in soils[J]. Environmental Chemistry, 2016, 35(2): 317–322. |
| [21] | Papassiopi N, Kontoyianni A, Vanuanidou K, et al. Assessment of chromium biostabilization in contaminated soils using standard leaching and sequential extraction techniques[J]. Science of the Total Environment, 2009, 407(2): 925–936. DOI:10.1016/j.scitotenv.2008.09.020 |
| [22] | Covelo E F, Vega F A, Andrade M L. Competitive sorption and desorption of heavy metals by individual soil components[J]. Journal of Hazardous Materials, 2007, 140(1/2): 308–315. |
| [23] | 贺婧, 颜丽, 杨凯, 等. 不同来源腐殖酸的组成和性质的研究[J]. 土壤通报, 2003, 34(4): 343–345. HE Jing, YAN Li, YANG Kai, et al. Study on component and character of humic acids from different sources[J]. Chinese Journal of Soil Science, 2003, 34(4): 343–345. |
| [24] | 鲍士旦. 土壤农化分析[M]. 3版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil agricultural chemistry analysis[M]. 3rd Edition. Beijing: China Agricultural Press, 2000. |
| [25] | 何峰, 苗金燕, 魏世强. 外源砷、铅在三类紫色土中形态分配与其化学、生物有效性研究[J]. 农业工程学报, 2005, 21(2): 44–47. HE Feng, MIAO Jin-yan, WEI Shi-qiang. Speciation distribution and its chemical, biological availability of arsenic, lead added in acid, neutral and alkali purple soil[J]. Transactions of the CSAE, 2005, 21(2): 44–47. |
| [26] | Woolson E A, Axley J H, Kearne P C. Correlation between available soil arsenic, estimated by six methods, and response of corn[J]. Soil Science Society of America Proceedings, 1971, 35(1): 101–105. DOI:10.2136/sssaj1971.03615995003500010030x |
| [27] | Janos P, Hula V, Bradnova P, et al. Reduction and immobilization of hexavalent chromium with coal-and humate-based sorbents[J]. Chemosphere, 2009, 75(6): 732–738. DOI:10.1016/j.chemosphere.2009.01.037 |
| [28] | 钟晓兰, 周生路, 黄明丽, 等. 土壤重金属的形态分布特征及其影响因素[J]. 生态环境学报, 2009, 18(4): 1266–1273. ZHONG Xiao-lan, ZHOU Sheng-lu, HUANG Ming-li, et al. Chemical form distribution characteristic of soil heavy metals and its influencing factors[J]. Ecology and Environmental Sciences, 2009, 18(4): 1266–1273. |
| [29] | Ji G W, Laird D A. Interactions of chlorpyrifos with colloidal materials in aqueous systems[J]. Journal of Environmental Quality, 2004, 33(5): 1765–1770. DOI:10.2134/jeq2004.1765 |
| [30] | Ylivainio K. Effects of iron(Ⅲ) chelates on the solubility of heavy metals in calcareous soils[J]. Environmental Pollution, 2010, 158(10): 3194–3200. DOI:10.1016/j.envpol.2010.07.004 |
| [31] | 李光林. 腐植酸与几种金属离子的相互作用及影响因素研究[D]. 重庆: 西南农业大学, 2002. LI Guang-lin. On the reaction of humic acids on some heavy metal ions and the affecting factors[D]. Chongqing:Southwest Agriculture University, 2002. |
| [32] | 袁婉潼. 生物腐植酸对盐碱土壤微生物数量和酶活性的影响[J]. 安徽农业科学, 2016, 44(1): 1–4, 45. YUAN Wan-tong. Effect of biological humic acid on microbe number and enzyme activities of alkali-saline soil[J]. Journal of Anhui Agriculture Science, 2016, 44(1): 1–4, 45. |
| [33] | 刘广良, 蔡勇. 环境中砷与溶解有机质的络合作用[J]. 环境化学, 2011, 30(1): 50–55. LIU Guang-liang, CAI Yong. Complexation of arsenic with dissolved organic matter in the environment[J]. Environmental Chemistry, 2011, 30(1): 50–55. |
| [34] | 马斌, 刘景辉, 张兴隆. 褐煤腐植酸对旱作燕麦土壤微生物量碳、氮、磷含量及土壤酶活性的影响[J]. 作物杂志, 2015(5): 134–140. MA Bin, LIU Jing-hui, ZHANG Xing-long. Effects of applying brown coal humic acid on soil enzyme activity and microbial biomass C, N and P content of oat in dry farming[J]. Crops, 2015(5): 134–140. |
| [35] | 苏世鸣, 曾希柏, 白玲玉, 等. 微生物对砷的作用机理及利用真菌修复砷污染土壤的可行性[J]. 应用生态学报, 2010, 21(12): 3266–3272. SU Shi-ming, ZENG Xi-bai, BAI Ling-yu, et al. Action mechanisms of microorganisms on arsenic and the feasibility of utilizing fungi in remediation of arsenic-contaminated soil[J]. Chinese Journal of Applied Ecology, 2010, 21(12): 3266–3272. |
| [36] | 余贵芬, 蒋新, 和文祥, 等. 腐植酸对红壤中铅镉赋存形态及活性的影响[J]. 环境科学学报, 2002, 22(4): 508–513. YU Gui-fen, JIANG Xin, HE Wen-xiang, et al. Effect of humic acids on species and activity of cadmium and lead in red soil[J]. Acta Scientiae Circumstantiae, 2002, 22(4): 508–513. |
| [37] | 崔岩山, 陈晓晨, 朱永官. 利用3种in vitro方法比较研究污染土壤中铅、砷生物可给性[J]. 农业环境科学学报, 2008, 27(2): 414–419. CUI Yan-shan, CHEN Xiao-chen, ZHU Yong-guan. Comparison of three in vitro methods to study the bioaccessibility of soil lead and arsenic[J]. Journal of Agro-Environment Science, 2008, 27(2): 414–419. |
| [38] | 唐健. 砷的体外生物利用度研究进展[J]. 环境卫生学杂志, 2012, 2(3): 141–144. TANG Jian. Progress on the bioaccessibility of arsenic in the simulated gastrointestinal absorption system[J]. Journal of Environmental Hygiene, 2012, 2(3): 141–144. |
 2017, Vol. 36
2017, Vol. 36