文章信息
- 张旺园, 张绍良, 陈浮, 侯湖平, 冯启言, 马静
- ZHANG Wang-yuan, ZHANG Shao-liang, CHEN Fu, HOU Hu-ping, FENG Qi-yan, MA Jing
- 模拟地下CO2泄漏对土壤微生物群落的短期影响
- Short-term effects of simulated underground CO2 leakage on the soil microbial community
- 农业环境科学学报, 2017, 36(6): 1167-1176
- Journal of Agro-Environment Science, 2017, 36(6): 1167-1176
- http://dx.doi.org/10.11654/jaes.2016-1559
文章历史
- 收稿日期: 2016-12-06
2. 中国矿业大学低碳能源研究院, 江苏省煤基 CO2捕集与地质储存重点实验室, 江苏 徐州 221008
2. Coal-based CO2 Capture and Geological Storage Key Laboratory, Low Carbon Energy Institute, China University of Mining and Technology, Xuzhou 221008, China
二氧化碳捕集与封存技术(Carbon Dioxide Capture and Storage,简称CCS),是指从点源将CO2分离捕集后注入深层地质储层,并长期与大气隔离[1]。在全球经济快速发展以及化石能源燃料迅速消费的背景下,因减排潜力大,长期应用成本低等优势,CCS被视为一项重要的减排手段[2]。但CCS技术存在着地质封存泄漏的可能性。强烈的快速泄漏会引起生命财产的巨大损失,而CO2缓慢向上入侵土壤,将会引发土壤气体、土壤水分、土壤pH以及土壤微生物群落组成的改变,进而引起土壤理化性质和土壤环境的变化。因此,重新衡量CCS技术的利弊是至关重要的。
从先前的研究来看,土壤CO2浓度变化对土壤性质产生影响是必然的。但受技术手段限制,实验较难反映真实的泄漏情景,土壤性质及微生物群落与环境因子的对应关系并不清晰。邓书林等[3]认为土壤CO2浓度升高主要通过影响氮等养分来限制真菌和细菌的生长;张丙华等[4]以胜利油田正在实施CO2驱油的某区块土壤为研究对象,发现随着CO2泄漏浓度的增大,土壤pH降低,土壤含水率和有机碳含量降低;张习美等[5]在开顶式气箱(OTC)中采用盆栽试验,发现CO2浓度升高可以显著增加美洲商陆(Phytolaccaamericana Linn)根际土壤中细菌、放线菌、真菌的数量,增幅分别为19%~32%、41%~21%、25% ~58%。尹飞虎等[6]在新疆石河子棉田土壤进行的试验表明,当CO2浓度升高到540 μmol·mol-1和720 μmol·mol-1时,0~40 cm土壤中细菌和0~20 cm土壤中放线菌数量均呈增加趋势,20~40 cm土壤中真菌数量则呈减少趋势;施翠娥等[7]开展的OTC平台和青菜盆栽试验结果表明,CO2升高不同程度地提高了土壤可溶性有机碳、全磷、总碳、铵态氮、硝态氮含量,进而不同程度地提高了土壤微生物量以及土壤各种酶活性。
本研究建立了廉价实用的简易地质封存CO2泄漏模拟装置,完全满足短期影响实验的要求,不同于我们先前的大田模拟实验平台[8-9]。通过模拟泄漏、土样采集、实验测试,研究土壤理化性质、酶活性以及土壤微生物群落结构对CO2泄漏的响应,探讨在土壤CO2增加的情况下,土壤环境因子变化与微生物群落变化之间的关系,揭示地质封存CO2泄漏可能产生的生态风险,旨在为建立CCS技术安全评估提供科学依据,促进CCS项目更快、更安全的实施。
1 材料与方法 1.1 试验设计和样品采集原始土样为褐潮土[9],来源于中国矿业大学南湖校区内农田(117.2°N,34.2°E),未经人为处理。当地属暖温带季风性气候,年均降水量800~930 mm,年均气温14 ℃。
将原始土样装入室外露天放置的花盆中,以进行CO2泄漏模拟实验。花盆高度30 cm,土层厚度至少可达25 cm。通过将气瓶、减压阀、分流器、塑料管等装置的连接,形成CO2输出控制装置。将塑料管固定在花盆底部中心位置,使其出气口位置保持在底部以上2~3 cm处(图 1)。试验设置无气体通入的控制组和其他四组CO2泄漏胁迫组,调整减压阀和可调节流量计使得进气浓度始终保持在400、1000、1500、2000 μL·L-1。控制组记为C组,胁迫组根据CO2浓度高低分别记为L、M、H、E组,共5组处理,每组3个重复,共15盆。实验过程中,每天进行实验装置的检查,保证气体通入不间断,同时使用便携式CO2检测仪确定采集点浓度是否稳定。

|
| 图 1地质封存CO2泄漏模拟装置 Figure 1CO2 geological storage leakage simulation appliance |
自2016年3月19日开始通气,共采样6次。通气前,即3月19日,采集第一批土样,第二批至第五批采样时间分别为4月1日、4月16日、5月1日、6月3日。6月3日采集土样后立即结束通气,一个月后,即7月4日,采集第六批土样,尝试观察解除CO2泄漏胁迫后的土壤环境的恢复状况。上述6个时间点分别记为0、10、25、40、70、100 d。
不同样点采用随机多点土壤混合样,一部分放置室内阴干,手工去除砂石和植物残枝,研磨过100目筛,用于测试土壤理化性质和酶活性,另一部分新鲜土样存入-20 ℃冰箱备用。
1.2 土壤理化性质测定土壤pH用电位法测定;电导率用电导率仪测定;土壤有机质用水合热重铬酸钾氧化-比色法测定;硝态氮用紫外分光光度法测定;全磷含量采用酸溶-钼锑抗比色法测定;有效磷采用氯化铵浸提-钼锑抗比色法测定[10]。
1.3 土壤酶实验脲酶用苯酚钠-次氯酸钠比色法测定,脲酶活性以24 h后1 g土壤中NH3-N的毫克数表示;用邻苯三酚比色法测定多酚氧化酶,其活性以培养2 h后1 g土壤中紫色没食子素的毫克数表示;蛋白酶用茚三酮比色法测定,其活性以24 h以后1 g土壤中氨基氮的毫克数表示[11];脱氢酶用氯化三苯基四氮唑(TTC)法测定,离心比色后,将1 h产生1 μg TF的量作为一个酶活力单位[12];荧光素二乙酸酯(FDA)水解酶用荧光素比色法测定[13]。各测试均设置三组重复,并分别设置无基质的土壤和无土壤的基质作对照组。
1.4 土壤DNA测序采用E.Z.N.ATM Mag-Bind Soil DNA Kit的试剂盒提取土壤样品DNA,从20个土壤样本提取DNA进行PCR扩增。20个土样分别为通气前(0 d)5个样,此处记为C0、L0、M0、H0、E0;通气一个月后(40 d)15个样,控制组记为C1、C2、C3,胁迫组记为L1、L2、L3;M1、M2、M3;H1、H2、H3;E1、E2、E3。
第一轮PCR扩增利用Qubit 2.0 DNA检测试剂盒对基因组DNA精确定量,以确定PCR反应加入的DNA量。PCR所用引物已经融合了Miseq测序平台的V3-V4通用引物,341F(CCCTACACGACGCTCTTCCGATCTG(barcode)CCTACGGGNGGCWGCAG)和805R(GACTGGAGTTCCTTGGCACCCGAGAATTCCAGAC-TACHVGGGTATCTAATCC)。50 μL PCR聚合酶链式反应体系包含:5 μL 10×PCR buffer,0.5 μL dNTP(10 mmol·L-1 each),10 ng Genomic DNA,两个特异引物各0.5 μL(50 μmol·L-1),0.5 μL Plantium Taq(5 U·μL-1),最后用超纯无菌水加至50 μL。PCR扩增程序如下:94 ℃预变性3 min;94 ℃变性30 s,45 ℃退火20 s,65 ℃延伸30 s,持续5个循环周期;94 ℃变性20 s,55 ℃退火20 s,72 ℃延伸30 s,持续20个循环周期;最后72 ℃持续10 min,降温至10 ℃。随后第二轮扩增程序,PCR体系除DNA增加至20 ng,其余与第一轮一致,扩增程序则为:95 ℃预变性30 s;95 ℃变性15 s,55 ℃退火15 s,72 ℃延伸30 s,持续5个循环周期;最后72 ℃持续5 min则程序结束。
PCR扩增结束后,PCR产物进行琼脂糖电泳检测,再对DNA进行纯化回收。对于细菌和古菌扩增的PCR产物和正常扩增片段在400 bp以上的PCR产物,选用0.6倍的磁珠(Agencourt AMPure XP)处理。利用Qubit 2.0 DNA检测试剂盒对回收的DNA精确定量,以方便按照1:1等量混合后测序。进行等量混合时,每个样品DNA量取10 ng,最终上机测序浓度为20 pmol。
1.5 测序数据处理利用SPSS 20软件对土壤理化性质和酶活性测定结果进行配对样本t检验,将胁迫组与控制组数据进行差异性分析,可判定CO2通气处理是否对土壤存在影响;同时对各胁迫组之间也进行差异性分析,判断不同浓度的CO2是否产生不同影响。
测序所得原始数据采用双端(Pair-end)FASTQ格式保存(R1.fastq和R2.fastq,Read1和Read2序列)。先对原始序列进行去接头、质量剪切等处理(即质量控制),再通过去除特异性扩增序列及嵌合体等预处理,然后运用Qiime软件进行OTU聚类分析,将序列划分为操作分类单元(OTU)。根据样本OTU数据,利用Mothur计算Chao1和Shannon丰富度指数,衡量样本物种多样性,随后筛选每个OTU代表性序列,采用RDP classifier将序列进行物种分类,赋予物种分类单元。对每个样本和每个物种单元分类进行序列丰度计算,已分类Reads数目较少的菌群种属归入Others,未确定种属的菌群归入Unclassified,并结合Origin 8构建样本和物种分类单元序列丰度矩阵,得到物种丰度条形图。为检测环境因子、样品、菌群三者之间的关系,利用Canoco windows for 4.5将0 d和40 d的土壤理化性质、酶活性、OTU信息数据继续做CCA分析。
2 结果与分析 2.1 地质封存CO2泄漏对土壤理化性质的影响原始土样为褐潮土,通气前土壤pH为8.12±0.03,电导率为(203.78±4.43)μS·cm-1,有机质含量为(15.13±0.40)g·kg-1,有效磷和全磷含量分别为(15.99±1.22)mg·kg-1和(0.41±0.01)g·kg-1,硝态氮和全氮含量分别为(1.02±0.04)mg·kg-1和(0.85±0.07)g·kg-1。
图 2A显示,土壤pH在CO2胁迫下发生显著变化(P < 0.05),相对控制组,胁迫组pH值随着通气时间的增加呈现显著下降趋势(P < 0.05)。L组、M组的pH值最终下降至7.34左右,而H、E组在100 d时已下降至7.29。随着通气的进行,pH值下降趋势为先迅速下降,后逐渐趋于平缓,可能是由于CO2通气造成的酸性影响趋于稳定。电导率在通气阶段仅略有波动,基本稳定,无显著差异(图 2B)。

|
| 图 2土壤理化性质变化情况 Figure 2Change in soil physical and chemical properties |
土壤有机质是评价土壤肥力和质量的重要指标[14]。图 2C显示土壤有机质呈急剧下降后上升的趋势。0~40 d期间,有机质含量基本为下降趋势,到70 d出现急剧增加的现象。恢复期阶段,有机质含量再次下降至接近初始含量,但控制组和胁迫组之间无明显差异。
磷是植物生长发育不可缺少的营养元素,但绝大部分以非有效态积累于土壤中[15]。由图 2D可知,土壤有效磷总体变化趋势复杂,表现为大幅升降。全磷变化趋势较有效磷平缓(图 2E),经检验控制组及各胁迫组之间无显著差异,从通气时长上来看,表现为前期累积,随后消耗,后期保持不变。
CO2胁迫通过影响氮固定、硝化作用、反硝化作用、厌氧氨氧化等过程,影响土壤中的氮含量[16]。图 2F显示各胁迫组硝态氮含量呈波动性上升,前期变化显著,且各胁迫组相比控制组在CO2通气后出现显著变化(P < 0.05)。通气前,各胁迫组平均值为1.01 mg·kg-1,而100 d时高达4.03 mg·kg-1。全氮含量略有波动,但无显著变化(图 2G)。
2.2 地质封存CO2泄漏对土壤酶活性的影响土壤酶在土壤生态系统的物质循环和能量转化中起着重要的作用,是比理化性质更敏感的指标[17]。
经检验,胁迫组和控制组的FDA水解酶含量存在显著的差异(P < 0.05),说明CO2泄漏对FDA水解酶活性产生一定的抑制作用(图 3A)。通气前各胁迫组FDA水解酶含量平均值为22.69 mg·kg-1·h-1,至100 d时已降至12.15 mg·kg-1·h-1。不同浓度胁迫组的响应程度相似,不存在显著差异。多酚氧化酶活性在通气后出现显著(P < 0.05)上升趋势(图 3B)。根据通气时长分析,各胁迫组在通气初期立即出现活性变化,且变化显著(P < 0.05),通气后期虽有变化,但并不显著,至100 d平均值相比通气前增加了约230%,100 d恢复期的活性相对于70 d无变化。

|
| 图 3土壤酶活性变化情况 Figure 3Changes in soil enzyme activity |
蛋白酶活性无显著变化。图 3C表明,通入CO2后蛋白酶活性出现波动,随后基本不变。土壤脲酶和脱氢酶分别是影响尿素水解、氮素循环和土壤微生物活性的重要酶类[18]。图 3D表明,脱氢酶出现降-升-降的趋势,变化显著(P < 0.05),但各胁迫组响应的时间点并不相同,总体上无显著变化。经检验,脲酶相邻胁迫组之间存在显著差异,通气时长对脲酶活性也存在显著影响(P < 0.05)。由图 3E可知,脲酶在10 d时含量下降,随后上升并保持稳定,且M组、E组上升幅度大于L组、H组。
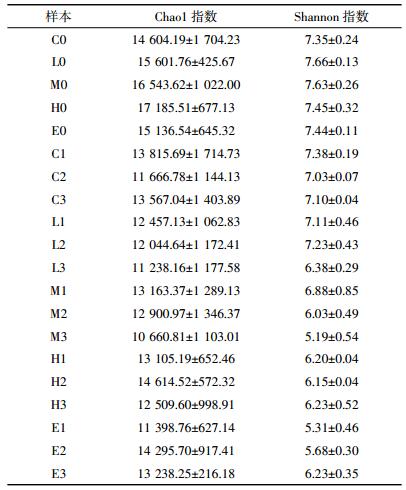
2.3 地质封存CO2泄漏对土壤微生物群落的影响取通气前及通气一个月之后(40 d)的20个土壤样本进行微生物多样性检测,0、40 d时样本标记与前文相同。Alpha多样性分析可以反映微生物群落的多样性和丰富度,结果如表 1所示。对比通气后各组Chao1指数可以发现,随着通气的进行和CO2胁迫浓度的增加,土壤群落丰富度在C、L、M组不断下降,H、E组又出现微弱的上升。Shannon指数用于衡量群落的异质性,数据显示CO2浓度越高,香农指数越低,说明土壤中微生物群落多样性在CO2胁迫下降低。
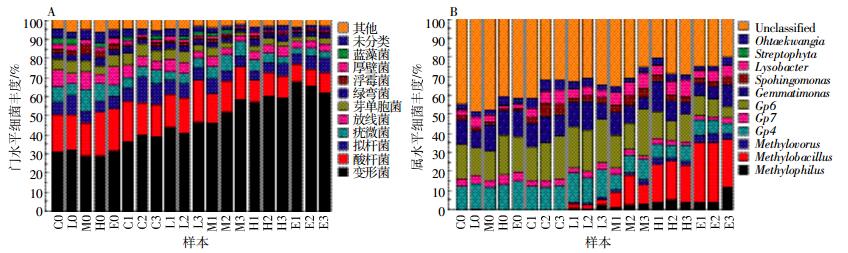
图 4A显示,20个样本中所含菌群门类较丰富。变形菌(Proteobacteria)、酸杆菌(Acidobacteria)、拟杆菌(Bacteroidetes)、疣微菌(Verrucomicrobia)、放线菌(Actnobacteria)、芽单胞菌(Gemmatimonadetes)、绿弯菌(Chloroflexi)、浮霉菌(Planctomycetes)、厚壁菌(Firmicutes)、蓝藻菌(Cyanobacteria)在各供试土样中均有分布。变形菌门相对丰度最大,0 d时平均比例高达30.5%,随着CO2浓度增加其丰度增大,E组变形菌门丰度甚至高达64%,是供试土样的优势菌门。酸杆菌门的平均丰度从通气前的20%降低至13.25%。其余门类丰度变化基本呈降低趋势。
|
| 图 4样本菌群丰度条形图 Figure 4Abundance barplot of genus and phylum |
在属水平上,按平均丰度大小排列的前11个属中,变形菌门中的嗜甲基菌属(Methylophilus)、甲基芽孢杆菌(Methylobacillus)、甲基营养菌(Methylovorus)在通气后丰度迅速增长,而且CO2胁迫浓度越高,丰度越大(图 4B)。控制组三属比例为0.1%、0.07%、0.01%,E组分别增加至22%、10.3%、10.2%。酸杆菌门的三个属Gp6、Gp4、Gp7,在通气胁迫下表现为抑制生长。
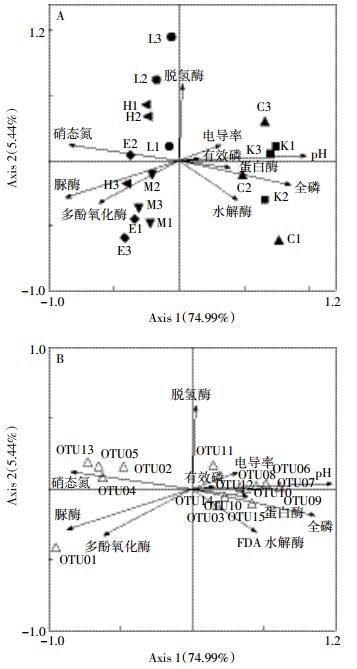
由于单因子无法完整解释土壤微生物群落结构变化,本研究引入典范对应分析(Canonical correspondence analysis,CCA),解析多个环境因子和微生物群落之间的关系,结果如图 5所示。为使结果更加显著,简化0 d样方信息,选择C0、M0、H0重新定义为K1、K2、K3,其余标记与前文相同。考虑OTU序列特征,选择丰度较大且具有样点特征的15个OTU作为物种信息元数据。10个环境因子分别为pH、有机质、有效磷、全磷、硝态氮、FDA水解酶、多酚氧化酶、蛋白酶、脱氢酶、脲酶。
|
| 图 5环境因子与样点、环境因子与OTU的CCA分析图 Figure 5CCA environ+samples、environ+OTU analysis charts |
结果(图 5A)表明,未通气K组与一个月后控制组物种信息相近。胁迫组的微生物对应菌属丰度均产生明显变化。比较样方和物种的直线距离发现,OTU01、OTU02、OTU04、OTU05、OTU13相对其他OTU距离控制组样方更远,距胁迫组更近,说明这部分OTU随胁迫组变化,相关性较大。
同时,沿箭头方向,样方中的环境变量值增加,说明胁迫组中,硝态氮、脲酶、多酚氧化酶的含量是增加的。其余环境因子变量不同程度减小,仅部分样方的脱氢酶含量增加,该结果与前文理化性质及酶活性分析结果一致。环境因子和物种信息的相关性,可以通过物种点与中心点连线在环境因子箭头上的投影来表示。图 5B表明,左侧硝态氮、脲酶、多酚氧化酶和OTU01、OTU02、OTU04、OTU05、OTU13相关性较大。剩余环境因子,除脱氢酶外,与其他OTU信息相关性较大。根据酶的来源[19]推测,土壤CO2浓度升高,直接影响理化性质及土壤微生物群落结构,从而影响酶活性。同时,理化性质和酶活性的改变间接影响土壤群落结构。因此,CO2胁迫下,硝态氮、脲酶、多酚氧化酶活性的增加及FDA水解酶、蛋白酶活性的减少可能导致OTU01等丰度的增加和OTU06、OTU07等丰度的减少,同时,OTU01等丰度增加产生的群落结构变化促进了酶活性的变化。
3 讨论在本试验中,供试材料为徐州市地区褐潮土,属弱碱性土壤。土壤CO2浓度的增加使得土壤pH值大幅降低,而对电导率则基本无影响,有效磷和有机质变化复杂,其余理化性质与对照组无明显差异,与先前报道[4]一致。在无植物土壤中,有机碳来源主要为微生物代谢活动,因此CO2浓度增加可能导致微生物数量下降从而影响有机质含量。CO2气体进入土壤后,形成酸性环境,可以通过影响碳酸根离子的浓度来改变铵根离子浓度,同时也可以通过形成厌氧环境来影响厌氧氨氧化过程。同理,土壤CO2浓度的增加可能促进了硝化作用,从而使得硝态氮浓度增加。
影响土壤酶活性的因素很多,土壤重金属污染以及不良水热条件会对土壤酶活性和土壤微生物多样性产生影响[19]。本实验中土壤CO2浓度的增加使得FDA水解酶活性出现明显的下降,对多酚氧化酶和脲酶都表现出不同程度的促进作用,与先前报道[18]一致。脱氢酶活性与呼吸代谢作用相关,因此其复杂变化可能与CO2浓度升高后抑制土壤微生物呼吸代谢有一定关系。
结合Alpha多样性以及物种丰度图分析,土壤CO2浓度增加使得变形菌门丰度增加,微生物群落结构逐渐趋于单一,证实了先前报道的结论[20-22]。Sibanc等[23]研究发现CO2浓度升高会导致土壤微生物群落结构变化,但是优势种群不变而其丰度上升,与本研究结论基本一致。本研究中,在CO2通气影响下,微生物群落多样性略有变化,丰富度明显越低,说明CO2模拟泄漏已产生重要影响。张帆等[24]对鄂尔多斯CO2地质封存地区的土壤研究过程中,得到了高浓度CO2入侵包气带对土壤微生物群落结构产生显著影响的结论,与本研究相似。另外,在CO2通气过程中,不同微生物丰度出现的变化不同,与Dunbar等[25]在11年的大气CO2浓度升高变化过程中检测到的细菌群落丰度明显增加趋势有所不同。本实验中酸杆菌门和拟杆菌门丰度也较高。土壤CO2浓度增加使得疣微菌门、放线菌门、芽单胞菌门丰度下降。也有研究表明,随着CO2泄漏时间的变化,土壤中不同门类细菌丰度变化不同[20]。
在属水平上,由CO2泄漏导致的土壤微生物属水平测定结果可知,变形菌门下的嗜甲基菌、甲基芽孢杆菌、甲基营养菌丰度上升。针对嗜甲基菌属的研究目前国内较少,国外较多,而在地质封存CO2泄漏胁迫研究中,尚未有提及嗜甲基菌属的报道,测序结果分析一般表示到变形菌门为止。嗜甲基菌属于变形菌门下β-变形菌纲,是一种专性甲基营养菌,因此土壤CO2浓度增加可能促进土壤中某些带甲基有机物质或其他间接刺激变量的增加,导致环境发生更适于嗜甲基菌的变化。Tsujimoto等[26]设计了甲基营养嗜甲基菌(Methylophilus methylotrophus)的L-赖氨酸的生物合成方式,研究表明嗜甲基菌有一个良好的赖氨酸生成量的控制系统。Xia等[27]在用甲烷富集甲烷氧化菌的过程中,从自来水中分离出了Methylophilus sp. TWE2,并通过其完整序列探究利用该细菌将甲烷基团转换成甲醛的途径。Khan等[28]通过在微生物菌剂中添加淀粉作为碳源提高了TNT的解毒效果,并在培养过程中发现嗜甲基菌丰度急剧增长逐渐成为优势菌属。具体的相关变量因子,将在未来试验中作更详细的探索。
通气后,土壤中的酸杆菌门下三属Gp6、Gp4、Gp7丰度下降。王春香等[29]的研究提到,酸杆菌是异养型微生物,其在土壤中的分布随着碳源浓度的变化而改变。Lauber等[30]的研究指出,土壤中酸杆菌相对丰度与土壤pH呈显著负相关。其他学者亦发现,向土壤中施加氮肥会导致酸杆菌丰度降低。此外,研究还发现酸杆菌的相对丰度与平均降水量、土壤有机碳含量和土壤碳氮比呈显著的正相关[20, 23, 31]。然而,中性甚至碱性的环境中也检测到了酸杆菌的基因序列[32],与本次实验结果一致。此外,近几年对酸杆菌属的研究打破了一些既定规律,如对我国东北旱地黑土农田细菌群落结构研究发现[33],黑土农田中酸杆菌相对丰度与土壤pH值没有显著的相关关系。Jones等[34]对北美和南美的87个土壤样品大尺度分析发现酸杆菌亚群Gp1、Gp2、Gp3、Gp12、Gp13和Gp15相对丰度与pH值呈显著负相关关系,而Gp4、Gp6、Gp7、Gp10、Gp11、Gp16、Gp17、Gp18、Gp22和Gp25相对丰度与pH值呈显著正相关关系。因此,不同属的酸杆菌对土壤pH的响应不同。
总之,小型模拟试验仍需要长期持续定点监测,完善监测数据序列,提高试验的操作便利性和数据的精确度,力求达到从机理上详细解析土壤对CCS泄漏的反馈过程,在此基础上优化大田试验方案,缩短试验周期并节约经费。
4 结论(1)土壤CO2浓度的增加较大程度地改变了土壤理化性质。土壤pH值、有效磷、有机质以及硝态氮含量发生明显变化。
(2)土壤CO2浓度的增加影响了土壤酶活性。FDA水解酶活性明显下降,多酚氧化酶和脲酶活性增强,蛋白酶和脱氢酶活性变化不甚明显。
(3)土壤CO2浓度的增加对土壤微生物群落结构影响显著。随着土壤CO2浓度的增加,变形菌门所占丰度上升,其余菌门基本表现为抑制作用,土壤微生物结构多样性逐渐降低,趋于单一。
(4)地质封存CO2泄漏对土壤环境的扰动作用较大,可能出现危害性较大甚至不可逆的生态风险。因此,需尽快完善CCS技术安全评估系统,建立CO2泄漏控制措施。
| [1] | Ko D, Yao G, Yun S T, et al. Impacts of CO2 leakage on plants and microorganisms:A review of results from CO2 release experiments and storage sites[J]. Greenhouse Gases Science and Technology, 2016, 6(3): 319–338. DOI:10.1002/ghg.2016.6.issue-3 |
| [2] | 张晓暄. 二氧化碳捕集与封存的国际法律研究[D]. 青岛: 中国海洋大学, 2013: 8-10. ZHANG Xiao-xuan. A study on the CCS international legal system[D]. Qingdao:Ocean University of China, 2013:8-10. |
| [3] | 邓书林, 刘芙蓉, 张咏梅. 增温和CO2浓度加倍对川西亚高山针叶林土壤微生物群落结构的影响[J]. 应用与环境生物学, 2016, 22(1): 20–26. DENG Shu-lin, LIU Fu-rong, ZHANG Yong-mei. Effects of elevated temperature and doubling of CO2 concentration on the soil microbial community structure in the subalpine coniferous forest of western Sichuan, China[J]. Chinese Journal of Applied and Environmental Biology, 2016, 22(1): 20–26. |
| [4] | 张丙华, 张倩, 耿春香, 等. 地质封存CO2泄漏对土壤理化性质的影响[J]. 广州化工, 2016, 44(7): 156–159. ZHANG Bing-hua, ZHANG Qian, GENG Chun-xiang, et al. Influence on physical and chemical properties of soil for the leakage of carbon dioxide during geological storage[J]. Guangzhou Chemical Industry, 2016, 44(7): 156–159. |
| [5] | 张习美, 唐世荣, 宋正国, 等. CO2浓度升高对美洲商陆富积铯及其根际微生物特征的影响[J]. 核农学报, 2010, 24(6): 1255–1261. ZHANG Xi-mei, TANG Shi-rong, SONG Zheng-guo, et al. Effect of elevated CO2 on Cs uptake and microbial characteristics in rhizosphere soil of Phytolacca americana L.[J]. Journal of Nuclear Agricultural Sciences, 2010, 24(6): 1255–1261. DOI:10.11869/hnxb.2010.06.1255 |
| [6] | 尹飞虎, 高志建, 谢宗铭, 等. 大气CO2浓度升高和施氮对棉田土壤理化性质及微生物区系的影响[J]. 地理研究, 2013, 32(2): 214–222. YIN Fei-hu, GAO Zhi-jian, XIE Zong-ming, et al. Influence of elevated CO2 and nitrogen supply on cotton field soil properties and microbial flora[J]. Geographical Research, 2013, 32(2): 214–222. |
| [7] | 施翠娥, 艾弗逊, 汪承润, 等. 大气CO2和O3升高对菜地土壤酶活性和微生物量的影响[J]. 农业环境科学学报, 2016, 35(6): 1103–1109. SHI Cui-e, AI Fu-xun, WANG Cheng-run, et al. Effects of elevated atmospheric CO2 and O3 on soil enzyme activities and microbial biomass[J]. Journal of Agro-Environment Science, 2016, 35(6): 1103–1109. DOI:10.11654/jaes.2016.06.012 |
| [8] | 陈浮, 杨宝丹, 马静, 等. CO2地质封存泄漏对土壤微生物群落的影响[J]. 中国矿业大学学报, 2016, 45(6): 1129–1138. CHEN Fu, YANG Bao-dan, MA Jing, et al. Effects of CO2 geological storage leakage on soil microbial community[J]. Journal of China University of Mining & Technology, 2016, 45(6): 1129–1138. |
| [9] | 陈浮, 杨宝丹, 马静, 等. 高浓度CO2地下泄漏对土壤微生物群落结构的影响[J]. 土壤学报, 2017, 54(1): 180–190. CHEN Fu, YANG Bao-dan, MA Jing, et al. Effects of high concentrations of CO2 underground leakage on soil microbial community structure[J]. Acta Pedologica Sinica, 2017, 54(1): 180–190. DOI:10.11766/trxb201607110265 |
| [10] | 林大仪. 土壤学实验指导[M]. 北京: 中国林业出版社, 2004: 109-121. LIN Da-yi. Soil science experiment instruction[M]. Beijing: China Forestry Publishing House, 2004: 109-121. |
| [11] | 关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 274-320. GUAN Yin-song. Soil enzyme and its study method[M]. Beijing: China Agriculture Press, 1986: 274-320. |
| [12] | 戴濡伊, 吴季荣, 徐剑宏, 等. 小麦根际土壤脱氢酶活性测定方法的改进[J]. 江苏农业学报, 2013, 29(4): 772–776. DAI Ru-yi, WU Ji-rong, XU Jian-hong, et al. Improvement of determination dehydrogenase activity in wheat rhizospheric soil[J]. Jiangsu Journal of Agricultural Sciences, 2013, 29(4): 772–776. |
| [13] | 马星竹. 长期施肥土壤的FDA水解酶活性[J]. 浙江大学学报(农业与生命科学版), 2010, 36(4): 451–455. MA Xing-zhu. FDA hydrolase activity of long-term fertilization soil[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2010, 36(4): 451–455. |
| [14] | 韩新忠, 朱利群, 杨敏芳, 等. 不同小麦秸秆还田量对水稻生长、土壤微生物生物量及酶活性的影响[J]. 农业环境科学学报, 2012, 31(11): 2192–2199. HAN Xin-zhong, ZHU Li-qun, YANG Min-fang, et al. Effects of different amount of wheat straw returning on rice growth, soil microbial biomass and enzyme activity[J]. Journal of Agro-Environment Science, 2012, 31(11): 2192–2199. |
| [15] | 王永壮, 陈欣, 史奕. 农田土壤中磷素有效性及影响因素[J]. 应用生态学报, 2013, 24(1): 260–268. WANG Yong-zhuang, CHEN Xin, SHI Yi. Phosphorus availability in cropland soils of China and related affecting factors[J]. Chinese Journal of Applied Ecology, 2013, 24(1): 260–268. |
| [16] | 张春辉, 吴永贵, 付天岭. 矿山废水污染对稻田土壤环境特征及不同形态氮含量的影响[J]. 贵州农业科学, 2014, 42(1): 122–126. ZHANG Chun-hui, WU Yong-gui, FU Tian-ling. Effects of mine drainage pollution on paddy soil environment characteristics and contents of different soil nitrogen forms[J]. Guizhou Agricultural Science, 2014, 42(1): 122–126. |
| [17] | 杨宁, 邹冬生, 杨满元, 等. 衡阳紫色土丘陵坡地不同植被恢复阶段土壤酶活性特征研究[J]. 植物营养与肥料学报, 2013, 19(6): 1516–1524. YANG Ning, ZOU Dong-sheng, YANG Man-yuan, et al. Soil enzyme activities in different re-vegetation stages on sloping-land with purple soils in Hengyang of Hunan Province[J]. China Journal of Plant Nutrition and Fertilizer, 2013, 19(6): 1516–1524. DOI:10.11674/zwyf.2013.0629 |
| [18] | 袁传卫, 姜兴印, 殷万元, 等. 吡唑醚菌酯对土壤微生物呼吸作用及土壤酶活性的影响[J]. 农业环境科学学报, 2015, 34(5): 897–903. YUAN Chuan-wei, JIANG Xing-yin, YIN Wan-yuan, et al. Effects of pyraclostrobin on soil microbial respiration and enzymatic activities[J]. Journal of Agro-Environment Science, 2015, 34(5): 897–903. DOI:10.11654/jaes.2015.05.012 |
| [19] | 田然, 周辉, 黄娟, 等. 大气CO2浓度升高条件下土壤镉污染对土壤酶及微生物群落多样性的影响[J]. 南京大学学报(自然科学), 2011, 47(6): 712–717. TIAN Ran, ZHOU Hui, HUANG Juan, et al. Effects of elevated atmospheric CO2 concentration on the soil enzymes and microbial communities under stress of Cd pollution[J]. Journal of Nanjing University(Natural Sciences), 2011, 47(6): 712–717. |
| [20] | 田地, 马欣, 李玉娥. 利用高通量测序对封存CO2泄漏情景下土壤细菌的研究[J]. 环境科学, 2013, 34(10): 4096–4104. TIAN Di, MA Xin, LI Yu-e. Research on soil bacteria under the impact of sealed CO2 leakage by highthroughput sequencing technology[J]. Environment Science, 2013, 34(10): 4096–4104. |
| [21] | Liu Y, Zhou H M, Wang J Q, et al. Short-term response of nitrifier communities and potential nitrification activity to elevated CO2 and temperature interaction in a Chinese paddy field[J]. Applied Soil Ecology, 2015, 96: 88–98. DOI:10.1016/j.apsoil.2015.06.006 |
| [22] | 赵光影, 刘景双, 王洋, 等. CO2浓度升高对三江平原湿地活性有机碳及土壤微生物的影响[J]. 地理与地理信息科学, 2011, 27(2): 96–100. ZHAO Guang-ying, LIU Jing-shuang, WANG Yang, et al. Effects of elevated CO2 on the soil active carbon and microbe of freshwater marsh in Sanjiang Plain[J]. Geography and Geo-Information Science, 2011, 27(2): 96–100. |
| [23] | Sibanc N, Dumbrell A J, Mandić-Mulec I, et al. Impacts of naturally elevated soil CO2 concentrations on communities of soil archaea and bacteria[J]. Soil Biology and Biochemistry, 2014, 68: 348–356. DOI:10.1016/j.soilbio.2013.10.018 |
| [24] | 张帆, 李春荣, 邓红章, 等. 高浓度CO2入侵包气带对土壤微生物的影响[J]. 应用化工, 2015, 44(10): 1778–1783. ZHANG Fan, LI Chun-rong, DENG Hong-zhang, et al. Effects of high concentration CO2 invasion into vadose zone on soil microbes[J]. Applied Chemical Industry, 2015, 44(10): 1778–1783. |
| [25] | Dunbar J, Gallegos-Graves L V, Steven B, et al. Surface soil fungal and bacterial communities in aspen stands are resilient to eleven years of elevated CO2 and O3[J]. Soil Biology & Biochemistry, 2014, 76(1): 227–234. |
| [26] | Tsujimoto N, Gunji Y, Ogawa-Miyata Y, et al. L-Lysine biosynthetic pathway of Methylophilus methylotrophus and construction of an l-lysine producer[J]. Journal of Biotechnology, 2006, 124: 327–337. DOI:10.1016/j.jbiotec.2005.12.026 |
| [27] | Xia F, Zou B, Shan C, et al. Complete genome sequence of Methylophilus sp. TWE2 isolated from methane oxidation enrichment culture of tap-water[J]. Journal of Biotechnology, 2015, 211: 121–122. DOI:10.1016/j.jbiotec.2015.07.023 |
| [28] | Khan M I, Lee J, Yoo K, et al. Improved TNT detoxification by starch addition in a nitrogen-fixing Methylophilus-dominant aerobic microbial consortium[J]. Journal of Hazardous Materials, 2015, 300(1): 873–881. |
| [29] | 王春香, 田宝玉, 吕睿瑞, 等. 西双版纳地区热带雨林土壤酸杆菌群体结构和多样性分析[J]. 微生物学通报, 2010, 37(1): 24–29. WANG Chun-xiang, TIAN Bao-yu, LÜ Rui, et al. Distribution and diversity of Acidobacteria in tropical rain forest soil of Xishuangbanna[J]. Microbiology China, 2010, 37(1): 24–29. |
| [30] | Lauber C L, Strickland M S, Bradford M A, et al. The influences of soil properties on the structure of bacterial and fungal communities across landuse types[J]. Soil Biology & Biochemistry, 2008, 40(9): 2407–2415. |
| [31] | 王光华, 刘俊杰, 于镇华, 等. 土壤酸杆菌门细菌生态学研究进展[J]. 生物技术通报, 2016, 32(2): 14–20. WANG Guang-hua, LIU Jun-jie, YU Zhen-hua, et al. Research progress of acidobacteria ecology in soils[J]. Biotechnology Bulletin, 2016, 32(2): 14–20. |
| [32] | Xiong J B, Liu Y Q, Lin X G, et al. Geographic distance and pH drive bacterial distribution in alkaline lake sediments across Tibetan Plateau[J]. Environmental Microbiology, 2012, 14(9): 2457–2466. DOI:10.1111/emi.2012.14.issue-9 |
| [33] | Liu J J, Sui Y Y, Yu Z H, et al. Soil carbon content drives the biogeographical distribution of fungal communities in the black soil zone of Northeast China[J]. Soil Biology and Biochemistry, 2015, 83: 29–39. DOI:10.1016/j.soilbio.2015.01.009 |
| [34] | Jones R T, Robeson M S, Lauber C L, et al. A comprehensive survey of soil acidobacterial diversity using pyrosequencing and clone library analyses[J]. The ISME Journal, 2009, 3(4): 442–453. DOI:10.1038/ismej.2008.127 |
 2017, Vol. 36
2017, Vol. 36