文章信息
- 梁文君, 蔡泽江, 宋芳芳, 周世伟, 艾天成, 徐明岗
- LIANG Wen-jun, CAI Ze-jiang, SONG Fang-fang, ZHOU Shi-wei, AI Tian-cheng, XU Ming-gang
- 不同母质发育红壤上玉米生长与土壤pH、交换性铝、交换性钙的关系
- Relationships between maize growth and the pH, exchangeable aluminum and calcium of red soils derived from different parent materials
- 农业环境科学学报, 2017, 36(8): 1544-1550
- Journal of Agro-Environment Science, 2017, 36(8): 1544-1550
- http://dx.doi.org/10.11654/jaes.2017-0369
文章历史
- 收稿日期: 2017-02-16
2. 中国农业科学院农业资源与农业区划研究所/耕地培育技术国家工程实验室, 北京 100081
2. National Engineering Laboratory for Improving Quality of Arable Land, Institute of Agricultural Resources and Reginal Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
红壤是我国南方的主要土壤类型,总面积约1.28×108 hm2,红壤地区是我国重要的茶、柑橘等经济作物,水稻、玉米等粮食作物主要产区[1-2]。红壤呈酸性至强酸性,阳离子交换量小,是典型的生态脆弱区[2-3]。红壤较强的酸性可导致作物铝中毒和钙等营养元素缺乏,使作物生长受到严重限制[4-7]。作物生长与土壤pH、交换性铝、交换性钙间存在定量关系,在pH和交换性钙临界值以下或交换性铝临界值以上,作物生长明显受到抑制,这些临界值在很大程度上也取决于土壤自身特性[8-10]。Baquy等[11]研究表明,湖南祁阳红壤影响小麦生长的pH和交换性铝临界值为5.29和0.56 cmol·kg-1,而安徽郎溪红壤,其值分别为4.66和2.36 cmol·kg-1;孟赐福等[12]通过对浙江红壤(红砂土)研究发现玉米生长的交换性铝临界值为1.0 cmol·kg-1;秦瑞君等[13]的研究结果表明玉米在湖南红壤(第四纪红土)上的交换性铝临界值为4.8 cmol·kg-1。Baquy等[11]将不同红壤间作物临界值的差异归因于土壤阳离子交换量(CEC)的不同,土壤的CEC主要受土壤有机质含量和土壤无机胶体含量影响,土壤母质不同,其CEC也有显著差别。不同母质发育的红壤上,维持作物正常生长的pH、交换性铝、交换性钙临界值尚未见报道。魏守兴等[14]和金媛[15]评价土壤肥力时提出了交换性钙的临界值为1.2 cmol·kg-1。在酸性和强酸性红壤需施用石灰类物质,以提高土壤pH,增加交换性钙含量,以促进作物正常生长。在酸性土壤上,作物生长主要受制于土壤pH、交换性铝和交换性钙的交互作用,Cronan等[16]和Alvarez等[17]提出土壤溶液或植物组织的Ca/Al摩尔比可作为森林生态系统评估的重要生态指标。
鉴于此,本研究选用三种典型母质发育的红壤,调控土壤酸度后进行玉米盆栽试验,研究了玉米生长与土壤pH、交换性铝和交换性钙的关系,以期给出不同母质红壤玉米生产的pH、交换性铝和交换性钙的临界值,为红壤改良和红壤玉米高效生产提供理论依据。
1 材料与方法 1.1 供试红壤2016年4月在湖南省祁阳县采集了三种代表性母质发育的红壤表层土壤(0~20 cm):第四纪红土,文富市镇111°31′16″E,26°27′15″N,为撂荒地;板页岩,文富市镇111°31′24″E,26°27′0″N,为杉木林地;红砂岩,三口塘镇111°28′54″E,26°15′15″N,为灌乔林地。去除石块和残根,晾干磨碎过1 cm筛,备用。土壤基本理化性质见表 1。
按照成杰民等[18]的研究方法,通过酸碱滴定法获取土壤酸碱缓冲曲线,计算缓冲容量,再确定预期pH值所需的酸或碱量。然后用1 mol·L-1的分析纯硫酸和分析纯氧化钙将三种母质发育的红壤调为目标pH值,分别为3.5、4.0、4.5、5.0、5.5、6.0、6.5、7.0和7.5,调节红壤pH梯度所需酸碱添加量见表 2。酸碱调节后,在70%田间持水量下保持15 d[19],将土壤晾干、粉碎、过2 mm筛,混合均匀,取样测定各土壤pH值,作为盆栽试验的实际pH值。
每盆称取1.5 kg风干土,全部处理氮、磷、钾肥施用量相同,尿素、磷酸二氢钾和氯化钾用量分别为0.428、0.192、0.054 g·kg-1(N:P2O5:K2O为2:1:1)[20]。土壤与肥料充分混匀后,装盆。试验用盆的规格为盆口内径17 cm、盆底内径11 cm、高12 cm。每盆分别均匀地播入大小一致的玉米种子5粒,于三叶苗期间保留生长一致的3株玉米苗。玉米在网室生长,每个处理3次重复,随机排列,各处理定时定量浇水。出苗后30 d收获地上部,先80 ℃杀青、后60 ℃烘干,测定干重即为生物量;同时采取土壤样品,自然风干、磨碎、分别过20目和60目筛后,测定土壤交换性铝和交换性钙含量。
1.3 分析方法土壤pH采用电位法测定(水土比为2.5:1);交换性钙采用1 mol·L-1乙酸铵交换-原子吸收分光光度法测定;交换性铝采用1 mol·L-1 KCl浸提-NaOH中和滴定法测定,具体测定步骤参考鲍士旦方法[21]。
1.4 数据处理采用Excel 2010进行数据计算和统计,采用SigmaPlot 12.5作图及曲线拟合。主要相关关系用双直线方程(Piecewise)和线性-平台方程拟合[22]:
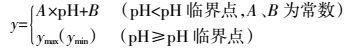
三种母质发育的红壤上,随土壤pH升高,玉米地上部生物量在第四纪红土上表现为先线性增加后基本保持不变,在板页岩和红砂岩上表现为先线性增加后略有下降的变化趋势(图 1)。用双直线方程模拟玉米生物量与土壤pH的关系(决定系数R2均大于0.9,达到极显著水平),从而得到拐点pH值(pH临界值),即最大生物量时的土壤pH,第四纪红土为pH 5.48,板页岩为pH 5.82,红砂岩为pH 5.54。三种红壤种植玉米的pH临界值均高于原土壤pH值,建议祁阳县红壤种植玉米前进行酸度改良,以提高土壤pH值,获得更高产量。红壤酸化使作物产量下降,严重酸化时甚至绝产,已在多数田间实验得到证实[7-10, 23],但不同母质发育的红壤,需改良目标pH是否相同,目前并不清楚。本项研究表明同一地区不同母质发育的红壤pH临界值略有差异,约在5.4~5.8之间,玉米在第四纪红土红壤上能耐受更强的酸,改良目标pH值达到5.5即可;而在板页岩红壤上耐酸能力较差,改良目标pH值达到5.8为佳。

|
| 图 1 玉米地上部生物量与土壤pH的关系 Figure 1 Relationships between maize shoot biomass and soil pH |
施用石灰是酸性土壤改良最常用措施,但过量施用可能引起作物产量下降。于世举[24]研究表明,在酸性土壤上施石灰每667 m2超过100 kg时,平均每千克石灰的水稻增产效果呈明显下降趋势;敖俊华等[25]的桶栽试验结果表明,每667 m2土壤施用石灰180 kg,甘蔗产量和糖分最佳,当石灰施用过多,单位石灰增施量对其表现出负效应;胡敏等[26]的盆栽试验结果表明,当每667 m2土壤生石灰用量超过270 kg后,其对大麦幼苗生长的促进作用明显减弱。有研究表明,过量的钙对磷素有效性产生影响,并抑制玉米对钾素的吸收利用,从而引起玉米生长受到限制[25, 27]。酸性土壤石灰施用量一般667 m2为100~200 kg,而本试验最高石灰调节用量每千克土壤为3.01 g,按此计算667 m2为452 kg,是正常用量的2倍以上,过量的钙导致营养元素的有效性降低和磷素的固定等,这可能是板页岩和红砂岩红壤上玉米生物量在pH 5.5以上出现下降趋势的主要原因。
2.2 红壤交换性铝、钙与土壤pH的关系伴随红壤pH升高,土壤交换性铝含量呈直线下降趋势,至pH 5.5附近接近于零,其变化趋势在三个母质发育的红壤上基本一致(见图 2),这与前人研究结果[9, 28]一致。通过线性-平台方程拟合土壤pH与交换性铝的关系(决定系数R2均大于0.97,达到极显著水平),计算得到三种红壤玉米生长pH临界值对应的土壤交换性铝含量分别为:第四纪红土0.14 cmol·kg-1、板页岩0.16 cmol·kg-1、红砂岩0.13 cmol·kg-1。说明红壤的交换性铝不宜超过0.2 cmol·kg-1,且基本不受母质影响。

|
| 图 2 交换性铝、交换性钙与土壤pH的关系 Figure 2 Relationships between exchangeable aluminum and calcium and soil pH |
土壤的母质不同,其对酸碱缓冲能力不同,导致盐基离子特别是钙含量差异显著,如红砂岩交换性钙含量(1/2Ca2+)仅0.5 cmol·kg-1,约为第四纪红土和板页岩的一半(表 1)。如图 2所示,第四纪红土的交换性钙含量随土壤pH升高呈直线增加趋势;板页岩和红砂岩的交换性钙含量在pH<5时没有明显变化,当pH≥5时呈直线增加趋势。在各pH临界值时交换性钙分别为:第四纪红土4.59 cmol·kg-1、板页岩5.46 cmol·kg-1、红砂岩3.06 cmol·kg-1,均大于魏守兴等[14]、金媛[15]研究的南方酸性土壤交换性钙含量(1.25 cmol·kg-1)。
2.3 玉米生物量与土壤交换性铝、钙的关系如表 3所示,红壤玉米生长主要受土壤pH控制,内在机制是交换性铝和交换性钙交互影响,随交换性铝减少和/或交换性钙增加,玉米生物量增加。在最佳生长下,第四纪红土和红砂岩的pH临界值、交换性铝临界值相当(pH 5.5、交换性铝0.13 cmol·kg-1);而板页岩的pH及交换性铝临界值都较高(pH 5.8、交换性铝0.16 cmol·kg-1),其交换性钙也较高(5.5 cmol·kg-1),意味着在三种母质发育的红壤中板页岩对酸害的缓冲最差,但对铝毒害的忍耐最强。
图 3为玉米生物量与土壤交换性铝、交换性钙的关系。随交换性铝含量的增加,玉米生物量减小;随交换性钙含量的增加,玉米生物量增加;当交换性钙含量>6 cmol·kg-1时,玉米生长受到一定抑制,尤其是板页岩表现更明显。过量添加石灰,一方面可能混合不够均匀、局部碱度过大,另一方面可能钙有效性过高,引起土壤钾、钙、镁等营养失衡,进而抑制磷等元素吸收,引起玉米生物量一定程度的下降[25, 27]。图 3也表明第四纪红土和红砂岩上玉米生物量随交换性铝含量的增加快速下降,即对铝毒害的耐受性极差;而板页岩发育的红壤中直至交换性铝≥2 cmol·kg-1,玉米生物量才明显下降,暗示对铝毒害有较强的耐性,印证了表 3的结论。

|
| 图 3 玉米地上生物量与交换性铝和交换性钙的关系 Figure 3 Relationships between maize shoot biomass and exchangeable aluminum and calcium |
总之,玉米生物量随土壤pH降低而降低的主要原因可能是,一方面,随着土壤pH降低交换性铝含量随之增加,对玉米根系产生毒害作用,抑制其生长;另一方面,由于土壤pH的下降,交换性钙含量减少,导致玉米营养元素尤其是钙元素的缺乏[4-7]。综上所述,三种母质发育的红壤,随着土壤pH的降低,玉米生物量下降的主要原因是交换性铝增加和/或交换性钙减少,而这二者的交互作用决定了玉米生物量的下降幅度。三种母质发育的红壤的pH、交换性铝、交换性钙临界值表现出较大差异。与第四纪红土和红砂岩相比较,玉米在板页岩上对酸较为敏感、对铝的耐受力略高。其机制可能是不同母质土壤具有不同的缓冲能力[5, 11]。
图 4是三个母质发育的红壤的酸碱缓冲曲线。根据滴定曲线及前人研究结果[29-30],选取pH 4~7区间以直线方程拟合求得三个母质的酸碱缓冲容量分别为:第四纪红土18.9 mmol·kg-1·pH-1,板页岩23.4 mmol·kg-1·pH-1,红砂岩21.3 mmol·kg-1·pH-1。三种母质红壤原pH值均为4.8左右,而玉米正常生长的pH临界值分别为5.48、5.82、5.54,板页岩要将土壤pH调至目标值5.82所需石灰用量最多。因此加入板页岩红壤的钙最多,土壤交换性钙含量也最多。而钙对铝毒有抑制作用,因此在板页岩上玉米表现为能耐受较大的交换性铝含量。

|
| 横轴正值表示加碱,负值表示加酸 图 4 不同母质发育的红壤酸碱缓冲曲线 Figure 4 Acid-base buffering curves of red soils developed from different parent materials |
(1)玉米生物量与土壤pH的关系可用双直线方程很好地拟合,决定系数均大于0.9,达到极显著水平。其具体表现为,土壤pH临界点为5.5左右,母质不同,临界点略有差异。土壤pH小于pH临界点时,玉米生物量随土壤pH的增加呈线性增加趋势。大于临界点时,生物量基本保持不变(第四纪红土)或略有下降(板页岩、红砂岩)。
(2)土壤pH与交换性铝的关系表现为,当土壤pH小于pH临界点时,随着土壤pH的增加,交换性铝的含量直线下降,添加的石灰中和了土壤中交换性铝。当土壤pH高于pH临界点时,交换性铝含量接近0,基本保持不变。
(3)土壤pH与交换性钙的关系表现为,第四纪红土土壤交换性钙含量随土壤pH增加线性增加;当土壤pH高于pH临界点时,板页岩、红砂岩土壤交换性钙含量随土壤pH增加而线性增加;当土壤pH低于pH临界点时,土壤交换性钙含量基本保持不变,且值很小。
(4)不同母质发育的红壤,其土壤pH、交换性铝、交换性钙的临界值分别为:第四纪红土pH 5.48、交换性铝0.14 cmol·kg-1、交换性钙4.59 cmol·kg-1;板页岩pH 5.82、交换性铝0.16 cmol·kg-1、交换性钙5.46 cmol·kg-1;红砂岩pH 5.54、交换性铝0.13 cmol·kg-1、交换性钙3.06 cmol·kg-1。
(5)三种母质红壤玉米生长对pH及交换性铝和交换性钙的不同响应可能是酸碱缓冲容量有差别:板页岩最大,为23.4 mmol·kg-1·pH-1,红砂岩次之,为21.3 mmol·kg-1·pH-1,第四纪红土最小,为18.9 mmol·kg-1·pH-1,所以板页岩发育的红壤改良至目标pH 5.82,所需石灰用量最大。
| [1] |
朱祖祥. 中国农业百科全书:土壤卷[M]. 北京: 中国农业出版社, 1996. ZHU Zu-xiang. Encyclopedia of Chinese agriculture:Soil volume[M]. Beijing: China Agricultural Press, 1996. |
| [2] |
赵其国, 黄国勤, 马艳芹. 中国南方红壤生态系统面临的问题及对策[J]. 生态学报, 2013, 33(24): 7615-7622. ZHAO Qi-guo, HUANG Guo-qin, MA Yan-qin. The problems in red soil ecosystem in southern of China and its countermeasures[J]. Acta Ecologica Sinica, 2013, 33(24): 7615-7622. |
| [3] |
于天仁, 季国亮, 丁昌璞. 可变电荷土壤的电化学[M]. 北京: 科学出版社, 1996. YU Tian-ren, JI Guo-liang, DING Chang-pu. Electrochemistry of variable-charge soils[M]. Beijing: Science Press, 1996. |
| [4] |
Brennan R F, Mda B, Bowden J W. Potassium deficiency, and molybdenum deficiency and aluminium toxicity due to soil acidification, have become problems for cropping sandy soils in south-western Australia[J]. Animal Production Science, 2004, 44(10): 1031-1039. DOI:10.1071/EA03138 |
| [5] |
Fageria N K, Baligar V C. Ameliorating soil acidity of tropical oxisols by liming for sustainable crop production[J]. Advances in Agronomy, 2008, 99(8): 345-399. |
| [6] |
Zheng S J. Crop production on acidic soils:Overcoming aluminium toxicity and phosphorus deficiency[J]. Annals of Botany, 2010, 106(1): 183-184. DOI:10.1093/aob/mcq134 |
| [7] |
吴道铭, 傅友强, 于智卫, 等. 我国南方红壤酸化和铝毒现状及防治[J]. 土壤, 2013, 45(4): 577-584. WU Dao-ming, FU You-qiang, YU Zhi-wei, et al. Status of red soil acidification and aluminum toxicity in South China and prevention[J]. Soils, 2013, 45(4): 577-584. |
| [8] |
Liu D L, Helyar K R, Conyers M K, et al. Response of wheat, triticale and barley to lime application in semi-arid soils[J]. Field Crops Research, 2004, 90(2): 287-301. |
| [9] |
Kemmitt S J, Wright D, Goulding K W T, et al. pH regulation of carbon and nitrogen dynamics in two agricultural soils[J]. Soil Biology & Biochemistry, 2006, 38(5): 898-911. |
| [10] |
Kidd P S, Proctor J. Effects of aluminium on the growth and mineral composition of Betula pendula Roth[J]. Journal of Experimental Botany, 2000, 51(347): 1057-1066. DOI:10.1093/jexbot/51.347.1057 |
| [11] |
Baquy M A, Li J Y, Xu C Y, et al. Determination of critical pH and Al concentration of acidic Ultisols for wheat and canola crops[J]. Solid Earth, 2017, 8: 149-159. DOI:10.5194/se-8-149-2017 |
| [12] |
孟赐福, 水建国, 方承先. 红壤施用石灰对玉米产量和肥料利用率的影响[J]. 浙江农业学报, 1998, 10(1): 23-27. MENG Ci-fu, SHUI Jian-guo, FANG Cheng-xian. Effects of liming and yield and fertilizer utilization efficiency of maize grown on red soils[J]. Acta Agriculturae Zhejiangensis, 1998, 10(1): 23-27. |
| [13] |
秦瑞君, 陈福兴. 湘南红壤作物苗期铝中毒的研究[J]. 植物营养与肥料学报, 1999, 5(1): 50-55, 84. QIN Rui-jun, CHEN Fu-xing. The aluminum toxicity of some crop seedlings in red soil of Southern Hunan[J]. Plant Nutrition and Fertilizer Science, 1999, 5(1): 50-55, 84. DOI:10.11674/zwyf.1999.0109 |
| [14] |
魏守兴, 谢子四, 李志阳, 等. 广西主要蕉园土壤肥力调查及评价[J]. 热带作物学报, 2012, 33(8): 1371-1377. WEI Shou-xing, XIE Zi-si, LI Zhi-yang, et al. Soil fertility investigation and evaluation for banana gardens in Guangxi[J]. Chinese Journal of Tropical Crops, 2012, 33(8): 1371-1377. |
| [15] |
金媛. 陕西茶园土壤养分评价研究[D]. 杨凌: 西北农林科技大学, 2014. JIN Yuan. Research on evaluation of soil nutrients in tea garden of Shaanxi Province[D]. Yangling:Northwest A & F University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10712-1014430170.htm |
| [16] |
Cronan C S, Grigal D F. Use of calcium/aluminum ratios as indicators of stress in forest ecosystems[J]. Journal of Environmental Quality, 1995, 24(2): 209-226. |
| [17] |
Alvarez E, Fernandezmarcos M L, Monterroso C, et al. Application of aluminium toxicity indices to soils under various forest species[J]. Forest Ecology & Management, 2005, 211(3): 227-239. |
| [18] |
成杰民, 胡光鲁, 潘根兴. 用酸碱滴定曲线拟合参数表征土壤对酸缓冲能力的新方法[J]. 农业环境科学学报, 2004, 23(3): 569-573. CHENG Jie-min, HU Guang-lu, PAN Gen-xing. New method for evaluating buffering capacity and equilibrium pH of paddy soil with simulation parameter[J]. Journal of Agro-Environment Science, 2004, 23(3): 569-573. |
| [19] |
雷永程. 长期施肥土壤的酸碱缓冲性能及红壤石灰改良[D]. 福州: 福建农林大学, 2010. LEI Yong-cheng. Acid-base buffering ability of long-term fertilization soil & red soil improvement with quicklime[D]. Fuzhou:Fujian Agriculture and Forest University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10389-2010181775.htm |
| [20] |
蔡泽江. 长期施肥下红壤酸化特征及影响因素[D]. 北京: 中国农业科学院, 2010. CAI Ze-jiang. Acidification characteristics of red soil under long-term fertilization and effect factors[D]. Beijing:Chinese Academy of Agricultural Sciences, 2010. http://cdmd.cnki.com.cn/Article/CDMD-82101-2010170984.htm |
| [21] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Analysis in soil agrochemistry[M]. 3rd Edition. Beijing: China Agricultural Press, 2000. |
| [22] |
Zhang X B, Sun N, Wu L H, et al. Effects of enhancing soil organic carbon sequestration in the topsoil by fertilization on crop productivity and stability:Evidence from long-term experiments with wheat-maize cropping systems in China[J]. Science of the Total Environment, 2016, 562: 247-259. DOI:10.1016/j.scitotenv.2016.03.193 |
| [23] |
Zhang H M, Wang B R, Xu M G, et al. Crop yield and soil responses to long-term fertilization on a red soil in Southern China[J]. Pedoshpere, 2009, 19(2): 199-207. |
| [24] |
于世举. 石灰改良酸性土壤的效果[J]. 现代农业科技, 2012(1): 278. YU Shi-ju. Effect of lime on improving acid soil[J]. Modern Agricultural Science and Technology, 2012(1): 278. |
| [25] |
敖俊华, 黄振瑞, 江永, 等. 石灰施用对酸性土壤养分状况和甘蔗生长的影响[J]. 中国农学通报, 2010, 26(15): 266-269. AO Jun-hua, HUANG Zhen-rui, JIANG Yong, et al. Effects of applying lime on the properties of acid soil and the growth of sugarcane[J]. Chinese Agricultural Science Bulletin, 2010, 26(15): 266-269. |
| [26] |
胡敏, 向永生, 鲁剑巍. 石灰用量对酸性土壤酸度及大麦幼苗生长的影响[J]. 中国农业科学, 2016, 49(20): 3896-3903. HU Min, XIANG Yong-sheng, LU Jian-wei. Effects of lime dosage on acidity of acid soil and growth of barley seedlings[J]. Chinese Agricultural Science, 2016, 49(20): 3896-3903. DOI:10.3864/j.issn.0578-1752.2016.20.004 |
| [27] |
Sims J T, Ellis B G. Adsorption and availability of phosphorous following the application of limestone to an acid, aluminous soil[J]. Soil Science Society of America Journal, 1983(5): 888-893. |
| [28] |
Kariuki S K, Zhang H, Schroder J L, et al. Hard red winter wheat cultivar responses to a pH and aluminum concentration gradient[J]. Agronomy Journal, 2007, 99(1): 88-98. DOI:10.2134/agronj2006.0128 |
| [29] |
姜军, 徐仁扣, 赵安珍. 用酸碱滴定法测定酸性红壤的pH缓冲容量[J]. 土壤通报, 2006, 37(6): 1247-1248. JIANG Jun, XU Ren-kou, ZHAO An-zhen. Determination of pH buffer capacity of acid red soils by acid-base titration[J]. Chinese Journal of Soil Science, 2006, 37(6): 1247-1248. |
| [30] |
Aitken R L, Moody P W, Aitken R L, et al. The effect of valence and ionic strength on the measurement of pH buffer capacity[J]. Australian Journal of Soil Research, 1994, 32(5): 975-984. DOI:10.1071/SR9940975 |
 2017, Vol. 36
2017, Vol. 36







