文章信息
- 李增强, 李丹丹, 赵炳梓, 张佳宝
- LI Zeng-qiang, LI Dan-dan, ZHAO Bing-zi, ZHANG Jia-bao
- 秸秆施用和作物种植对土壤团聚体和微生物群落组成的影响
- Effects of straw application and crop planting on soil aggregates and microbial community composition
- 农业环境科学学报, 2017, 36(8): 1557-1565
- Journal of Agro-Environment Science, 2017, 36(8): 1557-1565
- http://dx.doi.org/10.11654/jaes.2016-1658
文章历史
- 收稿日期: 2016-12-26
2. 浙江省农业科学院环境资源与土壤肥料研究所, 杭州 310021
2. Institute of Environment and Resource & Soil Fertilizers, Zhejiang Academy of Agricultural Sciences, Hangzhou 310021, China
土壤团聚体是土壤结构的基本组成单位,是土壤有机碳和养分的贮存库,为各种土壤生物提供了各自所需的生境[1]。不同粒径土壤团聚体的数量分布和空间排列方式决定了土壤中气体和水分的流动过程,进而影响土壤生物活性和物质循环过程[2]。土壤团聚体稳定性是反映土壤结构的重要指标,与土壤抗侵蚀能力有密切关系[3]。秸秆还田是国内大力推广的一种耕作方式,研究表明秸秆还田能够显著影响土壤团聚体的数量分布和稳定性[4-7]。目前关于秸秆还田对土壤团聚体影响的研究主要集中在秸秆还田的数量和方式[4-6],秸秆种类[7-8],秸秆还田配合施肥、耕作等田间管理措施[9-10],大部分相关试验为田间试验或室内培养试验,两者均忽略了作物生长对团聚体形成及稳定的影响。秦瑞杰等[11]发现种植冰草和紫花苜蓿能够增加土壤团聚体稳定性,而种植高羊茅则对土壤团聚体稳定性无显著影响。宋日等[12]发现将玉米和大豆的根系分泌物加入到土壤中能够显著增加大团聚体(>1 mm)比例,提高团聚体稳定性。因此,明确秸秆施用条件下作物种植对土壤团聚体形成及稳定的影响,研究两者的交互作用,对于更好的评价秸秆还田的效果具有重要意义。
土壤微生物能够参与土壤有机质分解、养分循环和能量流动,在土壤肥力形成和发展的许多方面起着关键作用[13]。土壤微生物也是参与土壤团聚体形成的重要因素[14],研究表明真菌能够通过分泌物的粘结和菌丝网络的缠绕作用促进大团聚体的形成,增加其稳定性[3]。秸秆还田、作物种植以及土壤水分等管理措施均能够显著影响微生物生物量及其群落结构[15-17]。目前磷脂脂肪酸(PLFA)分析常被用于土壤微生物的研究[18-19]。PLFA是微生物细胞膜的重要成分之一,不同微生物的PLFA组成与结构各异,因此通过对PLFA的定量测定可以揭示微生物特定群落生物量以及群落组成[18]。本文通过开展温室盆栽试验,研究秸秆施用、作物种植以及两者的交互作用对土壤团聚体稳定性以及微生物群落组成的影响,探讨不同管理措施下土壤团聚体形成及稳定的影响因素,为提高土壤生产力及保护生态环境提供理论依据。
1 材料与方法 1.1 试验材料供试土壤于2007年9月采集自中国科学院封丘农业生态国家实验站(114°24′E,35°00′N)。该实验站位于河南省封丘县潘店镇,当地气候属于北暖温带半干旱型季风气候区,年平均气温为13.9 ℃,年降雨量为615 mm。当地种植制度为冬小麦-夏玉米轮作,土壤质地为砂壤土,土壤类型为潮土[干润冲积新成土,中国土壤系统分类检索(2001)]。采集表层(0~20 cm)土壤样品,避光风干,过8 mm筛,备用。实验开始前土壤基本理化性质:有机碳8.50 g·kg-1,全氮0.64 g·kg-1,速效氮27.63 mg·kg-1,速效磷20.14 mg·kg-1,速效钾86.13 g·kg-1,pH 8.23。玉米秸秆来自以前的盆栽试验所保留的地上部全株秸秆,品种为郑单958,其基本化学性质:总碳439.14 g·kg-1,总氮22.83 g·kg-1,总磷1.68 g·kg-1,总钾7.85 g·kg-1。
1.2 试验设计盆栽试验在中国科学院南京土壤研究所温室进行,于2012年11月开始到2013年5月结束(共180 d)。实验共分4个处理:不种作物,不添加玉米秸秆(CON);不种作物,添加玉米秸秆(SR);作物(小麦)种植,不添加玉米秸秆(CP);作物种植,添加秸秆(SRCP)。每个处理分别设置40%(W40)和80%(W80)田间持水量。每个处理重复3次,共计24盆。每盆(直径23 cm,高25 cm)装填6 kg风干土,每个处理均施用氮、磷、钾肥(分别以分析纯的尿素作氮肥,重过磷酸钙作磷肥,硫酸钾作钾肥,用量为150 mg N·kg-1,110 mg P2O5·kg-1,82.5 mg K2O·kg-1),以保证小麦的正常生长。对于添加玉米秸秆处理,12 g烘干的粉碎玉米秸秆(过1 mm筛)加入土壤中,肥料和秸秆均于播种前与土壤充分混合。对于种植作物处理,每盆播种30粒小麦(品种选择矮抗58),出苗后保留15棵生长健壮的麦苗。试验过程中每天采用高精度磅秤称重,并用蒸馏水补充损失的水分至40%和80%田间持水量。除下雨天外,所有处理均在室外。
1.3 样品测定小麦收获后,按不同器官将小麦分开烘干、称重、计算生物量。同时取原状土样和混合土样,其中原状土样风干后用于测定团聚体组成,混合土样一部分风干后用于测定土壤多糖和球囊霉素含量,另一部分保存于-20 ℃冰箱中用于测定土壤微生物学性质。
土壤水稳性团聚体的测定按照Elliott[20]的方法进行。称取20 g风干原状土样放在团聚体分析套筛(孔径依次为2、1、0.5、0.25、0.053 mm)上,利用自制振荡仪上下振荡2 min。收集残留在筛上的土壤,60 ℃烘干、称重,计算水稳性团聚体的质量分数。土壤团聚体的稳定性用团聚体平均重量直径(Mean Weight Diameter,MWD)和几何平均直径(Geometry Mean Diameter,GMD)表示,其相应的计算公式如下:
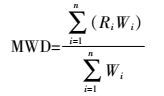
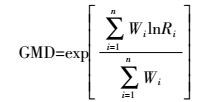
式中:Ri为某级别团聚体平均直径;Wi为该级别团聚体干重。
土壤多糖按照Puget等[21]的方法测定。在80 ℃恒温水浴锅中提取24 h,离心获取土壤上清液。采用苯酚-浓硫酸比色法测定上清液中的多糖,以葡萄糖溶液作为标准曲线计算多糖含量。
球囊霉素采用改良的Wright等[22]方法测定。风干土样采用柠檬酸盐缓冲液提取多次,直至上清液无红棕色为止;将数次的提取液合并,高速离心去除土壤颗粒;吸取上清液加入三氯乙酸溶液,离心移除上清液;加入0.1 mol·L-1 NaOH溶液将沉淀全部溶解;将溶液转入透析袋中,透析8 h以上,在此期间多次更换透析液,吸取透析后的溶液,加入预处理过的考马斯亮蓝溶液,比色。以牛血清蛋白(ABS)作为标准曲线计算土壤中球囊霉素含量。
PLFA采用Frostegård等[19]方法测定。用修正的Bligh和Dyer提取液(柠檬酸缓冲液:甲醇:氯仿体积比为0.8:2:1)振荡提取磷脂,提取两次。合并两次提取液中的氯仿部分,氮气吹干;用氯仿溶解氮气干燥的样品,转移至硅胶柱中,依次采用氯仿、丙酮和甲醇洗脱硅胶柱,收集甲醇相,氮气吹干;得到的磷脂用氢氧化钾-甲醇溶液皂化,然后氮气吹干,-20 ℃冷冻保存。用正己烷将样品溶出,用Agilent 6850气相色谱仪测定。色谱峰鉴定及峰面积计算采用MIDI软件。所用的溶剂均为色谱纯。
脂肪酸分子式以“X:YωZ(c/t)”表示,其中“X”代表脂肪酸分子的碳原子总数,“Y”代表不饱和烯键的数目,“ω”代表烯键距离羧基的位置,“Z”为烯键或环丙烷链的位置;前缀“i”(iso)代表异构甲基支链(距甲基端的第二个碳原子),“a”(anteiso)代表前异构甲基支链(距甲基端的第三个碳原子),“cy”代表环丙基支链,后缀“c”和“t”分别代表顺式和反式同分异构体。所有PLFA单体的总量表示群落微生物生物量,微生物群落脂肪酸标志物的选择按照Frosteg?覽rd等[19]方法进行,选择i14:0、14:0、i15:0、a15:0、16:0、i16:0、17:0、i17:0、a17:0、18:0、16:1ω7c、cy17:0、17:1ω8c、18:1ω7c、16:0 2OH、cy19:0、20:0和18:1ω9c作为细菌特征脂肪酸,革兰氏阳性菌(G+)特征脂肪酸选择i14:0、i15:0、a15:0、i17:0、a17:0、i16:0,革兰氏阴性菌(G-)的特征脂肪酸选择16:0 2OH、16:1ω7c、17:1ω8c、18:1ω7c、cy17:0、cy19:0、18:1ω9c,真菌选择16:1ω5c和18:2ω6,9c作为特征脂肪酸,其中16:1ω5c作为丛枝真菌特征脂肪酸,10me16:0、10me17:0和10me18:0作为放线菌特征脂肪酸。
1.4 数据分析本研究所列结果为3次重复测定值的平均值,所有结果均以烘干土重为基础(105 ℃,24 h),采用Microsoft Excel 2007软件对数据进行整理,采用SPSS 18.0统计软件进行多因素方差分析和相关性分析。数据分析前均进行了Shapiro-Wilk正态分布和levene方差齐质性检验。
2 结果与分析 2.1 小麦生物量由图 1可知,秸秆施用对小麦根、茎叶、籽粒及总生物量无显著影响(P > 0.05)。W80处理的小麦根、茎叶、籽粒和总生物量分别比W40处理高20%、43%、56%和48%,两处理间差异显著(P < 0.05)。秸秆施用和水分的交互作用对小麦根、茎叶、籽粒及总生物量无显著影响(P > 0.05)。

|
| 图 1 不同处理的小麦根、茎叶、籽粒以及总生物量 Figure 1 The wheat root, straw, grain and total biomass in different treatments |
不同处理及土壤水分对团聚体的影响如表 1所示。与CON处理相比,SR、CP和SRCP处理分别显著增加了>2、2~1、1~0.5、0.5~0.25 mm粒径土壤团聚体数量(P < 0.05),其中SR处理分别增加47%、11%、17%和26%,CP处理分别增加59%、24%、24%和21%,SRCP处理分别增加106%、21%、36%和16%。然而SR、CP和SRCP处理的0.25~0.053 mm和<0.053 mm粒径土壤团聚体数量均显著低于CON处理(P < 0.05)。W80处理的>2、2~1、0.5~0.25 mm粒径土壤团聚体数量分别比W40处理高17%、8%和11%,两处理间差异显著(P < 0.05)。W80处理的<0.053 mm粒径土壤团聚体数量显著低于W40处理(P < 0.05)。
 |
与CON处理相比,SR、CP和SRCP处理均显著增加了团聚体MWD和GMD(P < 0.05),其中SR处理分别增加了18%和17%,CP处理分别增加了22%和22%,SRCP处理分别增加了33%和30%。W80处理的MWD和GMD分别比W40处理高6%和8%,两处理间差异显著(P < 0.05)。处理和水分的交互效应对不同粒径土壤团聚体数量、MWD和GMD均无显著影响(P > 0.05)。
2.3 土壤多糖和球囊霉素由表 2可知,SR、CP和SRCP处理的多糖含量分别比CON处理增加了22%、9%和35%,其中SR和SRCP处理显著高于CON处理(P < 0.05),而CP处理与CON处理间无显著差异(P > 0.05)。W80处理的多糖含量比W40处理高19%,两处理间差异显著(P < 0.05)。不同处理对球囊霉素含量无显著影响(P > 0.05),W80和W40处理的球囊霉素含量无显著差异(P > 0.05)。处理和水分的交互效应对多糖和球囊霉素含量均无显著影响(P > 0.05)。
 |
如表 3所示,CON和SR处理的PLFA含量无显著差异(P > 0.05)。与CON处理相比,CP和SRCP处理均显著增加了革兰氏阳性菌、革兰氏阴性菌、细菌、丛枝真菌、放线菌和总PLFA含量(P < 0.05),其中CP处理分别增加36%、36%、23%、50%、30%和25%,SRCP处理分别增加39%、43%、29%、63%、33%和30%。CP和CON处理的真菌含量无显著差异(P > 0.05),而SRCP处理的真菌含量显著高于CON处理(P < 0.05)。不同处理对革兰氏阳性菌/革兰氏阴性菌(G+/G-)无显著影响(P > 0.05)。SR处理的真菌/细菌(F/B)与CON处理无显著差异(P > 0.05),而两处理的F/B值均显著低于CP和SRCP处理(P < 0.05)。
 |
W80处理的革兰氏阳性菌、革兰氏阴性菌、细菌、丛枝真菌、真菌、放线菌和总PLFA含量分别比W40处理高23%、23%、22%、22%、29%、25%和23%,两处理间差异显著(P < 0.05)。然而,W80和W40处理的G+/G-和F/B均无显著差异(P > 0.05)。处理和水分的交互作用对PLFA含量和PLFA比例均无显著影响(P > 0.05)。
基于23种PLFA的主成分分析发现,主成分1(PC1)和主成分2(PC2)分别解释了65.5%和13.7%的变量(图 2)。CP和SRCP处理均位于PC1的右半轴,而CON和SR处理均位于PC1的左半轴,表明作物种植显著改变了微生物群落组成。PC2主要体现了不同土壤水分对微生物群落组成的影响。18:1ω7c、16:02OH、16:1ω5c、18:1ω9c、cy19:0、10me 18:0、17:0、14:0和16:0在PC1上载荷值的绝对值较高,是影响PC1区分度的主要PLFA;而i16:0、a17:0、i17:0、18:2ω6,9c和17:1ω8c在PC2上载荷值的绝对值较高,是影响PC2区分度的主要PLFA。

|
| 图 2 不同处理的PLFA主成分分析(A)及PLFA载荷值(B) Figure 2 Principal component analysis of PLFA in different treatments(A) and loading value of PLFA(B) |
由表 4可知,不同粒径大团聚体(>0.25 mm)之间均存在显著正相关关系(P < 0.05),并且MWD和GMD均与不同粒径大团聚体存在显著正相关关系(P < 0.05);多糖和丛枝真菌含量与各粒径大团聚体及MWD和GMD之间存在显著正相关关系(P < 0.05);球囊霉素含量与>0.5 mm粒径团聚体及MWD和GMD之间也存在显著正相关关系(P < 0.05)。
 |
已有研究表明,秸秆还田能够增加土壤养分含量和有效性,改善土壤物理性状和水分条件,从而导致小麦生物量和产量的增加[23],然而也有研究发现秸秆还田对小麦生物量和产量无显著影响[24-25]。黄婷苗等[26]利用陕西关中平原的两年田间定位试验发现,与玉米秸秆不还田相比,秸秆还田对小麦生物量和产量的影响均表现出低施氮量降低,高施氮量增加的趋势。在本试验条件下秸秆施用对小麦根、茎叶、籽粒和总生物量无显著影响,与Mupangwa等[24]研究结果一致。一方面这可能是因为本试验仅进行了一季,时间较短,秸秆施用对土壤性质的改良效果还未体现在生物量和产量方面;另一方面可能是因为秸秆施用对小麦生物量和产量的影响也受到其他因素的制约,从而造成本试验条件下秸秆施用对小麦生物量和产量无显著影响。
本研究结果表明秸秆施用或作物种植均能显著增加大团聚体(>0.25 mm)数量,提高团聚体稳定性,与秦瑞杰等[11]、张鹏等[4]的研究结果相同。已有的研究认为土壤多糖和球囊霉素是土壤团聚体的重要胶结物质,对于大团聚体形成和稳定起着重要作用[21-22]。多糖主要来源于土壤微生物以及外源有机物质的分解过程[27],对土壤颗粒有很强的黏着力,能够黏着于土壤黏粒表面并填充于土壤孔隙表面,促进土壤团聚体的形成[28]。本研究结果也表明秸秆施用较对照处理显著增加了土壤多糖含量(表 2),从而有利于大团聚体的形成和稳定。相关分析进一步表明土壤多糖含量与大团聚体数量及稳定性存在显著正相关关系(表 4)。然而,作物种植与对照处理具有相似的多糖和球囊霉素含量(表 2),表明在本试验条件下作物种植可能通过其他途径促进土壤大团聚体的形成和稳定。Bronick等[3]指出根系生长过程中能够通过根系缠绕作用提高土壤团聚体稳定性,本研究发现作物种植较对照处理显著提高了丛枝真菌含量(表 3)。先前的研究表明,丛枝真菌通过分泌物的粘结和菌丝网络对土壤颗粒的缠绕作用,对大团聚体的形成及稳定起着重要的作用[29]。相关分析也进一步表明,丛枝真菌含量与大团聚体数量及稳定性存在显著正相关关系(表 4)。
另外,本研究发现SRCP处理较SR和CP处理显著增加了>2 mm和1~0.5 mm粒径土壤团聚体数量以及团聚体MWD和GMD,表明秸秆施用和作物种植对大团聚体的形成和稳定产生正交互作用。先前研究表明秸秆还田条件下,作物种植或添加根系分泌物能够显著促进秸秆的分解[30]。由于多糖能够显著影响土壤团聚体的形成和稳定[21],本研究结果可能是因为作物种植促进了秸秆的分解,导致更多的多糖进入土壤(表 2),从而提高了大团聚体数量和稳定性。
土壤微生物是土壤一系列生化过程的主要参与者,与土壤肥力的形成和发展有密切关系[13]。本研究发现,CON和SR处理具有相似的PLFA含量,而CP和SRCP处理较CON处理显著增加了PLFA含量,表明本试验条件下秸秆施用对土壤微生物数量影响较小,而作物种植是影响微生物数量的重要因素。Bird等[15]发现与裸地相比,作物种植显著增加了革兰氏阴性菌含量,改变了微生物群落组成;Wang等[31]也发现秸秆还田对土壤PLFA含量影响不显著;Soon等[32]在研究了秸秆翻压和覆盖还田对微生物群落的影响后也认为,在植物生长过程中根系对微生物的影响显著大于秸秆。与秸秆相比,根系分泌物主要由氨基酸、糖类等小分子有机物构成,更容易被微生物利用[33],从而有利于微生物的生长和繁殖。
真菌与细菌的比值(F/B)通常被用来表征微生物群落组成的变化[34]。本研究发现CON和SR处理具有相似的F/B,而CP和SRCP处理较CON和SR处理显著增加了F/B,表明作物种植显著改变了微生物群落组成。主成分分析也进一步表明作物种植处理的微生物群落组成明显不同于不种植处理。本研究结果与Bird等[15]、Yu等[34]研究结果相似。这可能与以下因素有关:首先,作物生长过程中会造成地表遮阴,降低土壤温度,从而改变微生物群落组成[35];其次,由于不同微生物群落对不同有机物质的利用能力不同[36],与秸秆或土壤有机质相比,根系分泌物的输入会造成微生物群落组成的改变;第三,作物生长需要从土壤中吸收大量的养分,造成土壤速效养分含量的降低,这也会导致微生物群落组成的改变[37]。
3.2 水分效应本研究表明增加土壤水分显著增加了小麦根、茎叶、籽粒和总生物量,与吕丽华等[38]的研究结果相似。这主要是因为干旱胁迫会降低作物的光合速率以及同化物从营养器官向生殖器官的分配[38]。另外,增加土壤水分显著增加了土壤大团聚体数量及稳定性。这可能与以下因素有关:首先增加土壤水分显著增加了小麦根生物量(图 1),有利于根系对土壤颗粒的缠绕导致更多的根系分泌物进入土壤中,从而有利于大团聚体的形成;其次增加土壤水分能够促进秸秆及土壤有机质的分解,增加多糖含量(表 2),从而有利于大团聚体的形成;第三,增加土壤水分显著增加了土壤丛枝真菌含量(表 3),从而促进了土壤大团聚体的形成,提高了其稳定性。
增加土壤水分显著增加了微生物含量,但是土壤水分对微生物群落组成影响不显著。在低水分条件下,微生物将会在其细胞内积累大量的渗透物质,避免细胞内水分的流失[39]。这些渗透物质的合成需要消耗大量的能量,导致更少的能量用于微生物的生长和繁殖,从而导致微生物数量降低。另外,Williams等[40]认为明显的微生物群落组成变化依赖于不同土壤含水量的长期累积效应,由于本试验仅持续了180 d,这种短期的水分效应可能不足以引起土壤微生物群落结构的明显变化。
4 结论单独秸秆施用或作物种植均能显著增加>0.25 mm粒径土壤团聚体数量,提高团聚体稳定性,并且秸秆施用配合作物种植能够进一步提高团聚体稳定性。单独秸秆施用以及秸秆施用配合作物种植均显著增加多糖含量,单独作物种植以及秸秆施用配合作物种植均显著增加丛枝真菌含量,多糖和丛枝真菌含量均与>0.25 mm粒径团聚体数量以及团聚体稳定性存在显著正相关关系。作物种植改变了土壤微生物群落组成。增加土壤水分能够显著增加>1 mm和0.5~0.25 mm粒径团聚体数量、多糖含量以及微生物PLFA含量。
| [1] |
Six J, Bossuyt B, Degryze H, et al. A history of research on the link between(micro) aggregates, soil biota, and soil organic matter dynamics[J]. Soil and Tillage Research, 2004, 78(1): 7-31. |
| [2] |
Dexter A R. Advances in characterization of soil structure[J]. Soil and Tillage Research, 1988, 11(3/4): 199-238. |
| [3] |
Bronick C J, Lal R. Soil structure and management:A review[J]. Geoderma, 2005, 124(1): 3-22. |
| [4] |
张鹏, 贾志宽, 王维, 等. 秸秆还田对宁南半干旱地区土壤团聚体特征的影响[J]. 中国农业科学, 2012, 45(8): 1513-1520. |
| [5] |
孙汉印, 姬强, 王勇, 等. 不同秸秆还田模式下水稳性团聚体有机碳的分布及其氧化稳定性研究[J]. 农业环境科学学报, 2012, 31(2): 369-376. SUN Han-yin, JI Qiang, WANG Yong, et al. The distribution of water-stable aggregate-associated organic carbon and its oxidation stability under different straw returning modes[J]. Journal of Agro-Environment Science, 2012, 31(2): 369-376. |
| [6] |
王海霞, 孙红霞, 韩清芳, 等. 免耕条件下秸秆覆盖对旱地小麦田土壤团聚体的影响[J]. 应用生态学报, 2012, 23(4): 1025-1030. WANG Hai-xia, SUN Hong-xia, HAN Qing-fang, et al. Effects of straw mulching on the soil aggregates in dryland wheat field under no-tillage[J]. Chinese Journal of Applied Ecology, 2012, 23(4): 1025-1030. |
| [7] |
Gentile R, Vanlauwe B, Six J. Litter quality impacts short-but not long-term soil carbon dynamics in soil aggregate fractions[J]. Ecological Applications, 2011, 21(3): 695-703. DOI:10.1890/09-2325.1 |
| [8] |
Le Guillou C, Angers D A, Leterme P, et al. Differential and successive effects of residue quality and soil mineral on water-stable aggregation during crop residue decomposition[J]. Soil Biology and Biochemistry, 2011, 43(9): 1955-1960. DOI:10.1016/j.soilbio.2011.06.004 |
| [9] |
田慎重, 王瑜, 李娜, 等. 耕作方式和秸秆还田对华北地区农田土壤水稳性团聚体分布及稳定性的影响[J]. 生态学报, 2013, 33(22): 7116-7124. TIAN Shen-zhong, WANG Yu, LI Na, et al. Effects of different tillage and straw systems on soil water-stable aggregate distribution and stability in the North China Plain[J]. Acta Ecologica Sinica, 2013, 33(22): 7116-7124. |
| [10] |
李录久, 吴萍萍, 耿言安, 等. 秸秆还田结合氮肥运筹管理对白土稻田土壤理化性状的影响[J]. 植物营养与肥料学报, 2016, 22(5): 1259-1266. LI Lu-jiu, WU Ping-ping, GENG Yan-an, et al. Effect of wheat straw addition with nitrogen application on physical-chemical properties of white paddy soil[J]. Journal of Plant Nutrition and Fertilizer, 2016, 22(5): 1259-1266. DOI:10.11674/zwyf.15351 |
| [11] |
秦瑞杰, 郑粉莉, 卢嘉. 草本植物生长发育对土壤团聚体稳定性影响的试验研究[J]. 水土保持研究, 2011, 18(3): 141-144. QIN Rui-jie, ZHENG Fen-li, LU Jia. The effect of herbaceous plant growth on the soil aggregate stability[J]. Research of Soil and Water Conservation, 2011, 18(3): 141-144. |
| [12] |
宋日, 刘利, 马丽艳, 等. 作物根系分泌物对土壤团聚体大小及其稳定性的影响[J]. 南京农业大学学报, 2009, 32(3): 93-97. SONG Ri, LIU Li, MA Li-yan, et al. Effect of crop root exudates on the size and stability of soil aggregate[J]. Journal of Nanjing Agricultural University, 2009, 32(3): 93-97. |
| [13] |
Cusack D F, Firestone M K. Changes in microbial community characteristics and soil organic matter with nitrogen additions in two tropical forests[J]. Ecology, 2011, 92(3): 621-632. DOI:10.1890/10-0459.1 |
| [14] |
Tisdall J M. Possible role of soil microorganisms in aggregation in soils[J]. Plant and Soil, 1994, 159(1): 115-121. DOI:10.1007/BF00000100 |
| [15] |
Bird J A, Herman D J, Firestone M K. Rhizosphere priming of soil organic matter by bacterial groups in a grassland soil[J]. Soil Biology and Biochemistry, 2011, 43(4): 718-725. DOI:10.1016/j.soilbio.2010.08.010 |
| [16] |
Guenet B, Lenhart K, Leloup J, et al. The impact of long-term CO2 enrichment and moisture levels on soil microbial community structure and enzyme activities[J]. Geoderma, 2012, 170(3): 331-336. |
| [17] |
Zhao S C, Li K J, Zhou W, et al. Changes in soil microbial community, enzyme activities and organic matter fractions under long-term straw return in north-central China[J]. Agriculture Ecosystems and Environment, 2016, 216: 82-88. DOI:10.1016/j.agee.2015.09.028 |
| [18] |
颜慧, 蔡祖聪, 钟文辉. 磷脂脂肪酸分析方法及其在土壤微生物多样性研究中的应用[J]. 土壤学报, 2006, 43(5): 851-859. YAN Hui, CAI Zu-cong, ZHONG Wen-hui. PLFA analysis and its applications in the study of soil microbial diversity[J]. Acta Pedologica Sinica, 2006, 43(5): 851-859. |
| [19] |
Frostegård A, Tunlid A, Bååth E. Phospholipid fatty acid composition, biomass, and activity of microbial communities from two soil types experimentally exposed to different heavy metals[J]. Applied Environmental Microbiology, 1993, 59(11): 3605-3617. |
| [20] |
Elliott E T. Aggregate structure and carbon, nitrogen, and phosphorus in native and cultivated soils[J]. Soil Science Society of America Journal, 1986, 50(3): 627-633. DOI:10.2136/sssaj1986.03615995005000030017x |
| [21] |
Puget P, Angers D A, Chenu C. Nature of carbohydrates associated with water-stable aggregates of two cultivated soils[J]. Soil Biology and Biochemistry, 1999, 31(1): 55-63. |
| [22] |
Wright S F, Upadhyaya A. Extraction of an abundant and unusual protein from soil and comparison with hyphal protein of arbuscular mycorrhizal fungi[J]. Soil Science, 1996, 161(9): 575-586. DOI:10.1097/00010694-199609000-00003 |
| [23] |
张亮, 黄婷苗, 郑险峰, 等. 施氮对秸秆还田冬小麦产量和水分利用率的影响[J]. 西北农林科技大学学报(自然科学版), 2013, 41(1): 49-54. ZHANG Liang, HUANG Ting-miao, ZHENG Xian-feng, et al. Effect of nitrogen fertilizer on yield and water use efficiency of winter wheat planted in the croplands with straw returning[J]. Journal of Northwest A & F University(Nat Sci Ed), 2013, 41(1): 49-54. |
| [24] |
Mupangwa W, Tomlow S, Walker S, et al. Effect of minimum tillage and mulching on maize(Zea mays L.) yield and water content of clayey and sandy soils[J]. Physics and Chemistry of the Earth, Parts A/B/C, 2007, 32(15-18): 1127-1134. DOI:10.1016/j.pce.2007.07.030 |
| [25] |
张传辉, 杨四军, 顾克军, 等. 秸秆还田对小麦碳氮转运和产量形成的影响[J]. 华北农学报, 2013, 28(6): 214-219. ZHANG Chuan-hui, YANG Si-jun, GU Ke-jun, et al. Effect of straw-returning on carbon and nitrogen assimilate translocation and yield formation in wheat[J]. Acta Agriculturae Boreali-Sinica, 2013, 28(6): 214-219. DOI:10.7668/hbnxb.2013.06.037 |
| [26] |
黄婷苗, 郑险峰, 侯仰毅, 等. 秸秆还田对冬小麦产量和氮、磷、钾吸收利用的影响[J]. 植物营养与肥料学报, 2015, 21(4): 853-863. HUANG Ting-miao, ZHENG Xian-feng, HOU Yang-yi, et al. Yield and N, P and K uptake and utilization of winter wheat affected by straw return to soil[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(4): 853-863. DOI:10.11674/zwyf.2015.0404 |
| [27] |
Kiem R, Kögel-Knabner I. Contribution of lignin and polysaccharides to the refractory carbon pool in C-depleted arable soils[J]. Soil Biology and Biochemistry, 2003, 35(1): 101-118. DOI:10.1016/S0038-0717(02)00242-0 |
| [28] |
Chaney K, Swift R S. Studies on aggregate stability:I. Re-formation of soil aggregates[J]. Journal of Soil Science, 1986, 37(2): 329-335. DOI:10.1111/ejs.1986.37.issue-2 |
| [29] |
Jastrow J D, Miller R M, Lussenhop J. Contributions of interacting biological mechanisms to soil aggregate stabilization in restored prairie[J]. Soil Biology and Biochemistry, 1998, 30(7): 905-916. DOI:10.1016/S0038-0717(97)00207-1 |
| [30] |
De Graaff M A, Classen A T, Castro H F, et al. Labile soil carbon inputs mediate the soil microbial community composition and plant residue decomposition rates[J]. New Phytologist, 2010, 188(4): 1055-1064. DOI:10.1111/j.1469-8137.2010.03427.x |
| [31] |
Wang J J, Li X Y, Zhu A N, et al. Effects of tillage and residue management on soil microbial communities in North China[J]. Plant Soil and Environment, 2012, 58(1): 28-33. |
| [32] |
Soon Y K, Lupwayi N Z. Straw management in a cold semi-arid region:Impact on soil quality and crop productivity[J]. Field Crops Research, 2012, 139: 39-46. DOI:10.1016/j.fcr.2012.10.010 |
| [33] |
Dennis P G, Miller A J, Hirsch P R. Are root exudates more important than other sources of rhizodeposits in structuring rhizosphere bacterial communities[J]. FEMS Microbiology Ecology, 2010, 72(3): 313-327. DOI:10.1111/fem.2010.72.issue-3 |
| [34] |
Yu W T, Bi M L, Xu Y G, et al. Microbial biomass and community composition in a Luvisol soil as influenced by long-term land use and fertilization[J]. Catena, 2013, 107(4): 89-95. |
| [35] |
Cookson W R, Osman M, Marschner P, et al. Controls on soil nitrogen cycling and microbial community composition across land use and incubation temperature[J]. Soil Biology and Biochemistry, 2007, 39(3): 744-756. DOI:10.1016/j.soilbio.2006.09.022 |
| [36] |
Paterson E, Osler G, Dawson L A, et al. Labile and recalcitrant plant fractions are utilised by distinct microbial communities in soil:Independent of the presence of roots and mycorrhizal fungi[J]. Soil Biology and Biochemistry, 2008, 40(5): 1103-1113. DOI:10.1016/j.soilbio.2007.12.003 |
| [37] |
de Vries F T, Hoffland E, van Eekeren N, et al. Fungal/bacterial ratios in grasslands with contrasting nitrogen management[J]. Soil Biology and Biochemistry, 2006, 38(8): 2092-2103. DOI:10.1016/j.soilbio.2006.01.008 |
| [38] |
吕丽华, 胡玉昆, 李雁鸣, 等. 灌水方式对不同小麦品种水分利用效率和产量的影响[J]. 麦类作物学报, 2007, 27(1): 88-92. LÜ Li-hua, HU Yu-kun, LI Yan-ming, et al. Effect of irrigating treatments on water use efficiency and yield of different wheat cultivars[J]. Journal of Triticeae Crops, 2007, 27(1): 88-92. DOI:10.7606/j.issn.1009-1041.2007.01.023 |
| [39] |
Beales N. Adaptation of microorganisms to cold temperatures, weak acid preservatives, low pH, and osmotic stress:A review[J]. Comprehensive Review in Food Science and Food Safety, 2004, 3(1): 1-20. DOI:10.1111/crfs.2004.3.issue-1 |
| [40] |
Williams M A, Ri ce, C W. Seven years of enhanced water availability influences the physiological, structural, and functional attributes of a soil microbial community[J]. Applied Soil Ecology, 2007, 35(3): 535-545. DOI:10.1016/j.apsoil.2006.09.014 |
 2017, Vol. 36
2017, Vol. 36




