文章信息
- 史磊磊, 范立民, 陈家长, 邴旭文, 赵志祥, 胡庚东, 吴伟
- SHI Lei-lei, FAN Li-min, CHEN Jia-zhang, BING Xu-wen, ZHAO Zhi-xiang, HU Geng-dong, WU Wei
- 组合填料对水质、罗非鱼生长及水体微生物群落功能多样性的影响
- Effects of combined fillers on the water quality, growth of tilapia, and functional diversity of the microbial community in tilapia aquaculture water
- 农业环境科学学报, 2017, 36(8): 1618-1626
- Journal of Agro-Environment Science, 2017, 36(8): 1618-1626
- http://dx.doi.org/10.11654/jaes.2017-0107
文章历史
- 收稿日期: 2017-01-18
2. 中国水产科学研究院淡水渔业研究中心, 农业部长江下游渔业生态环境监测中心, 农业部淡水鱼类遗传育种和养殖生物学重点开放实验室, 江苏 无锡 214081
2. Freshwater Fisheries Research Centre, Chinese Academy of Fishery Sciences, Fishery Eco-Environment Monitoring Center of Lower Reaches of Yangtze River, Ministry of Agriculture, Key Open Laboratory for Genetic Breeding and Aquaculture Biology, Wuxi 214081, China
罗非鱼作为我国主要养殖经济鱼类之一,集约化养殖单产可达到15~30 t·hm-2[1]。在集约化养殖过程中,因不断往养殖水体中投喂药物、饲料等,导致养殖水体中的有机物浓度增加较快,水体的自净能力受到严重破坏,如果使用频繁换水的办法进行处理,不仅使养殖成本增加,也会对周围环境造成一定的污染[2]。目前在养殖过程中常通过向水体泼洒微生物制剂和在池塘中悬挂生物填料等生物方法来净化养殖水体。何沅滨[3]、李南充等[4]利用微生物制剂降低了水体中的氨氮、亚硝酸盐含量。但直接使用游离的微生物存在很多的弊端,如微生物易流失,持续作用时间短,可能因培养基成分而出现二次污染问题等[5],而利用固定化微生物可有效解决上述问题[6-7]。生物填料因具有较大的比表面积可为微生物提供附着基质,从而在其表面形成固定化微生物菌膜,故在池塘中悬挂生物填料可达到净化水质的目的。但不同填料对水体的净化效果存在较大差异[8],因而对于填料的筛选仍将是今后研究的热点之一。微生物作为养殖系统中的物质转化者,对净化养殖水体作用重大,而微生物群落的代谢能力往往决定了其对物质的转化效率[9]。因此,有必要研究养殖池塘水体微生物群落的碳代谢特性,以便有针对性的建立微生物群落优化技术,从而缓解或消除养殖水体污染。
Biolog法是一种通过测定微生物对不同碳源的利用强度来反映微生物群落的碳代谢功能及其水平多样性的方法,在测定微生物群落代谢功能多样性方面应用较多[10]。近年来,关于生物膜上微生物群落功能多样性方面的研究已有所报道[11-12],但关于生物填料对养殖水体微生物群落功能多样性的影响研究却报道甚少,而水体微生物在水质净化中亦具有重要作用,且不存在被养殖对象摄食的情况。本文研究了组合填料对罗非鱼生长及水质的影响,并运用Biolog技术探究了组合填料对水体微生物群落功能多样性的影响及其与养殖环境因子间的关系,以期对池塘养殖系统生物填料的选择以及为利用微生物进行养殖水体生态调控的理论研究和生产实践提供参考。
1 材料与方法 1.1 试验材料本试验选用的填料为组合填料,其材质为全塑性夹片和维纶醛化丝,比表面积为800 m2·m-3,购自江苏大度塑材有限公司。试验选用12口容积约为500 L的圆形养殖桶(上外径1010 mm、下外径900 mm、高900 mm),共4组,分别记作A、B、C、D(对照)组,各组分别悬挂表面积为9、18、27、0 m2的组合填料,每组均设3个平行。为模拟罗非鱼养殖池塘环境,在每个养殖桶中加入等量的新鲜表层土壤,然后注水并放置在太阳下充分暴晒,之后进行罗非鱼养殖。在养殖开始时,将组合填料悬挂于养殖桶中,填料沿养殖桶直径等距离布置,并使填料上端处于水面下5 cm处,下端坠重物使填料能在水体中充分伸展,如图 1所示。根据作者的相关预试验和实际检测,当水温为28~30 ℃(罗非鱼养殖适宜水温)时,填料上生物膜成膜且相对稳定的时间一般在20 d左右,故试验于2016年9月6日—10月26日进行,总试验时间为50 d,生物膜稳定后试验时间为30 d。

|
| 图 1 实验装置示意图 Figure 1 Schematic diagram of experimental device |
试验共选用罗非鱼幼鱼120条,每个养殖桶放养等量且规格较一致的罗非鱼,试验期间养殖管理措施一致且不换水;投喂粒径为2~3 mm的天邦牌淡水鱼膨化饲料,日投喂3次(8:00、12:00、16:00),日投喂量为10 g(三餐等量投喂)。
1.2.2 水质指标的测定试验过程中,每7 d采集一次水面下30 cm处水样,采集的水样放入4 ℃冰箱中进行冷藏保存,并在48 h内完成相关指标测试。水质测定项目为NH4+-N、NO2--N、NO3--N、总有机碳(TOC)、无机碳(IC)、pH、DO。其中NH4+-N采用纳氏试剂光度法,NO2--N采用盐酸萘乙二胺比色法,NO3--N采用紫外分光光度法,三态氮测定所用仪器均为UV-1200型紫外可见分光光度计;TOC、IC采用有机碳分析仪(GE SieversInnovOx Laboratory TOC Analyzer)测定;采用手持便携式pH计(HI 98121)测定水体pH;采用溶解氧测定仪(JPBJ-608)测定水体DO。
1.2.3 罗非鱼生长指标的测定在试验开始与结束时对每个养殖桶中的罗非鱼体重进行称量,用于计算罗非鱼增重量及饵料系数。增重量(g)=终体重-初体重,饵料系数=总投喂量/总增重。
1.2.4 水体细菌数量的测定用移液枪分别从各组养殖水体的表面取1 mL水样,加入装有99 mL(因对照组水体微生物数量较多,故稀释倍数提高一倍,为199 mL)无菌生理盐水的250 mL玻璃瓶中并摇匀,然后在无菌条件下从玻璃瓶中取1 mL水样加入到菌落总数测试片(北京陆桥技术股份有限公司生产)上,并将测试片放置于30 ℃培养箱中培养,48 h后取出观察菌落生长情况并记录菌落数量。
1.2.5 微生物群落功能多样性测定在养殖的第28 d,进行水体微生物群落功能多样性的测定。在超净工作台中将水样倒入已灭菌的培养皿,用8孔加样器将水样加入到Biolog Eco板中,每孔加150 μL,28 ℃恒温避光培养;用酶标仪读取培养16、24、40、48、64、72、88、96、112、120、136、144 h时Blank 590和Blank 750波长的光密度值。孔的平均颜色变化率(Average well color development,AWCD)计算公式为:
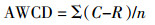
式中:C为每个碳源孔的两波段光密度差值;R为对照孔的光密度值;n为Biolog上碳源种类数,本研究中为31。
以培养72~144 h的数据来分析各组水体微生物对六大类碳源利用的显著性差异;用培养72 h各样品的AWCD值计算Shannon指数、Simpson指数、McIntosh指数、丰富度指数(Richness)、冗余分析(RDA)。Shannon指数、Simpson指数、McIntosh指数的计算依照文献[13];丰富度指数的计算依照文献[11]。各组水体微生物群落功能多样性与环境因子的关系用约束排列方法进行分析。首先进行各组水体微生物群落功能多样性的除趋势分析,计算其值小于3.0,因此适合采用RDA;再用蒙特卡洛检验RDA结果的可靠性。RDA分析过程中所使用的数据均用lg(x+1)进行转换。
数据统计、绘图在Excel 2010软件中完成,方差分析及均值LSD多重比较在SPSS 20.0中完成,RDA分析使用Canoco 4.5软件完成。数据结果以平均值±标准差(mean±SD)表示,以α=0.05作为差异显著水平。
2 结果与分析 2.1 组合填料作用下养殖水体水质的动态变化表 1显示了养殖期间各组水体水质指标的变化。在养殖第28 d,处理组氨氮含量均显著高于对照组(P<0.05),养殖第49 d,A、B、C组氨氮含量分别比对照组低27%、50%、40%,而氨氮下降量与组合填料悬挂密度无明显的正相关或负相关关系。处理组亚硝酸盐含量在养殖前28 d均低于0.2 mg·L-1,从养殖的第35 d开始逐渐积累,养殖结束时C组亚硝酸盐含量上升至1.49 mg·L-1,显著高于对照组(P<0.05),并且组合填料悬挂密度越高,亚硝酸盐积累量越多。处理组和对照组硝酸盐含量在整个养殖过程中呈现先增加后降低的趋势,在养殖第28 d,A、B、C组硝酸盐含量分别比对照组低91.8%、97.6%、59.2%,其中A、B组和对照组差异显著(P<0.05)。在养殖第28 d,处理组DO含量均低于对照组,其中B、C组和对照组差异显著(P<0.05),并且组合填料悬挂密度越高,DO含量下降越多,到养殖第35 d,处理组DO含量均高于对照组,A、B、C组DO含量分别比对照组高69.5%、89%、42.3%,其中A、B组和对照组差异显著(P<0.05),而DO上升量与填料悬挂密度无明显的正相关或负相关关系。从养殖第35 d至养殖结束,处理组pH均低于对照组,其中C组pH与对照组差异显著(P<0.05),组合填料悬挂密度越高,pH下降越多。B、C组TOC含量在养殖第49 d分别比对照组低17.9%、40%,差异不显著(P>0.05),组合填料悬挂密度越高,TOC含量下降趋势越明显。在整个养殖过程中,处理组IC含量均高于对照组,尤其是在养殖的第28 d,A、B、C组分别比对照组高33.5%、34.5%、56.4%,其中C组IC含量与对照组差异显著(P<0.05),而IC含量的增加与组合填料的悬挂密度无明显的正相关或负相关关系。

|
对比处理组和对照组罗非鱼增重量及饵料系数(表 2)可知,组合填料悬挂后,B、C组增重量和对照组差异显著(P<0.05),A组与C组的增重量差异显著(P<0.05);B、C组的饵料系数和对照组差异显著(P<0.05),A组与C组的饵料系数差异显著(P<0.05)。

|
图 2显示养殖过程中各组水体细菌数量的变化情况。组合填料的悬挂显著降低了水体细菌数量(P<0.05),而在不同悬挂密度下,组合填料对水体细菌数量影响仅在第35 d出现显著差异(P<0.05)。经统计学分析,第28 d与第35 d水体细菌数量以及第35 d与第42 d的水体细菌数量均具有显著性差异(P<0.05),说明水体细菌数量随养殖时间显著增加。

|
| 不同字母代表组间差异显著(P<0.05) Different letters represent significant differences between groups(P < 0.05) 图 2 组合填料对池塘养殖系统水体细菌数量的影响 Figure 2 Effects of combined filler on the number of bacteria in the pond aquaculture system |
表 3列出了各组水体微生物利用Biolog板中碳源的多样性指数。处理组和对照组的Shannon指数、Simpson指数、McIntosh指数及丰富度指数均无显著性差异(P>.05)。

|
对不同处理组水体微生物对糖类、氨基酸类、酯类、醇类、胺类和酸类等六大类碳源利用情况进行分析,结果如图 3所示。结果表明,悬挂组合填料后,处理组水体微生物对糖类、醇类、酯类的利用能力均有所提升。其中各处理组对糖类、酯类的利用强度均与对照组差异显著(P<0.05),A、B组对醇类的利用强度和对照组差异显著(P<0.05);B、C组对胺类的利用强度均显著低于对照组(P<0.05);A组水体微生物对酸类的利用强度显著高于对照组(P<0.05),而B、C组对酸类的利用强度显著低于对照组(P<0.05)。

|
| 图 3 组合填料处理下微生物对六大类碳源的利用 Figure 3 Utilization of carbon sources by microbes under combined filler treatment |
图 4显示各组水体微生物群落功能多样性与6种环境因子的关系。处理组样点主要在第一排序轴的的负端,其中C(CF7、CF8、CF9)组各样点比较集中,对照组样点在第一排序轴的正端。组合填料组与对照组能够在由RDA分析产生的前两个典范轴所对应的特征根RDA1和RDA2所构成的二维平面上很好地区分,表明二者之间是存在差异的。第一排序轴与DO(相关系数为0.639)、pH(相关系数为0.670)、TOC(相关系数为0.593)、硝酸盐(相关系数为0.754)呈正相关,与氨氮(相关系数为-0.418)、IC(相关系数为-0.694)呈负相关,表明影响罗非鱼养殖水体微生物群落功能多样性的主要环境因子为DO、pH、硝酸盐。冗余分析表明处理组水体微生物群落功能多样性与对照组存在一定的差异,并和水体环境因子具有一定的相关性。

|
| CF代表处理组,Control代表对照组 图 4 罗非鱼各组养殖水体微生物群落功能多样性与环境因子的冗余分析 Figure 4 Functional diversity of microbial communities and the redundancy analysis of environment factors in cultured tilapia |
生物填料主要是通过在其表面所形成生物膜的代谢作用来降解水体中的氨氮、亚硝态氮、硝态氮、悬浮物和有机污染物等[14]。本研究表明,在养殖第28 d,处理组氨氮含量均高于对照组,而DO含量均低于对照组;而在养殖第42 d,处理组氨氮含量均低于对照组,DO含量则高于对照组;养殖前28 d各组亚硝酸盐含量均较低,而从第35 d开始亚硝酸盐逐渐积累,其中B、C组亚硝酸盐含量上升较快;整个养殖过程中各组硝酸盐含量出现先上升后下降的趋势,而在养殖第21~28 d,处理组硝酸盐含量均低于对照组,其原因可能是:在养殖前28 d,填料表面为异养微生物提供附着基质,而填料所截留的罗非鱼排泄物为微生物生长繁殖提供了物质基础,随着异养微生物的生长繁殖,水体中的有机氮向氨氮转化,DO含量下降,氨氮浓度上升。这一过程在处理组中进行得快于对照组(由表 1第28 d的氨氮、DO含量可知),此时一方面硝化作用的底物-水体中氨氮比较充足,同时水体中的DO含量较高,有利于填料表面的氨氧化细菌大量繁殖,从而使氨氮向亚硝酸盐和硝酸盐转化。而从养殖第35 d开始,亚硝酸盐含量逐渐升高,虽然有利于硝化细菌的生长,但因其繁殖速度较慢,特别是水体中DO水平不高,难以将亚硝酸盐继续氧化为硝酸盐,从而造成亚硝酸盐积累;随着生物膜形成,填料及水体中DO下降,同时硝酸盐的累积等因素又形成了有利于反硝化的物质条件,从而使水体硝酸盐含量下降。有研究表明,硝化反应会降低水体碱度[15],因此从养殖第35 d至养殖结束,处理组pH低于对照组可能与处理组养殖系统中硝化反应的加强有关。B、C组在整个养殖过程中有使TOC下降的趋势,处理组IC含量在整个养殖过程中均高于对照组,可能是由于适宜的填料悬挂密度可以较好地促进微生物的大量生长繁殖,从而消耗水体中的TOC及代谢产生CO2。
3.2 组合填料对罗非鱼生长的影响在本研究中处理组增重量均高于对照组,而饵料系数均低于对照组,说明组合填料能够促进罗非鱼的生长,从而起到降低饵料系数的作用。本研究同时发现填料悬挂密度越高,罗非鱼增重量越多或饵料系数下降越多。这与韩勇望等[16]研究的填料可促进鲫鱼生长的结果一致。徐武杰[17]研究表明,生物絮团可以使对虾胃中脂肪酶、淀粉酶以及蛋白酶的活力增加。增重量的提高和饵料系数的降低很可能是罗非鱼摄食了填料表面的部分有机物质,使系统中饵料蛋白得以再次利用。此外,生物膜中的营养成分则有可能弥补了饲料中某些营养成分的不足,或刺激鱼体内某些消化酶活性增加,使罗非鱼的营养需求得到满足,进而促进了罗非鱼的生长。但生物填料表面形成的生物膜所吸附的有机颗粒物质是否为罗非鱼的生长提供了额外的食物还需要通过进一步的摄食观察来验证。
3.3 组合填料对养殖水体中微生物的影响微生物受到某些外界条件的刺激而向填料表面附着生长,这一过程是生物填料-生物膜形成的开端[18],水体的任一表面均可形成生物膜,这在各个领域已得到广泛证实[19-20],说明生物膜在形成过程伴随着微生物向填料的附着生长并定居的趋势。本研究发现,组合填料的使用均能有效降低水体细菌数量,并且随着时间推移水体细菌数量显著性增加,说明生物填料可为微生物提供良好的附着载体,一定程度上降低水体细菌数量。这与吴伟等[21]的弹性生物填料可使水体微生物数量提高100%以上的结果不太一致,可能与填料的材质、成膜过程是否外源添加微生物菌源等有关,这还有待进一步深入研究。
微生物群落的丰富度和均匀度可以通过多样性指数来反映,而多样性指数的变化则能较好地反映微生物群落功能多样性的变动情况,若采用的多样性指数不同,最终得出的结果可能会存在一定的差异[22]。本研究表明,填料的使用对水体微生物多样性及丰富度无显著性影响,说明组合填料对微生物的吸附无明显的选择性。这与李志斐等[10]研究的生物絮团可使水体微生物的Shannon指数和丰富度指数增加的结果不一致,可能与外源添加葡萄糖等物质有关。
王强等[23]研究认为,Biolog方法可以通过测定微生物对不同碳源利用强度的差异来反映微生物群落在时间及空间尺度上的变化。本研究结果表明,悬挂组合填料后,水体微生物加强了对糖类、酯类及醇类的利用,而对胺类、酸类的利用下降,表明填料悬挂后能有效改变水体微生物对六大类碳源的利用。在罗非鱼养殖池塘水体中含有大量在养殖过程中剩余溶解的营养物质,而水产动物对蛋白质、糖类、油脂三大类营养的利用量通常为蛋白质最高,其次为糖类,再者为油脂类,因此水体中含有的糖类及油脂碳源相对较高。处理组水体微生物对糖类等碳源代谢活性的提高有利于水体中残饵的分解转化,使残饵在养殖系统中得到二次利用,从而使水体质量得到提高,可间接促进罗非鱼的生长。
池塘微生物群落功能的发挥受到水质环境因子的影响,水质环境因子又会受到微生物群落功能的影响而发生一定程度的变化,二者相互限制影响[13, 24]。本试验结果表明,组合填料组和对照组在养殖水体微生物代谢功能上存在较大的差异性。这很可能是由于在养殖过程中水体环境与微生物群落之间的相互影响所致,但具体原因还需要进一步研究。本研究RDA分析发现,DO、pH和硝酸盐是造成养殖水体微生物代谢功能差异主要影响因子,表明DO、pH和硝酸盐对罗非鱼水体微生物群落代谢功能的重要性。袁翠霖[25]研究表明pH能显著影响水体异养细菌总数,DO浓度则会影响好氧微生物和厌氧微生物的代谢活性[26]。本研究表明,氨氮并不是处理组和对照组水体微生物群落功能多样性差异的主要影响因子,可能是各组水体中氨氮含量的差异尚未对参与氮循环的微生物群落的生长繁殖产生显著影响,具体原因还有待进一步研究。
4 结论(1)在罗非鱼养殖水体中以人工悬挂的组合填料作为微生物附着基质、以土著微生物为菌源构建固定化菌膜。组合填料可使养殖水体中氨氮、硝酸盐、pH、TOC含量下降,亚硝酸盐、DO、IC含量上升。组合填料可使水体细菌数量下降45.9%~85.7%,但对水体微生物多样性无显著影响;组合填料可使罗非鱼体重增加7%~34%,能较好地促进罗非鱼生长。
(2)组合填料明显提高了水体微生物对糖类、醇类、酯类的利用率,降低了对胺类和酸类的利用率;处理组和对照组水体微生物代谢多样性存在一定的差异,而DO、pH和硝酸盐是造成这种差异的主要影响环境因子。
| [1] |
罗然海, 唐高强, 叶啸川, 等. 2011年华南罗非鱼养殖概况[J]. 水产前沿, 2012, 8(2): 65-66. LUO Ran-hai, TANG Gao-qiang, YE Xiao-chuan, et al. Tilapia aquaculture profiles in Southern China in 2011[J]. Fisheries Advance Magazine, 2012, 8(2): 65-66. |
| [2] |
沈庆洲, 赵悦. 水产养殖环境中水体的微生物修复作用[J]. 环球市场信息导报, 2016, 22(4): 80. SHEN Qing-zhou, ZHAO Yue. Bioremediation of aquatic organisms in aquaculture environment[J]. Global Market Information Guide, 2016, 22(4): 80. |
| [3] |
何沅滨. 泥鳅养殖水体中芽孢杆菌的筛选、生长特性及其应用效果研究[D]. 苏州: 苏州大学, 2015. HE Yuan-bin. Screening of probiotic Bacillus from the aquaculture water of loach(Misgurnus anguillicaudatus) and study on its growth character and application effect[D]. Suzhou:Soochow University, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10285-1015424349.htm |
| [4] |
李南充, 钟雷, 杨克, 等. 微生态制剂在80:20池塘养殖中的应用及经济效益分析[J]. 水产科学, 2015, 34(4): 251-255. LI Nan-chong, ZHONG Lei, YANG Ke, et al. Application and economic benefit analysis of probiotics in 80:20 pond culture[J]. Fisheries Science, 2015, 34(4): 251-255. |
| [5] |
程树培. 环境生物技术[M]. 南京: 南京大学出版社, 1994, 111-135. CHENG Shu-pei. Environmental biotechnology[M]. Nanjing: Nanjing University Press, 1994, 111-135. |
| [6] |
汪怀建, 周跃龙, 汪新强, 等. 硝化菌的筛选、鉴定及其固定化颗粒的氨氮去除效能[J]. 环境污染与防治, 2016, 38(11): 43-46. WANG Huai-jian, ZHOU Yue-long, WANG Xin-qiang, et al. Isolation, identification and immobilization of nitrobacteria and the ammonia nitrogen removal efficiency of immobilized nitrobacteria particles[J]. Environmental Pollution & Control, 2016, 38(11): 43-46. |
| [7] |
唐伟. 一株苯酚降解菌HY-1的筛选、鉴定及其固定化应用研究[D]. 绵阳: 西南科技大学, 2015. TANG Wei. Strain of phenol degrading bacteria HY-1, identification immobilization and applied research[D]. Mianyang:Southwest University of Science and Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10619-1015318795.htm |
| [8] |
卢少勇, 万正芬, 李锋民, 等. 29种湿地填料对氨氮的吸附解吸性能比较[J]. 环境科学研究, 2016, 29(8): 1187-1194. LU Shao-yong, WAN Zheng-fen, LI Feng-min, et al. Ammonia nitrogen adsorption and desorption characteristics of twenty-nine kinds of constructed wetland substrates[J]. Research of Environmental Sciences, 2016, 29(8): 1187-1194. |
| [9] |
袁翠霖, 李卓佳, 杨莺莺, 等. 芽孢杆菌制剂对养殖前期罗非鱼池塘微生物群落代谢功能的影响[J]. 生态学杂志, 2010, 29(12): 2464-2470. YUAN Cui-lin, LI Zhuo-jia, YANG Ying-ying, et al. Effects of Bacillus preparation on metabolic function of microbial communities in tilapia ponds at early stock stage[J]. Chinese Journal of Ecology, 2010, 29(12): 2464-2470. |
| [10] |
李志斐, 王广军, 余德光, 等. 生物絮团对养殖水体水质和微生物群落功能的影响[J]. 上海海洋大学学报, 2015, 24(4): 503-512. LI Zhi-fei, WANG Guang-jun, YU De-guang, et al. Effects of biological floc on water quality and microbial community function in aquaculture water[J]. Journal of Shanghai Ocean University, 2015, 24(4): 503-512. |
| [11] |
李志斐, 王广军, 谢骏, 等. 草鱼养殖池塘生物膜固着微生物群落碳代谢Biolog分析[J]. 水产学报, 2014, 38(12): 1985-1995. LI Zhi-fei, WANG Guang-jun, XIE Jun, et al. The Biolog analysis of biofilm microbial community carbon metabolism in grass carp pond[J]. Journal of Fisheries of China, 2014, 38(12): 1985-1995. |
| [12] |
易绿云. 生物膜工艺处理生活废水研究及其微生物群落多样性分析[D]. 广州: 华南理工大学, 2013. YI Lü-yun. Investigation on domestic wastewater treatment by biofilm technology and analysis of microbial community diversity[D]. Guangzhou:South China University of Technology, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10561-1013317739.htm |
| [13] |
闫法军, 田相利, 董双林, 等. 刺参养殖池塘水体微生物群落功能多样性的季节变化[J]. 应用生态学报, 2014, 25(5): 1499-1505. YAN Fa-jun, TIAN Xiang-li, DONG Shuang-lin, et al. Seasonal variation of functional diversity of aquatic microbial community in Apostichopus japonicus cultural pond[J]. Chinese Journal of Applied Ecology, 2014, 25(5): 1499-1505. |
| [14] |
窦文博. 曝气生物滤池的发展现状及其填料的影响研究[J]. 广东化工, 2016, 43(10): 132-133. DOU Wen-bo. Research progress on biological aerated filter technique and the performance of its media[J]. Guangdong Chemical Industry, 2016, 43(10): 132-133. DOI:10.3969/j.issn.1007-1865.2016.10.066 |
| [15] |
张子健, 王舜和, 王建龙, 等. 利用碱度控制SBR中短硝化反应的进程[J]. 清华大学学报:自然科学版, 2008, 48(9): 1475-1478. ZHANG Zi-jian, WANG Shun-he, WANG Jian-long, et al. Effect of alkalinity on the[NH4+-N] ratio during partial nitrification in a sequencing batch reactor[J]. Journal of Tsinghua University(Sci & Tech), 2008, 48(9): 1475-1478. |
| [16] |
韩永望, 张哲勇, 罗国强, 等. 弹性立体填料在水产养殖中的应用研究[J]. 渔业现代化, 2014, 41(5): 26-30. HAN Yong-wang, ZHANG Zhe-yong, LUO Guo-qiang, et al. Study on the application of elastic packing in aquaculture[J]. Fishery Modernization, 2014, 41(5): 26-30. |
| [17] |
徐武杰. 生物絮团在对虾零水交换养殖系统中功能效应的研究与应用[D]. 青岛: 中国海洋大学, 2014. XU Wu-jie. Research and application of functional effects of biofloc in zero-water exchange Litopenaeus vannamei culture system[D]. Qingdao:Ocean University of China, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10423-1014369156.htm |
| [18] |
O'Toole G, Kaplan H B, Kolter R. Biofilm formation as microbial development[J]. Annual Review Microbiology, 2000, 54(1): 49-79. DOI:10.1146/annurev.micro.54.1.49 |
| [19] |
卢仁钵, 杜青平, 许燕滨, 等. 降解乙苯生物滴滤塔稳定运行期生物膜特征及微生物多样性研究[J]. 环境科学学报, 2016, 36(10): 3561-3568. LU Ren-bo, DU Qing-ping, XU Yan-bin, et al. Biofilm characteristics and microbial diversity in ethylbenzene degradation BTF during the stable operation periods[J]. Acta Scientiae Circumstantiae, 2016, 36(10): 3561-3568. |
| [20] |
袁兴程, 李丹. 生物绳填料净化河流的效果及微生物群落分析[J]. 环境工程, 2016, 34(4): 48-53. YUAN Xing-cheng, LI Dan. Purification performance of the bio-cord carrier for river water and microbial community analysis[J]. Environmental Engineering, 2016, 34(4): 48-53. |
| [21] |
吴伟, 陈家长, 胡庚东, 等. 利用人工基质构建固定化微生物膜对池塘养殖水体的原位修复[J]. 农业环境科学学报, 2008, 27(4): 1501-1507. WU Wei, CHEN Jia-zhang, HU Geng-dong, et al. Research on the immobilized biofilm structure of the artificial substrates and in-site bioremediation of the pond aquaculture water[J]. Journal of Agro-Environment Science, 2008, 27(4): 1501-1507. |
| [22] |
Garland J L. Analytical approaches to the characterization of samples of microbial communities using patterns of potential C source utilization[J]. Soil Biology and Bio-chemistry, 1996, 28(2): 213-221. DOI:10.1016/0038-0717(95)00112-3 |
| [23] |
王强, 戴九兰, 吴大千, 等. 微生物生态研究中基于BIOLOG方法的数据分析[J]. 生态学报, 2010, 30(3): 817-823. WANG Qiang, DAI Jiu-lan, WU Da-qian, et al. Statistical analysis of data from BIOLOG method in the study of microbial ecology[J]. Acta Ecologica Sinica, 2010, 30(3): 817-823. |
| [24] |
宋景华, 李谷, 张世羊, 等. 养殖池塘水质理化因子与微生物群落碳代谢的定量关系[J]. 淡水渔业, 2013, 43(5): 68-74. SONG Jing-hua, LI Gu, ZHANG Shi-yang, et al. Analysis of relationship between carbon metabolism of microbial community and physicochemical factors in recirculating ponds[J]. Freshwater Fisheries, 2013, 43(5): 68-74. |
| [25] |
袁翠霖. 罗非鱼养殖系统微生物群落生态研究及潜在有益菌的筛选[D]. 广州: 暨南大学, 2011. YUAN Cui-lin. The research on microbial community ecology and the screening of potential probiotics in tilapia culture system[D]. Guangzhou:Jinan University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10559-1011128033.htm |
| [26] |
于皓, 陈川, 张莉, 等. 溶解氧对碳氮硫共脱除工艺中微生物群落影响解析[J]. 环境科学, 2013, 34(6): 2368-2374. YU Hao, CHEN Chuan, ZHANG Li, et al. Effect of dissolved oxygen on microbial community in simultaneous removal of carbon, nitrogen and sulfur process[J]. Environmental Science, 2013, 34(6): 2368-2374. |
 2017, Vol. 36
2017, Vol. 36




