文章信息
- 王峰, 陈玉真, 吴志丹, 江福英, 翁伯琦, 尤志明
- WANG Feng, CHEN Yu-zhen, WU Zhi-dan, JIANG Fu-ying, WENG Bo-qi, YOU Zhi-ming
- 除草剂对茶园土壤尿素态氮转化和温室气体排放的影响
- Effects of herbicides on urea nitrogen transformation and greenhouse gas emission from tea garden soil
- 农业环境科学学报, 2017, 36(8): 1649-1657
- Journal of Agro-Environment Science, 2017, 36(8): 1649-1657
- http://dx.doi.org/10.11654/jaes.2016-1422
文章历史
- 收稿日期: 2016-11-08
2. 福建省红壤山地农业生态过程重点实验室, 福州 350013
2. Fujian Province Key Laboratory of Agro-Ecological Processes in Hilly Red Soil, Fuzhou 350013, China
随着我国农业现代化的不断发展,为应对农村劳动力成本的不断上升,农业生产方式趋向于规模化和集约化经营,对农药需求量显著增加,尤其是除草剂施用量逐年增加。据统计[1],在国家提出农药和化肥零增长的背景下,2015年我国除草剂(有效成分)施用量仍增长4.75%,施用量达10.7万t,占农药施用量比例达到了35.7%。大量施用除草剂在防治田间杂草的同时,除了小部分被植物吸收或因挥发进入大气外(我国农药利用率约为36.6%)[2],大部分残留于土壤耕作层或迁移进入地下水中[3],势必会污染自然的农业生态环境,不仅影响土壤动物和微生物群落结构及活性[4],而且不同程度地改变土壤酶的活性[5-6]。
土壤氮素转化和温室气体排放涉及一系列微生物过程和酶促反应,施用除草剂后直接影响土壤微生物和酶的活性,从而间接影响土壤氮素固定、氨化、硝化反硝化过程和温室气体排放[7-9]。加入适当浓度的除草剂对土壤微生物无不利影响,甚至可以给土壤提供新的碳源、氮源或磷源,从而促进土壤氮素转化,但其正负效应会因土壤性质的差异而不同,且对不同氮素转化途径的影响也不同[10]。Kara等[11]研究表明,特丁津会抑制酸性或中性土壤硝化微生物的活性,从而降低土壤硝态氮含量,但其对碱性土壤则有促进作用;张爱云等[12]研究指出,5种除草剂(常规剂量下)对水稻土和东北黑土微生物活性无影响,抑制两种土壤硝化作用,对东北黑土的抑制效果不明显,促进土壤氨化作用;呼蕾等[13]通过培养试验得出类似的结果,草甘膦总体激活土壤脲酶活性,但酸性红壤(pH 5.65)与碱性褐土(pH 8.12)之间的ED10值(生态剂量)相差达10倍。这说明不同土壤理化性质和微生物活性之间的巨大差异,导致除草剂对酶活性的影响不同。另外,田间和实验室条件下的研究结果也可能不一样,Hansen等[14]研究发现,田间条件下除草剂处理与对照处理土壤硝态氮含量没有明显差异,但在实验室条件下除草剂处理的土壤硝态氮含量及比例增加;Kinney等[15-16]研究表明,尽管除草剂氟磺隆(田间剂量和100倍剂量)会显著抑制N2O排放,但历时1年的田间试验却表明,除草剂氟磺隆能促进土壤N2O排放;而Jiang等[17]研究表明,田间和室内培养条件下,丁草胺均能显著增加稻田无机氮含量、氨氧化细菌和反硝化细菌数量,从而显著增加稻田N2O的排放,苯磺隆则对稻田N2O的排放无影响。以上研究由于土壤类型、除草剂种类及施用对象不同,研究结果不尽相同。
我国茶园主要分布于红壤、砖红壤及黄壤等亚热带丘陵地区,2015年全国茶园面积已达257.9万hm2[18],已成为世界第一茶叶生产和消费大国。已有研究表明,除草剂在土壤中的吸附和降解与土壤氧化铁铝、粘土矿物类型(蒙脱石和高岭土等)、盐基离子及有机质含量密切相关,尤其是与土壤pH呈极显著负相关[19]。自然土壤植茶后,受茶树自身物质循环及高强度栽培管理措施的影响,茶园土壤呈现明显酸化、脱硅富铁(铝)、盐基离子缺乏及酚酸类物质积累特征[20-21],这些均会影响除草剂活性,从而影响土壤微生物及酶活性。当前,我国茶园除草管理多以喷施除草剂为主,但很少关注喷施除草剂对茶园土壤氮素转化和温室气体排放的影响。在此背景下,本研究通过室内模拟培养实验,分析了4种茶园常用除草剂(触杀型和灭生性除草剂)对土壤尿素态氮转化和温室气体排放的影响,为深入了解除草剂和氮肥的配合施用效应以及合理评估除草剂的生态环境效应提供科学依据。
1 材料与方法 1.1 供试土壤和除草剂种类供试茶园土壤取自福建省武夷山市星村镇曹墩村(117°51′E,27°37′N),该地属于中亚热带季风气候,年均气温17.9 ℃,年均降雨量1847 mm。茶园管理为常规管理,以施化肥为主,除草方式为喷施除草剂,茶树种植品种为水仙,树龄为8 a。采样时间为春季施肥前,按照“S”型多点混合采样法,分别采集茶园0~20 cm表层土样6个,采样点位于茶行中线位置,然后混合为一个土样。土壤类型为黄壤,土壤有机碳和全氮含量分别为23.52、1.71 g·kg-1,C/N为13.88,硝态氮17.04 mg·kg-1,铵态氮31.19 mg·kg-1,容重1.06 g·cm-3,pH 4.18,土壤质地为粉粘土,砂砾19.17%、粉粒62.72%、粘粒18.11%。供试除草剂为茶园常用除草剂,分别为草甘膦钾盐水剂(浙江新安化工集团股份有限公司,草甘膦含量30%)、草甘膦异丙胺盐水剂(浙江新安化工集团股份有限公司,草甘膦含量30%)、草铵膦水剂(苏州富美实植物保护剂有限公司,草铵膦含量20%)和百草枯水剂(先正达南通植物保护有限公司,百草枯含量25%)。
1.2 试验设计采用室内模拟培养实验,设计对照(CK)、单施尿素(Urea)、尿素+草甘膦钾盐(Urea+GH)、尿素+草甘膦异丙胺盐(Urea+GP)、尿素+草铵膦(Urea+GF)和尿素+百草枯(Urea+PQ)6个处理,氮肥用量为200 mg N·kg-1,除草剂用量为10 mg有效成分·kg-1干土,所有处理均设3次重复。
称取150 g风干土(过2 mm筛)置于250 mL三角瓶中,加入去离子水至40%田间持水量(WHC),于25 ℃恒温预培养1周,激活土壤微生物活性,定期调节土壤水分。预培养结束后,尿素和除草剂按比例混合溶于水后定量加入,调节土壤含水量至60%WHC。用塑料保鲜膜封口,并在其上面扎若干个小孔以便保证有氧环境,恒温(25 ℃)恒湿(重量法调节)下培养43 d。取样时间分别为培养的第1、3、5、7、10、15、22、29、43 d,每次3次重复均为破坏性取样。取样前用带有三通阀的橡胶塞密封,培养24 h后抽取瓶中气样。采集气样前,反复抽气以使瓶中气体混匀,采集培养瓶上部空间气体样本,作为初始气体浓度,同时破坏性取土壤样品,测定其铵态氮和硝态氮含量。
1.3 样品分析和指标计算土壤理化性质按照中国土壤学会编写的《土壤农业化学分析方法》[22]进行,土壤铵态氮采用靛酚蓝比色法,土壤硝态氮采用双波长比色法,气体样品采用中国科学院大气物理所改装过的美国Agilent公司生产的GC7890A测定,用于分析CO2和CH4气体浓度的为FID检测器,N2O气体浓度的为ECD检测器。
单位时间内温室气体排放通量计算方法:
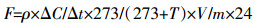
式中:F为温室气体CO2、CH4和N2O的排放通量,mg·kg-1·d-1或μg·kg-1·d-1;ρ为大气标准状态下气体密度,kg·m-3;ΔC/Δt为单位时间内气体浓度变化,mg·kg-1·h-1或μg·kg-1·h-1;V为培养三角瓶内的有效体积,m3;T为培养温度,℃;m为烘干土质量,kg。
温室气体累积排放量(mg·kg-1或μg·kg-1)=∑(Fi+1+Fi)/2×(ti+1-ti)
式中:F为温室气体排放通量;i为测定次数;t为测定时间,即培养天数。
土壤净硝化量(mg·kg-1)=培养结束时硝态氮含量-培养前硝态氮含量;土壤净硝化速率(mg·kg-1·d-1)=(培养结束时硝态氮含量-培养前硝态氮含量)/培养时间;土壤硝化率(%)=硝态氮/(硝态氮+铵态氮)×100;硝化抑制率(%)=(不加除草剂处理硝态氮含量-除草剂处理土壤硝态氮含量)/不加除草剂处理硝态氮含量×100。
1.4 数据处理与统计分析文中所有数据经过Excel 2003软件处理后,采用单因素(One-Way ANOVA)方差分析检验相同培养时间下土壤铵态氮、硝态氮和温室气体之间的差异,重复测量方差分析(Repeated-Measures ANOVA)检验整个培养期间土壤铵态氮、硝态氮和温室气体之间的差异,统计分析在SPSS 16.0上完成。图表制作分别采用GraphPad Prism 5和Excel 2003软件完成。
2 结果与分析 2.1 除草剂对茶园土壤无机氮含量的影响土壤中的尿素在脲酶作用下可水解成铵态氮,因此土壤中铵态氮含量的变化可间接反映尿素水解作用。从图 1可以看出,不同除草剂处理下土壤中铵态氮含量有明显的差异和时间变化。在培养前期,由于尿素水解作用,茶园土壤中铵态氮含量呈增加趋势,但铵态氮含量峰值的出现因除草剂种类不同而有所差异。单施尿素处理铵态氮含量在第5 d时达到峰值,施用除草剂处理在第10 d时达到峰值,说明施用除草剂能延长尿素水解时间。培养的前5 d,单施尿素处理铵态氮含量大于除草剂处理;此后施用除草剂处理铵态氮含量均高于单施尿素处理,培养结束时施用百草枯处理铵态氮含量显著高于其他除草剂处理(P<0.05),其他3种除草剂之间差异不显著(P>0.05)。以上结果说明除草剂对前期(5 d)尿素水解作用具有抑制作用,后期具有促进作用,并延长了尿素水解时间。

|
| 图 1 培养过程中茶园土壤无机氮含量的动态变化 Figure 1 Dynamics of NH4+-N and NO3--N contents in tea garden soils during the incubation period |
从图 1还可以看出,各处理茶园土壤硝态氮含量随着培养时间的延长而升高,具有明显的积累延滞期。CK和施尿素处理硝态氮含量延滞期为7 d,施用除草剂处理延长了其延滞期,达到15~22 d。同时,整个培养期间施用除草剂处理硝态氮含量均显著低于CK和单施尿素处理(P<0.05),说明土壤硝化作用被显著抑制;培养结束时施除草剂处理硝态氮含量为71.24~95.83 mg·kg-1,草甘膦钾盐处理显著高于其他除草剂处理(P<0.05),草甘膦异丙胺盐、草铵膦和百草枯处理间差异不显著(P>0.05)。重复测量方差分析(表 1)表明,除草剂、培养时间和除草剂×培养时间的交互作用对茶园土壤铵态氮和硝态氮影响显著。

|
土壤净硝化量、净硝化速率和硝化率是评价硝化作用强度的常用指标。培养结束时,从图 2A至2C可以看出,与CK处理相比,单施尿素后茶园土壤净硝化量和净硝化速率显著增加(P<0.05);与单施尿素处理相比,配施除草剂处理则显著降低了土壤净硝化量、净硝化速率和硝化率(P<0.05),其中草甘膦钾盐处理显著高于其他除草剂处理(P<0.05),其他3种除草剂之间差异不显著(P>0.05)。土壤硝化抑制率可直观反映除草剂对土壤硝化作用的抑制效果。从图 2D可以看出,施用除草剂的茶园土壤硝化抑制率分别为38.42%、51.68%、58.08%和54.16%,草甘膦钾盐处理显著低于其他3种除草剂处理(P<0.05),草甘膦异丙胺盐、草铵膦和百草枯处理之间差异不显著(P>0.05)。

|
| 不同小写字母表示处理间在0.05水平差异显著 图 2 除草剂对茶园土壤硝化作用的影响 Figure 2 Effects of herbicides on nitrification in tea garden soil |
图 3为添加除草剂处理后茶园土壤3种温度气体CO2、CH4和N2O排放通量随培养时间的变化。从图 3A可以看出,施尿素和除草剂对土壤CO2排放通量影响很大,尤其是培养前期(前5 d),5个施用尿素处理的CO2排放通量显著高于CK处理(P<0.05)。第1 d时各处理CO2排放通量达到峰值,其中百草枯处理显著高于其他处理(P<0.05),其他4个处理之间差异不显著(P>0.05);此后随着培养时间的延长CO2排放通量下降至较低水平,各处理差异不显著(P<0.05)。CK、单施尿素、草甘膦钾盐、草甘膦异丙胺盐、草铵膦和百草枯整个培养期间的平均排放通量分别为10.55、22.05、22.81、32.05、25.82、38.55 mg·kg-1·d-1,百草枯和草甘膦丙胺盐处理显著高于其他处理(P<0.05),单施尿素、草甘膦钾盐和草铵膦之间差异不显著(P>0.05)。

|
| 图 3 除草剂对茶园土壤温室气体排放的影响 Figure 3 Effects of herbicides on greenhouse gas from tea garden soil |
相比其他厌氧土壤环境,茶园土壤CH4排放通量处于较低水平(图 3B)。不同处理土壤CH4排放通量达到峰值的时间略有不同,CK和单施尿素处理达到峰值的时间为第5 d,其余处理第1 d达到峰值后振荡式下降。总体而言,单施尿素处理对茶园土壤CH4排放通量无影响,而施用除草剂则不同程度地降低了CH4排放通量,但各除草剂处理间差异不显著(P>0.05)。
从图 3C可以看出,各处理茶园土壤的N2O排放通量随时间的变化趋势基本一致。第1 d达到峰值后迅速下降,单施尿素处理N2O排放通量显著大于CK和除草剂处理(P<0.05),除草剂处理之间差异不显著(P>0.05);至第5 d时,单施尿素处理N2O排放通量仍显著大于其他处理(P<0.05),CK和除草剂处理之间差异不显著(P>0.05);此后各处理趋于稳定且差异不显著(P>0.05)。总体而言,单施尿素会促进土壤N2O排放,除草剂处理则显著降低土壤N2O排放。重复测量方差分析(表 1)表明,除草剂、培养时间和除草剂×培养时间的交互作用对茶园土壤CO2和N2O排放通量影响极显著,CH4排放通量仅受培养时间的影响。
2.4 除草剂对茶园土壤温室气体累积排放量的影响培养期结束后,各处理土壤CO2、CH4和N2O的累积排放量见表 2。施用尿素后茶园土壤CO2和N2O的累积排放量均显著增加(P<0.05),但CH4累积排放量影响不显著(P>0.05)。施用除草剂对茶园土壤CO2、CH4和N2O排放的影响不一,且不同除草剂之间的作用效果差异较大。具体表现为:4种除草剂均不同程度抑制了茶园土壤N2O的排放,N2O累积排放量下降了46.21%~63.58%,百草枯处理抑制效果最显著;4种除草剂均促进了茶园土壤CO2的排放,累积排放量增幅为6.05%~65.46%,与单施尿素处理相比,草甘膦钾盐和草铵膦处理差异不显著,草甘膦异丙胺和百草枯处理则显著增加;4种除草剂不同程度抑制了CH4的排放,累积排放量降幅为13.71%~32.09%,草甘膦异丙胺和百草枯处理显著降低,且4种除草剂之间差异不显著。综合以上结果表明,草甘膦异丙胺和百草枯会显著降低茶园土壤CH4和N2O的排放量(P<0.05),显著增加CO2的排放量(P<0.05),综合效应大于其他两种除草剂。

|
除草剂是农业生产应用最多的一种农药,其使用会影响土壤中微生物和酶的活性,进而对土壤中氮素转化过程产生影响。施入土壤中的尿素,必须在脲酶的催化作用下才能水解成铵态氮(氨化过程),整个进程的快慢与微生物及脲酶活性有关。不同除草剂及其剂量对土壤脲酶的影响差异较大,抑制、无影响甚至促进均有报道,即使是同一除草剂在不同土壤类型上的研究结果也存在差异[23]。本研究结果表明,剂量为10 mg有效成分·kg-1干土条件下,4种除草剂均抑制了培养前期(5 d)尿素水解,此后促进尿素水解,增加土壤铵态氮含量,同时尿素水解时间由5 d延长至10 d,与Sannino等[6]和杨春璐等[24]研究结果基本一致。除草剂在土壤中的吸附是评价其安全性的主要依据,其吸附量与该除草剂解离常数、土壤pH和氧化铁铝含量密切相关,与土壤pH呈显著负相关,与土壤氧化铁铝含量呈显著正相关[19]。茶园土壤为典型的酸性土壤(pH 4.18),成土矿物中铁铝氧化物粘粒比例较高,因而除草剂吸附量较大,对土壤微生物及酶抑制较小。同时,由于除草剂在土壤无机矿物或有机质外表面甚至内表面产生竞争性吸附,从而使得部分脲酶分子解吸附成为游离态酶,因而表现出更高的活性[25]。不同除草剂对尿素氨化促进作用效果存在差别,百草枯促进效果最为显著(P<0.05),其他除草剂之间差异不显著(P>0.05)。这与除草剂活性成分、剂型及基团结构不同有关。
硝化作用是土壤氮素转化的重要生物学过程,铵态氮在硝化细菌的作用下转化为硝态氮。从以往的研究来看,施用推荐剂量除草剂对土壤硝化作用多呈现抑制效应或无影响,少部分研究表现为促进作用[26]。Martens等[27]研究28种除草剂对氮素转化影响的结果表明,6种除草剂(5 mg·kg-1)抑制粗骨土硝化作用,其他除草剂对硝化作用无影响;当除草剂用量达50 mg·kg-1干土时,28种除草剂均会抑制4种土壤硝化作用,抑制效果与除草剂类型、土壤质地和有机碳含量有关。Cycoń等[28]研究发现,敌草胺(推荐剂量和10倍推荐剂量)会导致土壤硝态氮含量显著降低16%~45%,硝化细菌数量显著降低。本研究表明,4种除草剂均显著抑制土壤硝化作用,净硝化速率和硝化率均显著降低,硝化抑制率为38.42%~58.08%,与丁洪等[10]研究结果一致。究其原因可能有两点:(1)参与氮素转化的各类微生物种群及活性对除草剂的响应具有选择性[29],因而除草剂对不同氮转化途径的影响存在差异;(2)相比其他植被类型,强酸和酚类物质积累会导致土壤微生物数量和群落结构发生变化,茶园土壤中硝化细菌数量及活性相对较低[30],对除草剂毒害效应可能更为敏感,因而抑制硝化作用。
3.2 除草剂对茶园土壤温室气体排放的影响土壤中碳氮循环过程离不开微生物的参与,而使用除草剂会对土壤微生物(土壤微生物碳氮含量、微生物群落结构及活性)产生一定影响,从而间接影响土壤温室气体的产生。以往研究表明,除草剂品种对土壤中碳氮形态、微生物数量和群落结构的影响存在差异[31],导致3种温室气体CO2、CH4和N2O对除草剂品种的响应不尽相同。这既有除草剂本身剂量和活性结构效应的差异,也有生态环境条件不同(土壤特性和种植方式等)引起的差异。本研究结果也表现出除草剂品种的差异,与单施尿素处理相比,4种除草剂均促进了茶园土壤CO2的排放,累积排放量增幅为6.05%~65.46%,其中草甘膦异丙胺和百草枯处理显著增加,而草甘膦钾盐和草铵膦处理差异不显著。这可能与除草剂剂量较小(10 mg有效成分·kg-1干土)、土壤特性(酸性土壤)及培养时间较短有关。呼蕾等[32]研究表明,施用中低剂量草甘膦会促进9种土壤CO2排放,尤其是酸性土壤,仅仅抑制1种低有机质土壤,对酸性土壤微生物碳氮均有促进作用。茶园土壤独特的环境条件(低pH值和富氧化铁铝)有利于吸附除草剂[33],游离的除草剂量相对较少,因而对土壤微生物活性影响较小;新加入适当浓度的除草剂还可以给土壤提供新的碳、氮和磷源,进一步激活土壤微生物,引起土壤呼吸速率增加;当施用高剂量除草剂时,则会抑制土壤酶的活性,杀死或抑制土壤中某种微生物,从而降低土壤微生物代谢。
土壤N2O是由硝化与反硝化作用产生的,除草剂影响土壤硝化和反硝化细菌种群数量、结构及活性,势必对土壤N2O的产生与排放产生影响。本研究中,4种除草剂显著降低了N2O排放(P<0.05),累积排放量降幅为46.21%~63.58%,百草枯处理抑制效果最显著,与丁洪等[34]、Kyaw等[35]研究结果一致。这是由于施用除草剂抑制了土壤氨氧化细菌(AOB)、硝化细菌(NOB)及反硝化细菌(DNB)的活性[36-37],降低了硝化或反硝化作用的底物浓度,从而降低了N2O的排放。Zhang等[38]通过长期的田间定位试验发现,连续施用除草剂5 a和10 a会显著降低稻田土壤AOB、NOB和DNB数量,同时降低土壤硝化速率和硝化潜势。从图 2也可以看出,施用4种除草剂后,茶园土壤硝态氮含量、净硝化速率和硝化率均显著降低,硝化抑制率达到了38.42%~58.08%,意味着产生N2O的底物浓度降低,从而降低了土壤N2O的排放通量。另外,除草剂可能抑制了硝态氮向N2O转化关键酶的活性,或者促进N2O向N2转化还原酶的活性,使得N2/N2O比例上升[39],N2O排放量降低。由于未能测定土壤反硝化过程中N2O排放通量和微生物活性变化,所以尚不能确定减排茶园土壤N2O的主要途径。
CH4是在土壤中由产甲烷微生物通过厌氧有机分解而产生,主要排放源为厌氧环境的淹水稻田和湿地,通气条件良好的好氧环境表现为CH4吸收汇或者弱排放源。本研究中,60% WHC的好氧条件下,茶园土壤CH4排放通量为0.07~0.42 μg·kg-1·d-1,远低于稻田[40]和湿地土壤[41],表现为弱排放源。这可能是由于培养瓶中的局部土壤或土壤团粒结构内存在微域的厌氧条件,从而产生一定量的CH4。同时,4种除草剂均不同程度降低了CH4的排放,累积排放量降幅为13.71%~32.09%,草甘膦异丙胺盐和百草枯处理显著降低,但4种除草剂之间差异不显著,说明施用除草剂有利于抑制CH4排放,与Mohanty等[42]研究结果一致。这主要是因为施用除草剂会抑制土壤产甲烷菌数量[43],同时能改变氧化还原电位[44],从而降低土壤CH4排放。
综上可以看出,不同除草剂对茶园土壤尿素态氮转化途径和温室气体排放的影响存在明显差异,且不同除草剂品种间的影响程度也不同。这可能与除草剂的化学结构、用量以及在土壤中吸附、降解及转化产物毒性有关,同时其在土壤中的转化过程又受生物因素(微生物降解菌和酶)和环境因素(土壤理化性质、水分、温度和根系分泌物等)的影响。因此,考虑除草剂品种的多样性以及生态毒性的复杂性,且本研究结果仅局限于培养试验,其对土壤尿素态氮转化和温室气体的影响及其机理还需展开长期系统的研究。
4 结论(1)室内培养条件下,4种茶园常用除草剂(剂量10 mg有效成分·kg-1干土)均抑制了培养前期(5 d)尿素水解作用,后期促进尿素水解,并延长了尿素水解时间,百草枯施用效果最为显著;4种除草剂均显著抑制茶园土壤硝化作用,草甘膦钾盐抑制效果最弱。
(2)茶园土壤单施尿素显著促进CO2、N2O的排放和土壤碳氮代谢循环。而施用除草剂均促进了茶园土壤CO2的排放,显著抑制N2O排放,并不同程度降低了CH4的排放。
(3)不同除草剂对茶园土壤尿素态氮转化和温室气体排放的影响存在一定差异,不同除草剂的具体效应还需通过茶园野外试验进一步验证。
| [1] |
束放, 熊延坤, 韩梅. 2015年我国农药生产与使用概况[J]. 农药科学与管理, 2016, 37(7): 10-14. SHU Fang, XIONG Yan-kun, HAN Mei. In 2015, production and consumption of pesticides in China[J]. Pesticide Science and Administration, 2016, 37(7): 10-14. |
| [2] |
宁启文. 三大主粮化肥农药利用率明显提升[N]. 农民日报, 2015-12-03(1版). NING Qi-wen. Improve the utilization efficiency of pesticide in staple crops in China[N]. Farmer's Daily, 2015-12-03(1st Edition). |
| [3] |
叶常明, 雷志芳, 王杏君. 丁草胺在土壤中的吸附及环境物质的影响[J]. 环境化学, 2003, 22(1): 14-18. YE Chang-ming, LEI Zhi-fang, WANG Xing-jun. Adsorption of butachlor in soil and influence of environmental substances[J]. Environmental Chemistry, 2003, 22(1): 14-18. |
| [4] |
Weaver M A, Krutz L J, Zablotowicz R M, et al. Effects of glyphosate on soil microbial communities and its mineralization in a Mississippi soil[J]. Pest Management Science, 2007, 63(4): 388-393. DOI:10.1002/(ISSN)1526-4998 |
| [5] |
Sándor Z, Kátai J, Tállai M, et al. The effect of herbicides applied in maize on the dynamics of some soil microbial groups and soil enzyme activity[J]. Cereal Research Communications, 2007, 35(2): 1025-1028. DOI:10.1556/CRC.35.2007.2.215 |
| [6] |
Sannino F, Gianfreda L. Pesticide influence on soil enzymatic activities[J]. Chemosphere, 2001, 45(4): 417-425. |
| [7] |
Das S, Ghosh A, Adhya T K. Nitrous oxide and methane emission from a flooded rice field as influenced by separate and combined application of herbicides bensulfuron methyl and pretilachlor[J]. Chemosphere, 2011, 84(1): 54-62. DOI:10.1016/j.chemosphere.2011.02.055 |
| [8] |
Bai S H, Xu Z, Blumfield T J, et al. Soil carbon and nitrogen dynamics in the first year following herbicide and scalping in a revegetation trial in South-east Queensland, Australia[J]. Environmental Science Pollution Research International, 2014, 21(7): 5167-5176. DOI:10.1007/s11356-013-2491-2 |
| [9] |
陈林梅, 孙青, 陈玲, 等. 几种典型除草剂对冬麦田N2O排放及其相关土壤生化因子的影响[J]. 农业环境科学学报, 2014, 33(7): 1450-1459. CHEN Lin-mei, SUN Qing, CHEN Ling, et al. Effects of herbicides on N2O emissions and soil biochemical parameters in winter-wheat field[J]. Journal of Agro-Environment Science, 2014, 33(7): 1450-1459. DOI:10.11654/jaes.2014.07.028 |
| [10] |
丁洪, 郑祥洲, 雷俊杰, 等. 除草剂对尿素氮在土壤中转化的影响[J]. 生态环境学报, 2012, 21(3): 551-554. DING Hong, ZHENG Xiang-zhou, LEI Jun-jie, et al. Effects of herbicides on transformation of urea nitrogen in vegetable plantation soil[J]. Ecology and Environmental Sciences, 2012, 21(3): 551-554. |
| [11] |
Kara E E, Arli M, Uygur V. Effects of the herbicide Topogard on soil respiration, nitrification, and denitrification in potato-cultivated soils differing in pH[J]. Biology Fertility of Soils, 2004, 39(6): 474-478. DOI:10.1007/s00374-004-0729-3 |
| [12] |
张爱云, 蔡道基. 除草剂对土壤微生物活性、土壤氨化作用和硝化作用的影响[J]. 生态与农村环境学报, 1990, 6(3): 62-66. ZHANG Ai-yun, CAI Dao-ji. Effect of herbicide on the microbial activity, nitrification and ammonification on soils[J]. Journal of Ecology and Rural Environment, 1990, 6(3): 62-66. |
| [13] |
呼蕾, 和文祥, 王旭东, 等. 草甘膦的土壤酶效应研究[J]. 农业环境科学学报, 2009, 28(4): 680-685. HU Lei, HE Wen-xiang, WANG Xu-dong, et al. Effect of glyphosate on soil enzyme[J]. Journal of Agro-Environment Science, 2009, 28(4): 680-685. |
| [14] |
Hansen D H W I, Lopez J A, Quain O R. Application of atrazine and trifluralin in relation to nitrification in the soil[J]. Malezas, 1985, 13(1): 41-48. |
| [15] |
Kinney C A, Mandernack K W, Mosier A R. Laboratory investigations into the effects of the pesticides mancozeb, chlorothalonil, and prosulfuron on nitrous oxide and nitric oxide production in fertilized soil[J]. Soil Biology & Biochemistry, 2005, 37(5): 837-850. |
| [16] |
Kinney C A, Mosier A R, Ferrer I, et al. Effects of the herbicides prosulfuron and metolachlor on fluxes of CO2, N2O, and CH4 in a fertilized Colorado grassland soil[J]. Journal of Geophysical Research Atmospheres, 2004, 109(D5): 609-615. |
| [17] |
Jiang J, Chen L, Sun Q, et al. Application of herbicides is likely to reduce greenhouse gas(N2O and CH4) emissions from rice-wheat cropping systems[J]. Atmospheric Environment, 2015, 107: 62-69. DOI:10.1016/j.atmosenv.2015.02.029 |
| [18] |
中华人民共和国国家统计局. 2016中国统计年鉴[R]. 北京: 中华人民共和国国家统计局, 2016: 1201. National Bureau of Statistics of the People's Republic of China. 2016 China statistical yearbook[R]. Beijing:National Bureau of Statistics of the People's Republic of China, 2016:1201. |
| [19] |
王玉军, 周东美, 孙瑞娟, 等. 除草剂草甘膦在几种土壤和矿物上的吸附研究[J]. 土壤学报, 2006, 43(5): 780-785. WANG Yu-jun, ZHOU Dong-mei, SUN Rui-juan, et al. Adsorption of glyphosate on soil and minerals[J]. Acta Pedologica Sinica, 2006, 43(5): 780-785. |
| [20] |
俞慎, 何振立, 陈国潮, 等. 不同树龄茶树根层土壤化学特性及其对微生物区系和数量的影响[J]. 土壤学报, 2003, 40(3): 433-439. YU Shen, HE Zhen-li, CHEN Guo-chao, et al. Soil chemical characteristics and their impacts on soil microflora in the root layer of tea plants with different cultivating ages[J]. Acta Pedologica Sinica, 2003, 40(3): 433-439. DOI:10.11766/trxb200101130317 |
| [21] |
Yao H, Liu Y, Xue D. Influence of tea cultivation on soil microbial biomass and substrate utilization pattern[J]. Communications in Soil Science and Plant Analysis, 2006, 37(5/6): 641-651. |
| [22] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000, 146-226. LU Ru-kun. Analytical methods for soil agro-chemistry[M]. Beijing: Chinese Agricultural Science and Technology Press, 2000, 146-226. |
| [23] |
Haney R L, Senseman S A, Krutz L J, et al. Soil carbon and nitrogen mineralization as affected by atrazine and glyphosate[J]. Biology and Fertility of Soils, 2002, 35(1): 35-40. DOI:10.1007/s00374-001-0437-1 |
| [24] |
杨春璐, 孙铁珩, 和文祥, 等. 农药对土壤脲酶活性的影响[J]. 应用生态学报, 2006, 17(7): 1354-1356. YANG Chun-lu, SUN Tie-heng, HE Wen-xiang, et al. Effects of pesticides on soil urease activity[J]. Chinese Journal of Applied Ecology, 2006, 17(7): 1354-1356. |
| [25] |
Gianfreda L, Sannino F, Violante A. Pesticide effects on the activity of free, immobilized and soil invertase[J]. Soil Biology Biochemistry, 1995, 27(9): 1201-1208. DOI:10.1016/0038-0717(95)00034-C |
| [26] |
Kucharski J, Bac'Maga M, Wyszkowska J. Effect of herbicides on the course of ammonification in soil[J]. Journal of Elementology, 2009, 14(3): 477-487. |
| [27] |
Martens D A, Bremner J M. Influence of herbicides on transformations of urea nitrogen in soil[J]. Journal of Environmental Science Health, Part B, 1993, 28(4): 377-395. DOI:10.1080/03601239309372831 |
| [28] |
Cycoń M, Wójcik M, Borymski S, et al. Short-term effects of the herbicide napropamide on the activity and structure of the soil microbial community assessed by the multi-approach analysis[J]. Applied Soil Ecology, 2013, 66(1): 8-18. |
| [29] |
Chen S K, Edwards C A, Subler S. Effects of the fungicides benomyl, captan and chlorothalonil on soil microbial activity and nitrogen dynamics in laboratory incubations[J]. Soil Biology Biochemistry, 2001, 33(14): 1971-1980. DOI:10.1016/S0038-0717(01)00131-6 |
| [30] |
Xue D, Yao H, Huang C. Microbial biomass, N mineralization and nitrification, enzyme activities, and microbial community diversity in tea orchard soils[J]. Plant and Soil, 2006, 288(1): 319-331. |
| [31] |
Lo C C. Effect of pesticides on soil microbial community[J]. Journal of Environmental Science Health, Part B, 2010, 45(5): 348-59. DOI:10.1080/03601231003799804 |
| [32] |
呼蕾, 和文祥, 高亚军. 草甘膦对土壤微生物量及呼吸强度的影响[J]. 西北农业学报, 2010, 19(7): 168-172. HU Lei, HE Wen-xiang, GAO Ya-jun. Effect of glyphosate on soil microbial biomass and respiration[J]. Acta Agriculturae Boreali-occidentalis Sinica, 2010, 19(7): 168-172. |
| [33] |
Morillo E, Undabeytia T, Maqueda C, et al. Glyphosate adsorption on soils of different characteristics[J]. Chemosphere, 2000, 40(1): 103-107. DOI:10.1016/S0045-6535(99)00255-6 |
| [34] |
丁洪, 郑祥洲, 雷俊杰, 等. 除草剂对土壤温室气体排放的影响[J]. 农业环境科学学报, 2012, 31(2): 435-439. DING Hong, ZHENG Xiang-zhou, LEI Jun-jie, et al. Effects of herbicides on greenhouse gases emission from vegetable plantation soil[J]. Journal of Agro-Environment Science, 2012, 31(2): 435-439. |
| [35] |
Kyaw K M, Toyota K. Suppression of nitrous oxide production by the herbicides glyphosate and propanil in soils supplied with organic matter[J]. Soil Science Plant Nutrition, 2007, 53(4): 441-447. DOI:10.1111/j.1747-0765.2007.00151.x |
| [36] |
Vlad D C, Filimon M N, Popescu R, et al. Sulfonylureic herbicide influence on bacterial communities in soil[J]. Annals of the Romanian Society for Cell Biology, 2012, 17(2): 77-81. |
| [37] |
Li X Y, Zhang H W, Wu M N, et al. Impact of acetochlor on ammonia-oxidizing bacteria in microcosm soils[J]. Journal of Environmental Sciences, 2008, 20(9): 1126-1131. DOI:10.1016/S1001-0742(08)62159-2 |
| [38] |
Zhang X, Li X, Zhang C, et al. Responses of soil nitrogen-fixing, ammonia-oxidizing, and denitrifying bacterial communities to long-term chlorimuron-ethyl stress in a continuously cropped soybean field in Northeast China[J]. Annals of Microbiology, 2013, 63(4): 1619-1627. DOI:10.1007/s13213-013-0625-x |
| [39] |
Chen W C, Yen J H, Chang C S, et al. Effects of herbicide butachlor on soil microorganisms and on nitrogen-fixing abilities in paddy soil[J]. Ecotoxicology Environmental Safety, 2009, 72(1): 120-127. DOI:10.1016/j.ecoenv.2008.03.013 |
| [40] |
王欣欣, 邹平, 符建荣, 等. 不同竹炭施用量对稻田甲烷和氧化亚氮排放的影响[J]. 农业环境科学学报, 2014, 33(1): 198-204. WANG Xin-xin, ZOU Ping, FU Jian-rong, et al. Effects of bamboo biochar amendments on methane and nitrous oxide emission from paddy soil[J]. Journal of Agro-Environment Science, 2014, 33(1): 198-204. DOI:10.11654/jaes.2014.01.026 |
| [41] |
Petrescu A M R, Van Beek L P H, Van Huissteden J, et al. Modeling regional to global CH4 emissions of boreal and arctic wetlands[J]. Global Biogeochemical Cycles, 2010, 24(4): GB4009. |
| [42] |
Mohanty S R, Nayak D R, Babu Y J, et al. Butachlor inhibits production and oxidation of methane in tropical rice soils under flooded condition[J]. Microbiological Research, 2004, 159(3): 193-201. DOI:10.1016/j.micres.2004.03.004 |
| [43] |
吕镇梅, 闵航, 叶央芳. 除草剂二氯喹啉酸对水稻田土壤中微生物种群的影响[J]. 应用生态学报, 2004, 15(4): 605-609. LÜ Zhen-mei, MIN Hang, YE Yang-fang. Effect of herbicide quinclorac on microbic populations in a paddy soil[J]. Chinese Journal of Applied Ecology, 2004, 15(4): 605-609. |
| [44] |
Mohanty S R, Bharati K, Moorthy B T S, et al. Effect of the herbicide butachlor on methane emission and ebullition flux from a direct-seeded flooded rice field[J]. Biology Fertility of Soils, 2001, 33(3): 175-180. DOI:10.1007/s003740000301 |
 2017, Vol. 36
2017, Vol. 36




