文章信息
- 孟明辉, 贺泽英, 徐亚平, 王璐, 彭祎, 刘潇威
- MENG Ming-hui, HE Ze-ying, XU Ya-ping, WANG Lu, PENG Yi, LIU Xiao-wei
- QuEChERS方法结合高效液相色谱-串联质谱法同时测定土壤中20种抗生素
- Simultaneous extraction and determination of antibiotics in soils using a QuEChERS-based method and liquid chromatography-tandem mass spectrometry
- 农业环境科学学报, 2017, 36(8): 1672-1679
- Journal of Agro-Environment Science, 2017, 36(8): 1672-1679
- http://dx.doi.org/10.11654/jaes.2017-0249
文章历史
- 收稿日期: 2017-03-01
抗生素被广泛用于大批量养殖产业,能保护动物免受疾病[1, 3],但它也可以通过动物排泄以有机肥形式进入到环境土壤和周围的水体中[2]。在近四五十年中,这些药物的使用量不断增加,造成了重大的环境问题,因而备受关注。近年来,抗生素已经被认为是一种新型的潜在污染物[4-6]。
尽管在土壤环境基质中已发现了多种抗生素药物,但仍未有土壤中抗生素多残留的标准分析方法。由于土壤基质的复杂性,很难从土壤中提取抗生素[7]。为了评价抗生素的环境影响,需要建立一种可靠、准确的检测土壤环境中抗生素的方法。
传统环境样品中抗生素的提取方法是基于使用乙腈-磷酸盐超声提取,结合固相萃取(SPE)净化。Blackwell等[8]利用超声波辅助法提取,固相萃取净化土壤和猪粪中的兽药抗生素,马丽丽等[9]建立超高效液相色谱/串联质谱法同时测定土壤中18种抗生素,这两种方法具有良好的回收率、低的定量限,然而超声波提取和多次重复提取比较耗时。
在已有的净化方法中,固相萃取因其较好的净化效果和较高的回收率被广泛应用于土壤、粪便、牛奶和动物组织等基质中[10-13]。虽然固相萃取具有很多优点,但是其步骤繁琐、耗时,并且材料昂贵。2003年Anastassiades等[14]建立了一种快速、简单、廉价、高效、安全的方法,即QuEChERS方法,最初是用于蔬果类农药残留的提取、净化,近年来,它也被用于抗生素的多残留分析中[15-17]。这种方法采用乙腈提取,经分散固相萃取材料(d-SPE),如PSA(Primary Secondary Amine)、C18(Octadecylsilane)、GCB(Grafted Carbon Black)的净化,然后上机。该方法的优点是具有简单的前处理步骤、高的回收率、准确的测定结果,并且大幅降低了材料和试剂的成本以及实验人员接触有害溶剂的可能性。Bourdat-Deschamps等[18]建立了环境水样中抗生素的QuEChERS方法,回收率一般在75.0%以上。Dorival-García等[19]建立了QuEChERS方法用于检测堆肥中17种抗生素,回收率范围为95.3%~106.2%,相对标准偏差小于7.0%。但是,在土壤基质中抗生素多残留的QuEChERS分析方法尚未见报道。
本研究的目的是建立一种检测土壤基质中20种抗生素的QuEChERS方法。研究内容包括:色谱条件、提取步骤、净化步骤的优化,并通过回收率、线性、定量限、基质效应、实际样品的检测验证所建立方法的可行性。
1 材料和方法 1.1 标准溶液的配制标准品:磺胺醋酰(Sulfacetamide,SAA),磺胺二甲异嘧啶(Sulfisomidine,SIM),磺胺嘧啶(Sulfadiazine,SDZ),磺胺噻唑(Sulfathiazole,STZ),磺胺砒啶(Sulfapyridine,SPD),磺胺甲基嘧啶(Sulfamerazine,SMR),磺胺对甲氧嘧啶(Sulfameter,SME),磺胺二甲嘧啶(Sulfadimidine,SDD),磺胺甲噻二唑(Sulfamethizole,SMT),磺胺邻二甲氧嘧啶(Sulfadoxin,SDX),磺胺甲噁唑(Sulfamethoxazole,SMZ),磺胺噁唑(Sulfamoxole,SMX),磺胺间甲氧嘧啶(Sulfamonomethoxine,SMM),磺胺二甲异噁唑(Sulfisoxazole,SIX),磺胺苯酰(Sulfabenzamide,SBA),磺胺喹恶啉(Sulfaquinoxaline,SQX),磺胺间二甲氧嘧啶(Sulfadimethoxine,SDM),红霉素(Erythromycin,ERY),罗红霉素(Roxithromycin,ROX),克拉霉素(Clarithromycin,CLR),标准品纯度均大于98.0%,购于德国DrEhrenstorfer公司。上述标准品均使用甲醇配制成1000 mg·L-1标准储备液,-20 ℃储存。用甲醇配制上述20种抗生素的混合标准溶液,浓度为1 mg·kg-1,-20 ℃储存。
1.2 材料与试剂甲醇和乙腈(色谱纯,Fisher公司),甲酸(98.0%,Acros Organics公司),Na2EDTA·2H2O(分析纯,国药有限公司);磷酸,氯化钠(天津化学试剂公司)。实验用水均经Milli-Q净水系统净化。分散固相萃取材料(PSA、C18、GCB)购于Agilent公司,HLB固相萃取小柱(500 mg,6 mL)购于Waters公司。磷酸盐缓冲液(27.2 g KH2PO4与1.3 mL H3PO4用超纯水定容至1 L)。
1.3 仪器涡旋振荡器(美国Thermo公司);高速冷冻离心机(香港Heal Force公司);N-EVAP氮吹仪(美国Organomation公司);Acquity高效液相色谱仪,C18色谱柱(1.8 μm;2.1 mm × 100 mm, 美国Waters公司);Qtrap 4500三重四级杆质谱仪(美国SCIEX公司)。
1.4 色谱条件液相条件:柱温40 ℃,流动相为乙腈(A)、0.1%甲酸(B),流速0.3 mL·min-1;流动相梯度为0~1.5 min 10%A,1.5~8 min 10%~70%A,8~8.1 min 70%~10%A,8.1~10 min 10%A。
质谱条件:离子喷雾电压4.5 kV;离子源温度500 ℃;离子源气体1(GS1)50 psi(1 psi=6.89 kPa);离子源气体2(GS2)50 psi;采用正离子检测模式。目标抗生素的保留时间、离子对、去簇电压、碰撞能等质谱条件见表 1。
土样采自天津市西青区农田0 ~ 20 cm的表层土壤(经检测未含目标抗生素),在直径2.0 m左右的范围内取样约10.0 kg,自然风干后过2.0 mm孔径筛。土壤pH 7.2,有机质含量1.5%。
1.6 提取和净化步骤QuEChERS方法步骤:称取5.0 g土样于50 mL离心管中,加入一定量标准物质,静置一段时间,然后加入0.4 g Na2EDTA、10.0 mL缓冲液和10.0 mL乙腈,剧烈摇晃3 min,再加入2.0 g NaCl继续手摇1 min,8000 r·min-1离心5 min;吸取2.0 mL上清液于5.0 mL含有分散固相萃取材料(25.0 mg PSA、10.0 mg C18、100.0 mg MgSO4)的离心管中,涡旋1 min,5000 r·min-1离心3 min,吸取1.0 mL上清液于玻璃离心管中,在35 ℃水浴中氮吹至近干,1.0 mL甲醇:水(体积比1: 1)复溶,过0.22 μm纤维滤膜,LC-MS/MS上机。方法优化时,每组另加两个全程序空白平行样(上机之前加入一定量的标准物质溶液),以校正各待测化合物在土壤基质中存在的不可忽略的基质效应。
SPE方法步骤:称取5.0 g土壤样品于50 mL离心管中,加入0.4 g Na2EDTA、10.0 mL缓冲液和10.0 mL乙腈,手摇3 min,8000 r·min-1离心5 min,将上清液全部倒入球形瓶,然后旋蒸至10.0 mL以下,再用超纯水稀释至100 mL,用甲酸调节pH至2.5,开始过HLB小柱,过柱前,预先用6.0 mL甲醇、6.0 mL超纯水活化SPE小柱。过柱后,用6.0 mL甲醇洗脱HLB柱,将洗脱液氮吹至近干,后同QuEChERS方法。
2 结果与讨论 2.1 提取条件的优化采用超声辅助提取可提高目标物的回收率[2],本试验对该方法的效果进行了验证。按文1.6中QuEChERS方法步骤进行试验,结果(图 1)表明超声对目标抗生素的提取几乎没有影响。因此,本试验不采用超声辅助提取,进而节约前处理时间。

|
| 图 1 超声和不超声的回收率对比 Figure 1 The comparison of recoveries with and without ultrasonic bath |
提取完成后,为减少基质效应,将含有目标抗生素的有机相加入到d-SPE净化材料(PSA、C18、GCB)中进行下一步净化。PSA作为弱阴离子交换剂,可以形成强相互作用的氢键,并去除脂肪酸和其他极性有机酸;非极性吸附剂C18反相吸附脂肪和一些矿物质;GCB保留平面物质,用于去除色素[19, 22-23]。无水硫酸镁作为传统干燥剂用于去除有机溶剂残留的水。如图 2所示,在添加浓度为100.0 μg·kg-1水平下,选用5.0 mg GCB、100.0 mg MgSO4作为净化材料得到较低的回收率。其中,GCB对磺胺邻二甲氧嘧啶、磺胺噁唑、磺胺二甲异噁唑、磺胺间二甲氧嘧啶有少量吸附,回收率约60.0%,特别是对红霉素具有强烈的吸附作用,回收率为0.6%。因此,本试验没有选择GCB,而是选用PSA和C18作为净化材料。本试验对这两种净化材料分别设计了3个水平:C18(10.0、25.0、50.0 mg),PSA(10.0、25.0、50.0 mg)。为优化到其最佳配比,回收率和基质效应必须同时考虑。基质效应(Matrix Effects,ME)计算公式[24]如下:
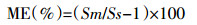 (1)
(1)

|
| 图 2 使用5.0 mg GCB作为d-SPE净化材料时20种抗生素的回收率 Figure 2 Recoveries of 20 antibiotics using 5.0 mg GCB as d-SPE sorbent |
式中:Sm和Ss分别表示基质标曲和溶剂标曲的斜率。
当ME为-20.0%~20.0%、-50.0%~-20.0%和20.0%~50.0%、<-50.0%和>50.0%时,分别表示轻微、中等、较强的基质效应。
如图 3至图 6所示,当选择50.0 mg PSA作为净化材料时,磺胺醋酰、磺胺二甲异嘧啶、磺胺甲噻二唑、磺胺噁唑的回收率低于55.0%。对于C18,三组基质效应均低于60.0%,大多数低于40.0%,但使用10.0 mg C18时的回收率均大于65.0%。所以,本试验最终选择25.0 mg PSA、10.0 mg C18作为净化材料。图 7为最终优化后的基质效应。

|
| 图 3 不同PSA加入量的基质效应 Figure 3 ME of different masses of PSA as d-SPE sorbent |

|
| 图 4 不同C18加入量的基质效应 Figure 4 ME of different masses of C18 as d-SPE sorbent |

|
| 图 5 不同PSA加入量下20种抗生素的回收率 Figure 5 The recoveries of 20 antibiotics using different masses of PSA as d-SPE sorbent |

|
| 图 6 不同C18加入量下20种抗生素的回收率 Figure 6 he recoveries of 20 antibiotics using different masses of C18 as d-SPE sorbent |

|
| 图 7 使用优化后的净化材料得到的20种抗生素的基质效应 Figure 7 The matrix effects of the optimized combination adsorbents for 20 analytes |
本研究将QuEChERS方法和传统SPE方法进行了回收率对比,实验结果如图 8所示。对于绝大多数抗生素而言,QuEChERS方法的回收率大于SPE方法,尤其是磺胺二甲异恶唑和红霉素。

|
| 图 8 QuEChERS方法与SPE方法的回收率对比 Figure 8 The recoveries of 20 antibiotics using QuEChERS and SPE |
实际试验过程对比表明,QuEChERS方法简单的前处理步骤仅耗时1 h,较SPE方法5 h大为缩短;QuEChERS方法单个样品比SPE方法节省约70元(主要节省了Waters Oasis HLB小柱);QuEChERS方法整个流程的试剂基本处于封闭状态,很大程度上降低了实验人员接触有害溶剂的可能性。试验证明,对于本试验所选定的目标抗生素,QuEChERS方法优于SPE方法。
2.4 方法验证本试验通过线性、回收率和定量限对QuEChERS方法进行了验证。
由空白基质配制的8个浓度水平(1.0、2.0、5.0、10.0、20.0、50.0、100.0、200.0 μg·kg-1)的标准工作曲线呈现良好的线性,R2在0.990~0.998之间(表 2)。
在7个添加浓度水平(2.0、5.0、10.0、20.0、50.0、100.0、200.0 μg·kg-1)下得到的回收率为61.4%~118.9%,相对标准偏差低于20.0%。
该方法的定量限取值为具有可接受的回收率(60.0%~120.0%)和相对标准偏差(小于20.0%)时的最低浓度。本试验所选取的目标抗生素的定量限大部分都低于5.0 μg·kg-1,比Peysson等[25]所报道的值低。在10.0、50.0、200.0 μg·kg-1添加浓度下的回收率、相对标准偏差、定量限见表 3。

|
在天津市东丽区菜地共采集10个土样:Q-1茄子地,Q-2甘蓝地,Q-3菠菜地,Q-4红薯地,Q-5花菜地,Q-6大白菜地,Q-7污灌区,Z-1、C-1、F-1为玉米地。每个样品约500 g,自然风干后过2.0 mm孔径筛,随后用本研究建立的QuEChERS方法进行检测,其中8个土样有检出,大部分检出抗生素低于定量限,Q-2中罗红霉素浓度高于定量限,浓度为3.7 μg·kg-1,Q-1和Q-5中克拉霉素浓度高于定量限,浓度分别为2.9、2.4 μg·kg-1。罗红霉素和克拉霉素这两种大环内酯类抗生素在土壤中降解较慢,吸附性较强[24],可较长时间稳定地残留在土壤基质中。上述结果表明,本方法可应用于土壤中抗生素含量的检测。
3 结论(1)通过对提取方式、净化材料用量及配比的优化,并进行方法的验证,建立了基于QuEChERS方法同时检测土壤中20种抗生素多残留的高效液相色谱-串联质谱法。
(2)对于所选定的目标抗生素,QuEChERS方法优于SPE方法,体现了快速、简单、廉价等特点。
(3)QuEChERS方法现已成功应用于土壤中多种抗生素含量的检测,可为环境风险评估提供一定的数据支持。
| [1] |
Freitas A, Barbosa J, Ramos F. Multidetection of antibiotics in liver tissue by ultra-high-pressure liquid-chromatography-tandem mass spectrometry[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2015, 976/977: 49-54. DOI:10.1016/j.jchromb.2014.11.008 |
| [2] |
Guo C N, Wang M R, Xiao H, et al. Development of a modified QuEChERS method for the determination of veterinary antibiotics in swine manure by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2016, 1027: 110-118. DOI:10.1016/j.jchromb.2016.05.034 |
| [3] |
Dickson L C. Performance characterization of a quantitative liquid chromatography-tandem mass spectrometric method for 12 macrolide and lincosamide antibiotics in salmon, shrimp and tilapia[J]. Journal of Chromatography B, Analytical Technologies in the Biomedical and Life Sciences, 2014, 967: 203-210. DOI:10.1016/j.jchromb.2014.07.031 |
| [4] |
Turiel E, Martín-Esteban A, Tadeo J L. Multiresidue analysis of quinolones and fluoroquinolones in soil by ultrasonic-assisted extraction in small columns and HPLC-UV[J]. Analytica Chimica Acta, 2006, 562(1): 30-35. DOI:10.1016/j.aca.2006.01.054 |
| [5] |
Li H, Sun H W, Zhang J X, et al. Highly sensitive and simultaneous determination of sixteen sulphonamide antibiotics, four acetyled metabolites and trimethoprim in meat by rapid resolution liquid chromatography-tandem mass spectrometry[J]. Food Control, 2013, 31(2): 359-365. DOI:10.1016/j.foodcont.2012.09.028 |
| [6] |
Balakrishnan V K, Exall K N, Toito J M. The development of a microwave-assisted extraction method for the determination of sulfonamide antibiotics in sediments and soils[J]. Canadian Journal of Chemistry, 2014, 92(5): 369-377. DOI:10.1139/cjc-2013-0457 |
| [7] |
Anthony J C, Gregory L B, Allison A M, et al. Sorption of ciprofloxacin and oxytetracycline zwitterions to soils and soil minerals:Influence of compound structure[J]. Environmental Science Technology, 2008, 42(20): 7634-7642. DOI:10.1021/es801277y |
| [8] |
Blackwell P A, HoltenLutzhoft H C, Ma H P, et al. Ultrasonic extraction of veterinary antibiotics from soils and pig slurry with SPE clean-up and LC-UV and fluorescence detection[J]. Talanta, 2004, 64(4): 1058-1064. DOI:10.1016/j.talanta.2004.05.006 |
| [9] |
马丽丽, 郭昌盛, 胡伟, 等. 固相萃取-高效液相色谱-串联质谱法同时测定土壤中氟喹诺酮、四环素和磺胺类抗生素[J]. 分析化学, 2010, 38(1): 21-26. MA Li-li, GUO Chang-sheng, HU Wei, et al. Simultaneous extraction and determination of fluoroquinolones, tetracyclines and sulfonamides antibiotics in soils using optimised solid phase extraction chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2010, 38(1): 21-26. |
| [10] |
Hu W, Ma L L, Guo C S, et al. Simultaneous extraction and determination of fluoroquinolones, tetracyclines and sulfonamides antibiotics in soils using optimised solid phase extraction chromatography-tandem mass spectrometry[J]. International Journal of Environmental Analytical Chemistry, 2012, 92(6): 698-713. DOI:10.1080/03067319.2010.520122 |
| [11] |
Ho Y B, Zakaria M P, Latif P A, et al. Degradation of veterinary antibiotics and hormone during broiler manure composting[J]. Bioresource Technology, 2013, 131: 476-484. DOI:10.1016/j.biortech.2012.12.194 |
| [12] |
Junza A, Dorival-Garcia N, Zafra-Gomez A, et al. Multiclass method for the determination of quinolones and beta-lactams, in raw cow milk using dispersive liquid-liquid microextraction and ultra high performance liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2014, 1356: 10-22. DOI:10.1016/j.chroma.2014.06.034 |
| [13] |
Zhang Z W, Li X W, Ding S Y, et al. Multiresidue analysis of sulfonamides, quinolones, and tetracyclines in animal tissues by ultra-high performance liquid chromatography-tandem mass spectrometry[J]. Food Chemistry, 2016, 204: 252-262. DOI:10.1016/j.foodchem.2016.02.142 |
| [14] |
Anastassiades M, Lehotay S J, tajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431. |
| [15] |
Stubbings G, Bigwood T. The development and validation of a multiclass liquid chromatography tandem mass spectrometry(LC-MS/MS)procedure for the determination of veterinary drug residues in animal tissue using a QuEChERS (Quick, Easy, Cheap, Effective, Rugged and Safe) approach[J]. Analytica Chimica Acta, 2009, 637(1/2): 68-78. |
| [16] |
Shendy A H, Al-Ghobashy M A, Gad Alla S A, et al. Development and validation of a modified QuEChERS protocol coupled to LC-MS/MS for simultaneous determination of multi-class antibiotic residues in honey[J]. Food Chemistry, 2016, 190: 982-989. DOI:10.1016/j.foodchem.2015.06.048 |
| [17] |
Wang Y L, Liu Z M, Ren J, et al. Development of a method for the analysis of multiclass antibiotic residues in milk using QuEChERS and liquid chromatography-tandem mass spectrometry[J]. Foodborne Pathogens and Disease, 2015, 12(8): 693-703. DOI:10.1089/fpd.2014.1916 |
| [18] |
Bourdat-Deschamps M, Leang S, Bernet N, et al. Multi-residue analysis of pharmaceuticals in aqueous environmental samples by online solid-phase extraction-ultra-high-performance liquid chromatography-tandem mass spectrometry:Optimisation and matrix effects reduction by quick, easy, cheap, effective, rugged and safe extraction[J]. Journal of Chromatography A, 2014, 1349: 11-23. DOI:10.1016/j.chroma.2014.05.006 |
| [19] |
Dorival-García N, Labajo-Recio C, Zafra-Gomez A, et al. Improved sample treatment for the determination of 17 strong sorbed quinolone antibiotics from compost by ultra high performance liquid chromatography tandem mass spectrometry[J]. Talanta, 2015, 138: 247-257. DOI:10.1016/j.talanta.2015.03.011 |
| [20] |
Salvia M V, Cren-Olive C, Vulliet E. Statistical evaluation of the influence of soil properties on recoveries and matrix effects during the analysis of pharmaceutical compounds and steroids by quick, easy, cheap, effective, rugged and safe extraction followed by liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1315: 53-60. DOI:10.1016/j.chroma.2013.09.056 |
| [21] |
Usui K, Hayashizaki Y, Minagawa T, et al. Rapid determination of disulfoton and its oxidative metabolites in human whole blood and urine using QuEChERS extraction and liquid chromatography-tandem mass spectrometry[J]. Legal Medicine, 2012, 14(6): 309-316. DOI:10.1016/j.legalmed.2012.06.005 |
| [22] |
He Z Y, Wang L, Peng Y, et al. Determination of selected polychlorinated biphenyls in soil and earthworm(Eisenia fetida) using a QuEChERS-based method and gas chromatography with tandem MS[J]. Journal of Separation Science, 2015, 38(21): 3766-3773. DOI:10.1002/jssc.201500624 |
| [23] |
Feng X, He Z Y, Wang L, et al. Multiresidue analysis of 36 pesticides in soil using a modified quick, easy, cheap, effective, rugged, and safe method by liquid chromatography with tandem quadruple linear ion trap mass spectrometry[J]. Journal of Separation Science, 2015, 38(17): 3047-3054. DOI:10.1002/jssc.v38.17 |
| [24] |
郭欣妍, 王娜, 郝利君, 等. 超高效液相色谱/串联质谱法同时测定水、土壤及粪便中25种抗生素[J]. 分析化学, 2015, 43(1): 13-20. GUO Xin-yan, WANG Na, HAO Li-jun, et al. Simultaneous extraction and determination of 25 antibiotics in water, soils and manure using chromatography-tandem mass spectrometry[J]. Chinese Journal of Analytical Chemistry, 2015, 43(1): 13-20. |
| [25] |
Peysson W, Vulliet E. Determination of 136 pharmaceuticals and hormones in sewage sludge using quick, easy, cheap, effective, rugged and safe extraction followed by analysis with liquid chromatography-time-of-flight-mass spectrometry[J]. Journal of Chromatography A, 2013, 1290: 46-61. DOI:10.1016/j.chroma.2013.03.057 |
 2017, Vol. 36
2017, Vol. 36






