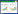文章信息
- 杨苗, 贺俊亚, 孙雨舟, 韩兆雪, 陈晓红, 李亚君, 温晓霞
- YANG Miao, HE Jun-ya, SUN Yu-zhou, HAN Zhao-xue, CHEN Xiao-hong, LI Ya-jun, WEN Xiao-xia
- 不同烃链长度咪唑类离子液体对玉米幼苗生长的影响
- Effects of imidazolium-based ionic liquids with different hydrocarbon chain Length on growth of maize seedlings
- 农业环境科学学报, 2017, 36(9): 1719-1725
- Journal of Agro-Environment Science, 2017, 36(9): 1719-1725
- http://dx.doi.org/10.11654/jaes.2017-0570
文章历史
- 收稿日期: 2017-04-17
2. 西北农林科技大学生命科学学院, 陕西 杨凌 712100
2. College of Life Science, Northwest A & F University, Yangling 712100, China
离子液体(Ionic Liquids,ILs)是由有机阳离子和无机或有机阴离子组成、室温下呈液体状态的盐。由于具有导电性强、化学性质稳定、不挥发、不易燃等特性,使其在电化学、化学反应和分离过程等领域被广泛应用[1-2]。伴随着ILs的大规模应用,其不可避免的通过水循环等途径进入生态系统,对环境和生物体造成不同程度的影响。咪唑类ILs为目前应用最广泛的一类ILs,并且越来越多的研究表明,咪唑类传统ILs的生物降解性较差,对分子(酶)、细胞、微生物、藻类和动植物等均有较显著的毒性[3-4]。
有关ILs的毒性研究主要集中在以下两方面:一是ILs对生态系统中各类生物的毒性作用情况;二是ILs的阴、阳离子组成及结构对其毒性之影响[5]。相关研究以生物个体水平的毒性试验为主,并有一些分子、细胞水平的毒性研究。其毒性机理主要与细胞膜结构的破坏以及氧化胁迫有关,例如:Hartmann等[6]从基因水平研究了季鏻离子液体对构巢曲霉的毒性,发现离子液体毒性作用的主要机制是损坏细胞壁以及增大细胞膜透性;Du等[7]分析了离子液体1-辛基-3-甲基咪唑六氟磷酸盐([Omim]PF6)对斑马鱼Danio rerio的抗氧化酶活性、DNA损伤等的影响,结果表明离子液体可诱导氧化应激反应和DNA损伤,并且程度随时间而累积;牧辉等[8]研究发现ILs对普通小球藻的生长和叶绿素a的产生均有显著的抑制作用;Liu等[9]在水稻中的研究也发现ILs对光合作用及叶绿素代谢具有显著的抑制作用。在所研究的生物类群方面,以对水生生物(如藻类、鱼类等)影响的研究居多,对陆生植物的相对较少。
玉米(Zea mays L.)是目前我国播种面积最大的农作物,在农田生态系统中具有重要地位。本研究以玉米为实验材料,探究三种不同烃链长度咪唑类ILs:1-丁基-3-甲基咪唑氯盐([C4mim]Cl)、1-己基-3-甲基咪唑氯盐([C6mim]Cl)和1-辛基-3-甲基咪唑氯盐([C8mim]Cl)对玉米幼苗的毒性效应,为综合评价ILs对生态环境的潜在危害提供理论依据。
1 材料与方法 1.1 供试材料本试验以目前我国广泛种植的玉米品种郑单958为材料(北京德农种业)。[C4mim]Cl、[C6mim]Cl和[C8mim]Cl均购自兰州中科凯特科工贸有限公司。
1.2 玉米幼苗培养幼苗的培养全部在恒温光照培养箱中进行。挑选均一饱满的玉米种子,用75%酒精溶液消毒5 min,蒸馏水多次冲洗后,28 ℃(暗)浸种催芽12 h,在发芽盒底部铺上双层滤纸,30 mL蒸馏水浸湿,28 ℃发芽48 h[9]。选取发芽均匀一致的种子,每20粒一组培养于带孔水培盒上,将种子初生根浸入培养液中培养,培养液为含不同浓度ILs的Hoagland营养液(pH=6.0)[10],无曝气装置。培养条件:光照强度10 000 lx,温度28 ℃,光照/黑暗周期为16 h /8 h[9],培养6 d,每隔1 d更换一次培养液。
1.3 实验设计玉米幼苗根、茎干重抑制率测定,依据预实验结果(数据未提供)设置:[C4mim]Cl,0、75、200、400、600、800、1000 mg·L-1;[C6mim]Cl,0、10、20、50、100、150 mg·L-1;[C8mim]Cl,0、5、10、25、50、75、100 mg·L-1。
玉米幼苗抗氧化酶系和MDA含量测定,参照根、茎生物量抑制情况设置:[C4mim]Cl,0、200、400、600、800 mg·L-1;[C6mim]Cl,0、10、20、30、40 mg·L-1;[C8mim]Cl,0、2、4、6、8 mg·L-1。
以不含ILs的Hoagland营养液为对照,每处理设3组重复。
1.4 测定方法ILs对玉米幼苗根、茎重的影响:取培养第7 d的玉米幼苗进行测定,根、茎重均为干重(80 ℃烘干48 h),根据测定结果计算根、茎重抑制率,每处理10株重复。采用Logistic模型[11]拟合根/茎干重抑制率-浓度曲线,并计算各处理的EC50值。
抗氧化酶活性和丙二醛(MDA)含量的测定:称取0.3 g玉米根/茎鲜样并匀浆,用于酶液的提取,参照李忠光等[12]的方法进行测定。本研究中所测定的酶活力为比活力,即每毫克可溶性蛋白所含的酶活力单位。可溶性蛋白含量的测定采用考马斯亮蓝G250染色法[13];超氧化物歧化酶(SOD)活性测定采用NBT还原法[13];过氧化物酶(POD)活性测定采用愈创木酚法[14];过氧化氢酶(CAT)活性测定参照Kang等[15]的方法;APX活性参照李忠光等[12]的方法;MDA含量测定参照邹琦等[13]的方法。
1.5 数据统计与分析用Orgin 7.5对抑制率进行拟合,模型为Losgitic模型y=(A1-A2)/[1+(x/x0)p]+A2,采用单因素方差分析(ANOVA)并用LSD法进行显著性检验。
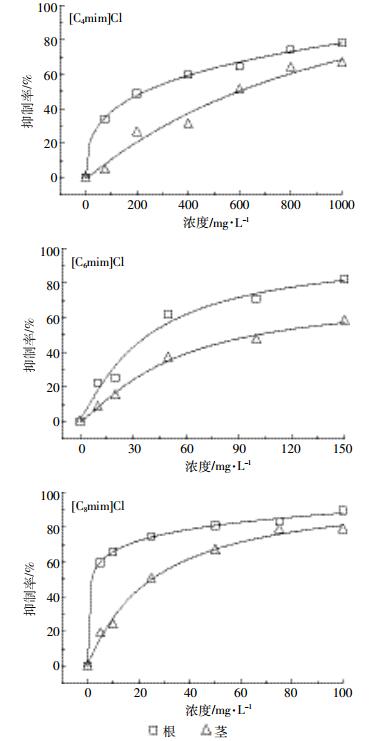
2 结果与分析 2.1 三种烃链长度ILs对玉米幼苗生长的影响不同浓度[C4mim]Cl、[C6mim]Cl和[C8mim]Cl培养6 d后,玉米幼苗根、茎生长均受到明显抑制,表现为植株细弱、侧根不生长等(图 1)。生物量积累是反映植株生长状况的重要指标,对不同浓度的三种ILs处理下玉米根、茎生物量进行测定发现,随着ILs浓度的增加,其对玉米幼苗根、茎生长的抑制率也逐渐升高。分别对不同浓度下[C4mim]Cl、[C6mim]Cl和[C8mim]Cl处理6 d后玉米根、茎重抑制率做曲线,建立玉米幼苗根、茎生长与离子种类及液体浓度的关系,并用Logistic模型进行拟合(图 2),计算三种ILs分别对玉米根、茎干重抑制的EC50值。结果表明,[C4mim]Cl、[C6mim]Cl和[C8mim]Cl抑制玉米根生长的EC50分别为194、38.4、2.97 mg·L-1,抑制玉米茎生长的EC50分别为369、52.9、23.3 mg·L-1。不同烃链长度ILs对玉米根、茎生长的抑制情况表现为[C4mim]Cl < [C6mim]Cl < [C8mim]Cl,即三种ILs对玉米幼苗根、茎生长的抑制作用随着烃链长度的增加而增大,且对根的抑制作用大于茎。

|
| 图 1 三种ILs对玉米幼苗形态的影响 Figure 1 Effect of three ILs on morphology of maize seedlings |
|
| (Logistic model) 图 2 三种ILs对玉米幼苗根/茎生物量的浓度原抑制率曲线 Figure 2 Concentration-inhibition rate curves of three ILs treatment on the growth of maize seeding root/shoot |
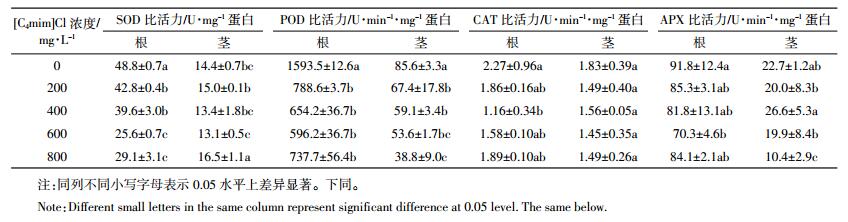
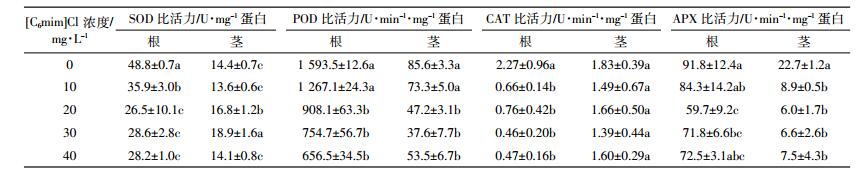
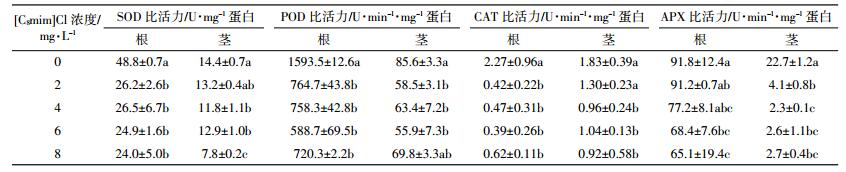
经不同浓度三种ILs处理6 d后,玉米幼苗根、茎部抗氧化酶活性均发生变化,结果如表 1至表 3所示。玉米幼苗根部SOD活性受到显著抑制,SOD活性随ILs浓度的升高而逐渐下降。[C6mim]Cl处理组茎部SOD活性表现为先激活后抑制,30 mg·L-1[C6mim]Cl处理组SOD活性比对照显著提高,随后逐渐下降,而[C8mim]Cl处理组茎部SOD活性被显著抑制。与对照相比,800 mg·L-1[C4mim]Cl处理组根部SOD活性下降40.4%;50 mg·L-1[C6mim]Cl处理组根部SOD活性下降42.2%;8 mg·L-1[C8mim]Cl处理组根、茎部SOD活性分别下降了50.8%和45.8%。
|
|
|
玉米幼苗根、茎部POD活性均受到显著抑制,表现为随ILs浓度的升高逐渐下降。与对照相比,800 mg·L-1[C4mim]Cl处理组根、茎部POD活性分别下降53.7%和54.7%;50 mg·L-1[C6mim]Cl处理组根、茎部POD活性分别下降58.8%和37.5%;8 mg·L-1 [C8mim]Cl处理组根、茎部POD活性分别下降54.8%和18.5%。
随着ILs浓度的增加,三种ILs处理下玉米幼苗根、茎部CAT和APX活性均呈逐渐下降趋势。同对照相比,800 mg·L-1 [C4mim]Cl处理组根、茎部CAT活性分别降低16.7%和18.6%;50 mg·L-1[C6mim]Cl处理组根、茎部CAT活性分别降低79.3%和12.6%;8 mg·L-1[C8mim]Cl处理组根、茎部CAT活性分别降低72.7%和49.7%;800 mg·L-1[C4mim]Cl处理组根、茎部APX活性分别降低8.4%和54.2%;50 mg·L-1 [C6mim]Cl处理组根、茎部APX活性分别降低21.0%和67.0%;8 mg·L-1 [C8mim]Cl处理组根、茎部APX活性分别降低29.1%和88.1%。
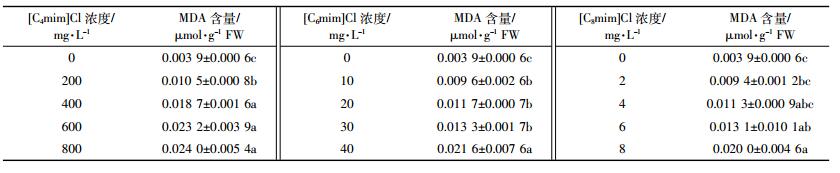
2.3 三种烃链长度ILs对玉米幼苗根、茎部MDA含量的影响三种ILs处理组对玉米幼苗根、茎部MDA含量的影响列于表 4和表 5。玉米幼苗根、茎部MDA含量均随ILs处理浓度的增加而上升。800 mg·L-1 [C4mim]Cl处理组根、茎部MDA含量为对照组的6.2倍;40 mg·L-1 [C6mim]Cl处理组根、茎部MDA含量为对照组的5.5倍;8 mg·L-1 [C8mim]Cl处理组根、茎部MDA含量为对照组的5.1倍。三种ILs处理组MDA含量均显著高于对照组。
ILs毒性与其种类及阴阳离子结构有关。在分子结构上,ILs可能是某些抗生素或除草剂的类似物,从而产生相似的毒性效应[16-18]。侧链基团是影响ILs毒性的重要因素。Bubalo等[19]通过建立定量结构-毒性关系(QSTR)模型,探讨14种带有功能侧链的咪唑类ILs对斑点叉尾鮰卵巢细胞(CCO)的毒性,发现细胞毒性主要与阳离子基团的形状和疏水性相关。Ma等[20]探讨了阴阳离子组成对海洋发光菌费氏弧菌Vibrio fischeri的定量结构-毒性关系,发现阳离子的尺寸、亲脂性及三维分子结构是影响ILs毒性的主要因素。在不同生物中的研究表明,ILs毒性随侧链取代基长度增加而增加[21-24]。究其原因,取代基链长度增加意味着更高的亲脂性,因此更容易破坏膜结构,对生物体产生不利影响[25]。本研究取得了相似的结果,三种ILs对玉米根茎生长的抑制作用表现为[C4mim]Cl < [C6mim]Cl < [C8mim]Cl,即侧链取代基链越长,毒性越高。
ILs对生长的影响并非完全不利。Chen等[26]发现[C2mim][OAc]添加可以对小麦Cd2+胁迫起到明显的缓解作用,原因是[C2mim][OAc]能够与Cd2+结合而使其钝化。Pernak等[18]发现ILs因具有与植物生长调节剂矮壮素(CCC)类似的结构而使其具有相似的生物活性。段炼等[27]研究[C4mim]Cl对藻类的毒性作用时发现,在较低浓度情况下,[C4mim]Cl在处理最开始的一段时期内对斜生栅藻的生长表现为轻微的促进作用,之后逐渐转为抑制,这暗示了ILs对生物生长的影响可能具有更复杂的生理机制。
植物在正常生理代谢过程或不良逆境胁迫下均存在活性氧(ROS)类物质的释放,包括H2O2、-OH、O2-·等,ROS通常来源于线粒体、叶绿体和过氧化物体,一般为代谢副产物[17]。植物在干旱、盐碱、冷冻、病虫害等不良逆境条件下,均可发生ROS的过量积累,引起细胞发生中毒反应,如对生物大分子的破坏及生物膜的过氧化等[25, 28]。正常情况下,植物通过抗氧化酶系统(如SOD、POD、CAT和APX等)或一些抗氧化物质(如谷胱甘肽、抗坏血酸等)清除自身代谢产生的ROS,使其维持在较低的水平[9]。逆境胁迫会对植物ROS代谢产生双重不利影响:一方面,逆境胁迫会刺激ROS的大量产生;另一方面,逆境胁迫下植物自身生理机能衰退,ROS清除能力亦受到限制[29]。
抗氧化酶系统在植物ROS清除过程中发挥着重要作用,其中SOD参与将O2-·转化为O2和H2O2[30],而POD、CAT则参与将H2O2分解为O2和H2O,APX参与将抗坏血酸作为电子供体消除H2O2的过程[4]。在本研究中,随着三种ILs处理浓度的增加,根/茎SOD、POD、CAT和APX比活力总体呈逐渐下降趋势。可见,尽管三种ILs毒性大小不同,但对玉米幼苗可能具有相同的毒性机理,即引起抗氧化酶活性降低。上述变化趋势与Bubalo等[25]在小麦中以及Liu等[9]在水稻中的研究一致。此外,[C6mim]Cl处理下茎部SOD活性随浓度增加呈现先上升后下降的规律。这可能与低浓度下ROS积累引起SOD活性的“刺激作用”有关[31],类似的趋势在其他文献中也有报道[11]。
抗氧化酶活性下降可能会引起植物体内ROS的大量积累,这些活泼ROS极易对生物膜上的重要结构——脂肪酸分子造成破坏,导致质膜过氧化,同时产生有毒的醛类物质。MDA是膜脂过氧化的最终产物,在植物中,MDA的积累通常作为反映质膜过氧化程度或植物遭受胁迫程度的重要指标。本研究中,三种ILs处理均引起玉米幼苗根、茎MDA含量显著增加,表明ILs处理引起玉米质膜过氧化,对根、茎造成伤害。质膜过氧化很可能与ROS的过量积累有关,而这也与抗氧化酶系统活性下降的结果相符。综上所述,三种咪唑类ILs对玉米幼苗的毒性机理很可能与抗氧化酶活性下降,以及膜脂过氧化有关,反映出ILs对植物的影响与干旱、高盐、冷冻或病虫害等环境胁迫具有相似的作用特点。考虑到不同ILs间特殊分子结构及其在工业生产中的重要作用,有关ILs对农业生物的综合影响还有待更详尽和深入的探讨。
4 结论(1)三种ILs([C4mim]Cl、[C6mim]Cl和[C8mim]Cl)对玉米幼苗根、茎生长具明显抑制作用,表现为侧链取代基越长,毒性越高;同一种ILs处理下对根重的抑制率大于茎重。
(2)总体而言,随浓度增加三种ILs对抗氧化酶系统(SOD、POD、CAT和APX)活性在根、茎中均表现为抑制趋势,且根、茎部MDA含量显著增加。
| [1] |
Stock F, Hoffmann J, Ranke J, et al. Effects of ionic liquids on the acetylcholinesterase:A structure-activity relationship consideration[J]. Green Chemistry, 2004, 6(6): 286-290. DOI:10.1039/B402348J |
| [2] |
Stepnowski P, Zaleska A. Comparison of different advanced oxidation processes for the degradation of room temperature ionic liquids[J]. Journal of Photochemistry and Photobiology A:Chemistry, 2005, 170(1): 45-50. DOI:10.1016/j.jphotochem.2004.07.019 |
| [3] |
Coleman D, Gathergood N. Biodegradation studies of ionic liquids[J]. Chemical Society Reviews, 2010, 39(2): 600-637. DOI:10.1039/b817717c |
| [4] |
Liu T, Zhu L S, Wang J H, et al. The genotoxic and cytotoxic effects of 1-butyl-3-methylimidazolium chloride in soil on Vicia faba seedlings[J]. Journal of Hazardous Materials, 2015, 285: 27-36. DOI:10.1016/j.jhazmat.2014.11.028 |
| [5] |
Zhao Y S, Zhao J H, Huang Y, et al. Toxicity of ionic liquids:Database and prediction via quantitative structure-activity relationship method[J]. Journal of Hazardous Materials, 2014, 278: 320-329. DOI:10.1016/j.jhazmat.2014.06.018 |
| [6] |
Hartmann D O, Pereira C S. A molecular analysis of the toxicity of alkyltributylphosphonium chlorides in Aspergillus nidulans[J]. New Journal of Chemistry, 2013, 37(5): 1569-1577. DOI:10.1039/c3nj00167a |
| [7] |
Du Z K, Zhu L S, Dong M, et al. Effects of the ionic liquid[Omim]PF6 on antioxidant enzyme systems, ROS and DNA damage in zebrafish(Danio rerio)[J]. Aquatic Toxicology, 2012, 124/125: 91-93. DOI:10.1016/j.aquatox.2012.08.002 |
| [8] |
牧辉, 彭新晶, 戴宁, 等. 离子液体[C8mim]PF6对水生生物的毒性作用[J]. 中国环境科学, 2009, 29(11): 1196-1201. MU Hui, PENG Xin-jing, DAI Ning, et al. Toxicity of[C8mim]PF6 to aquatic organisms[J]. China Environmental Science, 2009, 29(11): 1196-1201. DOI:10.3321/j.issn:1000-6923.2009.11.014 |
| [9] |
Liu H J, Zhang S X, Zhang X Q, et al. Growth inhibition and effect on photosystem by three imidazolium chloride ionic liquids in rice seedlings[J]. Journal of Hazardous Materials, 2015, 286: 440-448. DOI:10.1016/j.jhazmat.2015.01.008 |
| [10] |
常福辰, 陆长海, 沙莎. 植物生物学实验[M]. 南京: 南京师范大学出版社, 2007, 241. CHANG Fu-cheng, LU Chang-hai, SHA Sha. The plant biology experiment[M]. Nanjing: Nanjing Normal University Press, 2007, 241. |
| [11] |
Liu H J, Zhang S X, Hu X N, et al. Phytotoxicity and oxidative stress effect of 1-octyl-3-methylimidazolium chloride ionic liquid on rice seedlings[J]. Environmental Pollution, 2013, 181: 242-249. DOI:10.1016/j.envpol.2013.06.007 |
| [12] |
李忠光, 李江鸿, 杜朝昆, 等. 在单一提取系统中同时测定五种植物抗氧化酶[J]. 云南师范大学学报, 2002, 22(6): 44-48. LI Zhong-guang, LI Jiang-hong, DU Chao-kun, et al. Determination simultaneously of five plant antioxidant enzymes in a single extraction system[J]. Journal of Yunnan Normal Nniversity, 2002, 22(6): 44-48. |
| [13] |
邹琦. 植物生理学实验指导[M]. 北京: 中国农业出版社, 2003, 163-164. ZOU Qi. Guildlines of plant physiology experiments[M]. Beijing: China Agriculture Press, 2003, 163-164. |
| [14] |
Zaharieva T, Yamashita K, Matsumoto H. Iron deficiency induced changes in ascorbate content and enzyme activities related to ascorbate metabolism in cucumber roots[J]. Plant and Cell Physiology, 1999, 40(3): 273-280. DOI:10.1093/oxfordjournals.pcp.a029538 |
| [15] |
Kang H M, Saltveit M E. Effect of chilling on antioxidant enzymes and DPPH-radical scavenging activity of high-and low-vigour cucumber seedling radicles[J]. Plant Cell and Environment, 2002, 25(10): 1233-1238. DOI:10.1046/j.1365-3040.2002.00915.x |
| [16] |
Docherty K M, Kulpa Jr C F. Toxicity and antimicrobial activity of imidazolium and pyridinium ionic liquids[J]. Green Chemistry, 2005, 7(4): 185-189. DOI:10.1039/b419172b |
| [17] |
Li H Q, Yu C C, Chen R, et al. Novel ionic liquid-type Gemini surfactants:Synthesis, surface property and antimicrobial activity[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2012, 395: 116-124. |
| [18] |
Pernak J, Niemczak M, Materna K, et al. Ionic liquids as herbicides and plant growth regulators[J]. Tetrahedron, 2013, 69(23): 4665-4669. DOI:10.1016/j.tet.2013.03.097 |
| [19] |
Bubalo M C, Radosevic K, Srcek V G, et al. Cytotoxicity towards CCO cells of imidazolium ionic liquids with functionalized side chains:Preliminary QSTR modeling using regression and classification based approaches[J]. Ecotoxicology and Environmental Safety, 2015, 112: 22-28. DOI:10.1016/j.ecoenv.2014.10.029 |
| [20] |
Ma S Y, Lv M, Deng F F, et al. Predicting the ecotoxicity of ionic liquids towards Vibrio fischeri using genetic function approximation and least squares support vector machine[J]. Journal of Hazardous Materials, 2015, 283: 591-598. DOI:10.1016/j.jhazmat.2014.10.011 |
| [21] |
Jastorff B, Mölter K, Behrend P, et al. Progress in evaluation of risk potential of ionic liquids:Basis for an eco-design of sustainable products[J]. Green Chemistry, 2005, 7(5): 362-372. DOI:10.1039/b418518h |
| [22] |
Ranke J, Mölter K, Stock F, et al. Biological effects of imidazolium ionic liquids with varying chain lengths in acute Vibrio fischeri and WST-1 cell viability assays[J]. Ecotoxicology and Environmental Safety, 2004, 58(3): 396-404. DOI:10.1016/S0147-6513(03)00105-2 |
| [23] |
Studzińska S, Buszewski B. Study of toxicity of imidazolium ionic liquids to watercress(Lepidium sativum L.)[J]. Analytical and Bioanalytical Chemistry, 2009, 393(3): 983-990. DOI:10.1007/s00216-008-2523-9 |
| [24] |
Zhang B J, Li X Y, Chen D D, et al. Effects of 1-octyl-3-methylimidazolium bromide on the antioxidant system of Lemna minor[J]. Protoplasma, 2013, 250(1): 103-110. DOI:10.1007/s00709-012-0379-5 |
| [25] |
Bubalo M C, Hanousek K, Radosevic K, et al. Imidiazolium based ionic liquids:Effects of different anions and alkyl chains lengths on the barley seedlings[J]. Ecotoxicology and Environmental Safety, 2014, 101: 116-123. DOI:10.1016/j.ecoenv.2013.12.022 |
| [26] |
Chen Z L, Feng Y Y, Wang J, et al. Effects of[C2mim] [OAc](1-Ethyl-3-methyl-imidazolium acetate) on the growth of wheat seedlings under Cd2+ stress[J]. Bulletin of Environmental Contamination and Toxicology, 2014, 92(6): 714-718. DOI:10.1007/s00128-014-1267-9 |
| [27] |
段炼, 杜耀, 陆秋琳, 等. 离子液体1-丁基-3-甲基咪唑氯盐对斜生栅藻的毒性效应[J]. 中国环境科学, 2012, 32(5): 886-891. DUAN Lian, DU Yao, LU Qiu-lin, et al. Toxicity of 1-butyl-3-methylimidazolium chloride ionic liquid to Scenedesmus obliqnus[J]. China Environmental Science, 2012, 32(5): 886-891. |
| [28] |
陈忠林, 王洋, 关伟, 等. 离子液体[C2mim] [Val]对小麦幼苗生长及生理特性的影响[J]. 农业环境科学学报, 2011, 30(8): 1508-1513. CHEN Zhong-lin, WANG Yang, GUAN Wei, et al. Effects of ionic liquid[C2mim] [Val] on the growth and physiological characteristics of wheat seedlings[J]. Journal of Agro-Environment Science, 2011, 30(8): 1508-1513. |
| [29] |
Sanevas N, Sunohara Y, Matsumoto H. Characterization of reactive oxygen species-involved oxidative damage in hapalosiphon species crude extract-treated wheat and onion roots[J]. Weed Biology and Management, 2007, 7(3): 172-177. DOI:10.1111/wbm.2007.7.issue-3 |
| [30] |
Mittler R. Oxidative stress, antioxidants and stress tolerance[J]. Trends in Plant Science, 2002, 7(9): 405-410. DOI:10.1016/S1360-1385(02)02312-9 |
| [31] |
姚远, 李锋民, 李媛媛, 等. 水生植物热解生物油对中肋骨条藻抗氧化酶活性的影响[J]. 环境科学, 2013, 34(2): 589-595. YAO Yuan, LI Feng-min, LI Yuan-yuan, et al. Effects of macrophytes pyrolysis bio-oil on skeletonema costatum antioxidant enzyme activities[J]. Environmental Science, 2013, 34(2): 589-595. |
 2017, Vol. 36
2017, Vol. 36