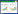文章信息
- 王盼亮, 张昊, 王瑞飞, 杨清香, 龚福利, 常芳媛
- WANG Pan-liang, ZHANG Hao, WANG Rui-fei, YANG Qing-xiang, GONG Fu-li, CHANG Fang-yuan
- 抗生素暴露对小白菜幼苗生长及内生细菌的影响
- Effects of antibiotic exposure on the growth and endophytic bacterial community of Chinese cabbage seedlings
- 农业环境科学学报, 2017, 36(9): 1734-1740
- Journal of Agro-Environment Science, 2017, 36(9): 1734-1740
- http://dx.doi.org/10.11654/jaes.2017-0042
文章历史
- 收稿日期: 2017-01-08
2. 河南师范大学环境学院, 河南 新乡 453007;
3. 资源微生物与功能分子河南省高校重点实验室培育基地(河南师范大学), 河南 新乡 453007
2. School of Environment, Henan Normal University, Xinxiang 453007, China;
3. Key Laboratory for Microorganisms and Functional Molecules(Henan Normal University), University of Henan Province, Xinxiang 453007, China
自20世纪50年代美国食品与药物管理局(FDA)首次批准抗生素可以用作饲料添加剂以来,因其能促进动物生长和增产而被广泛应用于禽畜养殖业[1]。据调查,中国每年生产超过21万t抗生素,其中48%用于禽畜养殖等农业生产[2]。然而,大多数兽药抗生素在动物体内不能被完全吸收代谢,其中30%~90%会随着动物粪尿排出而进入自然环境[3],造成农田土壤中抗生素污染日益严重[4]。国内外大量研究证实,土壤中四环素类、磺胺类、大环内酯类和喹诺酮类抗生素的残留浓度达到0.4~300 μg·kg-1,对生态环境造成了严重威胁[5-9]。
已有研究表明,在抗生素污染的土壤中,植物根系会吸收抗生素而造成药物在植株中积累[10]。吴小莲等[11]分析了珠三角地区长期施用粪肥的蔬菜基地的蔬菜中16种典型抗生素的含量,发现抗生素检出率高达100%,平均残留量为0.91 μg·kg-1。Dolliver等[12]用含有50、100 mg·L-1磺胺甲嘧啶的猪粪施肥后,玉米、莴苣及马铃薯中均检测到了磺胺甲嘧啶残留。王瑾等[13]报道了在长期施用猪粪的农田中种植韭菜后,植物根部有土霉素和金霉素检出,而未施用猪粪的对照组中则未检测出上述两种抗生素。据报道,农作物吸收和积累抗生素后首先会对植物生长造成影响。Kong等[14]研究土霉素暴露下紫花苜蓿生长时发现,幼苗芽生长和根生长的抑制率分别高达61%和85%。农作物中抗生素的污染会通过食物链的传播影响人类健康,食品中残留的抗生素被人体尤其是幼儿吸收之后,可能会引起过敏反应甚至中毒反应[15-16]。
植物内生细菌是存在于植物组织中的细菌,与植株的生长发育关系密切[17]。一方面,植物体为内生细菌提供了营养物质和适宜的生长条件。Rudrappa等[18]发现,植物组织中充分的水分和产生的一些分泌物有利于内生细菌在植物组织上的黏附,从而更好地为内生细菌的生长提供能量;另一方面,植物内生细菌能够促进植物体对环境中氮、磷和铁元素的吸收。如豆科植物根瘤菌的固氮作用就是根瘤细菌通过在宿主豆科植物的根部形成结瘤,再通过固氮作用为豆科植物提供氮素营养。同时,内生细菌还可以产生一些植物激素(如生长素、细胞分裂素和乙烯等)促进植株生长[19],如红辣椒幼苗根系中内生的蜡样芽孢杆菌(Bacillus cereus)、延长芽孢杆菌(Bacillus macroides)和短小芽孢杆菌(Bacillus pumilus)产生的赤霉素就可以对幼苗生长产生促进作用[20]。另外值得注意的是,一些致病性的内生细菌也会引起植物病害甚至导致植株的死亡。例如,能引起人类新生儿和免疫缺陷病人败血症的铜绿假单胞菌就可以定植在拟南芥中,并能够合成侵染叶片的特有毒力因子海藻糖,以帮助菌体在叶片细胞中增殖[21-22]。
目前,农作物对抗生素的吸收和积累问题以及对人类的健康威胁已经引起了人们的重视,但鲜有抗生素暴露对蔬菜内生细菌耐药性影响的报道。本研究选择日常生活中常见蔬菜小白菜为研究对象,模拟了水培环境下不同剂量四环素、环丙沙星暴露对种子萌发及苗期生长的影响,以了解环境中抗生素胁迫对蔬菜生长的毒性效应,并通过对幼苗中耐药性内生细菌数量变化的解析,探讨抗生素污染与作物内生细菌耐药性产生之间的关系,以期为畜禽粪肥应用于蔬菜种植而可能带来的生态安全和健康风险提供科学依据。
1 材料与方法 1.1 实验材料 1.1.1 蔬菜小白菜品种为上海青(Brassica chinensis L.,冬野美冠),发芽率98%,购自新乡市科达种子有限公司。
1.1.2 抗生素四环素,分子式C22H24N2O8,分析纯(≥97.0%);环丙沙星,分子式C17H18FN3O3,分析纯(≥95.0%)。均为Dr. Ehrenstorfer GmbH公司生产。
1.1.3 培养基蔬菜水培体系采用1/2浓度Hoagland营养液[23-24]。蔬菜幼苗中总可培养内生细菌的培养采用LB固体培养基[25],耐药性内生细菌培养采用含四环素、环丙沙星终浓度分别为16、4 μg·mL-1的LB固体培养基。培养基中抗生素浓度的设定参考CLSI(2013)[26]。
1.2 实验方法 1.2.1 种子萌发实验选取饱满度一致的种子,浸泡于0.1%的NaClO溶液中表面消毒10 min,然后用去离子水冲洗干净[27]。在铺有滤纸的培养皿中加入10 mL新配制的不同浓度抗生素溶液(四环素浓度分别为4、16、30、50、100 mg·L-1;环丙沙星浓度分别为1、4、10、20、50 mg·L-1),对照组中添加等体积无菌水。将表面消毒的种子均匀摆放入内,每皿20粒。每种抗生素每个浓度设置3个重复,25 ℃恒温遮光培养,待对照组种子根伸长约20 mm时停止实验。
1.2.2 水培育苗实验挑取1.2.1对照组中长势均一的种子播种于穴盘中育苗。苗龄两叶一心时,选取生长均一的幼苗移至含1/2浓度Hoagland营养液的水培箱中,每箱定植12株。同时水培箱中含有与1.2.1中一致的不同浓度抗生素溶液,对照组处理仅含有营养液,每个处理3个重复。水培箱采用打氧通气,调节营养液pH为6.0~6.4,培养环境保持白天温度(25±2)℃,夜晚温度(18±2)℃,每日光照12 h,湿度维持在65%~70%。幼苗生长15 d后收获。
1.2.3 蔬菜生长指标测定种子萌发实验结束后测量种子的根伸长和芽伸长[17]。幼苗收获后,先用去离子水将植株表面冲洗干净,再置于无菌滤纸上将表面残余水分吸干,然后测量植株的根长和株高。种子萌发的根伸长、芽伸长和幼苗的根长、株高抑制率计算公式如下[28]:
抑制率=(对照组测量值-实验组测量值)/对照组测量值×100%
1.2.4 蔬菜幼苗中内生细菌计数将各处理的蔬菜幼苗按以下步骤进行表面消毒:70%乙醇3 min,0.1%氯化汞3 min,70%乙醇1 min,灭菌蒸馏水冲洗6~7次后,用无菌滤纸吸干水分。将幼苗转入灭菌研钵中研磨成汁,经梯度稀释后涂布在LB固体培养基上。同时四环素暴露处理的样品涂布在含四环素的LB培养基上,环丙沙星暴露处理的样品涂布在含环丙沙星的LB培养基上,每个样品每个稀释度重复3次。28 ℃恒温培养72 h后,计数平板上的菌落数目,计算总可培养内生细菌数、四环素耐药内生细菌数和环丙沙星耐药内生细菌数[28]。
1.3 数据处理及分析用Excel 2016软件对实验数据进行整理并绘制图表,用SPSS V22.0软件进行单因素方差分析。
2 结果与分析 2.1 抗生素暴露对小白菜种子萌发的影响用不同浓度的四环素和环丙沙星处理小白菜种子,种子萌发过程中的根伸长和芽伸长结果以及不同浓度抗生素对种子萌发的抑制率见图 1。
|
| 不同字母表示处理组之间存在显著性差异(P < 0.05);*、**分别表示抗生素处理组与对照组间的显著性差异(P < 0.05)和极显著性差异(P < 0.01);柱状图上数字表示抗生素处理的抑制率(%)。下同 Bars with different letters are significantly different at P < 0.05; *indicates significant differences at P < 0.05 level, and ** significant differences at P < 0.01 level, respectively, as compared to the control; the numbers above standard deviation lines indicate the growth inhibition rates of different antibiotic treatments. The same below 图 1 四环素(A)、环丙沙星(B)暴露下小白菜种子萌发的根伸长、芽伸长及其抑制率 Figure 1 Root elongation, shoot elongation and their inhibition rates of Chinese cabbage seeds under the exposure of tetracycline (A)and ciprofloxacin (B) |
从图 1A可知,与对照处理相比,四环素暴露剂量为4 mg·L-1时,能促进小白菜种子的根伸长和芽伸长,且对根伸长的促进作用达到极显著水平(P < 0.01)。16 mg·L-1四环素暴露也能促进种子芽伸长,但极显著抑制了种子根伸长。随着暴露剂量增加,四环素对种子根伸长和芽伸长均表现出抑制作用,且抑制率与暴露剂量呈正相关。在最高浓度100 mg·L-1的四环素暴露下,小白菜种子根伸长的抑制率达到77.51%,芽伸长抑制率达到26.36%。图 1B显示,环丙沙星暴露时,除1 mg·L-1的暴露剂量能促进种子芽伸长外,在供试剂量下,环丙沙星对小白菜种子的萌发均表现出抑制作用,抑制率也与暴露剂量呈正相关性。高于4 mg·L-1的暴露剂量对种子的根伸长即表现出极显著的抑制作用,最高50 mg·L-1环丙沙星暴露时,对根伸长的抑制率达到76.94%,对芽伸长的抑制率达到58.53%。
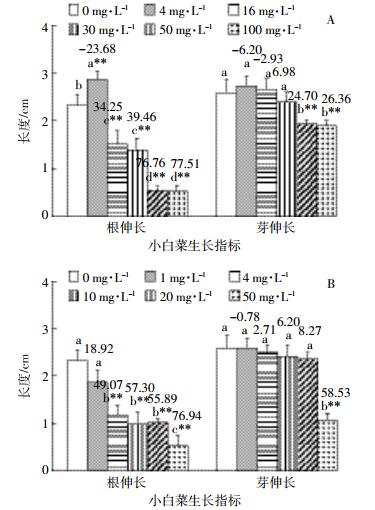
2.2 抗生素暴露对小白菜幼苗生长的影响用含有不同浓度四环素、环丙沙星的营养液分别培养小白菜幼苗,幼苗的株高、根长测量结果以及抗生素对其抑制率结果见图 2。
|
| 图 2 四环素(A)、环丙沙星(B)暴露下小白菜幼苗的根长、株高及其抑制率 Figure 2 Root length, plant height and their inhibition rates of Chinese cabbage seedlings under the exposure of tetracycline (A)and ciprofloxacin (B) |
从图 2A可以看出,与对照处理相比,供试浓度的四环素暴露对小白菜幼苗的生长均表现出极显著的抑制作用(P < 0.01),根长和株高均随着暴露剂量的增加而下降,其抑制率分别达到33.54%~65.54%和23.46%~57.26%。同样,环丙沙星暴露也抑制了小白菜幼苗的根长和株高(图 2B),抑制率随着暴露剂量的增加普遍上升,最高50 mg·L-1环丙沙星对小白菜幼苗根长和株高的抑制率分别达到51.68%和70.11%。
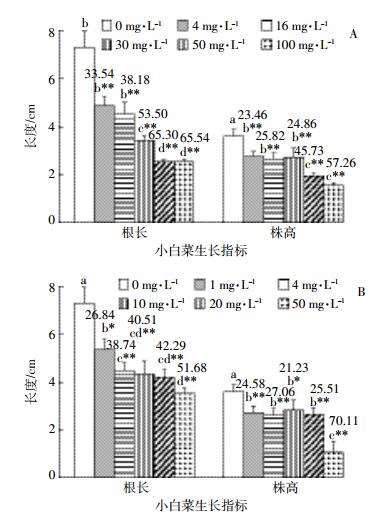
2.3 抗生素暴露对小白菜幼苗中可培养内生细菌的影响不同浓度四环素、环丙沙星暴露下,计数小白菜幼苗中总可培养内生细菌及耐药性内生细菌的数量可知:无抗生素暴露时,植株中总内生细菌数量为1.14×105 cfu·g-1;在供试四环素或环丙沙星暴露处理下,该数值分别减少到7.49×104~4.93×104 cfu·g-1和8.45×104~4.57×104 cfu·g-1。同时结果还显示,四环素暴露下的植株中四环素耐药内生细菌数量与对照处理相比均有所上升。环丙沙星暴露时,在1 mg·L-1的暴露剂量下,植株中环丙沙星耐药内生细菌数量比对照处理有所降低,但随着暴露剂量持续增加到50 mg·L-1,植株中环丙沙星耐药内生细菌数量不断上升,且均高于对照处理。进一步比较抗生素暴露下幼苗中耐药性内生细菌占总可培养内生细菌的比例(图 3)可知,除1 mg·L-1环丙沙星处理的样品之外,植株中四环素耐药内生细菌的比例从2.94%增加到13.10%(图 3A),环丙沙星耐药内生细菌的比例从10.40%增加到47.17%(图 3B),与对照处理相比均呈现极显著性增加。
|
| 图 3 四环素(A)、环丙沙星(B)暴露下小白菜幼苗中耐药性内生细菌占总可培养内生细菌的比例 Figure 3 Rates of antibiotic resistance endophytic bacteria of Chinese cabbage seedlings under the exposure of tetracycline (A)and ciprofloxacin (B) |
本研究探讨了不同剂量四环素、环丙沙星暴露对小白菜种子萌发及幼苗生长的影响。种子萌发过程中,4 mg·L-1四环素暴露促进了种子的根伸长和芽伸长,说明低剂量抗生素处理对小白菜种子萌发具有促进作用。魏子艳等[29]证实了低浓度的诺氟沙星和金霉素会促进黄瓜种子芽的伸长;Migliore等[30-32]也发现低浓度恩诺沙星对黄瓜、生菜、豆、萝卜的生长有促进作用,这是由于低剂量抗生素暴露对植物生长有积极的兴奋效应。也有研究表明,环境中的低剂量抗生素提高了植物的应激能力,植物体可以通过加强自身蛋白质合成来提高抵抗抗生素迫害的能力[33],从而表现出促生长现象。本研究同时发现,16 mg·L-1四环素或1 mg·L-1环丙沙星暴露仅能促进种子的芽伸长,对根伸长却表现出抑制作用。这可能是由于植物在较低含量的污染物胁迫下,当根已经受到毒害作用而表现出抑制时,芽的伸长还能够从种子自身吸取养分而不被抑制[23],随后,当抗生素暴露剂量继续增加时,种子的根伸长和芽伸长均被持续抑制,且对根伸长的抑制效应大于对芽伸长的抑制效应。导致这一现象的原因一方面是由于抗生素对植物的生物毒性效应[34],另一方面是因为种子萌发时通过根部直接吸收抗生素,导致根部药物积累而首先对根部生长产生胁迫,且随着污染物含量的增加,污染物被根部吸收、运输到种胚内以后,就表现为抑制芽的伸长[23]。这与魏瑞成等[35]的研究结果相似。
进一步比较四环素和环丙沙星对作物的生态毒性效应发现,在作物受害程度相同的情况下(即小白菜根伸长抑制率达到50%),需要的四环素暴露剂量明显高于环丙沙星,说明后者对作物的毒性要强于前者。已有研究证实,不同抗生素对同种蔬菜的生态毒性有很大差别。例如,魏子艳等[29]在研究金霉素、诺氟沙星和磺胺对甲氧嘧啶对黄瓜、油菜和小白菜种子根长和芽长的影响时发现,对于黄瓜,金霉素的毒性较强而诺氟沙星的毒害效应相对较弱;对于油菜,则是磺胺对甲氧嘧啶的生态毒性相对较强。由于我国农田土壤中普遍存在多种抗生素残留[36],应针对蔬菜对不同抗生素的耐受程度差异,充分考虑土壤中粪肥施用和抗生素残留情况,合理种植蔬菜,保障作物安全。
与抗生素暴露对种子萌发的影响类似,四环素、环丙沙星暴露均显著抑制了小白菜幼苗的生长。这与林琳等[34]关于四环素污染对小白菜幼苗生长发育影响的研究结果相似,说明长时间抗生素污染对植物的生长发育产生了毒性。研究发现,污染环境下,植物对抗生素的吸收会降低其对叶酸的吸收,而叶酸与脱落酸和细胞分裂素前体嘌呤的合成有关[24, 31],因此抗生素污染会影响植物体正常的生长发育。本研究发现,不论四环素还是环丙沙星,药物在某一暴露浓度下对小白菜幼苗根长的抑制率普遍高于对幼苗株高的抑制率。该现象与抗生素暴露对种子萌发的影响一致。作为植物重要的吸收和代谢器官,根系为植物的生长提供了充足的养分和水分,在抗生素污染胁迫下,药物在根部蓄积量最多,仅小部分会在根上部分积累[37],因此导致了药物对植株根生长的抑制作用更为明显。随着抗生素暴露剂量的增加,对植物根长和株高的抑制作用也逐渐增强[23]。
进一步分析抗生素暴露对小白菜幼苗中内生细菌的影响发现,两种抗生素暴露下植株中总可培养内生细菌的数量均有所下降,且降低的趋势与抗生素暴露剂量的增加相对应。由于本研究选择的供试药物四环素和环丙沙星均属于杀菌效果较好的广谱性抗生素[38-39],其在环境中的残留可以有效降低敏感细菌的数量。同时值得注意的是,除1 mg·L-1环丙沙星暴露外,本研究中随着抗生素暴露剂量的增加,植株中耐药性内生细菌的数量也随之上升,且耐药菌占总可培养内生细菌的比例均极显著高于无抗生素暴露的对照处理。据报道,环境中细菌产生耐药性的方式主要有三种:细菌本身具有耐药性;菌体发生突变或在外界环境条件诱导下产生耐药性;通过耐药基因水平转移的方式使细菌获得耐药性[40-41]。由于本研究在无抗生素暴露的对照处理中也检出了一定量的四环素和环丙沙星耐药细菌,说明植株中的耐药内生细菌是自然存在的,但其数量仍少于抗生素暴露环境中检出的耐药菌数。
分析抗生素暴露下植物耐药性内生细菌数增加的可能原因:一方面是因为水培条件下植物体更易于吸收环境中的抗生素,而植株中抗生素的积累为内生细菌的生存提供了持续的选择压力,在环境诱导和选择压力作用下,耐药性内生细菌得以优势生长,因而在总内生细菌中的比例显著增加。Schmitt等[42]在研究不同浓度磺胺氯哒嗪对土壤微生物群落的抗性诱导效应时发现,与对照相比,药物浓度升至7.3 mg·kg-1时,土壤微生物群落的抗性增长了10%。群落诱导抗性(Pollution-Induced Community Tolerance,PICT)理论[43]也认为,微生物群落为了在抗生素等污染环境中继续生存,会通过生理生化与遗传特征的改变或以抗性类群代替敏感性类群的方式,使整个群落抗性产生并不断提高。另一方面,植物内生菌的研究表明,环境中的微生物可以通过植物根系进入植株并定植在植物细胞中成为内生细菌[44]。因此,分析本研究中耐药内生细菌的另一来源可能是抗生素暴露环境中的耐药细菌,通过植物根系的吸收进入植物体内,从而导致植株中耐药内生细菌的比例显著增加。例如,针对小麦内生细菌的研究发现,土霉素耐药菌Bacillus licheniformis在小麦的根际土壤和根、茎器官中均有分布,表明该菌株在小麦内生系统中具有一定的传播性,但其在小麦种子中并未分离得到[45]。本课题组前期研究施用鸡粪(来自于使用抗生素的养殖场)对蔬菜内生细菌的影响时也发现,经常施用粪肥的菜地土壤以及芹菜、小白菜和黄瓜植株中的阿莫西林、卡那霉素、庆大霉素和头孢氨苄耐药性内生细菌的比例均明显高于不施用粪肥的对照样品[46]。但是,关于耐药细菌在环境-根际-植物系统中的迁移转化过程仍需要进一步的深入研究。
综上所述,抗生素暴露不仅会抑制蔬菜的生长发育,而且可以导致植株中耐药性内生细菌的增加。目前,在全球范围内,细菌耐药性的产生及其传播已经成为一个棘手的问题。尤其耐药性病原菌感染人的病例日益增多,甚至某些“超级细菌”的感染已经造成了“无药可医”的局面。考虑到蔬菜中的耐药性内生细菌会随着食物链传递到人体,对人类健康构成威胁,对此应当引起人们的关注。
4 结论(1)4 mg·L-1四环素暴露能促进小白菜种子萌发,高于4 mg·L-1的四环素和不同浓度环丙沙星暴露均抑制其萌发,且环丙沙星对作物的生态毒性效应强于四环素。
(2)四环素、环丙沙星暴露均显著抑制小白菜幼苗的生长,且对作物根生长的抑制作用更为明显。
(3)除1 mg·L-1环丙沙星暴露外,四环素、环丙沙星暴露均显著增加了小白菜中内生耐药细菌占总可培养内生细菌的比例,且与暴露剂量呈正相关性。
| [1] |
罗义, 周启星. 抗生素抗性基因(ARGs):一种新型环境污染物[J]. 环境科学学报, 2008, 28(8): 1499-1505. LUO Yi, ZHOU Qi-xing. Antibiotic resistance genes(ARGs) as emerging pollution[J]. Acta Scientiae Circumstantiae, 2008, 28(8): 1499-1505. |
| [2] |
Luo Y, Mao D, Rysz M, et al. Trends in antibiotic resistance genes occurrence in the Haihe River, China[J]. Environmental Science & Technology, 2010, 44(19): 7220-7225. |
| [3] |
Sarmah A K, Meyer M T, Boxall A B A. A global perspective on the use, sales, exposure pathways, occurrence, fate and effects of veterinary antibiotics(VAs) in the environment[J]. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [4] |
Zhu Y G, Johnson T A, Su J Q, et al. Diverse and abundant antibiotic resistance genes in Chinese swine farms[J]. Proceedings of the National Academy of Sciences, 2013, 110(9): 3435-3440. DOI:10.1073/pnas.1222743110 |
| [5] |
Baguer A J, Jensen J, Krogh P H, et al. Effects of the antibiotics oxytetracycline and tylosin on soil fauna[J]. Chemosphere, 2000, 40(7): 751-757. DOI:10.1016/S0045-6535(99)00449-X |
| [6] |
Hamscher G, Sczesny S, Höper H, et al. Determination of persistent tetracycline residues in soil fertilized with liquid manure by high-performance liquid chromatography with electrospray ionization tandem mass spectrometry[J]. Analytical Chemistry, 2002, 74(7): 1509-1518. DOI:10.1021/ac015588m |
| [7] |
D'ıAz-Cruz M S, Alda M J L D, Barceló D. Environmental behavior and analysis of veterinary and human drugs in soils, sediments and sludge[J]. Trac-Trends in Analytical Chemistry, 2003, 22(6): 340-351. DOI:10.1016/S0165-9936(03)00603-4 |
| [8] |
Xie Y F, Li X W, Wang J F, et al. Spatial estimation of antibiotic residues in surface soils in a typical intensive vegetable cultivation area in China[J]. Science of the Total Environment, 2012, 430(14): 126-131. |
| [9] |
Jacobsen A M, Halling-Sørensen B, Ingerslev F, et al. Simultaneous extraction of tetracycline, macrolide and sulfonamide antibiotics from agricultural soils using pressurised liquid extraction, followed by solid-phase extraction and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2004, 1038(1/2): 157-170. |
| [10] |
Kumar K, Gupta S C, Baidoo S K, et al. Antibiotic uptake by plants from soil fertilized with animal manure[J]. Journal of Environmental Quality, 2005, 34(6): 2082-2085. DOI:10.2134/jeq2005.0026 |
| [11] |
吴小莲, 向垒, 莫测辉, 等. 长期施用粪肥蔬菜基地蔬菜中典型抗生素的污染特征[J]. 环境科学, 2013, 34(6): 2442-2447. WU Xiao-lian, XIANG Lei, MO Ce-hui, et al. Concentrations of antibiotics in vegetables from manure-mended farm[J]. Environmental Science, 2013, 34(6): 2442-2447. |
| [12] |
Dolliver H, Kumar K, Gupta S. Sulfamethazine uptake by plants from manure-amended soil[J]. Journal of Environmental Quality, 2007, 36(4): 1224-1230. DOI:10.2134/jeq2006.0266 |
| [13] |
王瑾, 韩剑众. 饲料中重金属和抗生素对土壤和蔬菜的影响[J]. 生态与农村环境学报, 2008, 24(4): 90-93. WANG Jin, HAN Jian-zhong. Effects of heavy metals and antibiotics on soil and vegetables[J]. Journal of Ecology and Rural Environment, 2008, 24(4): 90-93. |
| [14] |
Kong W D, Zhu Y G, Liang Y C, et al. Uptake of oxytetracycline and its phytotoxicity to alfalfa(Medicago sativa L.)[J]. Environmental Pollution, 2007, 147(1): 187-193. DOI:10.1016/j.envpol.2006.08.016 |
| [15] |
王虹, 蒋卫杰, 余宏军, 等. 禽畜废弃物中的抗生素及其在蔬菜等农作物中的富集[J]. 中国蔬菜, 2011(12): 10-15. WANG Hong, JIANG Wei-jie, YU Hong-jun, et al. Antibiotics in livestock wastes and its enrichment in vegetable crops[J]. China Vegetables, 2011(12): 10-15. |
| [16] |
Patterson R, Deswarte R D, Greenberger P A, et al. Drug allergy and protocols for management of drug allergies[J]. Allergy Proceedings the Official Journal of Regional & State Allergy Societies, 1986, 15(5): 325-342. |
| [17] |
赵帅, 周娜, 赵振勇, 等. 基于高通量测序分析盐角草根部内生细菌多样性及动态规律[J]. 微生物学报, 2016, 56(6): 1000-1008. ZHAO Shuai, ZHOU Na, ZHAO Zhen-yong, et al. Endophytic bacterial diversity and dynamics in root of Salicornia europaea estimated via high throughput sequencing[J]. Acta Microbiologica Sinica, 2016, 56(6): 1000-1008. |
| [18] |
Rudrappa T, Biedrzycki M, Bais H. Causes and consequences of plant-associated biofilms[J]. Fems Microbiology Ecology, 2008, 64(2): 153-166. DOI:10.1111/fem.2008.64.issue-2 |
| [19] |
Santoyo G, Moreno-Hagelsieb G, del Carmen Orozco-Mosqueda M, et al. Plant growth-promoting bacterial endophytes[J]. Microbiological Research, 2016, 183: 92-99. DOI:10.1016/j.micres.2015.11.008 |
| [20] |
Joo G J, Kim Y M, Lee I J, et al. Growth promotion of red pepper plug seedlings and the production of gibberellins by Bacillus cereus, Bacillus macroides, and Bacillus pumilus[J]. Biotechnology Letters, 2004, 26(6): 487-491. DOI:10.1023/B:BILE.0000019555.87121.34 |
| [21] |
Djonović S, Urbach J M, Drenkard E, et al. Trehalose biosynthesis promotes Pseudomonas aeruginosa pathogenicity in plants[J]. PloS Pathogens, 2013, 9(3): e1003217. DOI:10.1371/journal.ppat.1003217 |
| [22] |
黄敏, 吴毅歆, 何鹏飞. 人和动物条件致病菌环境菌株侵染植物的研究进展[J]. 微生物学报, 2016, 56(2): 188-197. HUANG Min, WU Yi-xin, HE Peng-fei. Advances in humans and animals opportunistic pathogens from environment infecting plants by crossing kingdoms[J]. Acta Microbiologica Sinica, 2016, 56(2): 188-197. |
| [23] |
金彩霞, 陈秋颖, 刘军军, 等. 两种常用兽药对作物发芽的生态毒性效应[J]. 环境科学学报, 2009, 29(3): 619-625. JIN Cai-xia, CHEN Qiu-ying, LIU Jun-jun, et al. The eco-toxicological effect of two common veterinary drugs on crop germination[J]. Acta Scientiae Circumstantiae, 2009, 29(3): 619-625. |
| [24] |
Zhou Q X, Zhang Q R, Liang J D. Toxic effects of acetochlor and methamidophos on earthworm Eisenia fetida in phaiozem, Northeast China[J]. Journal of Environmental Sciences, 2006, 18(4): 741-745. |
| [25] |
陈天寿. 微生物培养基的制造与应用[M]. 北京: 中国农业出版社, 1995, 179-184. CHEN Tian-shou. Manufacture and application of microbial culture medium[M]. Beijing: China Agriculture Press, 1995, 179-184. |
| [26] |
Cockerill F R. Performance standards for antimicrobial susceptibility testing:Twenty-third informational supplement[M]. Clinical and Laboratory Standards Institute, 2013.
|
| [27] |
Pan M, Chu L M. Phytotoxicity of veterinary antibiotics to seed germination and root elongation of crops[J]. Ecotoxicology & Environmental Safety, 2016, 126: 228-237. |
| [28] |
肖明月, 安婧, 纪占华, 等. 六种常见抗生素对小白菜种子萌发及生理特性的影响[J]. 生态学杂志, 2014, 33(10): 2775-2781. XIAO Ming-yue, AN Jing, JI Zhan-hua, et al. Toxic effects of six typical antibiotics on seed germination and physiological characteristics of Chinese cabbage[J]. Chinese Journal of Ecology, 2014, 33(10): 2775-2781. |
| [29] |
魏子艳, 王金花, 夏晓明, 等. 三种抗生素对蔬菜种子芽与根伸长的生态毒性效应[J]. 农业环境科学学报, 2014, 33(2): 237-242. WEI Zi-yan, WANG Jin-hua, XIA Xiao-ming, et al. Ecotoxicity of three antibiotics to shoots and root elongation of cucumber, rape and Chinese cabbage[J]. Journal of Agro-Environment Science, 2014, 33(2): 237-242. DOI:10.11654/jaes.2014.02.005 |
| [30] |
Migliore L, Cozzolino S, Fiori M. Phytotoxicity to and uptake of enrofloxacin in crop plants[J]. Chemosphere, 2003, 52(7): 1233-1244. DOI:10.1016/S0045-6535(03)00272-8 |
| [31] |
Migliore L, Civitareale C, Cozzolino S, et al. Laboratory models to evaluate phytotoxicity of sulphadimethoxine on terrestrial plants[J]. Chemosphere, 1998, 37(14): 2957-2961. |
| [32] |
Migliore L, Cozzolino S, Fiori M. Phytotoxicity to and uptake of flumequine used in intensive aquaculture on the aquatic weed, Lythrum salicaria L.[J]. Chemosphere, 2000, 40(7): 741-750. DOI:10.1016/S0045-6535(99)00448-8 |
| [33] |
Zhou W L, Qiao X T, Xiao H, et al. Effects of antibiotics on chlorophyll-a level in marine microalga[J]. Marine Environmental Science, 2009, 28(3): 268-271. |
| [34] |
林琳, 安婧, 周启星. 土壤四环素污染对小白菜幼苗生长发育的生态毒性[J]. 环境科学, 2011, 32(8): 2430-2435. LIN lin, AN Jing, ZHOU Qi-xing. Ecotoxicological effects of tetracycline on the seedling development of Chinese white cabbage(Brassica rapa L. Chinese Group.) in soil[J]. Environmental Science, 2011, 32(8): 2430-2435. |
| [35] |
魏瑞成, 邵明诚, 陈明, 等. 金霉素和4-差向金霉素对油菜生长的影响及其在幼苗体内的积累[J]. 农业环境科学学报, 2012, 31(7): 1289-1295. WEI Rui-cheng, SHAO Ming-cheng, CHEN Ming, et al. Effects of chlortetracycline and 4-epi-chlortetracycline on the growth of rape and its accumulation in seedling[J]. Journal of Agro-Environment Science, 2012, 31(7): 1289-1295. |
| [36] |
张兰河, 王佳佳, 哈雪姣, 等. 北京地区菜田土壤抗生素抗性基因的分布特征[J]. 环境科学, 2016, 37(11): 4395-4401. ZHANG Lan-he, WANG Jia-jia, HA Xue-jiao, et al. Distribution characteristics of antibiotic resistance genes in vegetable soils in Beijing[J]. Environmental Science, 2016, 37(11): 4395-4401. |
| [37] |
Herklotz P A, Gurung P, Vanden H B, et al. Uptake of human pharmaceuticals by plants grown under hydroponic conditions[J]. Chemosphere, 2010, 78(11): 1416-1421. DOI:10.1016/j.chemosphere.2009.12.048 |
| [38] |
Lee H B, Peart T E, Svoboda M L. Determination of ofloxacin, norfloxacin, and ciprofloxacin in sewage by selective solid-phase extraction, liquid chromatography with fluorescence detection, and liquid chromatography-tandem mass spectrometry[J]. Journal of Chromatography A, 2007, 1139(1): 45-52. DOI:10.1016/j.chroma.2006.11.068 |
| [39] |
田哲, 张昱, 杨敏. 四环素类药物酶修饰基因-tet(X)的起源、分布及在环境中的作用[J]. 环境化学, 2014, 33(12): 2027-2037. TIAN Zhe, ZHANG Yu, YANG Min. The origin, environmental distribution and potential application of tetracycline resistance gene-tet(X)[J]. Environmental Chemistry, 2014, 33(12): 2027-2037. DOI:10.7524/j.issn.0254-6108.2014.12.003 |
| [40] |
Blair J M, Al E. Molecular mechanisms of antibiotic resistance[J]. Nature Reviews Microbiology, 2015, 13(1): 42-51. |
| [41] |
Yang Q X, Zhang H, Guo Y H, et al. Influence of chicken manure fertilization on antibiotic-resistant bacteria in soil and the endophytic bacteria of pakchoi[J]. International Journal of Environmental Research & Public Health, 2016, 13(7): 662. |
| [42] |
Schmitt H, Haapakangas H, Pvan B. Effects of antibiotics on soil microorganisms:time and nutrients influence pollution-induced community tolerance[J]. Soil Biology & Biochemistry, 2005, 37(10): 1882-1892. |
| [43] |
张昊, 张利兰, 王佳, 等. 土霉素暴露对小麦根际抗生素抗性细菌及土壤酶活性的影响[J]. 生态学报, 2012, 32(2): 508-516. ZHANG Hao, ZHANG Li-lan, WANG Jia, et al. Influence of oxytetracycline exposure on antibiotic resistant bacteria and enzyme activities in wheat rhizosphere soil[J]. Acta Ecologica Sinica, 2012, 32(2): 508-516. |
| [44] |
Gyaneshwar P, James E K, Mathan N, et al. Endophytic colonization of rice by a diazotrophic strain of serratia marcescens[J]. Journal of Bacteriology, 2001, 183(8): 2634-2645. DOI:10.1128/JB.183.8.2634-2645.2001 |
| [45] |
杨清香, 王育水, 张晶, 等. 小麦土霉素抗性内生细菌分离、鉴定及分布[J]. 生态学报, 2009, 29(8): 4580-4587. YANG Qing-xiang, WANG Yu-shui, ZHANG Jing, et al. Isolation and distribution of oxytetracycline-resistant entophytic bacteria in plant of wheat[J]. Acta Ecologica Sinica, 2009, 29(8): 4580-4587. |
| [46] |
Yang Q X, Ren S W, Niu T Q, et al. Distribution of antibiotic-resistant bacteria in chicken manure and manure-fertilized vegetables[J]. Environmental Science and Pollution Research, 2014, 21(2): 1231-1241. DOI:10.1007/s11356-013-1994-1 |
 2017, Vol. 36
2017, Vol. 36