文章信息
- 黄亚萍, 俎丽红, 沈广爽, 高张莹, 周美利, 石福臣
- HUANG Ya-ping, ZU Li-hong, SHEN Guang-shuang, GAO Zhang-ying, ZHOU Mei-li, SHI Fu-chen
- 铅胁迫对蜀葵重金属积累及抗氧化酶活性的影响
- Effects of lead stress on accumulation ability and antioxidant enzyme activities of Althaea rosea Cavan.
- 农业环境科学学报, 2017, 36(9): 1746-1752
- Journal of Agro-Environment Science, 2017, 36(9): 1746-1752
- http://dx.doi.org/10.11654/jaes.2017-0328
文章历史
- 收稿日期: 2017-03-10
近年来,随着城镇化和工业化的发展,土壤污染问题已经引起了人们极大的关注[1-2]。污水灌溉、过量施用农药和化肥等,导致农田污染日益严重[3]。在众多污染物中,重金属尤为突出,仅过去五十年,全球Pb排放量已达到7.83×104 t,大部分进入了土壤[4]。我国耕地土壤位点超标率已达19.4%,其中Pb污染占到1.5%(全国土壤污染状况调查公报)。许多近郊农田都受到不同程度的Pb污染,黄浦江中上游地区Pb含量超过土壤背景值的45%[5]。Pb作为植物体非必需元素,能导致农作物生长受阻、产量下降,过量累积还会引发植物内环境的紊乱,导致膜质过氧化损伤[6]。
应用植物修复技术进行重金属污染的土壤修复,具有广泛适用性和廉价性[7]。目前对超积累植物的研究较多,国内外共发现700余种、分布在50个科[8]。所谓的超积累植物是指能吸收一种或多种重金属、积累能力比一般植物高100~1000倍、且无毒害症状出现的植物[9-10]。迄今发现的Pb积累植物中,多数生物量较小、生长季受限,在实践中有一定的局限性[11],因此寻找生物量大、适应性强、耐重金属且生态幅更广的植物具有现实意义。
蜀葵(A. rosea),锦葵科(Malvaceae)蜀葵属(Althaea Linn.),一年生或多年生直立草本,高达2 m,花朵艳丽,具有生物量大、根系发达和适应能力强的特点。蜀葵在我国分布范围极广,南至海南、北至内蒙古,东至黑龙江、西至新疆(《中国植物志》第49(2)卷11页)。蜀葵种皮厚且粗糙,对重金属具有一定的抵抗能力,幼苗对Pb、Cd具有一定的耐性和积累性[12-13]。本研究针对华北地区的土壤特点和在广泛考察各种适生植物的基础上,选择以蜀葵为材料,通过研究不同浓度Pb处理对蜀葵生长及叶片抗氧化酶活性的影响,探究蜀葵对重金属的耐受性,并为土壤Pb污染的生态修复提供理论依据。
1 材料与方法本实验用蜀葵种子采集于天津市内花卉种植区。
1.1 材料培养实验于2016年6—10月进行,地点在南开大学校内实验地(北纬39°06′41.66″、东经117°10′33.91″)。实验地顶部用透光板搭建,四周围有铁丝网,室内保持正常通风和透光。选择健康饱满的种子播于营养土内(草炭土:蛭石=3:1),浇水保持湿润。待种子萌发后选择生长一致的幼苗进行移栽,塑料盆(口径18 cm,高16 cm)内盛放洗净的砂子2.8 kg,每盆种植一株,每周浇200 mL Hoagland营养液,适时补充水分。生长20 d后用Pb(NO3)2处理,设置五个Pb浓度梯度:0、50、100、200、500 mg·kg-1。每个处理六次重复,每个重复种植两盆。
1.2 取样Pb处理70 d后收获植株。收获时用蒸馏水清洗,并将根部置于20 mmol·L-1 EDTA-Na2中浸泡15 min,去除吸附在根表面的Pb。然后分别用蒸馏水和去离子水清洗3次。清洗后的植物置于烘箱,105 ℃杀青30 min,80 ℃烘干至恒重。
1.3 测定方法 1.3.1 Pb积累量测定烘干后的植物粉碎研磨过60目筛。称取0.4 g植物样品,用HNO3-HCl(V/V,1:9)消解[14]后加热至无黄烟产生,冷却后置于25 mL容量瓶,超纯水多次洗涤定容。上清液过0.45 μm滤膜,用原子吸收分光光度计(SP-3520 AA,上海光谱)测定Pb含量。根据测定结果计算富集系数、转运系数和耐性指数,用于判断植物对Pb的吸附和转运能力[15],公式如下:
富集系数(Bioconcentration coefficient,BCF)=植株体积累的Pb浓度/土壤中Pb浓度
转运系数(Translocation coefficient,TF)=(植物地上部Pb浓度/植物地下部Pb浓度)×100%
耐性指数(Tolerance index,TI)=处理组植物鲜重/对照组植物鲜重
1.3.2 SPAD值测定SPAD-502(Soil and Plant Analyzer Development)是一种快速、方便、非破坏性的测定叶片相对叶绿素含量的仪器[16],SPAD值能够较好地反映叶绿素含量的变化[17-18]。从Pb处理第10 d开始,每个处理选取3个植株,每个植株选取3个叶片,每片叶选取不同部位测定3次。每10 d测量1次,共6次。
1.3.3 丙二醛(MDA)含量和电解质外渗率(EL)测定丙二醛的测定采用硫代巴比妥酸法[19]。电解质外渗率的测定采用Singh等[20]的方法,计算公式为:
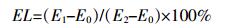
式中:E1为初始电导率;E2为沸水浴后电导率;E0为去离子水的电导率。
1.3.4 过氧化氢(H2O2)和超氧阴离子(O2-·)含量测定H2O2含量的测定参照Choudhury等[21]的方法;O2-·产生速率参照王爱国等[22]的方法。
1.3.5 抗氧化酶活性测定Pb处理70 d后测定抗氧化酶活性。超氧化物歧化酶(SOD)活性采用氮蓝四唑(NBT)光还原法、过氧化物酶(POD)活性采用愈创木酚法、过氧化氢酶(CAT)活性采用过氧化氢分解法[19]、抗坏血酸过氧化物酶(APX)的活性采用Nakano等[23]的方法。
1.4 数据分析数据以平均数±标准误来表示,采用Microsoft Excel 2013软件对数据进行处理,用SPSS 19.0进行单因素方差分析(One-way ANOVA),最小显著差异法(LSD)在α=0.05水平进行差异显著性检验。
2 结果与分析 2.1 Pb处理对蜀葵生物量及Pb积累量的影响从表 1可以看出,蜀葵地上生物量在Pb浓度为50 mg·kg-1时,比对照增加了4.13%(P<0.05);Pb浓度为100 mg·kg-1时,与对照间无显著差异;当Pb处理浓度达到200 mg·kg-1时,显著低于对照(P<0.05)。蜀葵地下生物量随着Pb浓度的升高而显著降低,各处理间与对照均存在显著差异(P<0.05)。Pb浓度在500 mg·kg-1时地下生物量最小,为对照组的80.33%。

|
Pb处理浓度较低时,Pb主要积累在蜀葵根部,随着处理浓度的增加,植株Pb的积累逐渐向地上部转移。在Pb处理50 mg·kg-1时转移系数为13.74%;500 mg·kg-1时转移系数达到75.88%。实验发现,蜀葵的富集系数、耐性指数随Pb浓度的升高而降低,最高浓度Pb(500 mg·kg-1)比最低浓度(50 mg·kg-1)的富集系数降低了0.27,耐性指数降低了0.21。
2.2 Pb处理对蜀葵SPAD值变化的影响图 1为Pb胁迫处理后蜀葵叶片相对叶绿素含量(用SPAD值表示)随时间的变化情况。蜀葵叶片SPAD值随Pb处理时间的增加呈现先升后降的趋势,并在Pb处理第30 d达到最大值。此时,对照组SPAD值比第10 d提高了1.14倍,Pb浓度50、100、200、500 mg·kg-1的SPAD值分别提高了1.09倍、1.06倍、1.03倍和1.01倍。进一步可以看出,Pb浓度与蜀葵叶片SPAD值成反比。在第30 d时,各处理下SPAD值分别比对照降低了6.11%、11.26%、14.30%和15.95%。

|
| 图例中数字分别表示Pb浓度0、50、100、200、500 mg·kg-1 Datas in the figure above represent different Pb concentrations of 0, 50, 100, 200 and 500 mg·kg-1 图 1 不同浓度Pb处理下蜀葵叶片SPAD值随时间的变化 Figure 1 The change of SPAD of A. rosea in different Pb concentrations |
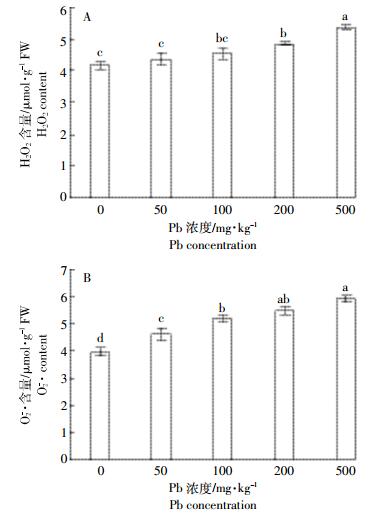
图 2A表示了不同Pb浓度处理下蜀葵叶片中H2O2含量的变化。蜀葵叶片中H2O2含量随Pb处理浓度升高而增加。在Pb浓度最高时(500 mg·kg-1)与其他各处理间存在显著差异(P<0.05),此时H2O2含量是对照的1.29倍。当Pb浓度为200 mg·kg-1时,H2O2含量与对照间存在显著性差异(P<0.05);Pb浓度为100 mg·kg-1和50 mg·kg-1时差异不显著。
|
| 图 2 不同Pb浓度处理下蜀葵叶片H2O2和O2-·含量的比较 Figure 2 The comparision of H2O2 content and O2-·content in different Pb concentrations of A. rosea |
不同Pb浓度处理对蜀葵叶片中O2-·含量影响显著(图 2B)。随着Pb浓度的升高,O2-·含量逐渐增加。当Pb浓度为50 mg·kg-1时,蜀葵叶片中O2-·含量比对照增加了16.15%,与各处理间存在显著差异(P<0.05)。当Pb浓度500 mg·kg-1时,O2-·含量达到最大,是对照的1.49倍,但与浓度为200 mg·kg-1的Pb处理差异不显著。同时,Pb浓度200 mg·kg-1的处理与100 mg·kg-1的处理间O2-·含量差异不显著。
2.4 Pb处理对蜀葵MDA含量和EL的影响植物受氧化胁迫时组织内MDA含量的高低反映了膜脂过氧化水平[24]。图 3A表示不同Pb浓度处理下蜀葵叶片中MDA含量的变化。随着Pb浓度的增加MDA含量逐渐提高,各处理与对照间存在显著差异(P<0.05)。Pb浓度为50、100、200、500 mg·kg-1时,MDA含量分别是对照的1.09、1.12、1.14、1.19倍。Pb浓度为50、100、200 mg·kg-1的处理间差异不显著;Pb处理浓度200、500 mg·kg-1处理间也无显著差异。

|
| 图 3 不同Pb浓度处理下蜀葵叶片MDA含量和EL的比较 Figure 3 The comparision of the content of MDA and EL in different Pb concentrations of A. rosea |
当细胞膜的完整性遭到破坏时,会导致膜内大量离子外渗使溶液的电导率增加[25]。图 3B比较了不同Pb浓度处理下蜀葵叶片电解质外渗率的变化。蜀葵叶片电解质外渗率随Pb浓度的升高而增加,且各处理与对照间存在显著性差异(P<0.05)。Pb浓度为500、200、100、50 mg·kg-1时,电解质外渗率分别比对照高出70.50%、50.08%、18.46%和11.57%。最高浓度Pb(500 mg·kg-1)与其他处理间存在显著性差异(P<0.05),Pb浓度为50 mg·kg-1和100 mg·kg-1的处理之间差异不显著。
2.5 Pb处理对蜀葵叶片抗氧化酶活性的影响过量的Pb积累会诱导活性氧(Reactive oxygen species,ROS)的积累,植物体内的抗氧化酶(SOD、POD、CAT和APX)能够有效消除过量的活性氧自由基,缓解植物中毒特征[26]。从图 4可以看出,随着Pb处理浓度的升高,蜀葵叶片内抗氧化酶活性呈先升后降趋势。当Pb处理浓度为100 mg·kg-1时,抗氧化酶活性达到最大,与对照之间存在显著差异(P<0.05),SOD、POD、CAT和APX分别比对照提高了5.60%、29.36%、22.48%和54.18%。随着Pb浓度的升高,蜀葵叶片抗氧化酶活性逐渐降低,在500 mg·kg-1时,SOD活性比对照组低8.55%,差异显著(P<0.05);而CAT、POD和APX与对照组相比无显著差异。

|
| 图 4 不同Pb浓度处理下蜀葵叶片抗氧化酶活性的比较 Figure 4 The activity of antioxidant enzymes in different Pb concentrations of A. rosea |
实验表明,当环境Pb浓度较低时,Pb对蜀葵地上生物量有促进作用。当浓度为50 mg·kg-1时,地上生物量是对照的1.09倍,而地下生物量略有下降,为对照的91.13%;当Pb浓度达到100 mg·kg-1时,地上生物量与对照无显著差异,地下生物量为对照的87.10%。随着Pb处理浓度的升高,蜀葵转移系数增大,富集系数和耐性指数降低,地上和地下部Pb积累量增加,Pb在植物体内的分布特征为地下>地上。这说明,Pb胁迫对蜀葵的生长产生了抑制作用,且吸收的Pb主要积累在根部,与田菁(Sesbania drummondii)、槐树(Sophora japonica)和侧柏(Platycladus orientalis)的重金属Cd、Pb胁迫实验结果一致[27-28]。植物体面对胁迫时会表现出相应的适应机制,Hall和Tauqeer等指出,植物体通过限制有毒重金属离子向地上器官的转移、将吸收的重金属离子大部分积累在根部,从而保护叶组织、特别是代谢活性光合细胞免受重金属损伤[29-30],其地上部生物量的增加可能与低浓度的Pb增加淀粉酶、蛋白酶和脂肪酶的活性有关[31]。
细胞膜是植物体物质交换的主要结构,Pb浓度的增加导致蜀葵叶片膜脂过氧化水平加剧、细胞膜完整性受到一定破坏。本研究中,Pb浓度50 mg·kg-1处理下,蜀葵叶片H2O2含量变化不显著;随着Pb浓度的增加,蜀葵叶片中H2O2和O2-·含量积累、MDA和EL增加。通过Cd、Pb、Hg、Ni胁迫大麦幼苗、Pb胁迫臭荠(Coronopus didymus)和棱轴土人参(Talinum triangulare)以及Cd胁迫番茄(Solanum lycopersicum)得到的实验结果[32-34]与此一致。低浓度Pb胁迫环境下,植物体可能启动了抗氧化酶保护机制和增加了渗透调节物质,而随着Pb浓度的增加,抗氧化酶活性受到抑制,过高的ROS水平导致细胞膜不饱和脂肪酸发生氧化,形成的MDA能交联脂类、核酸、糖类及蛋白质,进一步破坏了膜结构并导致细胞内电解质的外渗[35]。因此,MDA含量反映了膜脂过氧化程度,电解质外渗率是膜损伤的直接证据。
蜀葵叶片抗氧化酶(SOD、POD、CAT和APX)活性与Pb浓度之间呈现先升高后降低的趋势。抗氧化酶在植物ROS解毒中起着重要作用,SOD能将O2-·歧化为H2O2,POD将H2O2分解成H2O[36],CAT存在于过氧化物酶体,而叶绿体中H2O2的分解主要依赖于APX[27]。当Pb浓度较低(小于100 mg·kg-1)时,蜀葵启动了叶片抗氧化酶保护系统,SOD、POD、CAT和APX活性随Pb浓度的升高而增加,使得低浓度下蜀葵叶片中H2O2和O2-·的积累量变化不明显、MDA和EL增加不显著;而随着Pb浓度的增加(大于100 mg·kg-1),SOD、POD、CAT和APX活性下降。这与Kaur对小麦(Triticum aestivum)[37]、Israr对田菁(Sesbania drummondii)[38]、Hasan对番茄(Solanum lycopersicum)[34]、钟珍梅对圆叶决明(Chamaecrista rotundifolia)[39]和Gupta对东南景天(Sedum alfredii)[40]的研究结果相同。低浓度Pb处理下蜀葵叶片中抗氧化酶活性的增加可能是植物体对重金属胁迫的主要防御机制[30],随着Pb浓度的增加抗氧化酶活性降低,可能与叶片中H2O2、O2-·含量的增加[41]、酶催化位点或蛋白质结构的改变及合成金属酶的必需离子如锌、铁、锰等的吸收发生紊乱有关[42]。同时ROS的大量积累导致细胞膜结构损伤、代谢失调,植物体内稳态平衡遭到破坏。当Pb浓度增加到500 mg·kg-1时,SOD活性降低至对照的91.45%,而POD、CAT和APX的活性与对照差异不显著。这说明,蜀葵能够通过调节自身抗氧化酶系统对Pb胁迫环境进行防御,因此还需要进一步研究Pb胁迫对蜀葵的长期影响,并对蜀葵的耐受机制进行深入研究。
4 结论(1)Pb胁迫下,蜀葵叶片叶绿素含量降低、膜脂过氧化加剧、细胞完整性遭到破坏,但这种胁迫诱导了抗氧化酶系统形成。在Pb浓度为100 mg·kg-1时SOD、POD、CAT和APX的活性达到最大,并显著高于对照。抗氧化酶系统的防御在一定程度上缓解了的植物的受害症状。
(2)蜀葵对于重金属Pb胁迫有较强的耐受性,根系对Pb较敏感。低浓度Pb处理(50 mg·kg-1)增加了蜀葵地上生物量,随着Pb浓度的增加,蜀葵转移系数增大、富集系数和耐性指数降低。这说明蜀葵能够适应一定浓度的Pb环境,可以作为一种集园林花卉和Pb污染土壤修复为一体的较有前途的植物材料。
| [1] |
Zhang C, Shan B, Tang W, et al. Heavy metal concentrations and speciation in riverine sediments and the risks posed in three urban belts in the Haihe basin[J]. Ecotoxicology and Environmental Safety, 2017, 139: 263-271. DOI:10.1016/j.ecoenv.2017.01.047 |
| [2] |
Islam M S, Ahmed M K, Raknuzzaman M, et al. Heavy metal pollution in surface water and sediment:A preliminary assessment of an urban river in a developing country[J]. Ecological Indicators, 2015, 48: 282-291. DOI:10.1016/j.ecolind.2014.08.016 |
| [3] |
樊霆, 叶文玲, 陈海燕, 等. 农田土壤重金属污染状况及修复技术研究[J]. 生态环境学报, 2013, 22(10): 1727-1736. FAN Ting, YE Wen-ling, CHEN Hai-yan, et al. Review on contamination and remediation technology of heavy metal in agricultural soil[J]. Ecology and Environmental Sciences, 2013, 22(10): 1727-1736. DOI:10.3969/j.issn.1674-5906.2013.10.015 |
| [4] |
Duruibe J O, Ogwuegbu M O C, Egwurugwu J N. Heavy metal pollution and human biotoxic effects[J]. International Journal of Physical Sciences, 2007, 2(5): 112-118. |
| [5] |
谢小进, 康建成, 闫国东, 等. 黄浦江中上游地区农用土壤重金属含量特征分析[J]. 中国环境科学, 2010, 30(8): 1110-1117. XIE Xiao-jin, KANG Jian-cheng, YAN Guo-dong, et al. Heavy metal concentration in agricultural soil around the upper-middle reaches of Huangpu River[J]. China Environmental Science, 2010, 30(8): 1110-1117. |
| [6] |
Ahamed M, Siddiqui M K J. Low level lead exposure and oxidative stress:Current opinions[J]. Clinica Chimica Acta, 2007, 383(1): 57-64. |
| [7] |
McIntyre T. Phytoremediation of heavy metals from soils[M]//Phytoremediation. Springer Berlin Heidelberg, 2003:97-123.
|
| [8] |
Rascio N, Navari-Izzo F. Heavy metal hyperaccumulating plants:How and why do they do it? And what makes them so interesting?[J]. Plant Science, 2011, 180(2): 169-181. DOI:10.1016/j.plantsci.2010.08.016 |
| [9] |
Baker A J M, Mcgrath S P, Reeves R D, et al. Metal hyperaccumulator plants[M]//Phytoremediation of Contaminated Soil and Water. CRC Press, 1999.
|
| [10] |
Chaney R L. Plant uptake of inorganic waste constituents[J]. Land Treatment of Hazardous Wastes, 1983, 50-76. |
| [11] |
Shen Z G, Li X D, Wang C C, et al. Lead phytoextraction from contaminated soil with high-biomass plant species[J]. Journal of Environmental Quality, 2002, 31(6): 1893-1900. DOI:10.2134/jeq2002.1893 |
| [12] |
白瑞琴, 樊明寿, 孙振元. 蜀葵、二月蓝对镉的吸收与积累[J]. 中国观赏园艺研究进展, 2012, 498-502. BAI Rui-qin, FAN Ming-shou, SUN Zhen-yuan. The absorption and accumulation of cadmium in the Alther rosea and Orychophragmus violace[J]. Advances in Ornamental Horticulture of China, 2012, 498-502. |
| [13] |
刘家女, 周启星, 孙挺. Cd-Pb复合污染条件下3种花卉植物的生长反应及超积累特性研究[J]. 环境科学学报, 2006, 26(12): 2039-2044. LIU Jia-nü, ZHOU Qi-xing, SUN-Ting. Growing responses and hyperaccumulating characteristics of three ornamental plants to Cd-Pb combined pollution[J]. Acta Scientiae Circumstantiae, 2006, 26(12): 2039-2044. DOI:10.3321/j.issn:0253-2468.2006.12.017 |
| [14] |
Kingston H M. Microwave assisted acid digestion of siliceous and organically-based matrices, Method 3052[R]. US Environmental Protection Agency IAG DWI-393254-01-0, Quarterly Report, 1988.
|
| [15] |
Liu Z, He X, Chen W, et al. Accumulation and tolerance characteristics of cadmium in a potential hyperaccumulator:Lonicera japonica Thunb[J]. Journal of Hazardous Materials, 2009, 169(1): 170-175. |
| [16] |
Netto A T, Campostrini E, de Oliveira J G, et al. Photosynthetic pigments, nitrogen, chlorophyll a fluorescence and SPAD-502 readings in coffee leaves[J]. Scientia Horticulturae, 2005, 104(2): 199-209. DOI:10.1016/j.scienta.2004.08.013 |
| [17] |
姜丽芬, 石福臣, 王化田, 等. 叶绿素计SPAD-502在林业上应用[J]. 生态学杂志, 2005, 24(12): 1543-1548. JIANG Li-fen, SHI Fu-chen, WANG Hua-tian, et al. Application tryout of chlorophyll meter SPAD-502 in forestry[J]. Chinese Journal of Ecology, 2005, 24(12): 1543-1548. DOI:10.3321/j.issn:1000-4890.2005.12.034 |
| [18] |
Asai H, Samson B K, Stephan H M, et al. Biochar amendment techniques for upland rice production in Northern Laos:1. Soil physical properties, leaf SPAD and grain yield[J]. Field Crops Research, 2009, 111(1): 81-84. |
| [19] |
张志良, 瞿伟菁. 植物生理学实验指导[M]. 北京: 高等教育出版社. ZHANG Zhi-liang, ZHAI Wei-jing. The experimental guidance plant physiology[M]. Beijing: Higher Education Press. |
| [20] |
Singh H P, Batish D R, Kohli R K, et al. Arsenic-induced root growth inhibition in mung bean(Phaseolus aureus Roxb.) is due to oxidative stress resulting from enhanced lipid peroxidation[J]. Plant Growth Regulation, 2007, 53(1): 65-73. DOI:10.1007/s10725-007-9205-z |
| [21] |
Choudhury S, Panda S K. Induction of oxidative stress and ultrastructural changes in moss Taxithelium nepalense(Schwaegr.) Broth. under lead and arsenic phytotoxicity[J]. Current Science, 2004, 87: 342-347. |
| [22] |
王爱国, 罗广华. 植物的超氧物自由基与羟胺反应的定量关系[J]. 植物生理学通讯, 1990, 26(6): 55-57. WANG Ai-guo, LUO Guang-hua. Quantitative relation between the reaction of hydroxylamine and superoxide anion radicals in plants[J]. Plant Physiology Communication, 1990, 26(6): 55-57. |
| [23] |
Nakano Y, Asada K. Hydrogen peroxide is scavenged by ascorbate-specific peroxidase in spinach chloroplasts[J]. Plant and Cell Physiology, 1981, 22(5): 867-880. |
| [24] |
Sidhu G P S, Singh H P, Batish D R, et al. Tolerance and hyperaccumulation of cadmium by a wild, unpalatable herb Coronopus didymus(L.) Sm.(Brassicaceae)[J]. Ecotoxicology and Environmental Safety, 2017, 135: 209-215. DOI:10.1016/j.ecoenv.2016.10.001 |
| [25] |
Sidhu G P S, Singh H P, Batish D R, et al. Effect of lead on oxidative status, antioxidative response and metal accumulation in Coronopus didymus[J]. Plant Physiology and Biochemistry, 2016, 105: 290-296. DOI:10.1016/j.plaphy.2016.05.019 |
| [26] |
Chen M, Zhang L L, Li J, et al. Bioaccumulation and tolerance characteristics of a submerged plant(Ceratophyllum demersum L.) exposed to toxic metal lead[J]. Ecotoxicology and Environmental Safety, 2015, 122: 313-321. DOI:10.1016/j.ecoenv.2015.08.007 |
| [27] |
Ruley A T, Sharma N C, Sahi S V. Antioxidant defense in a lead accumulating plant, Sesbania drummondii[J]. Plant Physiology and Biochemistry, 2004, 42(11): 899-906. DOI:10.1016/j.plaphy.2004.12.001 |
| [28] |
Zhou F, Wang J, Yang N. Growth responses, antioxidant enzyme activities and lead accumulation of Sophora japonica and Platycladus orientalis seedlings under Pb and water stress[J]. Plant Growth Regulation, 2015, 75(1): 383-389. DOI:10.1007/s10725-014-9927-7 |
| [29] |
Hall J L. Cellular mechanisms for heavy metal detoxification and tolerance[J]. Journal of Experimental Botany, 2002, 53(366): 1-11. |
| [30] |
Tauqeer H M, Ali S, Rizwan M, et al. Phytoremediation of heavy metals by Alternanthera bettzickiana:Growth and physiological response[J]. Ecotoxicology and Environmental Safety, 2016, 126: 138-146. DOI:10.1016/j.ecoenv.2015.12.031 |
| [31] |
Cheng S. Effects of heavy metals on plants and resistance mechanisms[J]. Environmental Science and Pollution Research, 2003, 10(4): 256-264. DOI:10.1065/espr2002.11.141.2 |
| [32] |
张义贤, 张丽萍. 重金属对大麦幼苗膜脂过氧化及脯氨酸和可溶性糖含量的影响[J]. 农业环境科学学报, 2006, 25(4): 857-860. ZHANG Yi-xian, ZHANG Li-ping. Effects of heavy metals on membrane lipid peroxidation, proline and soluble sugar in roots of hordeum vulgare[J]. Journal of Agro-Environment Science, 2006, 25(4): 857-860. |
| [33] |
Kumar A, Prasad M N V, Sytar O. Lead toxicity, defense strategies and associated indicative biomarkers in Talinum triangulare grown hydroponically[J]. Chemosphere, 2012, 89(9): 1056-1065. DOI:10.1016/j.chemosphere.2012.05.070 |
| [34] |
Hasan M, Ahammed G J, Yin L, et al. Melatonin mitigates cadmium phytotoxicity through modulation of phytochelatins biosynthesis, vacuolar sequestration, and antioxidant potential in Solanum lycopersicum L.[J]. Frontiers in Plant Science, 2015, 6: 601. |
| [35] |
Gutteridge J M C. Free-radical damage to lipids, amino acids, carbohydrates and nucleic acids determined by thiobarbituric acid reactivity[J]. International Journal of Biochemistry, 1982, 14(7): 649-653. DOI:10.1016/0020-711X(82)90050-7 |
| [36] |
Srivastava R K, Pandey P, Rajpoot R, et al. Cadmium and lead interactive effects on oxidative stress and antioxidative responses in rice seedlings[J]. Protoplasma, 2014, 251(5): 1047-1065. DOI:10.1007/s00709-014-0614-3 |
| [37] |
Kaur G, Singh H P, Batish D R, et al. A time course assessment of changes in reactive oxygen species generation and antioxidant defense in hydroponically grown wheat in response to lead ions(Pb2+)[J]. Protoplasma, 2012, 249(4): 1091-1100. DOI:10.1007/s00709-011-0353-7 |
| [38] |
Israr M, Jewell A, Kumar D, et al. Interactive effects of lead, copper, nickel and zinc on growth, metal uptake and antioxidative metabolism of Sesbania drummondii[J]. Journal of hazardous materials, 2011, 186(2): 1520-1526. |
| [39] |
钟珍梅, 黄勤楼, 王义祥, 等. 圆叶决明(Chamaecrista rotundifolia)对重金属镉胁迫的响应及镉吸收效果研究[J]. 农业环境科学学报, 2010, 29(12): 2287-2292. ZHONG Zhen-mei, HUANG Qin-lou, WANG Yi-xiang, et al. Response to cadmium stress and cadmium uptake of Chamaecrista rotundifolia[J]. Journal of Agro-Environment Science, 2010, 29(12): 2287-2292. |
| [40] |
Gupta D K, Huang H G, Yang X E, et al. The detoxification of lead in Sedum alfredii H. is not related to phytochelatins but the glutathione[J]. Journal of Hazardous Materials, 2010, 177(1): 437-444. |
| [41] |
Islam E, Liu D, Li T, et al. Effect of Pb toxicity on leaf growth, physiology and ultrastructure in the two ecotypes of Elsholtzia argyi[J]. Journal of Hazardous Materials, 2008, 154(1): 914-926. |
| [42] |
Pourrut B, Shahid M, Dumat C, et al. Lead uptake, toxicity, and detoxification in plants[M]//Reviews of Environmental Contamination and Toxicology Volume 213. Springer New York, 2011:113-136.
|
 2017, Vol. 36
2017, Vol. 36