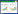文章信息
- 冯桐桐, 杨雯, 刘克思, 童菊秀, 商建英
- FENG Tong-tong, YANG Wen, LIU Ke-si, TONG Ju-xiu, SHANG Jian-ying
- 离子强度和腐植酸对高岭土协同磺胺二甲基嘧啶迁移的影响
- Effect of ionic strength and humic acid on the collaborative transport of kaolinite and sulfamethazine
- 农业环境科学学报, 2017, 36(9): 1804-1810
- Journal of Agro-Environment Science, 2017, 36(9): 1804-1810
- http://dx.doi.org/10.11654/jaes.2017-0273
文章历史
- 收稿日期: 2017-03-03
2. 中国地质大学(北京)水资源与环境学院, 北京 100083;
3. 中国农业大学资源与环境学院, 北京 100193;
4. 中国农业大学动物科技学院草业科学系, 北京 100193;
5. 农业部华北耕地保育重点实验室, 北京 100193
2. College of Water Resources and Environment, China University of Geosciences(Beijing), Beijing 100083, China;
3. College of Resource and Environment, China Agricultural University, Beijing 100193, China;
4. Department of Pratacultural Sciences, College of Animal Science and Technology, China Agricultural University, Beijing 100193, China;
5. Key Laboratory of Arable Land Conservation(North China), Ministry of Agriculture, Beijing 100193, China
抗生素是微生物(包括细菌、真菌、放线菌属)或高等动植物产生的具有抗病原体或其他活性的一类小分子天然有机物,在低浓度下能抑制其他微生物或生活细胞的生长。目前,它被广泛应用于畜禽养殖和水产养殖中[1],由于其使用量大、代谢率低(10%~ 40%),大量具有生物活性的抗生素可通过畜禽粪便或养殖废水直接排放进人土壤环境中,在土壤中迁移、降解、残留和富集[2]。土壤中的抗生素不仅可以改变土壤微生物种群,还可以被农作物吸收,并积累在作物中,对人类和生态健康与安全造成影响[3]。目前世界范围内,抗生素的使用量巨大,而且逐年递增[2]。随着抗生素的大量使用,细菌对抗生素的耐药性会不断增强,且细菌的耐药性基因可能会在自然界中发生转移,从而使耐药性基因进一步传播,发展成为生态层次上的耐药性,使没有接触过抗生素的个体也产生耐药性[4-5]。我国是抗生素使用大国,抗生素不合理使用情况比欧洲和美国更严重,然而我国对抗生素的环境行为和毒理研究还处于起步阶段[1, 6]。
磺胺二甲基嘧啶(SM2) 是磺胺类抗生素的一种,属于广谱性抗生素,具有抗菌谱广、疗效强等特点,故广泛应用于防治人类、禽畜及水产养殖中的各种细菌感染疾病[7]。但是磺胺类抗生素会在人体内残留、蓄积,破坏人体造血系统,造成溶血性贫血症,甚至具有潜在致癌的可能性[3]。
无机粘土矿物是土壤胶体的主要成分之一,其中高岭土作为一种主要矿物类型,在我国土壤中广泛分布[8-9]。高岭土与抗生素的相互作用很可能会影响抗生素在土壤中的归趋。高岭土胶体对SM2有很强的吸附性能,从而对SM2的环境行为产生一系列的影响[10]。高岭土胶体对SM2运移的潜在影响大致分为以下三种(1) 外生高岭土胶体随水流进人土壤,吸附土壤中的SM2发生共同迁移,从而活化土壤中被固定的SM2; (2) SM2进人土壤后,被土壤中移动性较强的高岭土胶体吸附,从而促进SM2迁移; (3) SM2进人土壤后,被土壤中固定的高岭土胶体吸附,从而抑制SM2迁移,使得SM2在土壤中积累[4, 11]。另外,Sukul等发现有机质可以促进土壤和沉积物对磺胺类抗生素的吸附[12],而腐植酸(HA)是土壤有机质的重要组成部分之一,因此本文也研究了HA对高岭土及高岭土协同SM2在高离子强度条件下迁移的影响[13-15]。本研究选用高岭土胶体和SM2作为研究对象,以石英砂柱作为多孔介质,通过室内砂柱实验,研究不同离子强度和腐殖质条件下高岭土胶体及其协同SM2的迁移,分析胶体运移过程及规律,从而为相关环境条件下胶体协同SM2在饱和含水层中的迁移研究提供理论基础[16-17]。
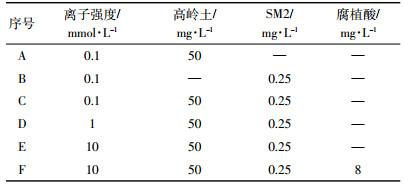
1 材料与方法 1.1 实验材料的制备在1 L超纯水中加人5 g高岭土(Sigma公司,美国),超声分散30 min,静置24 h,用虹吸法提取上清液,存放于玻璃试剂瓶中备用,溶液浓度通过重量法确定。称取0.02 g SM2(Aladdin公司,上海)溶解于20 mL乙醇(95%,北京化工厂冲,配制成浓度为1 g·L-1的储备液备用[18]。
1.2 多孔介质实验采用粒径425~600 μm的石英砂(国药集团化学试剂有限公司)作为多孔介质。为清除表面杂质,将石英砂在浓HCI中浸泡24 h,然后用超纯水反复清洗,直至上清液电导率低于1 S·cm-1,再将石英砂于105 ℃烘干,放人坩埚中600 ℃灼烧4 h,冷却至室温,保存于聚四氟乙烯塑料瓶中备用[19]。
1.3 高岭土的电化学性质实验采用纳米粒度仪(Zetasizer Nano ZS 90, 马尔文有限公司)测量高岭土和石英砂在不同背景溶液中的Zeta(ζ)电势。对于石英砂ζ电势的测定,需将其通过研钵磨碎,采用沉降法获取粒径小于2 μm的部分进行测量[20]。
1.4 迁移实验迁移实验在不镑钢柱(内径2.5 cm,高12.5 cm)中进行,土柱垂直放置,采用湿法分层填装石英砂。柱底与柱顶分别放置两片尼龙薄膜,防止石英砂堵塞进出水口,并使水流均勻地通过石英砂柱。用蠕动栗(DHL-A型,上海沪西分析仪器厂有限公司)自下而上供水,流速恒为1 mL·min-1。
在迁移实验过程中,以一定浓度的NaCl溶液作为背景溶液,具体条件如表 1所示。为了获得稳定水流条件,先持续通人5孔隙体积(PV)背景溶液(不含高岭土胶体)。然后通人3 PV加人0.25 mg·L-1SM2的高岭土胶体(浓度为50 mg·L-1),最后通人约5 PV背景溶液,直至流出液中不再含有高岭土胶体为止[16, 21]。在实验过程中,高岭土胶体采用磁力搅拌器(90-1型,上海沪西分析仪器厂有限公司)持续搅拌。流出液使用自动部分收集器(CBS-A型,上海沪西分析仪器厂有限公司)以固定时间间隔采集。高岭土胶体浓度通过紫外可见分光光度计(TU-1900型,北京普析通用仪器公司)在波长400 nm处测定(此波长条件下SM2没有任何吸收峰); SM2浓度采用双波长法测定[22],即通过测定混合溶液在200 nm处的吸光度,减去流出液中已知浓度高岭土胶体在200 nm处的吸光度,确定SM2浓度。经验证,双波长法测定SM2浓度的相对误差为3.6%。
为了计算滞留在石英砂上的高岭土,土柱实验结束后,将土柱中填装的石英砂纵向均勻剖分成12份并装人三角瓶中,加人20 mL超纯水振荡2 h。用紫外可见分光光度法测定溶液中高岭土胶体的浓度。通过计算得到滞留在多孔介质中的高岭土的纵向浓度分配,并根据质量守衡,计算流出液中和滞留在石英砂上高岭土的回收率[9, 23]。
1.5 DLVO理论为了定性地理解高岭土胶体在饱和多孔介质(石英砂)中的迁移与滞留行为,本研究采用经典DLVO理论,通过计算高岭土与石英砂之间的范德华势能与双电层势能来描述胶体与固相表面之间的相互作用。为计算双电层势能,实验测定了高岭土和石英砂在背景溶液中的ζ电势,用于计算其表面电势。计算时将高岭土假设为小球,直径采用动态光散射法(DLS)测定的平均水合粒径。因石英砂粒径比高岭土粒径大几百倍,故将石英砂表面看作平板。下式为详细的小球和平板型DLVO能量方程[24-25]:
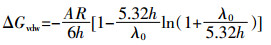 (1)
(1) 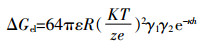 (2)
(2) 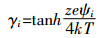 (3)
(3) 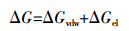 (4)
(4) 式中:△Gvdw表示范德华引力势能; A为Hamaker常数(高岭土的常数是4.84×10-20 J)[26]; R表示胶体半径; h表示球与平板之间的距离; λ0表示德拜特征长度;△Gel表示双电层排斥势能; ε表示液体的介电常数; k表示开尔文参数; T表示绝对温度; z表示离子价态; e表示电子电荷; κ表示德拜长度的逆; γi表示物体的表面电势(i=1时表示小球,i=2时表示平板)。
式(1) 为计算范德华引力势能[23],式(2) 为计算双电层排斥势能[24],式(4) 为计算DLVO势能。
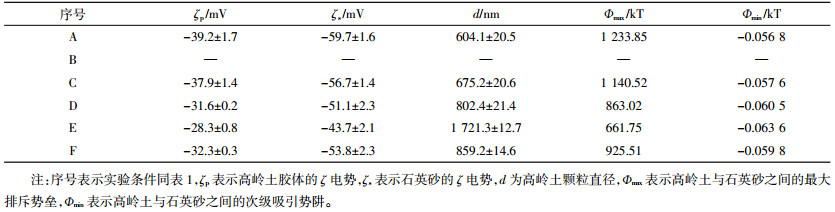
2 结果与讨论 2.1 高岭土胶体和石英砂之间的电势特征如表 2所示,在各离子强度条件下,高岭土和石英砂的ζ电势都为负值。当背景溶液离子强度从0.1 mmo·L-1增加到10 mmo·L-1时,高岭土的ζ电势从-60 mV提高到-43 mV。这是由于随着背景溶液离子强度增加,高岭土胶体的双电层被压缩导致其ζ电势的绝对值降低[39]。
|
高岭土的平均水合粒径随离子强度增加而增加,并在背景溶液为10 mmol·L-1时,出现明显的聚集现象(表 2)。这是由于随着离子强度的升高,高岭土胶体的ζ电势值降低,使得颗粒间的双电层排斥作用减弱,高岭土胶体易聚集,Birdi等也观察到同样的规律[27]。在背景溶液为10 mmol·L-1 NaCl时,加人HA后,高岭土ζ电势绝对值明显增大,颗粒间排斥作用增强,从而抑制了高岭土胶体的聚集,平均聚集粒径明显减小。Lian等研究了HA对生物炭胶体聚集的影响,也发现加人HA会抑制生物炭胶体的聚集[28]。
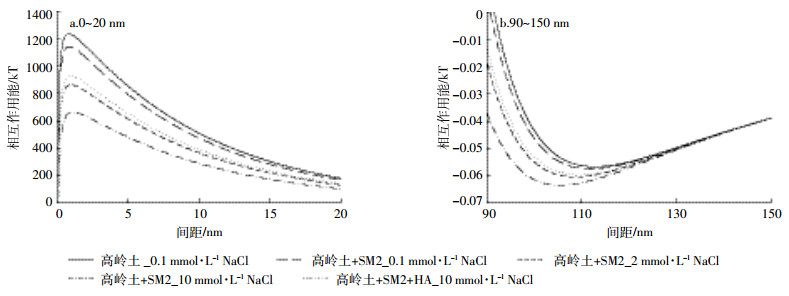
通过DLVO理论计算发现,在不同离子强度背景溶液中,高岭土胶体与石英砂间的相互作用力明显不同(图 1),图 1a显示了不同实验条件下高岭土与石英砂之间最大排斥势垒变化,图 1b显示了次级吸引势阱的变化。通过DLVO理论计算发现,随离子强度升高,高岭土与石英砂之间的最大排斥势垒与次级吸引势阱均逐渐降低,说明高岭土颗粒越容易附着在石英砂表面。而当离子强度为10 mmol·L-1时,加人HA后高岭土与石英砂的最大排斥势垒与次级吸引势阱显著增大,说明HA抑制了高岭土胶体在石英砂表面的附着,从而可以促进高岭土胶体的迁移[13]。
|
| 图 1 不同实验条件下高岭土与石英砂之间的总势能随两者之间距离的变化 Figure 1 Calculated DLVO interaction energy between kaolinite and sand plotted asa function of separation distance at different experiment conditions |
在背景溶液离子强度为0.1 mmol·L-1时,高岭土胶体的穿透曲线峰值为76%,而当胶体中加人SM2后,高岭土的穿透曲线峰值减小为70%(图 2)。这表明SM2对高岭土迁移略有抑制,但影响较小。这是由于加人SM2后,高岭土与石英砂的ζ电势的绝对值均有所降低,通过DLVO理论计算发现,高岭土与石英砂之间的最大排斥势垒从1234 kT降低到1141 kT,次级吸引势阱从-0.057 kT降低到-0.058 kT,说明加人SM2后高岭土胶体略微容易附着在石英砂表面。这与实验结果一致(表 2, 图 1)。

|
| 图 2 高岭土及协同SM2后高岭土迁移的穿透曲线 Figure 2 Breakthrough curves of kaolinite transport in the absence and presence of SM2 |
在0.1 mmol·L-1 NaCl溶液中,SM2本身的穿透量很低,穿透曲线峰值仅为5.4%,而在高岭土和SM2共同迁移的过程中,由于高岭土胶体对SM2的协同作用,SM2穿透量明显增大,穿透曲线峰值可以达到50%(图 3),说明高岭土胶体可以显著促进SM2的迁移。这是由于抗生素可以吸附在黏土矿物表面[12],而高岭土胶体在多孔介质中的移动性较强(图 2),通过高岭土胶体的协同作用,使得SM2的迁移量明显得到提升。
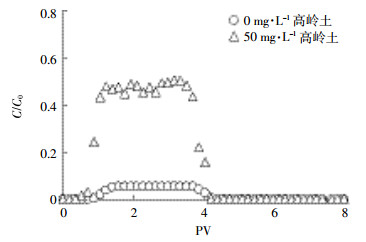
|
| 图 3 SM2及高岭土协同SM2迁移的穿透曲线 Figure 3 Breakthrough curves of SM2 and kaolinite-facilitated transport |
高岭土胶体及其协同SM2迁移过程中,高岭土胶体的迁移量随离子强度的升高而显著降低(图 4a),其穿透曲线峰值依次为70%(离子强度0.1 mmol·L-1)、27%(1 mmol·L-1)和3%(10 mmol·L-1),说明较低的离子强度有利于高岭土胶体的迁移。高岭土胶体在多孔介质中的滞留规律也受背景溶液离子强度的影响,随着离子强度的升高,高岭土胶体在多孔介质中的滞留量明显增大,且呈超指数分布(图 4b)。根据DLV0理论,当背景溶液离子强度为0.1、1 mmol·L-1和10 mmol·L-1时,高岭土胶体与石英砂之间的最大排斥势垒从1141kT分别降低到863 kT和662kT,次级吸引势阱从-0.058 kT分别降低到-0.061 kT和-0.064 kT。这说明当离子强度增大时高岭土胶体越容易在石英砂表面附着,实验结果与DLV0势能的计算结果一致(表 2,图 1)。Zhuang等也发现降低溶液离子强度能够增加胶体与石英砂之间的双电层排斥力,从而有利于胶体迁移[29],与本研究发现的规律一致。
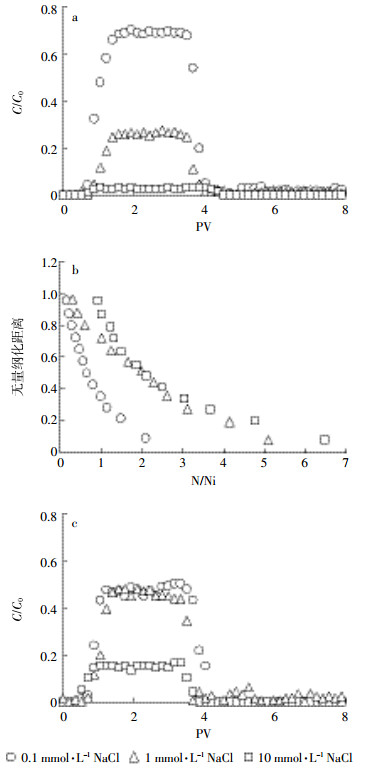
|
| 图 4 不同离子强度条件下高岭土胶体协同SM2迁移过程中高岭土胶体穿透(a)和剖分曲线(b)及SM2穿透曲线(c) Figure 4 Breakthrough curves(a)and retention profiles(b)of kaolinite and breakthrough curves(c)of facilitated SM2 under different ionic strength conditions |
协同迁移过程中SM2的穿透量也随着离子强度的增强而逐渐降低,当溶液离子强度为0.1、1 mmol·L-1和10 mmol·L-1时,穿透曲线的峰值分别为50%、48%与17%(图 4c)。由于离子强度对高岭土胶体吸附SM2影响较小,SM2迁移受离子强度影响较大表明协同其迁移的高岭土胶体穿透量明显受离子强度影响,故SM2在不同离子强度条件下的迁移规律与高岭土胶体类似。
2.5 HA对高岭土胶体协同SM2迁移的影响当10 mmol·L-1 NaCl溶液中加人8 mg·L-1的HA后,高岭土胶体的穿透曲线峰值从3%显著升高至57%(图 5a),且加人HA后高岭土胶体在石英砂中的滞留量有所降低(图 5b),说明HA明显促进了高岭土胶体的迁移。在离子强度为10 mmol·L-1时,加人HA后高岭土胶体的ζ电势从-28 mV降到-32 mV,说明加人HA增大了高岭土胶体与石英砂之间的双电层排斥力,使得加人HA后高岭土胶体与石英砂的最大排斥势垒从662 kT显著增加到926 kT,次级吸引势阱从-0.064 kT增至-0.060 kT(表 2),因此有利于高岭土胶体的迁移。另外由表 1所示,加人HA前后高岭土胶体的粒径发生了明显变化,从之前的1620 nm减小到963 nm,说明加人HA可以有效促进高岭土胶体的分散,使其更容易从多孔介质的孔隙中通过而促进迁移。Cheng等也发现有机物的存在可以通过增强双电层排斥力和空间位阻而促进高岭土胶体的迁移[15]。
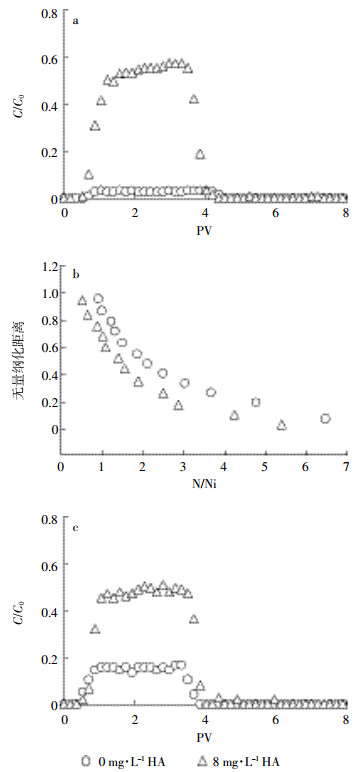
|
| 图 5 不同HA浓度条件下高岭土胶体协同SM2迁移过程中高岭土胶体的穿透(a)和剖分曲线(b)及SM2的穿透曲线(c) Figure 5 Breakthrough curves(a)and retention profiles(b)of kaolinite and breakthrough curves(c)of facilitated SM2 under different HA concentrations |
在加人HA后,SM2的穿透曲线峰值从17%增长至50%(图 5c)。这是由于HA显著促进了高岭土胶体的迁移(图 5a),故高岭土胶体协同SM2的迁移也明显得到促进。除此之外,Kahle等发现有机质可以通过与土壤和沉积物形成有机无机复合胶体促进对磺胺类抗生素的吸附[30],因此加人HA后,可以通过提高高岭土胶体对SM2的吸附能力,从而促进高岭土胶体协同SM2的迁移。
3 结论(1) 当背景盐溶液离子强度较低(0.1 mmol·L-1)时,SM2本身在多孔介质中迁移量很低。当背景溶液存在高岭土胶体时,高岭土胶体在多孔介质中的迁移量较高,高岭土胶体可以显著促进SM2的迁移,SM2会略微抑制高岭土胶体迁移,但整体上影响很小。
(2) 背景盐溶液离子强度显著影响高岭土胶体的迁移,从而影响高岭土胶体协同的SM2在多孔介质中的迁移。当背景盐溶液离子强度从0.1 mmol·L-1增强到10 mmol·L-1时,高岭土胶体及其协同的SM2穿透量均明显降低。
(3) 当背景盐溶液离子强度较高(10 mmol·L-1)时,腐植酸明显促进了高岭土胶体及其协同的SM2在多孔介质中的迁移。
| [1] |
章强, 辛琦, 朱静敏. 中国主要水域抗生素污染现状及其生态环境效应研究进展[J]. 环境化学, 2014, 33(7): 1075-1083. ZHANG Qiang, XIN Qi, ZHU Jing-min. The antibiotic contaminations in the main water bodies in China and the associated environmental and human health impacts[J]. Environmental Chemistry, 2014, 33(7): 1075-1083. DOI:10.7524/j.issn.0254-6108.2014.07.001 |
| [2] |
高立红, 史亚利, 厉文辉, 等. 抗生素环境行为及其环境效应研究进展[J]. 环境化学, 2013, 32(09): 1619-1631. GAO Li-hong, SHI Ya-li, LI Wen-hui, et al. Advances in environmental behavior and environmental effects of antibiotics[J]. Environmental Chemistry, 2013, 32(9): 1619-1631. DOI:10.7524/j.issn.0254-6108.2013.09.004 |
| [3] |
段丽丽. 磺胺二甲嘧啶及其主要代谢产物在砂质壤土中转归的研究[D]. 北京: 中国农业大学, 2005. DUAN Li-li. Study on the fate of sulfadimidine and its main metabolites in sandy loam[D]. Beijing:China Agricultural University, 2005. |
| [4] |
Xing Y N, Chen X J, Zhuang J, et al. What happens when pharmaceuticals meet colloids[J]. Ecotoxicology, 2015, 24(10): 2100-2114. DOI:10.1007/s10646-015-1557-y |
| [5] |
张毅, 岳振峰, 郭文, 等. 动物源性食品中药物多残留分析的研究进展[J]. 食品科学, 2016, 37(1): 213-221. ZHANG Yi, YUE Zhen-feng, GUO Wen, et al. Progress in multiresidue analysis of veterinary drugs in foods of animal origin[J]. Food Science, 2016, 37(1): 213-221. DOI:10.7506/spkx1002-6630-201601038 |
| [6] |
苏仲毅. 环境水样中24种抗生素残留的同时分析方法及其应用研究[D]. 厦门: 厦门大学, 2008. SU Zhong-yi. Simultaneous analysis and application of 24 antibiotic residues in environmental water samples[D]. Xiamen:Xiamen University, 2008. |
| [7] |
常红, 胡建英, 王乐征, 等. 城市污水处理厂中磺胺类抗生素的调查研究[J]. 科学通报, 2008, 53(2): 159-164. CHANG Hong, HU Jian-ying, WANG Le-zheng, et al. Investigation on sulfonamides antibiotics in municipal wastewater treatment plant[J]. Chinese Science Bulletin, 2008, 53(2): 159-164. |
| [8] |
张从良, 王岩, 王福安. 2种黏土矿物对磺胺嘧啶的吸附[J]. 生态与农村环境学报, 2007, 23(4): 41-44. ZHANG Cong-liang, WANG Yan, WANG Fu-an. Adsorption of sulfadiazine by two clay minerals[J]. Journal of Ecology and Rural Environment, 2007, 23(4): 41-44. |
| [9] |
孙慧敏, 殷宪强, 王益权. pH对粘土矿物胶体在饱和多孔介质中运移的影响[J]. 环境科学学报, 2012, 32(2): 419-424. SUN Hui-min, YIN Xian-qiang, WANG Yi-quan. The effect of pH on the transport of clay mineral colloid in saturated porous media[J]. Acta Scientiae Circumstantiae, 2012, 32(2): 419-424. |
| [10] |
Flury, M, Qiu H X. Modeling colloid-facilitated contaminant transport in the vadose zone[J]. Vadose Zone Journal, 2008, 7(2): 682-697. DOI:10.2136/vzj2007.0066 |
| [11] |
Gao Bin, Saiers J E, Ryan J N. Deposition and mobilization of clay colloids in unsaturated porous media[J]. Water Resources Research, 2004, 40(8). |
| [12] |
Sukul, P, Lamshoft M, Zuhlke S, et al. Sorption and desorption of sulfadiazine in soil and soil-manure systems[J]. Chemosphere, 2008, 73(8): 1344-1350. DOI:10.1016/j.chemosphere.2008.06.066 |
| [13] |
Lian F, Sun B B, Chen X, et al. , Effect of humic acid(HA) on sulfonamide sorption by biochars[J]. Environmental Pollution, 2015, 204: 306-312. DOI:10.1016/j.envpol.2015.05.030 |
| [14] |
Mohan D, Sarswat A, Ok Y S, et al. Organic and inorganic contaminants removal from water with biochar, a renewable, low cost and sustainable adsorbent:A critical review[J]. Bioresource Technology, 2014, 160: 191-202. DOI:10.1016/j.biortech.2014.01.120 |
| [15] |
Cheng T, Saiers J E. Effects of dissolved organic matter on the co-transport of mineral colloids and sorptive contaminants[J]. Journal of Contaminant Hydrology, 2015, 177-178: 148-157. DOI:10.1016/j.jconhyd.2015.04.005 |
| [16] |
Yecheskel, Dror Y I, Berkowitz B. Transport of engineered nanoparticles in partially saturated sand columns[J]. Journal of Hazardous Materials, 2016, 311: 254-262. DOI:10.1016/j.jhazmat.2016.03.027 |
| [17] |
Mader, B T, Goss K U, Eisenreich S J. Sorption of nonionic, hydrophobic organic chemicals to mineral surfaces[J]. Environmental Science & Technology, 1997, 31(4): 1079-1086. |
| [18] |
姜岩, 韦新东, 孟庆玲. 腐植酸·高岭土·铜在多孔介质中的迁移及相互作用[J]. 安徽农业科学, 2016, 44(33): 63-65. JIANG Yan, WEI Xin-dong, MENG Qing-ling. Migration and interaction of humic acid, Kaolinite and copper in porous media[J]. Journal of Anhui Agricultural Sciences, 2016, 44(33): 63-65. DOI:10.3969/j.issn.0517-6611.2016.33.020 |
| [19] |
Chen C Q, L i, J, DeVries S L, et al. Transport of antibiotic resistance plasmids in porous media[J]. Vadose Zone Journal, 2015, 14(3). |
| [20] |
Cheng D, Liao P, Yuan S H. Effects of ionic strength and cationic type on humic acid facilitated transport of tetracycline in porous media[J]. Chemical Engineering Journal, 2016, 284: 389-394. DOI:10.1016/j.cej.2015.08.159 |
| [21] |
Molnar I L, Johnson W P, Gerhard J I, et al. Predicting colloid transport through saturated porous media:A critical review[J]. Water Resources Research, 2015, 51(9): 6804-6845. DOI:10.1002/2015WR017318 |
| [22] |
马仁坤, 余震虹, 鱼瑛, 等. 双波长法快速测定饮用水中的硝酸盐氮和亚硝酸盐氮[J]. 光谱实验室, 2010, 27(3): 821-824. MA Ren-kun, YU Zhen-hong, YU Ying, et al. Rapid determination of nitrate and nitrite nitrogen in drinking water by dual wavelength method[J]. Chinese Journal of Spectroscopy Laboratory, 2010, 27(3): 821-824. |
| [23] |
Lou L P, Wu B B, Wang L N, et al. , Sorption and ecotoxicity of pentachlorophenol polluted sediment amended with rice-straw derived biochar[J]. Bioresource Technology, 2011, 102(5): 4036-4041. DOI:10.1016/j.biortech.2010.12.010 |
| [24] |
Gregory J. Interaction of unequal double-layers at constant charge[J]. Journal of Colloid and Interface Science, 1975, 51(1): 44-51. DOI:10.1016/0021-9797(75)90081-8 |
| [25] |
Gregory J. Approximate expressions for retarded vanderwaals interaction[J]. Journal of Colloid and Interface Science, 1981, 83(1): 138-145. DOI:10.1016/0021-9797(81)90018-7 |
| [26] |
刘炯天, 张明青, 曾艳. 不同类型黏土对煤泥水中颗粒分散行为的影响[J]. 中国矿业大学学报, 2010, 39(1): 59-63. LIU Jiong-tian, ZHANG Ming-qing, ZENG Yan. Effects of different type clays on the dispersion of fine particles in coal slurry[J]. Journal of China University of Mining & Technology, 2010, 39(1): 59-63. |
| [27] |
Birdi K S. Handbook of surface and colloid chemistry[M]. Handbook of Environmental Chemistry, 1991.
|
| [28] |
Lian F, Sun B B, Song Z G, et al. Physicochemical properties of herb-residue biochar and its sorption to ionizable antibiotic sulfamethoxazole[J]. Chemical Engineering Journal, 2014, 248: 128-134. DOI:10.1016/j.cej.2014.03.021 |
| [29] |
Zhuang J, Goeppert N, Tu C, et al. Colloid transport with wetting fronts:Interactive effects of solution surface tension and ionic strength[J]. Water Research, 2010, 44(4): 1270-1278. DOI:10.1016/j.watres.2009.12.012 |
| [30] |
Kahle M, Stamm C. Time and pH-dependent sorption of the veterinary antimicrobial sulfathiazole to clay minerals and ferrihydrite[J]. Chmosphere, 2007, 68(7): 1224-1231. DOI:10.1016/j.chemosphere.2007.01.061 |
 2017, Vol. 36
2017, Vol. 36