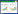文章信息
- 孟延, 李雪松, 郝平琦, 张盈科, 张永民, 周建斌
- MENG Yan, LI Xue-song, HAO Ping-qi, ZHANG Ying-ke, ZHANG Yong-min, ZHOU Jian-bin
- 施用不同种类氮肥对陕西关中地区塿土碳释放的影响
- Effect of different N fertilizer applications on CO2 emissions from Lou soil in Central Shaanxi
- 农业环境科学学报, 2017, 36(9): 1901-1907
- Journal of Agro-Environment Science, 2017, 36(9): 1901-1907
- http://dx.doi.org/10.11654/jaes.2017-0125
文章历史
- 收稿日期: 2017-01-26
2. 渭南市农业科学研究所, 陕西 渭南 714000
2. Weinan Agricultural Science Research Institute, Weinan 714000, China
人类活动已经成为当前温室效应的主要推动因素,由此带来的气候问题正日益威胁着人类的生存和发展。在诸多温室气体中,CO2浓度的增加无疑最引人关注。尽管不同温室气体对温室效应都有影响,但IPCC第五次评估报告指出,CO2仍是目前对全球气候变暖影响最大的气体[1]。除工业排放外,农业排放也是目前大气CO2浓度增加的来源之一[2],每年从农田土壤碳库向大气排放的CO2占当年人为排放总量的21%~30%[3-5],因而有关土壤碳库的固持与转化也是当前众多学者研究的热点。
土壤碳库包括有机碳库和无机碳库。就全球范围而言,干旱半干旱地区以碳酸盐的形式贮藏了大量无机碳,储量达750~950 Pg[6],这些地区无机碳库储量为有机碳库的2~5倍,约占全球无机碳库的92%[7]。我国无机碳库主要分布在西北地区,贮量在53.3~77.9 Pg[8-9]。以往多认为土壤无机碳库比较稳定,对于土壤碳的相关研究以有机碳为主。近年来许多研究表明,含有无机碳的土壤发生碳酸盐沉淀和溶解时有13%~30%的CO2释放[10-12],证明了无机碳在稳定碳库储量和调节CO2浓度方面同样具有不可忽视的作用,尤其在旱区土壤碳循环方面更为突出[13-14]。
我国氮肥的大量施用,尽管在作物增产方面发挥了显著作用,但过量施用带来的土壤、河流污染问题也日趋严重。北方由于降水少且土壤富集碳酸盐而被认为具有较强的缓冲能力,受到的影响不大。但近年来有研究表明氮肥过量引起土壤酸化已经对全球无机碳储量和组分产生影响[15]。Yang等[16]对我国1980—2000年间草原无机碳库储量进行研究后发现,土壤酸化已使无机碳以每年平均26.8 g C·m-2的速率在降低;Wu等[17]则发现,由于我国长期农业活动的影响,土壤无机碳自20世纪80年代至今已损失约1.6 Pg C,表层土壤的损失占28.8%。作为我国古老农业发源地之一的陕西关中地区已有两千多年的耕种历史,由于长期施用土粪,在原地带性土壤——褐土剖面的基础上形成了厚度达50~100 cm的覆盖层,使得塿土的特性有别于其他土壤[18-19]。而施用氮肥对于塿土无机碳释放的影响如何,尚少见报道。
干烧法是在特定温度下将土壤灼烧一定时间,通过计算干烧前后土壤质量的差值而得出有机碳含量[20],该方法也是分析石灰性土壤无机碳常用的前处理方法。因此,本试验选取塿土作为研究对象,利用室内培养法探究了施用不同氮肥后塿土干烧前后碳释放、矿质态氮及pH值的变化,旨在评价石灰性土壤碳、氮作用机理及效应。
1 材料与方法 1.1 供试土壤供试土壤采自西北农林科技大学农作一站试验地0~20 cm土层。该地位于渭河三级阶地,海拔523 m,年平均气温13 ℃,年平均降水量600~650 mm,主要集中在7—9月,年均蒸发量1400 mm,属于半湿润易旱区。土壤类型为褐土类,塿土亚类,红油土属,系统分类为土垫旱耕人为土,耕层土壤质地为粉砂粘壤土[21]。土样采回后风干除杂,过2 mm筛备用。试验前土壤基本性质为:pH 7.86,有机质11.41 g·kg-1、全氮0.86 g·kg-1、硝态氮27.65 mg·kg-1、铵态氮0.75 mg·kg-1、碳酸钙75.6 g·kg-1。
1.2 试验设计及方法 1.2.1 干烧法处理土样称取足量的过筛土壤,置于105 ℃烘箱中12 h去除水分,再均匀地将烘干土壤放入瓷坩埚中,马福炉550 ℃条件下干烧5 h至赤红色。
1.2.2 培养试验1试验设两个研究因素:氮肥种类和干烧。氮肥种类设3种:NH4NO3(含N 35%)、KNO3(含N 13.8%)、(NH4)2SO4(含N 21.2 %),施氮量均为0.3 g·kg-1。干烧处理分干烧和未干烧,共组成8个处理,每个处理重复3次。以不加氮肥土壤为对照(CK)。
对于未干烧土壤,正式培养前先调节含水量为当地田间持水量(23%)的70%左右,预培养7 d以恢复微生物活性。干烧土壤预培养时应进行微生物接种,方法如下[22]:称取5.00 g鲜土,加入25 mL 5 mmol·L-1 CaCl2溶液,振荡30 min后静置1 h,将上清液过5 μm滤膜,将滤液与土壤所要加入的水分按1:100(V/V)混合。
预培养结束后,未干烧和干烧土壤根据不同氮肥用量加入氮肥并混匀,每个处理都称取相当于20 g风干土的土壤放入小培养瓶中,同时将装有10 mL 0.1 mol·L-1 NaOH溶液的小瓶与装有土样的培养瓶一同放入0.5 L的大培养瓶中加盖密封,置于25 ℃恒温培养箱培养。分别在培养的第1、3、5、7、9、13、17、21、25、32、39、46 d测定各处理的CO2释放量。每次测定后更换NaOH溶液并用称重法补充土壤水分。
1.2.3 培养试验2与培养试验1施肥、干烧及培菌方法相同,共组成8个处理,每个处理重复3次。与试验1在相同条件下同时开始培养,每个处理称取相当于120 g风干土的土壤后加无菌透气膜封好,并在第1、5、9、21、32、46 d采集土壤样品,测定土壤硝态氮、铵态氮及pH值。定期用称重法保持水分。
1.3 分析项目及计算方法CO2释放量采用碱液吸收法测定[23]:每次向装有NaOH的小瓶加入1.5 mL 1 mol·L-1 BaCl2使吸收的CO2沉淀,再用0.1 mol·L-1 HCl滴定剩余NaOH,利用差减法计算CO2释放量。
土壤无机碳释放CO2的估算比例α(%)=干烧土壤CO2释放量/未干烧土壤CO2释放量
土壤矿质态氮的测定:每次称取土样5.00 g,用1 mol·L-1 KCl浸提,经180 r·min-1振荡1 h后过滤,连续流动分析仪测定。
土壤pH值测定:每次称取土样10.00 g,水土比2.5:1,PHS-3C精密pH计测定。
1.4 数据处理方法数据分析采用Microsoft Excel 2007,作图采用Sigmaplot 12.0,方差分析采用SAS 8.0。
2 结果与分析 2.1 干烧前后土壤主要指标含量的变化由表 1可知,干烧后土壤有机质和全氮含量极显著低于未干烧土壤(P < 0.01),无机碳和速效磷含量均无显著差异(P >0.05),无机碳含量仅降低了0.21 g·kg-1。有机质含量降低了10.49 g·kg-1,干烧率达到92%。
由图 1可以看出,无论是否干烧,加入NH4NO3与(NH4)2SO4的土壤在培养起始阶段铵态氮含量都很高,且(NH4)2SO4处理的土壤铵态氮在培养前20 d显著高于NH4NO3处理(P < 0.05),而KNO3处理与对照土壤在整个培养周期内铵态氮含量极低。这与氮肥种类有关。未干烧(图 1a)加入NH4NO3与(NH4)2SO4的土壤随培养时间的延长铵态氮迅速降低,20 d之后无明显变化。干烧后加入(NH4)2SO4的土壤铵态氮也随时间延长而降低(图 1b),但降低幅度明显小于未干烧土壤,到培养结束时铵态氮残留量为80.11 mg·kg-1,相比起始减少了67%;加入NH4NO3的土壤在整个培养时间内铵态氮无明显降低,培养结束时含量为91.39 mg·kg-1,相比起始减少了24%。
|
| 图 1 加入不同氮肥后未干烧及干烧土壤铵态氮含量 Figure 1 Soil NH4+-N amount of different N fertilizer treatments with and without dry combustion |
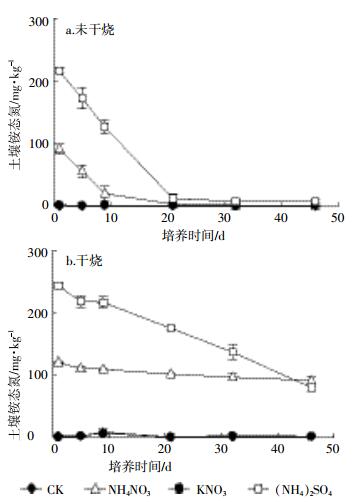
未干烧条件下加入(NH4)2SO4的土壤硝态氮含量随培养时间延长迅速增加(图 2a),到培养结束时含量达279.30 mg·kg-1,是起始值的7.17倍;加入NH4NO3的土壤培养结束时硝态氮也增加了43.5%,与未干烧条件下铵态氮肥的硝化作用有关。干烧后加入(NH4)2SO4的土壤硝态氮增加幅度明显小于未干烧土壤(图 2b),培养结束时比起始增加了92.86 mg·kg-1。相比可知,NH4NO3处理、KNO3处理及对照土壤的硝态氮含量均无明显变化,与干烧后各处理的铵态氮结果相似。
|
| 图 2 加入不同氮肥后未干烧及干烧土壤硝态氮含量 Figure 2 Soil NO3--N amount of different N fertilizer treatments with and without dry combustion |
从图 3可以看出,未干烧土壤加入不同氮肥后pH值随培养时间显著降低(图 3a),培养结束时施氮土壤的pH平均值为7.21,比对照土壤降低0.23个单位。培养第20 d起,加入NH4NO3与(NH4)2SO4的土壤pH值始终低于加入KNO3土壤,但三者之间差异均未达显著(P >0.05)。相比未干烧土壤,干烧后各土壤pH值显著升高,培养第1 d的pH平均值为9.66,比未干烧土壤高2.0个单位,之后随培养持续而迅速降低,培养结束时NH4NO3、KNO3、(NH4)2SO4及对照处理分别比起始降低了1.86、1.99、1.79、1.70个单位。虽然干烧后土壤pH值显著降低,但相比未干烧施氮土壤培养结束时的pH平均值(7.21),干烧后施氮土壤培养结束时pH平均值仍高出0.57个单位。

|
| 图 3 加入不同氮肥后未干烧及干烧土壤pH值 Figure 3 Soil pH of different N fertilizer treatments with and without dry combustion |
对于未干烧处理(图 4a),加入氮肥后土壤CO2释放量与对照相比都有了一定程度的增加,但不同氮肥增加的结果不同。加入(NH4)2SO4的土壤在培养第7 d起至结束CO2累积释放量始终显著高于加入KNO3处理及对照,培养17 d之后显著高于NH4NO3处理(P < 0.05),培养结束时(NH4)2SO4处理土壤累积释放量达711.50 mg·kg-1,分别比NH4NO3、KNO3及对照土壤高38%、71%及77%;相比对照,加入NH4NO3在25 d之后也显著增加了CO2释放量,培养结束时比对照增加28.3%;KNO3处理仅比对照增加3.7%,且在整个培养周期与对照差异不显著。
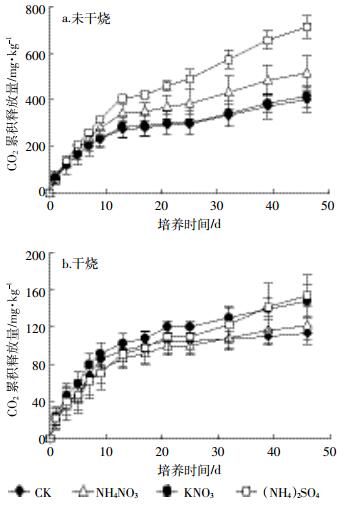
|
| 图 4 加入不同氮肥对未干烧、干烧土壤CO2累积释放量的影响 Figure 4 Soil CO2 cumulative release of different N fertilizer treatments with and without dry combustion |
干烧后土壤CO2释放量显著低于未干烧土壤(图 4b),培养结束时最高释放量为153.63 mg·kg-1,NH4NO3、KNO3、(NH4)2SO4处理及对照释放量分别比未干烧处理结束时降低了76.4%、64.5%、78.4%及71.8%。但相比干烧对照,加入氮肥也使土壤CO2释放量有了不同程度的增加。在培养前期至中期,KNO3处理的CO2释放量高于其他三者,NH4NO3处理则低于对照。培养32 d之后3种施氮土壤CO2释放量均有了一定提高,培养结束时NH4NO3、KNO3、(NH4)2SO4处理分别比对照释放量增加7.2%、30.5%及35.8%。
2.5 土壤CO2释放比例由于干烧处理去除了绝大部分土壤有机质,根据干烧和未干烧土壤的CO2释放比值可以估算出培养过程中来自无机碳的释放比例。由图 5可以看出,不同氮肥处理在整个培养期内土壤无机碳释放比例为21%~40%,比例大小总体表现为KNO3>CK>NH4NO3>(NH4)2SO4。后两种氮肥释放比例低于对照,与两者的CO2总释放量较高有关。培养结束时,不同处理土壤源于无机碳的CO2平均释放比例为27.2%。

|
| 图 5 培养结束时土壤无机碳释放估算比例 Figure 5 Approximate releasing proportion of SIC at the end of incubation |
未干烧条件下施用氮肥促进了塿土CO2的释放,经过46 d的培养施氮土壤CO2释放量比对照平均增加36.6%。这与施氮为土壤微生物提供了氮源促进有机质矿化有关[24]。Workneh等[25]也指出,无论是何种肥料,只要能够增加土壤中营养元素的含量尤其是氮元素,都会影响土壤有机碳和微生物碳含量,进而影响碳排放量。但有学者用酸性草甸土培养后发现,加入NH4NO3使有机碳矿化速率降低,认为是NH4NO3降低土壤pH值抑制了微生物活性所致[26]。这与本试验结果不同,表明了土壤类型也是影响碳排放量的因素之一。本试验不同氮肥对CO2释放增加的程度明显不同,增加幅度依次为(NH4)2SO4>NH4NO3>KNO3。有研究证明硝化作用适宜在土壤偏碱性条件下进行,且硝化速率与土壤pH正相关[27-28]。因此,当施氮量相同时,硝化细菌利用(NH4)2SO4进行氨化作用,产生的碱性环境又促进了硝化作用的发生:
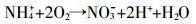 (1)
(1) 试验所用塿土属石灰性土壤,碳酸钙含量75.6 g·kg-1,含有SO42-或NO3-的氮肥都可以与土壤H+结合成酸促进碳酸钙分解[12]:
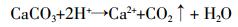 (2)
(2) 因此认为硝化作用更强的(NH4)2SO4对土壤碳释放促进作用更明显,同时(NH4)2SO4与CaCO3在土壤水分的介质下通过化学反应也会释放出CO2:
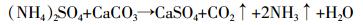 (3)
(3) 相比其他两种氮肥,加入(NH4)2SO4的土壤CO2释放量得以显著提高。这也证明了对于含有碳酸盐的石灰性土壤,加入不同形态氮肥其碳释放机理不同。
3.2 干烧对土壤性质、pH值及矿质态氮的影响以往培养试验常采用灭菌方法来抑制微生物活性,从而达到区分土壤生物与非生物过程的目的,但操作过程中如果灭菌不彻底会对试验带来影响。相比之下,干烧法由于操作简便而被广泛应用于区分土壤有机、无机碳的研究中[29-30]。虽然有人指出干烧温度和时间的不同会导致土壤无机碳、挥发性盐类和结构水的损失[31],但本试验在550 ℃条件下干烧5 h发现无机碳仅损失了0.21 g·kg-1,干烧率达92%,表明采用该方法较为彻底地去除了有机质,达到了区分土壤有机、无机碳的效果。矿质态氮结果表明,干烧后加入(NH4)2SO4的土壤在接种微生物的条件下也发生了硝化作用,但硝化程度明显低于未干烧土壤,培养结束时仍有33%的铵态氮残留,而加入NH4NO3的土壤铵态氮仅减少了24%,说明干烧后仅靠接种外源微生物氮素硝化能力有限。
土壤有机质能吸附大量的阳离子使其具有缓冲性[32],而缓冲能力是决定pH值变化速率的决定性因素[33]。研究结果表明干烧后土壤pH值显著升高,培养结束时比未干烧土壤高0.57个单位。由于干烧去除了大部分有机质导致土壤缓冲能力降低使其起始阶段pH值很高,之后随着硝化作用的进行有所降低,而干烧后微生物硝化能力有限也是导致培养结束时干烧土壤pH值仍高于未干烧土壤的原因。
3.3 碳释放来源分析本试验通过干烧法去除了有机质使来源于有机质矿化的CO2得以去除,但干烧后土壤经过46 d的培养仍有133.92 mg·kg-1的CO2释放量,且相比对照,加入氮肥的土壤释放量增加了7.2%~35.8%。这表明塿土CO2的释放不仅来自有机碳,也可来源于无机碳。氮肥的硝化作用降低了土壤pH值导致的碳酸盐的分解,与Tamir等[11]的研究结果相似。根据干烧和未干烧土壤的CO2释放比值估算,无机碳在整个培养过程中释放比例约为27.2%。关于无机碳的释放比例,国内外学者有不同的研究结果:董燕婕[31]对不同土层的土壤进行32 d的培养后测得CO2源于无机碳的比例在34%~84%,其中耕层土壤无机碳释放比例为40%;Tamir等[12]对以色列0~10 cm土层的石灰性土壤(CaCO3 63%)培养56 d后计算出有30%的CO2来自于无机碳;Stevenson等[34]对美国莫哈维沙漠的表层土壤(CaCO3 14.7%)进行14 d的培养后测得有13%的CO2来源于碳酸盐;Bertrand等[35]对5~25 cm的石灰性土壤(CaCO3 74%)培养91 d后发现有27%的CO2来源于无机碳;Inglima等[36]发现地中海气候下田间释放的CO2有15%~40%来自无机碳。不同地区的土壤性质及培养方法、时间等因素的不同导致了无机碳释放比例结果的差异,但本文及其他研究均证明了石灰性土壤培养过程中释放的CO2可以来源于无机碳,在计算中若忽略无机碳的作用则会造成对有机碳的矿化量估计过高。
本试验采用干烧法只能间接估计无机碳的释放比例,故在随后的研究中宜采用δ13C或14C标记等更为先进的方法来进一步准确区分土壤有机、无机碳的释放比例。
4 结论施用不同种类氮肥均促进了塿土CO2的释放,加入(NH4)2SO4的土壤CO2释放幅度显著高于NH4NO3和KNO3两种氮肥。一方面与施氮促进有机质矿化有关,同时也与氮肥的硝化作用降低土壤pH值促进碳酸盐分解有关。干烧后氮素硝化程度低于未干烧土壤,但施氮仍促进了土壤CO2的释放,表明无机碳也是石灰性土壤碳释放的来源。
| [1] |
张晓华, 高云, 祁悦, 等. IPCC第五次评估报告第一工作组主要结论对《联合国气候变化框架公约》进程的影响分析[J]. 气候变化研究进展, 2014, 10(1): 14-19. ZHANG Xiao-hua, GAO Yun, QI Yue, et al. Implications of the findings from the working group Ⅰ contribution to the IPCC fifth assessment report on the UNFCCC process[J]. Advances in Climate Change Research, 2014, 10(1): 14-19. |
| [2] |
王国强, 常玉妍, 宋星星, 等. 稻草还田下添加DCD对稻田NH4、N2O和CO2排放的影响[J]. 农业环境科学学报, 2016, 35(12): 2431-2439. WANG Guo-qiang, CHANG Yu-yan, SONG Xing-xing, et al. Effects of DCD addition on NH4, N2O and CO2 emissions from paddy field under rice straw incorporation[J]. Journal of Agro-Environment Science, 2016, 35(12): 2431-2439. DOI:10.11654/jaes.2016-0877 |
| [3] |
Duxbury J M. The significance of agricultural sources of greenhouse gases[J]. Fertilizer Research, 1994, 38(2): 151-163. DOI:10.1007/BF00748775 |
| [4] |
齐玉春, 郭树芳, 董云社, 等. 灌溉对农田温室效应贡献及土壤碳储量影响研究进展[J]. 中国农业科学, 2014, 47(9): 1764-1773. QI Yu-chun, GUO Shu-fang, DONG Yun-she, et al. Advances in research on the effects of irrigation on the greenhouse gases emission and soil carbon sequestration in agro-ecosystem[J]. Scientia Agricultura Sinica, 2014, 47(9): 1764-1773. |
| [5] |
徐钰, 刘兆辉, 朱国梁, 等. 不同农业管理措施对华北地区麦田温室气体排放的影响[J]. 中国土壤与肥料, 2016(2): 7-13. XU Yu, LIU Zhao-hui, ZHU Guo-liang, et al. Effects of greenhouse gas emission under different agricultural management practices in wheat field in the North China Plain[J]. Soil and Fertilizer Sciences in China, 2016(2): 7-13. DOI:10.11838/sfsc.20160202 |
| [6] |
Eswaran H, Reich P, Kimble J, et al. Global carbon stocks[M]. Global Climate Change and Pedogenic Carbonates, 2000, 15-25.
|
| [7] |
Lal R, Kimble J M, Stewart B, et al. Global climate change and pedogenic carbonates[M]. United States: CRC Press, 1999.
|
| [8] |
Mi N A, Wang S, Liu J, et al. Soil inorganic carbon storage pattern in China[J]. Global Change Biology, 2008, 14(10): 2380-2387. DOI:10.1111/gcb.2008.14.issue-10 |
| [9] |
Li Z P, Han F X, Su Y, et al. Assessment of soil organic and carbonate carbon storage in China[J]. Geoderma, 2007, 138(1): 119-126. |
| [10] |
Emmerich W E. Carbon dioxide fluxes in a semiarid environment with high carbonate soils[J]. Agricultural and Forest Meteorology, 2003, 116(1/2): 91-102. |
| [11] |
Tamir G, Shenker M, Heller H, et al. Organic N mineralization and transformations in soils treated with animal waste in relation to carbonate dissolution and precipitation[J]. Geoderma, 2013, 209/210: 50-56. DOI:10.1016/j.geoderma.2013.05.028 |
| [12] |
Tamir G, Shenker M, Heller H, et al. Can soil carbonate dissolution lead to overestimation of soil respiration?[J]. Soil Science Society of America Journal, 2011, 75(4): 1414-1422. DOI:10.2136/sssaj2010.0396 |
| [13] |
王玉红, 马天娥, 魏艳春, 等. 黄土高原半干旱草地封育后土壤碳氮矿化特征[J]. 生态学报, 2017, 37(2): 378-386. WANG Yu-hong, MA Tian-e, WEI Yan-chun, et al. Influence of grazing exclusion on soil organic carbon and nitrogen mineralization in semiarid grasslands of the Loess Plateau[J]. Acta Ecologica Sinica, 2017, 37(2): 378-386. |
| [14] |
郭洋, 李香兰, 王秀君, 等. 干旱半干旱区农田土壤碳垂直剖面分布特征研究[J]. 土壤学报, 2016, 53(6): 1433-1443. GUO Yang, LI Xiang-lan, WANG Xiu-jun, et al. Profile distribution of soil inorganic and organic carbon in farmland in arid and semi-arid areas of China[J]. Acta Pedologica Sinica, 2016, 53(6): 1433-1443. DOI:10.11766/trxb201603140654 |
| [15] |
Sanderman J. Can management induced changes in the carbonate system drive soil carbon sequestration?A review with particular focus on Australia[J]. Agriculture, Ecosystems & Environment, 2012, 155: 70-77. |
| [16] |
Yang Y, Fang J, Ji C, et al. Widespread decreases in topsoil inorganic carbon stocks across China's grasslands during 1980s-2000s[J]. Global Change Biology, 2012, 18(12): 3672-3680. DOI:10.1111/gcb.12025 |
| [17] |
Wu H, Guo Z, Gao Q, et al. Distribution of soil inorganic carbon storage and its changes due to agricultural land use activity in China[J]. Agriculture, Ecosystems & Environment, 2009, 129(4): 413-421. |
| [18] |
郭兆元, 黄自立, 冯立孝, 等. 陕西土壤[M]. 北京: 科学出版社, 1992, 177-187. GUO Zhao-yuan, HUANG Zi-li, FENG Li-xiao, et al. Shaanxi soil[M]. Beijing: Science Press, 1992, 177-187. |
| [19] |
周建斌, 王春阳, 梁斌, 等. 长期耕种土壤剖面累积有机碳量的空间分布及影响因素[J]. 农业环境科学学报, 2009, 28(12): 2540-2544. ZHOU Jian-bin, WANG Chun-yang, LIANG Bin, et al. Stock and distribution of organic carbon in the profiles of soil with long cultivating history[J]. Journal of Agro-Environment Science, 2009, 28(12): 2540-2544. DOI:10.3321/j.issn:1672-2043.2009.12.016 |
| [20] |
Wang X, Smethurst P, Herbert A. Relationships between three measures of organic matter or carbon in soils of eucalypt plantations in Tasmania[J]. Soil Research, 1996, 34(4): 545-553. DOI:10.1071/SR9960545 |
| [21] |
蔡苗, 董燕婕, 李佰军, 等. 不同施氮处理玉米根茬在土壤中矿化分解特性[J]. 生态学报, 2013, 33(14): 4248-4256. CAO Miao, DONG Yan-jie, LI Bai-jun, et al. Decomposition characteristics of maize roots derived from different nitrogen fertilization fields under laboratory soil incubation conditions[J]. Acta Ecologica Sinica, 2013, 33(14): 4248-4256. |
| [22] |
Schwesig D, Kalbitz K, Matzner E. Mineralization of dissolved organic carbon in mineral soil solution of two forest soils[J]. Journal of Plant Nutrition and Soil Science, 2003, 166(5): 585-593. DOI:10.1002/(ISSN)1522-2624 |
| [23] |
柯跃进, 胡学玉, 易卿, 等. 水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响[J]. 环境科学, 2014, 35(1): 93-99. KE Yue-jin, HU Xue-yu, YI Qing, et al. Impacts of rice straw biochar on organic carbon and CO2 release in arable soil[J]. Environmental Science, 2014, 35(1): 93-99. |
| [24] |
王艳萍, 高吉喜, 冯朝阳, 等. 北京京郊果园施用不同农肥的土壤呼吸特征研究[J]. 浙江大学学报(农业与生命科学版), 2009, 35(1): 77-83. WANG Yan-ping, GAO Ji-xi, FENG Chao-yang, et al. Soil respiration characteristics of different fertilization types in peach farms in Beijing suburb[J]. Journal of Zhejiang University(Agric & Life Sci), 2009, 35(1): 77-83. |
| [25] |
Workneh F, Van Bruggen A H C. Microbial density, composition, and diversity in organically and conventionally managed rhizosphere soil in relation to suppression of corky root of tomatoes[J]. Applied Soil Ecology, 1994, 1(3): 219-230. DOI:10.1016/0929-1393(94)90013-2 |
| [26] |
李英臣, 宋长春, 侯翠翠, 等. 不同氮输入对湿地草甸沼泽土N2O排放和有机碳矿化的影响[J]. 生态学杂志, 2010, 29(11): 2091-2096. LI Ying-chen, SONG Chang-chun, HOU Cui-cui, et al. Effects of nitrogen input on meadow marsh soil N2O emission and organic carbon mineralization[J]. Chinese Journal of Ecology, 2010, 29(11): 2091-2096. |
| [27] |
刘秋丽, 马娟娟, 孙西欢, 等. 土壤的硝化-反硝化作用因素研究进展[J]. 农业工程, 2011, 1(4): 79-82. LIU Qiu-li, MA Juan-juan, SUN Xi-huan, et al. Research advancement on soil nitrification-denitrification and its influencing factors[J]. Agricultural Engineering, 2011, 1(4): 79-82. |
| [28] |
王小治, 孙伟, 王子波, 等. pH变化对中性土壤硝化过程N2O释放的影响[J]. 农业环境科学学报, 2009, 28(8): l748-l752. WANG Xiao-zhi, SUN Wei, WANG Zi-bo, et al. Effect of pH on N2O emission from nitrification in neutral soil[J]. Journal of Agro-Environment Science, 2009, 28(8): l748-l752. |
| [29] |
Santisteban J I, Mediavilla R, Lopez-Pamo E, et al. Loss on ignition:A qualitative or quantitative method for organic matter and carbonate mineral content in sediments?[J]. Journal of Paleolimnology, 2004, 32(3): 287-299. DOI:10.1023/B:JOPL.0000042999.30131.5b |
| [30] |
Dankers N, Laane R. A comparison of wet oxidation and loss on ignition of organic material in suspended matter[J]. Environmental Technology, 1983, 4(7): 283-290. DOI:10.1080/09593338309384208 |
| [31] |
董燕婕. 塿土剖面不同碳库贮量及释放特性研究[D]. 杨凌: 西北农林科技大学, 2013. DONG Yan-jie. The study of stock and stabilization of soil carbon pool in Lou soil horizon[D]. Yangling:Northwest A&F University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013347242.htm |
| [32] |
苏有健, 王烨军, 张永利, 等. 不同植茶年限茶园土壤pH缓冲容量[J]. 应用生态学报, 2014, 25(10): 2914-2918. SU You-jian, WANG Ye-jun, ZHANG Yong-li, et al. Soil pH buffer capacity of tea garden with different planting years[J]. Chinese Journal of Applied Ecology, 2014, 25(10): 2914-2918. |
| [33] |
胡波, 王云琦, 王玉杰, 等. 模拟氮沉降对土壤酸化及土壤酸缓冲能力的影响[J]. 环境科学研究, 2015, 28(3): 418-424. HU Bo, WANG Yun-qi, WANG Yu-jie, et al. Effects of simulated nitrogen deposition on soil acidification and soil buffering capacity[J]. Research of Environmental Sciences, 2015, 28(3): 418-424. |
| [34] |
Stevenson B, Verburg P. Effluxed CO2-13C from sterilized and unsterilized treatments of a calcareous soil[J]. Soil Biology and Biochemistry, 2006, 38(7): 1727-1733. DOI:10.1016/j.soilbio.2005.11.028 |
| [35] |
Bertrand I, Delfosse O, Mary B. Carbon and nitrogen mineralization in acidic, limed and calcareous agricultural soils:Apparent and actual effects[J]. Soil Biology and Biochemistry, 2007, 39(1): 276-288. DOI:10.1016/j.soilbio.2006.07.016 |
| [36] |
Inglima I, Alberti G, Bertolini T, et al. Precipitation pulses enhance respiration of Mediterranean ecosystems:The balance between organic and inorganic components of increased soil CO2 efflux[J]. Global Change Biology, 2009, 15(5): 1289-1301. DOI:10.1111/gcb.2009.15.issue-5 |
 2017, Vol. 36
2017, Vol. 36