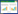文章信息
- 李娟, 田保华, 刘旦梅, 裴雁曦
- LI Juan, TIAN Bao-hua, LIU Dan-mei, PEI Yan-xi
- 硫化氢调节谷子幼苗P-ATPase响应镉胁迫
- Hydrogen sulfide regulates cadmium stress resistance through P-ATPases in foxtail millet seedlings
- 农业环境科学学报, 2018, 37(1): 52-57
- Journal of Agro-Environment Science, 2018, 37(1): 52-57
- http://dx.doi.org/10.11654/jaes.2017-0908
文章历史
- 收稿日期: 2017-06-27
- 录用日期: 2017-08-10
2. 太原理工大学, 太原 030024
2. Taiyuan University of Technology, Taiyuan 030024, China
硫化氢(Hydrogen sulfide,H2S),一直以来被认为是一种有毒气体,并且具有臭鸡蛋气味。然而在气体信号分子一氧化氮(NO)和一氧化碳(CO)之后,H2S也成为了气体信号分子的一员[1],虽然其研究起步较晚,但发展迅速[2]。起初,H2S被证明在动物体内有多种生理功能。近年来,已经有许多研究报道证明植物内源H2S也有多种生理生化功能,如在种子的萌发[3]、根形态的建成、植物的光合作用和细胞程序性死亡等生理过程中都发现有H2S的参与[3-5];此外H2S在对植物抗逆性方面也扮演着重要的角色,如抵抗干旱胁迫[6]、温度胁迫、重金属胁迫[7-8]等。总之,植物整个生长、发育、成熟和衰老的过程都有H2S的参与。
三磷酸腺苷(Adenosine triphosphate,ATP)是生物细胞中的一种活性物质,三磷酸腺苷酶(Adenosine triphosphatase,ATPase)在ATP分解释放出能量过程中扮演着重要的角色。ATPase主要包括F型、P型、V型和ABC型四类[9]。主要定位于植物细胞的叶绿体内膜和线粒体内膜,还有少部分存在于微生物中,其活性受环境以及各种因素的影响。ATP是生命活动的主要物质,ATPase在植物细胞的生长、气孔开闭、跨膜运输以及抵御非生物胁迫等方面有重要作用[10]。
P型ATPases作为ATPase家族中的一个成员,在植物响应重金属胁迫方面有着重要的作用。它们可以通过氨基酸序列中的天冬氨酸残基的磷酸化循环使一些阳离子进行跨膜运输。P型ATPase主要包括P1A-ATPase和P1B-ATPase,HMA是P1B-ATPase亚家族中一员,亚家族根据其金属特征可分为Zn2+/Cd2+/Pb2+/Co2+组和Cu+/Ag+组。对于Cd胁迫产生毒害作用的关键步骤是根部吸收并向地上部分运输,因此削弱Cd向上运输,从而阻止Cd进入木质部和韧皮部是一个研究热点[10-11, 13],但是,不同物种的HMA家族对Cd胁迫的响应存在差异。
目前,对于Cd胁迫处理下ATPase和H2S的关系,以及H2S与具有金属转运蛋白活性的P1B-ATPase亚家族中HMA的关系尚无相关研究报道,本研究以谷子幼苗为材料,研究H2S在植物响应重金属Cd的过程中,H2S与ATPase及HMA之间的关系。
1 材料与方法 1.1 实验材料晋谷21号由山西农科院谷子所提供。
1.2 培养条件选用萌发后生长5 d的幼苗作为实验材料。种子消毒处理:将种子放于相应的离心管,75%的乙醇洗1 min,弃掉乙醇后用浓度为6%的次氯酸钠洗10 min,最后用无菌水清洗3次。然后将消毒后的种子播种于培养皿中,23 ℃黑暗浸泡24 h。并且每天换10 mL新的1/4 Hoagland营养液,保持水分[17]。
1.3 胁迫处理在进行胁迫处理时,选取生长一致的谷子幼苗分为4组。其中3组分别用5 mmol·L-1 CdCl2(Cd)、50 μmol·L-1 NaHS(H2S)、50 μmol·L-1 NaHS与5 mmol·L-1 CdCl2(H2S+Cd)进行处理,另外1组未处理的幼苗作为对照(CK)。所有实验进行三次重复,其中H2S处理采用熏蒸法处理,将50 μmol·L-1 NaHS置于小盖子中放入培养皿中进行H2S处理。分别处理24 h后取样,然后测定ATPase的活性以及HMA基因的表达量。
1.4 生理指标测定可溶性蛋白含量和可溶性糖含量测定参照李合生[18]的方法。
1.5 ATPase酶活性的测定剪取1 g谷子幼苗,加入2倍(体积:质量)体积预冷的研磨缓冲液(50 mmol·L-1 Tris-MES,250 mmol·L-1甘露醇,1.5% PVP,0.5% BSA,1 mmol·L-1 DTT,pH 7.0),在冰上研磨,然后在4 ℃冷冻离心机下5000 r·min-1离心3 min,取上清测定ATPase的活性[19]。
H+-ATPase、Ca2+-ATPase、Mg2+-ATPase活性的测定:反应体系为1 mL,Ca2+-ATPase和Mg2+-ATPase的反应体系中包括Tris-Mes 50 mmol·L-1(pH 6.5)、ATP-Na2 3.0 mmol·L-1、(NH4)2MoO4 1.0 mmol·L-1、NaN3 1.0、NaNO3 50 mmol·L-1、EDTA-Na2 0.1 mmol·L-1;H+-ATPase的反应体系除Ca2+-ATPase、Mg2+-ATPase体系中所包含的试剂,还包括CaCl2 3.0 mmol·L-1、MgCl2 5.0 mmol·L-1。以上三种酶反应均由50 μL的60 mmol·L-1 ATP-Na2进行启动,水浴37 ℃下反应30 min,最后终止反应进而测定无机磷的含量。
1.6 谷子幼苗HMA家族蛋白进化分析谷子幼苗HMA家族蛋白进化分析,用NCBI网站中BlastP(http://blast.ncbi.nlm.nih.gov/)查找与HMA蛋白同源性高的序列,然后用ClustalW(http://www.ebi.ac.uk/clustalw/)对所找的同源序列进行排序并分析,用MEGA 5.0软件的最大简约法(MP)构建系统进化树,校验参数为BootStrap,重复1000次。
1.7 RNA提取和Real-time PCR分别取各处理组的谷子幼苗,用RNAiso Plus试剂进行RNA的提取,用反转录试剂盒反转录,具体操作方法按照试剂的说明书进行。以cDNA为模板,用谷子ACTIN基因作为内参,用荧光定量PCR仪进行检测,最后分析各处理组基因表达水平的变化,每个实验均重复3次。表 1为用于Real-time PCR的引物,表 2为Real-time PCR反应体系。
用Excel和SPSS 12.0软件进行数据处理与分析,然后用t检验进行显著性分析和图表的制作。
2 结果与分析 2.1 外源H2S对Cd胁迫下谷子幼苗的可溶性蛋白、可溶性糖含量的影响如图 1所示,与对照组相比,Cd处理、H2S处理以及H2S+Cd处理的可溶性蛋白含量略微降低,降幅分别为4.2%、3.1%和1.5%,三种不同处理对谷子幼苗的可溶性蛋白含量几乎没有影响;Cd处理可溶性糖的含量明显降低,而H2S+Cd处理则可以缓解Cd胁迫所引起的可溶性糖含量的降低。糖是调节渗透胁迫的小分子物质。以上实验结果表明,H2S可以通过增加谷子幼苗可溶性糖的含量进而缓解重金属Cd导致的渗透胁迫的损伤。
|
| 不同字母表示处理间差异显著(P < 0.05)。下同 Different letters indicate the significant differences among treatments(P < 0.05). The same below 图 1 H2S处理对Cd胁迫下谷子幼苗可溶性蛋白和可溶性糖含量的影响 Figure 1 Effects of H2S on soluble protein and soluble sugar contents in foxtail millet seedlings under Cd stress |
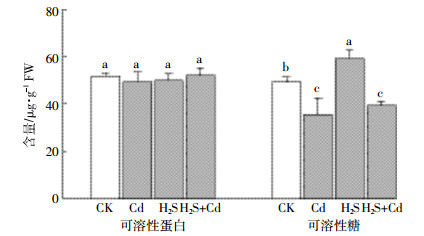
如图 2所示,与对照组比较,Cd处理的Ca2+-ATPase、Mg2+-ATPase和H+-ATPase活性显著降低;H2S处理的Mg2+-ATPase活性高于对照,而H+-ATPase和Ca2+-ATPase的活性与对照相比没有显著变化;与Cd处理组相比,H2S+Cd处理的H+-ATPase和Ca2+-ATPase的活性显著上升,Mg2+-ATPase的活性也有所升高,但并不显著。以上实验结果表明,H2S可以提高Cd胁迫下谷子ATPase活性,增加ATP等生物能量的生成,从而增强根系的主动吸收,进而缓解Cd胁迫对谷子幼苗的损伤。
|
| 图 2 H2S对Cd胁迫下谷子幼苗ATPase活性的影响 Figure 2 Effect of H2S on ATPase enzyme activity in foxtail millet seedlings under Cd stress |
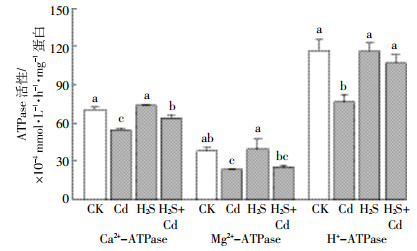
从拟南芥序列库中查找出8个HMAs的家族相关蛋白,分别命名为AtHMA1-8,接下来,通过比对的方法又从谷子数据库中找出11条相关基因。对这19条HMA基因编码蛋白按距离法(Neighbor-joining method)构建了它们的进化树,如图 3所示在拟南芥中有4个基因属于Cu+/Ag+亚家族,分别为AtHMA5-8,而谷子中该亚家族中有6个成员;对于Zn2+/Co2+/Cd2+/Pb2+亚家族,拟南芥中有蛋白AtHMA1-4 4个成员,而谷子中含有5个成员并且其中的2个与AtHMA1亲缘关系很近,将其命名为SiHMA1-1、SiHMA1-2。由以下分析结果可得出,家族分类结果与其功能基本是一致的。
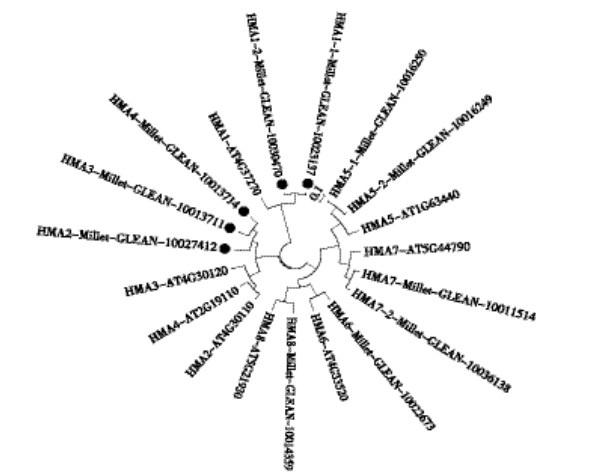
|
| ●代表谷子中Zn2+/Co2+/Cd2+/Pb2+亚组基因 The dark circles indicate the five members in the Zn2+/Co2+/Cd2+/Pb2+ subgroup in foxtail millet seedlings 图 3 谷子和拟南芥HMAs家族系统树 Figure 3 Phylogenetic analysis of the foxtail millet seedlings and Arabidopsis HMAs family proteins |
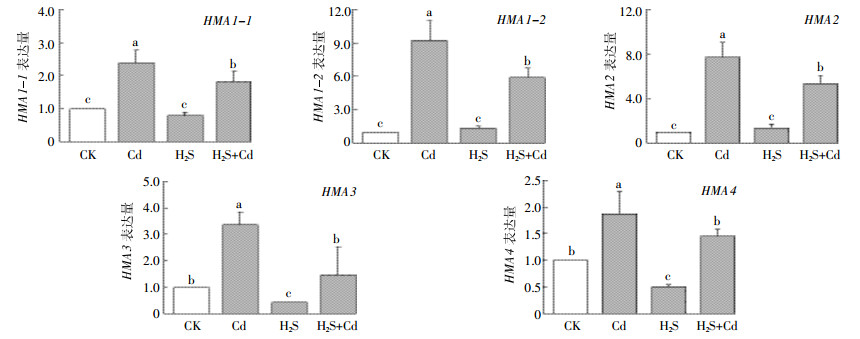
为了研究H2S缓解Cd胁迫的分子机理,直接参照拟南芥HMA家族基因序列设计引物,并通过qRT-PCR在谷子中扩增出目的片段,对Cd胁迫下,H2S对谷子Zn2+/Co2+/Cd2+/Pb2+亚组中HMA1-4的表达量进行了分析,实验结果如图 4显示,Cd处理组SiHMA1-1、SiHMA1-2、SiHMA2、SiHMA3和SiHMA4显著上调,与之相比,H2S+Cd处理组5个基因的表达量则均有显著的下调。综上结果表明,H2S可能通过调节谷子幼苗中起金属转运作用的HMAs家族基因的表达量,来缓解Cd胁迫对谷子幼苗的损伤。
|
| 图 4 H2S对谷子HMAs家族金属转运基因的表达调控 Figure 4 The expression levels of the HMAs family of the metal transporter genes under H2S treatment |
ATP是一种高能磷酸化合物,是细胞各项生命活动的能量供应。而根系的主要功能之一为吸收水分和无机盐,这一过程则需要ATPase催化ATP水解进而提供能量。位于细胞质膜上的H+-ATPase、Ca2+-ATPase、Mg2+-ATPase是较为重要的ATP酶类,其活性可直接反映出细胞质膜的作用,并且质膜H+-ATPase所构成的跨膜质子梯度,是根部吸收营养物质的重要驱动力。已有研究报道1 mmol·L-1 CdCl2能够显著抑制根系的质膜H+-ATPase活性。这表明1 mmol·L-1 CdCl2可以将细胞质膜的功能破坏,同时也对根系主动吸收的能力有所抑制[19];同时也有研究报道,不同浓度的CdCl2胁迫处理对龙葵和长春花等幼苗的H+-ATPase、Ca2+-ATPase活性影响比较显著[22-23]。本研究发现,在CdCl2胁迫下Ca2+-ATPase、Mg2+-ATPase和H+-ATPase的活性显著被抑制,而H2S处理则可以缓解这一现象,这与H2S可以缓解Al对小麦ATPase活性的抑制[24]这一研究报道相一致。尽管Cd胁迫对ATPase的影响有众多研究,但并无一致的结果,因此在这方面还值得进一步深入研究。
P型ATPases存在于大部分真核生物中,它们对生物体的离子运输、信号转导以及稳态维持,尤其是在应对环境胁迫的生理过程中发挥着重要作用。P型ATPases家族成员中P1B-ATPases(HMAs)则为植物中的重要金属转运蛋白。HMAs亚家族分为Cu+/Ag+和Zn2+/Co2+/Cd2+/Pb2+两个亚族,研究报道拟南芥AtHMA1-4属于Zn2+/Co2+/Cd2+/Pb2+亚族[10]。本研究利用生物信息学方法,在谷子中预测到有5个编码基因属于Zn2+/Co2+/Cd2+/Pb2+亚组。进一步的Real-time PCR表达分析(图 4)表明,H2S处理使得在Cd胁迫下谷子幼苗中SiHMA1-1、SiHMA1-2、SiHMA2、SiHMA3和SiHMA4表达的上调有所抑制。由此推测,根细胞内的Cd往地上部分运输时受H2S抑制,从而将Cd集中于根细胞的液泡中,进而缓解了Cd对谷子幼苗的损伤。这一结果与H2S可以下调龙葵HMA4基因的表达,抑制Zn向地上部分转运,从而缓解Zn对龙葵幼苗的毒害[26]结果相一致。AtHMA3和OsHMA3可使得Zn2+/Co2+/Cd2+/Pb2+储存于植物液泡当中,AtHMA3也是唯一能使Cd在叶片中积累发生变化的一个转运蛋白[11];而拟南芥HMA家族中的另外两成员HMA2、HMA4和水稻中OsHMA2的主要功能则是分别把根中Zn和Cd从根细胞中运输至地上部分[10-11]。从以上分析可以推测,不同物种中的HMAs家族基因及其亚组中的转运蛋白都有着功能差异性。
因此,本实验研究H2S在谷子幼苗响应重金属Cd胁迫机制中的作用,为进一步深入研究谷子对重金属Cd的调控机制提供理论支持。但是,目前对HMAs家族的功能及更深的研究尚不清楚。因此,对谷子中HMAs家族进行详细的功能分析与基因定位是我们后续研究的方向。
4 结论(1) 在Cd胁迫处理下谷子幼苗会产生一系列生理指标和转录水平的变化,主要表现有可溶性糖和可溶性蛋白含量均降低,三种ATP酶活性下降,以及P1B-ATPase转运家族HMAs的基因表达升高,从而导致谷子幼苗受到不同程度的损伤。
(2) H2S处理则可以增加Cd胁迫下谷子幼苗的可溶性糖含量,提高Cd胁迫下谷子幼苗的三种ATP酶活性,下调HMA1、HMA2、HMA3和HMA4基因的表达,从而提高根系主动吸收能力,将Cd集中于根细胞的液泡中,进而缓解Cd对谷子幼苗的损伤。
| [1] |
裴雁曦. 植物中的气体信号分子硫化氢:无香而立, 其臭如兰[J]. 中国生物化学与分子生物学报, 2016, 32(7): 721-733. PEI Yan-xi. Gasotransmitter hydrogen sulfide in plants:Stinking to high heaven, but refreshing to fine life[J]. Chinese Journal of Biochemistry and Molecular Biology, 2016, 32(7): 721-733. |
| [2] |
程双妮, 叶迦宁, 金东宁, 等. 硫化氢在番茄耐受镉胁迫过程中的作用[J]. 安徽农业科学, 2017, 45(5): 140-143. CHENG Shuang-ni, YE Jia-ning, JIN Dong-ning, et al. The fuction of hydrogen sulfide in tomato under cadmium stress condition[J]. Journal of Anhui Agricultural Sciences, 2017, 45(5): 140-143. |
| [3] |
Zhang H, Hu L Y, Hu K D, et al. Hydrogen sulfide promotes wheat seed germination and alleviates oxidative damage against copper stress[J]. Journal of Integrative Plant Biology, 2008, 50(12): 1518-1529. DOI:10.1111/jipb.2008.50.issue-12 |
| [4] |
Zhang H, Tang J, Liu X P, et al. Hydrogen sulfide promotes root organogenesis in Ipomoea batatas, Salix matsudana and Glycine max[J]. Journal of Integrative Plant Biology, 2009, 51(12): 1086-1094. DOI:10.1111/jipb.2009.51.issue-12 |
| [5] |
Zhang H, Hu S L, Zhang Z J, et al. Hydrogen sulfide acts as a regulator of flower senescence in plants[J]. Postharvest Biology & Technology, 2011, 60(3): 251-257. |
| [6] |
Jin Z P, Shen J J, Qiao Z J, et al. Hydrogen sulfide improves drought resistance in Arabidopsis thaliana[J]. Biochem Biophys Res Commun, 2011, 414(3): 481-486. DOI:10.1016/j.bbrc.2011.09.090 |
| [7] |
Fang H H, Liu Z Q, Pei Y X, et al. Hydrogen sulfide interacts with calcium signaling to enhance the chromium tolerance in Setaria italica[J]. Cell Calcium, 2014, 56(6): 472-481. DOI:10.1016/j.ceca.2014.10.004 |
| [8] |
Zhang H, Hu L Y, Li P, et al. Hydrogen sulfide alleviated chromium toxicity in wheat[J]. Biologia Plantarum, 2010, 54(4): 743-747. DOI:10.1007/s10535-010-0133-9 |
| [9] |
邓林, 陈少良. ATPase与植物抗盐性[J]. 植物学通报, 2005, 22(增刊): 11-21. DENG Lin, CHEN Shao-liang. ATPase and salt resistance in plants[J]. Chinese Bulletin of Botany, 2005, 22(Suppl): 11-21. |
| [10] |
Lin Y F, Aarts M G M. The molecular mechanism of zinc and cadmium stress response in plants[J]. Cellular & Molecular Life Sciences, 2012, 69(19): 3187-3206. |
| [11] |
Takahashi R, Bashir K, Ishimaru Y, et al. The role of heavy-metal ATPases, HMAs, in zinc and cadmium transport in rice[J]. Plant Signaling & Behavior, 2012, 7(12): 1605-1607. |
| [12] |
Zorrig W, Abdelly C, Berthomieu P, et al. The phylogenetic tree gathering the plant Zn/Cd/Pb/Co P1B-ATPases appears to be structured according to the botanical families[J]. Comptes Rendus-Biologies, 2011, 334(12): 863-871. DOI:10.1016/j.crvi.2011.09.004 |
| [13] |
Fang X L, Wang L, Deng X, et al. Genome-wide characterization of soybean P1B-ATPases gene family provides functional implications in cadmium responses[J]. Bmc Genomics, 2016, 17(1): 1-15. |
| [14] |
Zhang Z C, Yu Q, Du H Y, et al. Enhanced cadmium efflux and root-to-shoot translocation are conserved in the hyperaccumulator Sedum alfredii(Crassulaceae family)[J]. FEBS Lett, 2016, 590(12): 1757-1764. DOI:10.1002/1873-3468.12225 |
| [15] |
Jin Z P, Pei Y X. Physiological implications of hydrogen sulfide in plants:Pleasant exploration behind its unpleasant odour[J]. Oxid Med Cell Longev, 2015, Artical ID 397502.
|
| [16] |
Guo H M, Xiao T Y, Zhou H, et al. Hydrogen sulfide:A versatile regulator of environmental stress in plants[J]. Acta Physiologiae Plantarum, 2016, 38(1): 1-13. |
| [17] |
田保华, 张彦洁, 张丽萍, 等. 镉/铬胁迫对谷子幼苗生长和NADPH氧化酶及抗氧化酶体系的影响[J]. 农业环境科学学报, 2016, 35(2): 240-246. TIAN Bao-hua, ZHANG Yan-jie, ZHANG Li-ping, et al. Effects of cadmium or chromium on growth and NADPH oxidase and antioxidant enzyme system of foxtail millet seedlings[J]. Journal of Agro-Environment Science, 2016, 35(2): 240-246. DOI:10.11654/jaes.2016.02.005 |
| [18] |
李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2006. LI He-sheng. Technology of plant physiological and biochemical[M]. Beijing: China Higher Education Press, 2006. |
| [19] |
邵小杰, 杨洪强, 冉昆, 等. 水杨酸对镉胁迫下葡萄根系质膜ATPase和自由基的影响[J]. 中国农业科学, 2010, 43(7): 1441-1447. SHAO Xiao-jie, YANG Hong-qiang, RAN Kun, et al. Effects of salicylic acid on plasma membrane ATPase and free radical of grape root under cadmium stress[J]. Scientia Agricultura Sinica, 2010, 43(7): 1441-1447. |
| [20] |
Forbush B. Assay of Na, K-ATPase in plasma membrane preparations:Increasing the permeability of membrane vesicles using sodium dodecyl sulfate buffered with bovine serum albumin[J]. Analytical Biochemistry, 1983, 128(1): 159-163. DOI:10.1016/0003-2697(83)90356-1 |
| [21] |
陈国忠, 李文均, 徐丽华, 等. 16S rRNA二级结构的研究进展及其在系统分类中的应用[J]. 微生物学杂志, 2005, 25(5): 54-57. CHEN Guo-zhong, LI Wen-jun, XU Li-hua, et al. Advanced in 16S rRNA secondary structure and its application in systematic classification[J]. Journal of Microbiology, 2005, 25(5): 54-57. |
| [22] |
刘柿良, 杨容孑, 马明东, 等. 土壤镉胁迫对龙葵(Solanum nigrum L.)幼苗生长及生理特性的影响[J]. 农业环境科学学报, 2015, 34(2): 240-247. LIU Shi-liang, YANG Rong-jie, MA Ming-dong, et al. Effects of soil cadmium on growth and physiological characteristics of Solanum nigrum L. plants[J]. Journal of Agro-Environment Science, 2015, 34(2): 240-247. DOI:10.11654/jaes.2015.02.006 |
| [23] |
刘柿良, 潘远智, 杨容孑, 等. 外源一氧化氮对镉胁迫下长春花质膜过氧化、ATPase及矿质营养吸收的影响[J]. 植物营养与肥料学报, 2014, 20(2): 445-458. LIU Shi-liang, PAN Yuan-zhi, YANG Rong-jie, et al. Effects of exogenous NO on mineral nutrition absorption, lipid peroxidation and ATPase of plasma membrane in Catharanthus roseus tissues under cadmium stress[J]. Journal of Plant Nutrition and Fertilizer, 2014, 20(2): 445-458. DOI:10.11674/zwyf.2014.0222 |
| [24] |
Dawood M, Cao F B, Jahangir M M, et al. Alleviation of aluminum toxicity by hydrogen sulfide is related to elevated ATPase, and suppressed aluminum up take and oxidative stress in barley[J]. Journal of Hazardous Materials, 2012, 209/210(1): 121-128. |
| [25] |
Li L, Zhou W H, Dai H X, et al. Selenium reduces cadmium uptake and mitigates cadmium toxicity in rice[J]. Journal of Hazardous Materials, 2012, 235/236(2): 243-351. |
| [26] |
Liu X, Chen J, Wang G H, et al. Hydrogen sulfide alleviates zinc toxicity by reducing zinc uptake and regulating genes expression of antioxidative enzymes and metallothioneins in roots of the cadmium/zinc hyperaccumulator Solanum nigrum L.[J]. Plant & Soil, 2015, 400(1): 1-16. |
 2018, Vol. 37
2018, Vol. 37