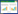文章信息
- 王晓旭, 孙丽娜, 郑学昊, 吴昊, 王辉, 刘春跃
- WANG Xiao-xu, SUN Li-na, ZHENG Xue-hao, WU Hao, WANG Hui, LIU Chun-yue
- DDTs污染农田土壤的强化微生物修复研究
- Enhanced microbial remediation of dichlorodiphenyltrichloroethane(DDT)-contaminated farmland soil
- 农业环境科学学报, 2018, 37(1): 72-78
- Journal of Agro-Environment Science, 2018, 37(1): 72-78
- http://dx.doi.org/10.11654/jaes.2017-0882
文章历史
- 收稿日期: 2017-06-20
- 录用日期: 2017-09-06
滴滴涕[(1,1,1-trichloro-2,2-bis(p-chlorophenyl)ethane,DDT]是环境中典型的持久性有机污染物(Persistent Organic Pollutants,POPs),由于其突出的持久性、生物蓄积性,并对生物体存在潜在毒性而受到广泛关注[1],许多国家都将其列入优先控制污染物的黑名单中。环境中残留的DDT同分异构体/初级代谢产物主要包括p,p′-DDT、o,p′-DDT、p,p′-DDE和p,p′-DDD,统称DDTs。由于DDTs的亲脂性,易被土壤颗粒吸附,使土壤成为其主要的环境归宿之一[2]。虽然我国早在1983年已经禁止使用DDTs,但各地土壤中仍能检测到不同浓度的DDTs残留[3]。残留在土壤中的DDTs可以通过迁移、转化及食物链等进入其他环境介质和生物体,对生态系统和人类健康造成潜在危害[4]。因此,对DDTs污染土壤进行修复是极其必要的。
微生物降解是DDTs污染土壤修复经济有效的方法[5]。但对于疏水性强的DDTs化合物,较低的生物利用性是限制其微生物修复效率的主要因素[6]。此外,在现场修复环境中,通常采用定期接种新的降解菌以及添加微生物生长所需营养物以提高污染土壤中降解菌的数目和活性[7-8]。因此,采用强化手段提高微生物修复效率成为生物修复DDTs污染土壤的关键。血粉是良好的动物性蛋白饲料,是屠宰禽畜时所得血液经干燥制成的。血粉中不仅含有丰富的氨基酸和多种微量元素,而且粗蛋白含量可达到80%~90%,可以对微生物的生长繁殖起促进作用。血粉作为一种微生物刺激物,近期在我国已成功应用于原位处理DDTs污染土壤的生物修复中,并取得了良好的修复效果[9]。因此,血粉可以作为微生物刺激物应用于污染农田土壤修复中。另外,针对DDTs极易被土壤固相吸附,导致其生物利用性低的问题,人们通常利用表面活性剂的增溶作用提高疏水性有机污染物(Hydrophobic Organic Compounds,HOCs)的溶解性和生物可利用性,从而达到促进微生物降解、提高修复效率的目的[10-11]。目前,该技术中多采用单一表面活性剂进行强化修复,而阴-非离子混合表面活性剂可协同增溶土壤中有机污染物,有效降低表面活性剂用量,且环境适应范围更广泛[12]。因此,在污染土壤的生物强化修复研究中受到广泛关注。如阴离子表面活性剂十二烷基苯磺酸钠SDBS和非离子表面活性剂Tween 80已被报道用于PAHs污染土壤的微生物修复研究中[13-14],但田间应用表面活性剂强化微生物降解DDTs方面的研究较少。
因此,本研究针对国内DDTs等有机污染土壤修复技术需求,在前期的研究基础上,以东北地区设施农业DDTs污染土壤为对象,开展现场微生物原位修复及血粉、阴-非离子混合表面活性剂强化修复措施,同时探讨了修复过程中对DDT同分异构体/初级代谢产物的影响,以期为DDTs等有机污染土壤的微生物强化修复技术提供理论指导。
1 材料与方法 1.1 修复场地实验场地位于沈阳市沈北新区某设施农业大棚内,平整实验田0~20 cm表层土壤,去除植物根系、石砾、塑料等残留物,不断进行翻耕混匀。土壤基本理化性质参照土壤农业化学分析方法测定[15]:土壤容重1220 kg·m-3,pH值6.39,有机质62.18 g·kg-1,总氮3.09 g·kg-1,总磷0.69 g·kg-1,粘粒、粉粒和砂粒含量分别为24.78%、74.07%、1.15%,土壤类型为粉砂质粘土。实验田DDTs平均浓度为130.63 μg·kg-1,其中p,p′-DDT、o,p′-DDT、p,p′-DDD和p,p′-DDE分别为95.56、6.08、8.95 μg·kg-1和20.04 μg·kg-1。
1.2 主要实验材料混合菌:球形节杆菌(Arthrobacter globiformis)和甲基营养型芽孢杆菌(Bacillus methylotrophicus)由本课题组分离、培养[16]。球形节杆菌和甲基营养型芽孢杆菌按2:1(体积比)混合配成混合菌液。
血粉:购于贵州金万和农业科技有限公司。
阴-非离子混合表面活性剂:即十二烷基苯磺酸钠(SDBS)和失水山梨醇单油酸酯聚氧乙烯醚(Tween 80),购于国药集团化学试剂有限公司,其混合质量比为2:3。
DDTs标准样品:p,p′-DDE、p,p′-DDD、o,p′-DDT、p,p′-DDT(浓度100 μg·mL-1)购于百灵威科技有限公司,采用气相色谱仪(CP-3800,美国Varian)进行DDTs分析。
1.3 实验设计各田间实验小区面积均为1.0 m×1.0 m,相邻小区间设置约20 cm隔离沟。共设置两组实验:
实验一,混合菌的接种方式对DDTs污染土壤的影响:(1)初始1次接种混合菌(PN-1);(2)连续3次接种混合菌(3PN-1),按照每30 d接种1次的频率进行添加。在每次喷施降解菌过程中进行翻耕混匀。同时设不接种的小区作为对照(CK)。
实验二,在实验一的基础上,研究不同强化措施对混合菌修复DDTs污染土壤的影响:(1)添加血粉和接种混合菌(3X+3PN-1);(2)添加阴-非离子混合表面活性剂SDBS-Tween 80和接种混合菌(3H+3PN-1);(3)添加阴-非离子混合表面活性剂SDBS-Tween 80、血粉和接种混合菌(3X+3H+3PN-1)。上述3种处理均在每30 d添加1次,并进行翻耕混匀。
对照与处理小区各设置3个平行重复。修复周期为90 d,为空白样地,分别在0、30、60、90 d时使用梅花取样法对每个小区采集表层0~20 cm处土壤样品并混合均匀,监测土壤中DDTs的残留量。其中初始1次接种混合菌的菌液量为1.5 L·m-2,每30 d接种1次混合菌的菌液量为500 mL·m-2,菌落形成单位均为1×108 mL-1;血粉每次添加量为5 g·kg-1土;SDBS-Tween 80每次添加量为100 mg·kg-1土;混匀翻耕深度为0~20 cm表层土壤,定期浇水,使土壤含水率保持在最大田间持水量的60%。
1.4 土壤样品中DDTs的前处理方法和残留测定条件土壤样品室温自然风干后,碾磨粉碎过60目筛,称取5.0 g试样,移入萃取池中,加硅藻土把萃取池填满,土壤中DDTs的提取采用加速溶剂萃取法,萃取液为正己烷和丙酮混合液(体积比1:1)[17]。萃取后的溶液使用浓硫酸磺化法对萃取液进行净化[18],净化后使用氮吹法使样品近干后,用色谱纯正己烷定容到1.0 mL,然后过0.45 μm有机滤膜,转移到气相进样瓶中,使用气相色谱-电子捕获检测器(GC-ECD)进行测定。
测定条件:色谱柱为CP-sil 8CB型石英毛细管柱(30 m×0.32 mm×0.25 μm);色谱柱升温程序为初始温度120 ℃并保持1 min,以25 ℃·min-1升至230 ℃,再以3 ℃·min-1升至255 ℃,最后以20 ℃·min-1升至280 ℃保持5 min;进样口温度250 ℃;检测器温度300 ℃。载气、辅助气均为高纯氮气,载气流速为0.6 mL·min-1(恒流)。进样方式为脉冲不分流进样,脉冲压力276 kPa、保持0.75 min,进样量1 μL;尾吹30 mL·min-1。以色谱峰保留时间定性,外标法定量,方法的线性范围为2~200 μg·L-1,检出限为0.87~2.63 μg·kg-1,加标回收率为89.2%~107.1%。
1.5 数据处理采用Origin 8.0和SPSS 18.0对数据进行处理分析作图。
2 结果与讨论 2.1 混合菌的接种方式对DDTs污染农田土壤的影响降解菌在土壤中的定殖是决定DDTs污染土壤微生物修复的关键,投加到实际污染土壤中的降解菌往往会存在菌体流失的现象[19],因此本研究通过90 d的田间实验,比较对照组(CK)、初始1次接种混合菌(PN-1)和分3次接种混合菌(3PN-1)对农田土壤中DDTs残留浓度动态变化的情况,结果如图 1所示。与各田间小区DDTs本底值(129.58~131.10 μg·kg-1)相比,不添加任何修复措施的CK在90 d残留量变化不明显,降解率仅为4.6%。说明土壤中虽然存在降解DDTs的土著微生物,但这种降解作用非常缓慢。
|
| 图 1 混合菌的接种方式对DDTs污染农田土壤的影响 Figure 1 Effects of inoculating mixed bacteria on the biodegradation of DDTs contaminated farmland soil |
在接种混合菌的两种处理中,土壤中DDTs残留量在前30 d内降低迅速,3PN-1处理的DDTs残留浓度与PN-1处理相比虽有减少,但并不显著。其原因可能是当接菌量达到一定浓度时,菌体与底物已经充分接触,此时接菌量已经接近饱和,不再是制约降解DDTs的主要原因[20]。而在随后的30~90 d,3PN-1和PN-1两种处理的DDTs残留浓度变化出现差异。PN-1处理在30~90 d DDTs残留浓度降低幅度较小,90 d后DDTs降解率为41.9%,仅比第30 d提高了5.5%,这表明初始1次性接种混合菌,随着培养时间的延长,降解菌会逐渐衰亡,导致降解效果变差。而3PN-1处理在30~90 d DDTs残留浓度亦有不同程度下降,90 d后DDTs降解率达到50.5%,比第30 d提高了17.1%。虽然3PN-1处理每30 d均有接种1次混合菌菌液,但是30 d之后残留浓度的下降程度逐渐减弱,其原因可能是:一方面,土壤中DDTs浓度降低,导致反应速度减慢;另一方面,DDTs降解过程中产生的中间产物的竞争代谢和毒性作用[21],也可能造成微生物降解速率降低。与本研究类似,谢慧[22]通过盆栽试验研究了降解菌株DXZ9对模拟DDTs污染土壤的影响,结果表明土壤中DDTs残留浓度在前期降低较快,后期降低较慢,DDTs降解率最高达到65.5%,高于本研究中混合菌对DDTs降解率,这可能是由于田间土壤环境较为复杂,残留在土壤中的DDTs经过长期老化其生物可利用性大幅降低。综上所述,分3次接种混合菌比初始1次接种混合菌对DDTs修复效果好(P<0.05)。这与Boon等[23]报道生物强化中投加土著降解菌即使是从原污染环境中分离筛选出的并有适宜的生长环境也难以长期存活,必须要定期补充接种新的降解菌是一致的。因此,为保证降解菌在土壤中的存活和繁殖,需定期连续地接种混合菌。
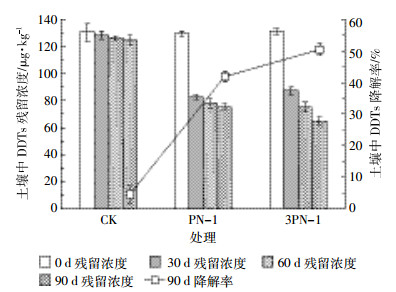
2.2 不同强化措施对混合菌修复DDTs污染农田土壤的影响采用定期添加血粉(3X)和阴-非离子混合表面活性剂SDBS-Tween 80(3H)强化混合菌(3PN-1)修复DDTs农田土壤的影响如图 2所示。经过90 d的修复,与单独接种混合菌3PN-1处理相比,采用不同强化措施均可显著降低土壤中DDTs的残留(P<0.05),3X+3PN-1、3H+3PN-1、3X+3H+3PN-1修复后土壤中DDTs残留浓度分别为56.08、47.66、44.56 μg·kg-1,平均降解率分别达到57.5%、63.2%和65.9%。添加营养物质可以提高微生物降解活性,而且相关研究表明外加碳源不仅有利于微生物定殖,还能作为共代谢底物促进DDTs的降解[24]。血粉中营养物比较丰富,可以为微生物提供足够碳源,刺激微生物提高其活性。王辉等[9]研究了添加营养物对土著微生物修复DDTs污染土壤的影响,结果表明,与葡萄糖相比较,血粉能够更长效地刺激土著微生物提高其活性,更有效地提高土壤中DDTs的微生物降解率。因此,添加血粉强化混合菌(3X+3PN-1)可以使土壤中DDTs残留浓度显著降低。与3X+3PN-1处理相比,3H+3PN-1处理可以使土壤中DDTs残留浓度进一步降低。已有研究表明,阴-非离子混合表面活性剂可产生协同增溶作用,减少各自的吸附或沉淀损失,增加了土壤中的有效浓度,促进了DDTs从土壤颗粒中解吸下来,进而提高了DDTs的生物可利用性和微生物降解效率[25]。陈苏等[26]报道SDBS-Tween 80浓度仅为70 mg·kg-1土时,即可达到对微生物修复DDTs污染土壤较好的效果,150 d后DDTs降解率达到64.0%。因此,较低浓度的SDBS-Tween 80能有效促进土壤中DDTs的生物修复效果,同时降低了田间应用表面活性剂的成本。3X+3H+3PN-1联合作用对DDTs降解的促进作用强于单独的3X+3PN-1和3H+3PN-1处理,这说明血粉和SDBS-Tween 80在促进DDTs降解方面存在协同作用。外加血粉提高微生物降解活性;添加SDBS-Tween 80提高了DDTs生物可利用性,两者共同促进了土壤中DDTs降解。
|
| 图 2 不同强化措施对混合菌修复DDTs污染农田土壤的影响 Figure 2 Effects of different enhanced measures on mixed bacteria remediation of DDTs contaminated farmland soils |
为比较不同强化措施间DDTs的修复效果是否具有显著差异,对3X+3PN-1、3H+3PN-1和3X+3H+3PN-1修复后DDTs残留浓度进行两两之间t检验。在成对t检验中,3X+3PN-1与3H+3PN-1之间具有显著性差异(P<0.05),且3H+3PN-1处理后土壤中DDTs残留浓度较低。表明与添加血粉相比,利用SDBS-Tween 80强化混合菌对土壤中DDTs修复效果更显著;3H+3PN-1与3X+3H+3PN-1之间无显著差异(P>0.05),即添加血粉并没有显著提高SDBS-Tween 80与混合菌对土壤中DDTs的修复效果。因此,考虑到田间修复成本,利用SDBS-Tween 80强化混合菌处理即可达到对DDTs污染土壤较好的修复效果。
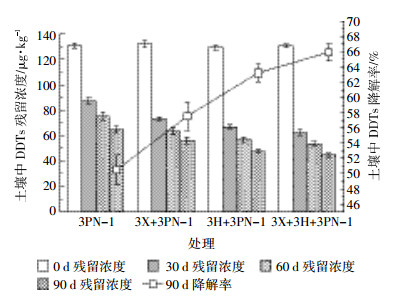
2.3 不同强化措施下农田土壤中DDT同分异构体/初级代谢产物的残留情况混合菌的接种方式、添加血粉和阴-非离子混合表面活性剂SDBS-Tween 80强化修复后,土壤中DDT同分异构体/初级代谢产物(p,p′-DDT、o,p′-DDT、p,p′-DDD和p,p′-DDE)残留情况见图 3。图 3a为不同强化措施下土壤中p,p′-DDT残留浓度。p,p′-DDT是DDTs中有效的杀虫活性成分,生物毒性强,在土壤环境中消失缓慢,半衰期可达到30年[27]。采用不同强化措施修复90 d后,可以看出土壤中p,p′-DDT残留浓度显著降低。其中,PN-1处理在修复30 d后,p,p′-DDT降解速度明显比其他处理低,这表明仅初始接种1次混合菌,其降解活性会随着培养时间的延长而逐渐降低,导致p,p′-DDT降解效果变缓。而每30 d接种1次混合菌的处理(3PN-1),p,p′-DDT残留量亦呈现不断降低趋势。可以看出与3PN-1处理对比,3H+3PN-1和3X+3H+3PN-1两种处理对p,p′-DDT修复效果更好。从图 3b中可见,修复90 d后不同强化措施间o,p′-DDT残留浓度相差不大,其原因可能是土壤中残留的o,p′-DDT浓度较低,不利于微生物降解,但o,p′-DDT杀虫活性较弱,对生态环境影响相对较小。图 3c为不同强化措施下土壤中p,p′-DDD残留浓度。与土壤中其他DDT同分异构体/初级代谢产物相比,p,p′-DDD残留浓度下降较为缓慢,其原因为p,p′-DDD在厌氧条件下可以被降解细菌进一步还原脱氯至DDMS和DDNU[28],而表层土壤以有氧条件为主,对p,p′-DDD进一步降解不利,其中以3H+3PN-1处理对p,p′-DDD残留浓度下降最为明显。由图 3d可以看出,PN-1、3PN-1和3X+3PN-1处理p,p′-DDE残留浓度在降解30 d后出现累积现象,这可能是由于各异构体间相互转化所导致的。p,p′-DDE是p,p′-DDT在有氧条件下生物降解主要的代谢产物之一[29],当在某个时期,还来不及再转化消失,p,p′-DDE会暂时累积,出现残留浓度升高的现象。这与Fan等[30]研究白腐真菌在人工模拟DDTs污染土壤条件下对p,p′-DDE降解情况类似。p,p′-DDE比其母体化合物具有更强的持久性、生物蓄积性和生态毒性[31],因此去除土壤中残留的p,p′-DDE非常重要。对比不同强化措施下土壤中p,p′-DDE残留浓度可以看出,3H+3PN-1处理残留浓度最低,对p,p′-DDE降解率高达62.4%。因此,综合考虑不同强化措施对土壤中DDTs残留浓度的影响及DDT同分异构体/初级代谢产物的修复效果,最终确定3H+3PN-1处理为适宜的强化措施,即利用阴-非离子混合表面活性剂SDBS-Tween 80强化混合菌修复DDTs污染土壤,修复90 d后DDTs降解率可达63.2%。
|
| 图 3 不同强化措施下土壤中DDT同分异构体/初级代谢产物的残留情况 Figure 3 Effects of DDT isomers/primary metabolites residue in different enhanced measures |
(1) 混合菌的接种方式对DDTs污染土壤修复存在显著影响,连续3次接种的修复效果比1次好,DDTs的降解率最高可达50.5%,比对照组提高了45.9%,比1次接种混合菌提高了8.6%。
(2) 定期添加血粉和阴-非离子混合表面活性剂SDBS-Tween 80能明显强化混合菌对土壤中DDTs的降解效果,3X+3PN-1、3H+3PN-1和3X+3H+3PN-1处理对土壤中DDTs降解率分别达到57.5%、63.2%和65.9%,比单独接种混合菌处理分别提高了7.1%、12.8%和15.5%。
(3) SDBS-Tween 80强化混合菌处理(3H+3PN-1)可以显著降低土壤中DDTs的残留浓度,且对生态毒性强的p,p′-DDE去除效果好,有效降低了修复后的生态风险,为适宜的强化措施。
| [1] |
Sari A A, Tachibana S, Itoh K. Determination of co-metabolism for 1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl) ethane(DDT) degradation with enzymes from Trametes versicolor U97[J]. Journal of Bioscience and Bioengineering, 2012, 114(2): 176-181. DOI:10.1016/j.jbiosc.2012.03.006 |
| [2] |
Zhang A P, Fang L, Wang J L, et al. Residues of currently and never used organochlorine pesticides in agricultural soils from Zhejiang Province, China[J]. Journal of Agricultural & Food Chemistry, 2012, 60(12): 2982-2988. |
| [3] |
Hu W Y, Huang B, Zhao Y C, et al. Distribution, sources and potential risk of HCH and DDT in soils from a typical alluvial plain of the Yangtze River Delta region, China[J]. Environmental Geochemistry and Health, 2014, 36(3): 345-358. DOI:10.1007/s10653-013-9554-7 |
| [4] |
Purnomo A S, Mori T, Kamei I, et al. Basic studies and application on bioremediation of DDT:A review[J]. International Biodeterioration & Biodegradation, 2011, 65(7): 921-930. |
| [5] |
Purnomo A S, Kamei I, Kondo R. Degradation of 1, 1, 1-trichloro-2, 2-bis(4-chlorophenyl) ethane(DDT) by brown-rot fungi[J]. Journal of Bioscience & Bioengineering, 2008, 105(6): 614-621. |
| [6] |
Walters G W, Aitken M D. Surfactant-enhanced solubilization and anaerobic biodegradation of 1, 1, 1-Trichloro-2, 2-bis(p-Chlorophenyl)-ethane(DDT) in contaminated soil[J]. Water Environment Research, 2001, 73(1): 15-23. DOI:10.2175/106143001X138633 |
| [7] |
Gao C M, Jin X X, Ren J B, et al. Bioaugmentation of DDT-contaminated soil by dissemination of the catabolic plasmid pDOD[J]. Journal of Environmental Sciences, 2015, 27(1): 42-50. |
| [8] |
Kuppusamy S, Thavamani P, Megharaj M, et al. Biodegradation of polycyclic aromatic hydrocarbons(PAHs) by novel bacterial consortia tolerant to diverse physical settings-assessments in liquid-and slurry-phase systems[J]. International Biodeterioration & Biodegradation, 2016, 108: 149-157. |
| [9] |
王辉, 王晓旭, 孙丽娜, 等. 血粉刺激修复DDTs污染农田土壤的现场实验[J]. 中国环境科学, 2017, 37(2): 654-660. WANG Hui, WANG Xiao-xu, SUN Li-na, et al. Field test on biostimulation to remediation DDTs in contaminated farmland soil using blood meal[J]. China Environmental Science, 2017, 37(2): 654-660. |
| [10] |
Walters G W, Aitken M D. Surfactant-enhanced solubilization and anaerobic biodegradation of 1, 1, 1-trichloro-2, 2-bis(p-chlorophenyl)-ethane(DDT) in contaminated soil[J]. Water Environment Research, 2001, 73(1): 15-23. DOI:10.2175/106143001X138633 |
| [11] |
Laha S, Tarsel B, Ussawarujikulchai A. Surfactant-soil interactions during surfactant-amended remediation of contaminated soils by hydrophobic organic compounds:A review[J]. Journal of Environmental Management, 2009, 90(1): 95-100. DOI:10.1016/j.jenvman.2008.08.006 |
| [12] |
Holland P M, Rubingh D N. Nonideal multicomponent mixed micelle model[J]. Journal of Physical Chemistry, 1983, 87(11): 1984-1990. DOI:10.1021/j100234a030 |
| [13] |
Ni H W, Zhou W J, Zhu L Z. Enhancing plant-microbe associated bioremediation of phenanthrene and pyrene contaminated soil by SDBS-Tween 80 mixed surfactants[J]. Journal of Environmental Sciences, 2014, 26(5): 1071-1079. DOI:10.1016/S1001-0742(13)60535-5 |
| [14] |
Li F, Zhu L Z. Effect of surfactant-induced cell surface modifications on electron transport system and catechol 1, 2-dioxygenase activities and phenanthrene biodegradation by Citrobacter sp. SA01[J]. Bioresource Technology, 2012, 123(2): 42-48. |
| [15] |
刘光崧, 蒋能慧, 张连第, 等. 土壤理化分析与剖面描述[M]. 北京: 中国标准出版社, 1996, 5-38. LIU Guang-song, JIANG Neng-hui, ZHANG Lian-di, et al. Soil physical and chemical analysis description of soil profiles[M]. Beijing: China Standard Methods Press, 1996, 5-38. |
| [16] |
王晓旭, 郑学昊, 孙丽娜, 等. 表面活性剂强化微生物修复DDTs-PAHs复合污染农田土壤影响研究[J]. 生态环境学报, 2017, 26(3): 486-492. WANG Xiao-xu, ZHENG Xue-hao, SUN Li-na, et al. Enhanced effects of surfactants on the bioremediation of DDTs-PAHs in co-contaminated farmland soil[J]. Ecology and Environmental Sciences, 2017, 26(3): 486-492. |
| [17] |
张岩, 张景发, 陈艳梅, 等. 加速溶剂萃取-气相色谱法测定土壤中有机氯农药和多氯联苯[J]. 岩矿测试, 2010, 29(5): 491-496. ZHANG Yan, ZHANG Jing-fa, CHEN Yan-mei, et al. Determination of organochlorine pesticides and polychlorinated biphenyls in soils by gas chromatography with accelerated solvent extraction[J]. Rock and Mineral Analysis, 2010, 29(5): 491-496. |
| [18] |
中华人民共和国国家质量监督检验检疫总局. GB/T 14550-2003土壤中六六六和滴滴涕测定的气相色谱法[S]. 北京: 中国标准出版社, 2003. General Administration of Quality Supervision, Inspection and Quarantine of the People's Republic of China. GB/T 14550-2003 Method of gas chromatographic for determination of BHC and DDT in soil[S]. Beijing:China Standards Press, 2003. |
| [19] |
王洪, 李海波, 孙铁珩, 等. PAHs污染土壤生物修复强化技术研究进展[J]. 安全与环境学报, 2011, 11(1): 83-88. WANG Hong, LI Hai-bo, SUN Tie-heng, et al. Research progress in enhanced bioremediation of polycylic aromatic hydrocarbons contaminated soil[J]. Journal of Safety and Environment, 2011, 11(1): 83-88. |
| [20] |
Comeau Y, Greer C W, Samson R. Role of inoculums preparation and desity on the bioremediation of 2, 4-D contaminated soils[J]. Applied Microbiology Biotechnology, 1993, 38: 681-687. |
| [21] |
Fang H, Dong B, Yan H, et al. Characterization of a bacterial strain capable of degrading DDT congeners and its use in bioremediation of contaminated soil[J]. Journal of Hazardous Materials, 2010, 184(1/2/3): 281-289. |
| [22] |
谢慧. 土壤中DDT和DDE的生物强化降解及对土壤微生物群落结构的影响[D]. 泰安: 山东农业大学, 2013. XIE Hui. Enhanced biodegradation of DDT and DDE in the soil and its effect on the microbial community structure diversity of the soil[D]. Taian:Shandong Agricultural University, 2013. |
| [23] |
Boon N, Goris J, Vos P D, et al. Bioaugmentation of activated sludge by an indigenous 3-chloroaniline-degrading comamonas testosteroni Strain, I2gfp[J]. Applied & Environmental Microbiology, 2000, 66(7): 2906-2913. |
| [24] |
Sun G D, Zhang X, Hu Q, et al. Biodegradation of dichlorodiphenyltrichloroethanes(DDTs) and Hexachlorocyclohexanes(HCHsc) with plant and nutrients and their effects on the microbial ecological kinetics[J]. Microbial Ecology, 2015, 69(3): 721-722. DOI:10.1007/s00248-014-0520-4 |
| [25] |
肖鹏飞, 李玉文, KONDORyuichiro. Tween60和SDS强化白腐真菌修复DDT污染土壤[J]. 中国环境科学, 2015, 35(12): 3737-3743. XIAO Peng-fei, LI Yu-wen, KONDO Ryuichiro. Enhancement of Tween60 and SDS for bioremediation of DDT-contaminated soil by white rot fungus[J]. China Environmental Science, 2015, 35(12): 3737-3743. DOI:10.3969/j.issn.1000-6923.2015.12.027 |
| [26] |
陈苏, 单岳, 晁雷, 等. 表面活性剂-微生物联合修复滴滴涕污染土壤的研究[J]. 生态环境学报, 2016, 25(9): 1522-1527. CHEN Su, SHAN Yue, CHAO Lei, et al. Study on surfactant-microorganism combined bioremediation of DDT contaminated soil[J]. Ecology and Environmental Sciences, 2016, 25(9): 1522-1527. |
| [27] |
Mansouri A, Cregut M, Abbes C, et al. The environmental issues of DDT pollution and bioremediation:A multidisciplinary review[J]. Appl Biochem Biotechnol, 2017, 181(1): 309-339. DOI:10.1007/s12010-016-2214-5 |
| [28] |
Aislabie J M, Richards N K. Boul H L. Microbial degradation of DDT and its residues:A review[J]. New Zealand Journal of Agricultural Research, 1997, 40(2): 269-282. DOI:10.1080/00288233.1997.9513247 |
| [29] |
Chen L G, Ran Y, Xing B S, et al. Contents and sources of polycyclic aromatic hydrocarbons and organochlorine pesticides in vegetable soils of Guangzhou, China[J]. Chemosphere, 2005, 60(7): 879-890. DOI:10.1016/j.chemosphere.2005.01.011 |
| [30] |
Fan B, Zhao Y C, Mo G H, et al. Co-remediation of DDT-contaminated soil using white rot fungi and laccase extract from white rot fungi[J]. Journal of Soils Sediments, 2013, 13(7): 1232-1245. DOI:10.1007/s11368-013-0705-3 |
| [31] |
Teeyapant P, Ramchiun S, Polputpisatkul D, et al. Serum concentrations of organochlorine pesticides p, p-DDE in adult Thai residents with background levels of exposure[J]. The Journal of Toxicological Sciences, 2014, 39(1): 121-127. DOI:10.2131/jts.39.121 |
 2018, Vol. 37
2018, Vol. 37