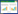文章信息
- 韩帅, 孙兴滨, 陈默, 高敏, 王旭明
- HAN Shuai, SUN Xing-bin, CHEN Mo, GAO Min, WANG Xu-ming
- 鸡场空气及粪便中耐甲氧西林金黄色葡萄球菌(MRSA)的分布特征与影响因素
- Methicillin-resistant Staphylococcus aureus(MRSA) in the air environment and feces from poultry feeding operations
- 农业环境科学学报, 2018, 37(1): 148-156
- Journal of Agro-Environment Science, 2018, 37(1): 148-156
- http://dx.doi.org/10.11654/jaes.2017-0841
文章历史
- 收稿日期: 2017-06-13
- 录用日期: 2017-09-06
2. 北京市农林科学院农业生物技术研究中心, 农业基因资源与生物技术北京市重点实验室, 北京 100097;
3. 中国农业大学生物学院, 北京 100193
2. Beijing Agro-Biotechnology Research Center, Beijing Key Laboratory of Agricultural Genetic Resources and Biotechnology, Beijing Academy of Agriculture and Forestry Sciences, Beijing 100097, China;
3. College of Biological Sciences, China Agricultural University, Beijing 100193, China
金黄色葡萄球菌是一种重要的人畜共患条件致病菌。在临床上可引起人类皮肤组织感染、败血症、肺炎、肠炎、脑膜炎和中毒性休克综合征等疾病[1]。在动物养殖中可引起家畜乳房炎[2]、禽类关节炎[3]、外伤化脓性炎症、泌尿道感染[4]等多种疾病。严重侵害家畜健康,使畜牧业遭受重大经济损失[5]。1961年,英国的Jevons[6]发现了第一株耐甲氧西林金黄色葡萄球菌(Methicillin-resistant Staphylococcus aureus,MRSA)。MRSA含有mecA及其相关基因[7],几乎对所有β-内酰胺类抗生素具有耐药性[8-9],被称为“超级细菌”[10]。目前对感染MRSA的治疗已经成为最棘手的问题[11]。MRSA不仅可以感染人类,而且也是家畜感染的重要致病菌[12-13]。近年来,由于抗生素药物在养殖业的不规范使用,导致动物感染MRSA的事件逐年增加[14]。
随着我国经济不断发展和人们饮食结构的改变,以集约化、工厂化为主要养殖模式的现代化畜禽养殖场数量不断增加[15]。其中,蛋鸡数量已占全球的40%[16]。在高密度的养殖条件下,垫料、动物自身以及粪便中含有的包括病原菌或条件致病菌在内的微生物,通过风化、腐蚀、空气气流弥散等作用悬浮在空气中形成生物气溶胶[17],引起动物或饲养员的感染[18]。这些微生物还可以负载到颗粒物表面,传播到舍外环境[19],导致气源性传染病流行[20],给附近居民健康带来极大威胁[21-22]。其中,动力学当量直径小于2.5 μm的颗粒(PM2.5)可直接深入到细支气管和肺泡,从而增加人和动物的发病率和死亡率[23]。因此,越来越多的学者开始关注颗粒物特别是细颗粒物负载的空气微生物[24-25]。
自首次发现以来,MRSA已成为爆发率最高的医院内感染病原菌之一,分离率可达55.73%[26]。动物中最先在患乳房炎的奶牛中发现MRSA[27],之后相继在猪、牛、羊和鸡等动物中发现[28]。在欧洲地区的家禽、猪和牛肉类制品中MRSA的检出率达到27.3%、10.4%和9.6%[29]。目前有关MRSA的研究多集中在人医环境[30-31]和部分猪、牛、羊养殖环境[32-34]中的定殖情况、传播扩散与耐药机制。而对于家禽空气环境中的MRSA研究相对较少,尤其是细颗粒物负载MRSA以及其影响因素均未见报道。因此,本研究通过对北京地区一家蛋鸡养殖场进行等时间间隔连续采样,记录养殖环境中MRSA的浓度变化,分析其影响因素。
1 材料与方法 1.1 采样时间和地点本研究在2016年7-11月期间,对北京平谷地区一家规模化蛋鸡养鸡场两栋鸡舍分别进行同时采样调查。鸡场所处位置地势平坦,其800 m辐射半径内不受较高建筑物及公路主干道影响。采样当日天气均为晴天。主要采集空气样本和相应粪便样本。两栋鸡舍饲养品种均为海兰蛋鸡,所处环境及养殖方式相同,采取笼上养殖,每个鸡舍内蛋鸡数量均在9300只左右,鸡舍采取机械通风,每周带鸡消毒2次。
1.2 采样方法和培养方法生物气溶胶采集在清粪、喷淋消毒等作业开始前40 min完成。采集使用FA-Ⅰ撞击式采样器(辽阳,中国)。该仪器将空气中的带菌粒子按空气动力学直径大小分别捕捉在各级培养皿上,具体粒径分布信息如表 1所示。采样高度距地面1.5 m,细菌与抗生素耐药菌样本采集时间经优化,分别为1 min和2 min,气体流量28.3 L·min-1,每次采样前用流量计(余姚,中国)对采样泵进行流量校正,每个采样点同时采集3个平行样本。采用相同方式检测舍内温度、相对湿度和各粒径颗粒物浓度,使用温湿度计检测(WD-35612,OAKTON,德国)。
样本采集选用9 cm培养皿,灭菌后加入20 mL培养基。细菌采用LB营养琼脂培养基,28 ℃培养2 d。金黄色葡萄球菌和耐甲氧西林金黄色葡萄球菌均采用CHRMagar显色培养基(法国科玛嘉公司),37 ℃培养24 h,均选取培养基上呈红色、红褐色或粉红色的边缘光滑菌落进行计数[35-36]。采集样本在进行菌落计数时,采用Positive hole method方法进行菌落计数校正。取同一采样点3次计数校正后平均值计算出平均细菌浓度(CFU·m-3)。
1.2.2 粪便中细菌及耐药菌的培养收集与空气样本对应的新鲜粪便样本,采用五点法,将5个点采集的新鲜粪便混合均匀作为一个样本,冷藏运输。为使得粪便中细菌具有良好活性,取10 g粪便加0.8%灭菌生理盐水100 mL,37 ℃、160 r·min-1,摇菌12~16 h。得到的菌液取1 mL加入装有9 mL灭菌生理盐水的离心管中,按10-2、10-3、10-4、10-5、10-6、10-7倍比稀释,选取10-5、10-6、10-7梯度菌液各100 μL用涂布棒均匀涂布在LB培养基上,每稀释梯度涂布3块培养皿,28 ℃培养2 d。选取10-3、10-4、10-5梯度菌液各100 μL用涂布棒均匀涂布于CHRMagar显色培养基上,每稀释梯度涂布3块培养皿,37 ℃培养24 h。在进行菌落计数时,选取各重复菌落计数相近且菌落计数在30~300个的稀释梯度平板为宜。采用Positive hole method方法进行菌落计数校正。取同一稀释梯度3次计数校正后平均值计算出平均细菌浓度(CFU·g-1)。
1.3 计算方法 1.3.1 空气中细菌气溶胶浓度根据采样时间和气体流量,利用公式(1)计算各级生物气溶胶浓度。
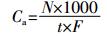 (1)
(1) 式中:Ca为细菌或耐药菌气溶胶浓度,CFU·m-3;N为各级菌落数,CFU;t为采样时间,min;F为采样时的气体流量,L·min-1。
1.3.2 粪便中细菌浓度根据稀释梯度和样品质量,利用公式(2)计算粪便中细菌浓度。
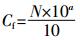 (2)
(2) 式中:Cf为粪便中细菌或耐药菌浓度,CFU·g-1;N为各稀释梯度菌落数,CFU;a为稀释倍数;10为实验样本质量,g。
1.3.3 耐药菌占总细菌浓度比例 (3)
(3) 式中:η为耐药菌所占比例;C为细菌或耐药菌浓度,CFU·m-3。
1.3.4 细颗粒物中耐药菌气溶胶所占比例本研究将粒径D50≤2.1 μm(stageⅣ)定义为细颗粒物。细颗粒物所负载耐药菌气溶胶比例(FBT)计算公式如下:
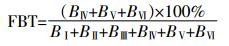 (4)
(4) 式中:BⅠ、BⅡ、BⅢ、BⅣ、BⅤ、BⅥ分别为分布在Stage Ⅰ、Ⅱ、Ⅲ、Ⅳ、Ⅴ、Ⅵ粒径范围内耐药菌气溶胶浓度,CFU·m-3。
1.4 数据统计分析采用SPSS 21.0对数据进行Spearman相关性分析。当P < 0.05时,表明在95%置信区间内具有统计学意义上的差异;当P < 0.01时,表明在99%置信区间内具有统计学意义上的显著差异。运用逐步回归方法,建立鸡舍空气及粪便中与MRSA浓度相关影响因素的回归方程,R趋近于1表明此回归效果较好。
2 结果与讨论 2.1 鸡舍空气中MRSA特点 2.1.1 鸡舍空气中MRSA浓度及比例本研究采集了蛋鸡舍内环境中总细菌(LB)、金黄色葡萄球菌(S)和MRSA气溶胶样本,并进行微生物培养和计数,对比分析上述细菌生物气溶胶浓度和比例随蛋鸡日龄的变化趋势,结果如图 1所示。

|
| 图 1 鸡舍内部空气中MRSA、金黄色葡萄球菌(S)和总细菌(LB)浓度及比值 Figure 1 Concentrations and percentages of MRSA, Staphylococcus aureus(S) and total bacteria(LB) in air of layer house |
由图 1可知,在蛋鸡日龄分别为145、404 d检出舍内环境总细菌气溶胶浓度最低值和最高值,即总细菌气溶胶浓度变化范围在1.9×103~3.8×104 CFU·m-3。整体来看,总细菌气溶胶浓度随日龄增加呈上升趋势。其中,日龄分别为209、270、378 d所检测到的总细菌气溶胶浓度相比临近日龄浓度略有下降,但浓度差异小于1个数量级。本研究中所检测到的总细菌气溶胶浓度略低于莱芜市蛋鸡舍内浓度[21],相比山西地区某牛场(2.1×102~5.26×103 CFU·m-3)和羊场(3.7×102~5.55×103 CFU·m-3)中空气细菌浓度略高[37]。值得关注的是,在较大日龄343 d和404 d所检测到的总细菌浓度高于我国《畜禽场环境质量标准》的细菌浓度界定值(2.5×104 CFU·m-3)。金黄色葡萄球菌浓度的最低和最高值分别在日龄145 d和343 d检出,浓度分别为2.8×102 CFU·m-3和2.19×103 CFU·m-3,整体变化趋势与总细菌相似。该浓度变化范围与山西某牛场和羊场以及山东泰安市某鸡舍内检测到的浓度范围相近[37-38]。其中,在日龄分别为209、270 d和404 d所检测到的金黄色葡萄球菌浓度略有下降。据既往研究,养殖环境中的细菌会负载到细颗粒物(动力学当量直径≤2.5 μm),通过空气途径传播[19]。本研究检测到的金黄色葡萄球菌浓度变化可能是受到鸡舍内细颗粒物浓度变化的影响。在上述3个日龄下检测到的PM2.5浓度较前一日龄相比浓度均有下降,分别为6.93、2.77 μg·m-3和4.23 μg·m-3。MRSA浓度的检测结果显示,整体上,MRSA的平均值为(4.31×102±4.56×102)CFU·m-3,在145~176 d,其浓度随日龄增加有升高趋势。在176~270 d,MRSA浓度由4.7×102 CFU·m-3逐步下降到80 CFU·m-3,310 d浓度上升到最高值1.15×103 CFU·m-3,后逐步下降,404 d检测到最低值70 CFU·m-3。
由图 1可知,与MRSA浓度变化趋势相似,在176~270 d,MRSA/LB由最高值5.47%下降到0.76%,310~343 d,MRSA/LB由1.84%上升到3.22%后逐步下降,404 d检测到最低值0.21%。在所检测的259 d中,MRSA/LB的均值为2.04%±1.72%。该值略低于已有研究对山东两个养鸡场检出具有耐甲氧西林抗性基因的金黄色葡萄球菌比例(4.2%和8.3%)[39]。MRSA/S比值在14%~95%之间,均值为41.99%±26.99%,该比率变化可能受到舍内温度的影响。在MRSA/S最高比例的第310 d,温度检测到最高值为29 ℃,当378 d温度为17 ℃时,检测到MRSA/S的最低值。S/LB变化趋势与MRSA/LB相似,在145 d和404 d检测到最高值与最低值,分别为14.4%和0.66%,均值为4.91%±5.89%。本阶段研究结果表明,MRSA/LB和MRSA/S的比值变化可能受到MRSA浓度及舍内温度的影响。在鸡舍环境中虽检测到金黄色葡萄球菌和MRSA,但二者占总细菌浓度比例较低。而在检测到的金黄色葡萄球菌中具有耐甲氧西林抗性的细菌平均比例高达41.99%,这一结果与以往研究对广东地区饲养场、屠宰场、肉类市场3种空气环境的研究(48.2%)结果相似[40],低于医院环境中的MRSA检出率(55.6%和57.1%)[26, 31]。
2.1.2 细颗粒物表面负载MRSA比例据流行病学研究,长期暴露在细颗粒物(动力学当量直径小于2.5 μm的颗粒)污染的环境中,可增加人和动物的发病率和死亡率[25]。因此,本研究对PM2.5所负载的MRSA浓度及比例进行计算分析,结果如图 2所示。

|
| 图 2 鸡舍空气中PM2.5负载MRSA浓度及比例 Figure 2 Concentrations and percentages of MRSA on fine particles(PM2.5) in air of layer house |
由图 2可知,PM2.5负载的MRSA浓度的变化规律与空气中总的MRSA浓度相似,其浓度范围在26~441 CFU·m-3之间,均值为(151±170)CFU·m-3。其中,PM2.5负载浓度的最高值与最低值检出日龄和MRSA浓度临界值检出日龄相同,分别在343 d和404 d。PM2.5负载MRSA比例变化范围11%~75%,均值为38.13%±20.17%,其中在日龄244、270、343 d和404 d的负载比例均高于40%,该负载比值说明MRSA浓度变化可能会受到细颗粒物浓度变化影响。
2.2 鸡舍粪便中MRSA浓度及比例畜禽粪便被认为是养殖环境中抗性细菌存在的重要来源库,本研究在采集气溶胶样品的同时收集相同日龄的粪便样品,进行涂板计数后计算出相应浓度,并分析鸡舍粪便中总细菌、金黄色葡萄球菌及MRSA随蛋鸡日龄增长的浓度及比例变化。结果如图 3所示。

|
| 图 3 鸡舍内粪便中MRSA、金黄色葡萄球菌(S)和总细菌(LB)浓度及比值 Figure 3 Concentrations and percentages of MRSA, Staphylococcus aureus(S) and total bacteria(LB) in faeces of layers |
如图 3可知,在蛋鸡日龄增加过程中,粪便中细菌浓度虽有小幅度波动,但整体上粪便样品中总细菌、金黄色葡萄球菌以及MRSA的浓度均随日龄增加呈现上升趋势。总细菌浓度的变化范围在3.1×107~4.1×108 CFU·g-1,其最高值及最低值分别在日龄343 d和145 d时检出,其浓度变化趋势与空气中总细菌浓度变化一致,说明粪便可能是鸡舍内空气中细菌主要来源。柳敦江[39]对泰安养鸡场舍内金黄色葡萄球菌的研究也得到了相似结论。259 d的检测结果显示,粪便中金黄色葡萄球菌浓度变化范围在1.6×104~2.3×105 CFU·g-1,其最高值及最低值分别在404 d和176 d检出。其中MRSA浓度的最低值和最高值在同一天检测出,分别为3×103 CFU·g-1和1.31×105 CFU·g-1,其浓度平均值为(3.37×104±4.83×104)CFU·g-1。
与MRSA浓度变化相比,MRSA/LB和MRSA/S比值变化趋势虽波动较大,但二者比例的最高值仍在日龄404 d检出,分别为4.49%和57.75%。MRSA/LB比例变化范围为0.11%~4.49%,其中在日龄244、378、404 d所检测到比值较其他日龄高,该变化趋势与粪便中MRSA浓度变化相符。S/LB比例变化范围为3.72%~51.8%,MRSA/S的比例变化范围在4.375%~57.75%。以上3种比例的均值分别为1.82%±1.81%、13.67%±15.99%、22.11%±20.06%。本研究结果显示,蛋鸡粪便中的MRSA/LB与MRSA/S的比值均低于空气中所检测到的相应浓度比值,该结果可能与MRSA的存活率会受到养殖环境中不同介质影响有关。
2.3 鸡舍空气中MRSA影响因素畜禽养殖环境中细菌气溶胶浓度可能会受到多种不定因素影响,其中包括温度、湿度及各粒径颗粒物浓度。本研究对上述所涉及到的影响因素进行监测,结果如图 4所示。

|
| 图 4 鸡舍内温度、湿度和颗粒物 Figure 4 Temperature, humidity and concentration of particles in air of layer house |
由于样品来源于同一家养鸡场的两栋不同日龄鸡舍,温度受采样时季节变化的影响。由图 4可知,蛋鸡日龄在145~270 d之间时,舍内温度由28 ℃逐步下降到13 ℃;在310~404 d之间时,舍内温度由最高值29 ℃逐步降到最低值12 ℃。在采样期间,温度的均值为(21.9±6.6)℃。湿度的变化范围为33%~71%,与温度变化规律相似,最高值与最低值检出日龄分别在310 d和404 d,均值为53%±14%。PM1浓度变化范围为0.6~18.1 μg·m-3,均值为(6.73±6.19)μg·m-3,最高值与最低值检出日龄在310 d和404 d,变化规律与温度相似。PM2.5浓度变化范围为4.2~36.5 μg·m-3,均值为(16.14±11.59)μg·m-3,临界值检出日龄与PM1相同。整体来看,细颗粒物浓度变化趋势与温度和湿度变化趋势保持一致。PM4浓度变化为9.2~55.6 μg·m-3,均值为(33.6±15.1)μg·m-3。PM7浓度范围为20.3~169.3 μg·m-3,均值为(76.9±38.6)μg·m-3。PM10浓度范围为54.1~332.6 μg·m-3,均值为(130.2±82.7)μg·m-3。总悬浮颗粒物浓度变化范围为111.6 ~919.8 μg·m-3,均值为(292.9±253.5)μg·m-3。其中总悬浮颗粒物与PM10颗粒物浓度均符合我国《畜禽场环境质量标准》。
本研究进一步考察了鸡日龄、温度和各粒径颗粒物浓度对鸡舍内总细菌、金黄色葡萄球菌以及MRSA的影响相关性。分析结果如表 2所示。

|
由表 2可知,空气中总细菌浓度与粪样中总细菌浓度呈显著正相关(P < 0.01),而粪样中总细菌浓度与鸡日龄呈显著正相关(P < 0.01)。因此,空气中总细菌浓度随日龄变化呈现上升趋势,同时说明粪便可能是空气中生物气溶胶的主要来源。空气中MRSA浓度与温度(P < 0.01)、PM1浓度(P < 0.05)、金黄色萄葡球菌浓度(P < 0.01)呈显著正相关,其中PM1浓度与温度(P < 0.05)、PM2.5浓度(P < 0.01)呈显著正相关。该相关性结果表明,温度的变化会引起细颗粒物浓度的变化,从而引起所负载的MRSA浓度变化,导致空气中MRSA、金黄色萄葡球菌随蛋鸡日龄变化过程中所呈现的浓度变化与采样时温度变化相一致。值得注意的是,上述结果未发现空气中MRSA与粪便中MRSA的显著相关性,这可能和鸡场所处地理环境和养殖管理方式有关,也可能由于MRSA除了分布在粪便中还可存在于鸡的羽毛、皮肤和呼吸道中。空气中MRSA/LB比值与空气中MRSA浓度(P < 0.05)呈显著正相关,而S/LB与MRSA/LB(P < 0.05)呈显著正相关,二者比值变化趋势与MRSA浓度变化相类似。粪样中MRSA浓度变化与温度(P < 0.05)为显著负相关,粪样中MRSA/LB与MRSA(P < 0.05)为显著正相关。这可能是因为温度升高,加速粪便中MRSA逸散,空气中MRSA浓度相应升高。这导致了粪样中MRSA和MRSA/LB、MRSA/S比值有异于空气中相应变化。
本研究根据上述相关性分析结果作出初步回归分析,以此得到影响因素与MRSA、金黄色萄葡球菌和总细菌之间的量化关系。分析结果如表 3所示。

|
由表 3可知,当环境中其他变量保持稳定时,鸡舍内温度每升高1 ℃,空气中MRSA浓度平均升高49 CFU·m-3(R2=0.53)。同样条件下,日龄每增加1 d,空气中总细菌浓度平均升高110 CFU·m-3(R2=0.63);粪样中总细菌浓度平均升高1.27×106 CFU·m-3(R2=0.71),MRSA浓度平均升高434 CFU·m-3(R2=0.53),金黄色葡萄球菌浓度平均升高899 CFU·m-3(R2=0.94)。其中,粪样总细菌浓度每升高1 CFU·m-3,空气中总细菌浓度上升8.07×10-5 CFU·m-3(R2=0.77)。
3 结论本研究对蛋鸡场空气和粪便中MRSA、金黄色葡萄球菌和总细菌的浓度进行检测。实验结果表明,当蛋鸡在145~404 d日龄之间时,其舍内空气中总细菌、粪便中总细菌、MRSA和金黄色葡萄球菌浓度与日龄存在显著正相关。鸡舍空气中MRSA浓度随蛋鸡日龄增加而增加,与鸡舍内温度和细颗粒物呈显著正相关。整体上,MRSA/S较S/LB和MRSA/LB比值高,且空气中的MRSA/S比值略高于粪便中相应比值。本研究结果将为养鸡场空气中MRSA对工人以及对环境和居民的危害评估提供基础数据。
| [1] |
Trautmann M, Lepper P, Schmitz F J. Three cases of bacterial meningitis after spinal and epidural anesthesia[J]. European Journal of Clinical Microbiology and Infectious Diseases, 2002, 21(1): 43-45. DOI:10.1007/s10096-001-0643-7 |
| [2] |
Lee J H. Methicillin(oxacillin)-resistant Staphylococcus aureus strains isolated from major food animals and their potential transmission to humans[J]. Applied and Environmental Microbiology, 2003, 69(11): 6489-6494. DOI:10.1128/AEM.69.11.6489-6494.2003 |
| [3] |
朱晓平, 范国雄, 程金科, 等. 鸡葡萄球菌病发病机理的研究[J]. 畜牧兽医学报, 1990, 21(2): 167-173. ZHU Xiao-ping, FAN Guo-xiong, CHENG Jin-ke, et al. Studies on the pathogenesis of Staphylococcus in chickens[J]. Acta Veterinariaet Zoo-technica Sinica, 1990, 21(2): 167-173. |
| [4] |
Lee J H, Jeong J M, Park Y H, et al. Evaluation of the methicillin-resistant Staphylococcus aureus(MRSA):Screen latex agglutination test for detection of MRSA of animal origin[J]. Journal of Clinical Microbiology, 2004, 42(6): 2780-2782. DOI:10.1128/JCM.42.6.2780-2782.2004 |
| [5] |
Weese J S. Methicillin-resistant Staphylococcus aureus in animals[J]. Institute for Laboratory Animal Research, 2010, 51(3): 233-244. DOI:10.1093/ilar.51.3.233 |
| [6] |
Jevons M P. "Celbenin"-resistant Staphylococci[J]. British Medical Journal, 1961, 1(5219): 124-125. |
| [7] |
Grundmann H, Aires-de-Sousa M, Boyce J, et al. Emergence and resurgence of meticillin-resistant Staphylococcus aureus as a public-health threat[J]. The Lancet, 2006, 368(9538): 874-885. DOI:10.1016/S0140-6736(06)68853-3 |
| [8] |
欧阳应斌, 陈宁庆. 耐甲氧西林金黄色葡萄球菌感染研究进展[J]. 国外医学(流行病学传染病学分册), 1989, 2(3): 49-53. OUYANG Ying-bin, CHEN Ning-qing. Progress in research on infection of methicillin-resistant Staphylococcus aureus[J]. International Journal of Epidemiology and Infectious Disease, 1989, 2(3): 49-53. |
| [9] |
Schwartz, David A. Principles and practice of infectious disease[J]. Archives of Pathology & Laboratory Medicine, 1997, 121(8): 908. |
| [10] |
寇芮. 动物源耐甲氧西林金黄色葡萄球菌耐药性分析及分子流行病学研究[D]. 南京: 南京农业大学, 2010: 10-11. KOU Rui. Study on antibiotic resistance analysis and molecular epidemiology of methicillin-resistant Staphylococcus aureus from animals[D]. Nanjing: Nanjing Agriculture University, 2010: 10-11. http://d.wanfangdata.com.cn/Thesis/Y1986480 |
| [11] |
Hiramatsu K, Cui L Z, Kuroda M, et al. The emergence and evolution of methicillin-resistant Staphylococcus aureus[J]. Trends in Microbiology, 2001, 9(10): 486-493. DOI:10.1016/S0966-842X(01)02175-8 |
| [12] |
裴双, 苏建荣. 耐甲氧西林金黄色葡萄球菌耐药性分析及mecA和PVL基因检测[J]. 临床和实验医学杂志, 2017, 16(1): 94-97. PEI Shuang, SU Jian-rong. An analysis on methicillin-resistant Staphylococcus aureus and testing for genes mecA and PVL[J]. Journal of Clinical and Experimental Medicine, 2017, 16(1): 94-97. |
| [13] |
Meemken D, Cuny C, Witte W, et al. Occurrence of MRSA in pigs and in humans involved in pig production:Preliminary results of a study in the Northwest of Germany[J]. Dtsch Tierarztl Wochenschr, 2008, 115(4): 132-139. |
| [14] |
姜慧娇, 苏艳, 韦海娜, 等. 牛乳源耐甲氧西林金黄色葡萄球菌的检测与耐药性分析[J]. 新疆农业大学学报, 2013, 36(1): 16-20. JIANG Hui-jiao, SU Yan, WEI Hai-na, et al. Analysis on dectection of methicillin-resistant Staphylococcus aureus isolated from bovine milk and its resistance to drugs[J]. Journal of Xinjiang Agricultural University, 2013, 36(1): 16-20. |
| [15] |
柴同杰, 黄艳群. 蛋鸡生产中的健康饲养与动物福利[J]. 中国家禽, 2010, 32(22): 41-44. CHAI Tong-jie, HUANG Yan-qun. Healthy feeding and animal welfare of layers production[J]. China Poultry, 2010, 32(22): 41-44. |
| [16] |
Mekouar M A. Food and agriculture organization(FAO)[J]. Yearbook of International Enviromental Law, 2014, 24(1): 587-602. DOI:10.1093/yiel/yvu027 |
| [17] |
高敏, 贾瑞志, 仇天雷, 等. 畜禽养殖中逸散生物气溶胶特征的研究进展[J]. 生态与农村环境学报, 2015, 31(1): 12-21. GAO Min, JIA Rui-zhi, QIU Tian-lei, et al. Progress in research on characteristics of bioaerosol diffused during livestock breeding[J]. Journal of Ecology and Rural Environment, 2015, 31(1): 12-21. DOI:10.11934/j.issn.1673-4831.2015.01.003 |
| [18] |
Fiegel J, Clarke R, Edwards D A. Airborne infectious disease and the suppression of pulmonary bioaerosols[J]. Drug Discov Today, 2006, 11(1/2): 51-57. |
| [19] |
Mceachran A D, Blackwell B R, Hanson J D, et al. Antibiotics, bacteria, and antibiotic resistance genes:Aerial transport from cattle feed yards via particulate matter[J]. Environmental Health Perspectives, 2015, 123(4): 337-343. |
| [20] |
段会勇, 柴同杰, 蔡玉梅, 等. ERIC-PCR对鸡舍大肠杆菌气溶胶向舍外环境传播的鉴定[J]. 中国科学(C辑:生命科学), 2008, 39(1): 74-83. DUAN Hui-yong, CHAI Tong-jie, CAI Yu-mei, et al. Identification of airborne Escherichia coli from hen house spreads to surroundings using ERIC-PCR[J]. Science in China(Series C:Life Sciences), 2008, 39(1): 74-83. |
| [21] |
姚美玲, 张彬, 柴同杰. 鸡兔舍耐药大肠杆菌气溶胶向环境扩散的研究[J]. 西北农林科技大学学报(自然科学版), 2007, 35(8): 60-64. YAO Mei-ling, ZHANG Bin, CHAI Tong-jie. Antibiotic resistance of airborne Escherichia coli from hen house and rabbitry and their spreading to surroundings[J]. Journal of Northwest A&F University(Nat Sci Ed), 2007, 35(8): 60-64. |
| [22] |
Pathare N A, Asogan H, Tejani S, et al. Prevalence of methicillin resistant Staphylococcus aureus[MRSA] colonization or carriage among health-care workers[J]. Journal of Infection and Public Health, 2016, 9(5): 571-576. DOI:10.1016/j.jiph.2015.12.004 |
| [23] |
赵传阳, 李永安, 刘学来. 粉尘PM2.5及其对人体的危害[J]. 制冷与空调, 2013, 119(4): 403-406, 419. ZHAO Chuan-yang, LI Yong-an, LIU Xue-lai. PM2.5 and its impact on the health hazards[J]. Refrigeration and Air Conditioning, 2013, 119(4): 403-406, 419. |
| [24] |
高敏, 仇天雷, 秦玉成, 等. 养鸡场空气中抗性基因和条件致病菌污染特征[J]. 环境科学, 2017, 38(2): 510-516. GAO Min, QIU Tian-lei, QIN Yu-cheng, et al. Sources and pollution characteristics of antibiotic resistance genes and conditional pathogenic bacteria in concentrated poultry feeding operations[J]. Environmental Science, 2017, 38(2): 510-516. |
| [25] |
高敏, 贾瑞志, 仇天雷, 等. 集约化养鸡场舍内细菌气溶胶群落结构研究[J]. 农业环境科学学报, 2015, 34(10): 1985-1990. GAO Min, JIA Rui-zhi, QIU Tian-lei, et al. Bacterial community of bioaerosols in atmospheric environment of confined poultry feeding operations[J]. Journal of Agro-Environment Science, 2015, 34(10): 1985-1990. DOI:10.11654/jaes.2015.10.021 |
| [26] |
李建宁, 曹龙翎. 耐甲氧西林金黄色葡萄球菌院内感染和耐药性分析[J]. 中国社区医师(医学专业), 2012, 14(22): 196-197. LI Jian-ning, CAO Long-ling. Analysis on methicillin-resistant Staphylococcus aureus hospital infection and resistance to drugs[J]. Chinese Community Doctors, 2012, 14(22): 196-197. |
| [27] |
Alt K, Fetsch A, Schroeter A, et al. Factors associated with the occurrence of MRSA CC398 in herds of fattening pigs in Germany[J]. BMC Vet Res, 2011, 37(7): 69. |
| [28] |
刘洋, 梁耀峰, 焦新安, 等. 中国部分地区猪源和牛源金黄色葡萄球菌耐药性及凝固酶分型研究[J]. 中国农业科学, 2012, 45(17): 3608-3616. LIU Yang, LIANG Yao-feng, JIAO Xin-an, et al. Antibiotic resistance and coagulase typing of Staphylococcus aureus isolates from pigs and cows in part of China[J]. Scientia Agricultura Sinica, 2012, 45(17): 3608-3616. |
| [29] |
De Boer E, Zwartkruis-Nahuis J T M, Wit B, et al. Prevalence of methicillin-resistant Staphylococcus aureus in meat[J]. International Journal of Food Microbiology, 2009, 134(1/2): 52-56. |
| [30] |
吴泰顺, 吴礼康, 张勤, 等. 金黄色葡萄球菌医院感染与外环境关系的研究[J]. 华南预防医学, 2004, 34(5): 1-3. WU Tai-shun, WU Li-kang, ZHANG Qin, et al. Research on the correlation between the Staphylococcus aureus nosocomial infection and hospital environment[J]. South China J Prev Med, 2004, 34(5): 1-3. |
| [31] |
陈端, 袁惠, 严其荣, 等. 耐甲氧西林金黄色葡萄球菌的监测(摘要)[J]. 昆明医学院学报, 1993, 14(4): 26. CHEN Duan, YUAN Hui, YAN Qi-rong, et al. Monitor of methicillin-resistant Staphylococcus aureus[J]. Journal of Kunming Medical College, 1993, 14(4): 26. |
| [32] |
刘敬兰, 刘继超, 姜铁民, 等. 北京某牛场奶牛乳房炎金黄色葡萄球菌的分离鉴定与药敏试验[J]. 中国奶牛, 2015, 291(7): 39-42. LIU Jing-lan, LIU Ji-chao, JIANG Tie-min, et al. The survey and analysis of the resistant bacteria from cow mastitis in a dairy farm in Beijing[J]. China Dairy Cattle, 2015, 291(7): 39-42. |
| [33] |
黄仆. 四川地区猪群中耐甲氧西林金黄色葡萄球的分离鉴定和耐药性研究[D]. 成都: 四川农业大学, 2014: 20-24. HUANG Pu. Study on isolation and drug resistance of Staphylococcus aureus from pigs in Sichuan Province[D]. Chengdu: Sichuan Agriculture University, 2014: 20-24. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=J0120491 |
| [34] |
王爱华, 赵德东. 羊血液中携带金黄色葡萄球菌的调查报告[J]. 职业卫生与应急救援, 2004, 22(1): 51. WANG Ai-hua, ZHAO De-dong. Research on Staphylococcus aureus in the blood of sheeps[J]. Occupational Health and Emergency Rescue, 2004, 22(1): 51. |
| [35] |
王林, 梅力, 韦海涛, 等. 北京地区奶牛隐性乳房炎金黄色葡萄球菌的分离鉴定及药敏试验[J]. 动物医学进展, 2015, 36(4): 124-127. WANG Lin, MEI Li, WEI Hai-tao, et al. Isolation, identification and drug sensitivity test of Staphylococcus aureus from dairy cow with subclinical mastitis in Beijing[J]. Progress in Veterinarty Medicine, 2015, 36(4): 124-127. |
| [36] |
邱梅, 郝智慧, 张万江, 等. 动物源金黄色葡萄球菌的分离鉴定及其耐药性分析[J]. 中国农学通报, 2011, 27(7): 356-359. QIU Mei, HAO Zhi-hui, ZHANG Wan-jiang, et al. Isolation and identification of Staphylococcus aureus from animals and drug resistance analysis[J]. Chinese Agricultural Science Bulletin, 2011, 27(7): 356-359. |
| [37] |
熊云梅. 牛、羊场环境中气载需氧菌及金黄色葡萄球菌的检测与散播研究[D]. 晋中: 山西农业大学, 2016: 7-8. XIONG Yun-mei. The detection and spread of airbone aerobic bacteria and Staphylococcus aureus in cattle and sheep farms[D]. Jinzhong: Shanxi Agriculture University, 2016: 7-8. http://cdmd.cnki.com.cn/Article/CDMD-10113-1017021272.htm |
| [38] |
柴同杰, 赵云玲, 刘辉, 等. 鸡舍耐药细菌气溶胶鉴定及某向环境传播的研究[J]. 中国预防兽医学报, 2003, 23(3): 209-214. CHAI Tong-jie, ZHAO Yun-ling, LIU Hui, et al. The resistance against antibiotics of bacteria from a poultry house and their spreading to surroundings of the house[J]. Chinese Journal of Preventive Veterinary Medicine, 2003, 23(3): 209-214. |
| [39] |
柳敦江. 养鸡场舍环境携带耐药基因的金黄色葡萄球菌的气溶胶形成及传播研究[D]. 泰安: 山东农业大学, 2012: 45-46. LIU Dun-jiang. Formation and transmission of the bacterial Staphylococcus aureus carrying antibiotic-resistant genes in a poultry farming environment[D]. Taian: Shandong Agriculture University, 2012: 45-46. http://d.wanfangdata.com.cn/Thesis/Y2117118 |
| [40] |
叶小华. 动物源性耐甲氧西林金黄色葡萄球菌跨宿主感染的风险研究[D]. 广州: 南方医科大学, 2015: 53-54. YE Xiao-hua. Risk of cross-species infection of livestock-associated methicillin-resistant Staphylococcus aureus[D]. Guangzhou: Southern Medical University, 2015: 53-54. http://cdmd.cnki.com.cn/Article/CDMD-12121-1016003089.htm |
 2018, Vol. 37
2018, Vol. 37