文章信息
- 仇祯, 周欣彤, 韩卉, 张秋卓
- QIU Zhen, ZHOU Xin-tong, HAN Hui, ZHANG Qiu-zhuo
- 互花米草生物炭的理化特性及其对镉的吸附效应
- Properties of Spartina alterniflora Loisel. derived-biochar and its effect on cadmium adsorption
- 农业环境科学学报, 2018, 37(1): 172-178
- Journal of Agro-Environment Science, 2018, 37(1): 172-178
- http://dx.doi.org/10.11654/jaes.2017-0810
文章历史
- 收稿日期: 2017-06-07
- 录用日期: 2017-08-23
近年来,利用农作物残体、畜禽粪便等生物质废弃物制备生物炭已获得国内外学者的广泛关注[1]。同时,因生物炭含碳量高、孔隙丰富、吸附能力强,目前已被应用于吸湿剂、土壤改良剂、除味剂、重金属吸附稳定剂等诸多领域[2]。不同热解温度制备生物炭的表面性质和空隙结构等性质存在很大差异,而这些性质是影响其吸附性能的控制因素[3]。
在重金属吸附方面,研究表明,生物炭对土壤镉污染吸附颇有成效。Komkiene等[4]发现,通过苏格兰松和银桦制备的生物炭能有效降低重金属镉的浓度。高译丹等[5]通过室内培养试验,发现土壤添加生物炭后,可显著降低土壤可交换态镉比例,增加碳酸盐结合态、铁锰氧化物结合态、有机结合态和残渣态镉比例,从而降低土壤重金属的生物有效性。Li等[6]比较了玉米秸秆生物炭和硬木生物炭对土壤中镉稳定性的影响,3年盆栽实验表明,硬木生物炭使土壤镉浓度和吸收量先降后升,而秸秆生物炭施加则使土壤中镉浓度逐年下降。
互花米草(Spartina alterniflora Loisel.)原产北美东岸,是当地盐沼优势种[7]。由于适应性强,并具有很强的促泥沙沉降功能,互花米草被引入到许多河口湾和海湾的潮间带[8-10]。上海市崇明东滩是国际重要湿地(编号1144),也是中国生物多样性的关键地区之一[11]。由于自然传播和人为种植,互花米草在崇明东滩快速扩散,正在大量竞争取代潮间带的优势植物--海三棱藨草,对东滩造成严重入侵[12]。利用东滩泛滥的互花米草制备生物炭,不仅可以作为废弃资源的出路,有助于控制崇明互花米草入侵现状,而且制备的生物炭可应用于重金属镉的修复,对土壤重金属污染修复具有重要意义。
本研究对采自崇明东滩的互花米草进行热解特性分析,并通过元素组成、孔径分布特征、吸附率等指标,研究不同热解温度对互花米草生物炭吸附镉性能的影响。此外,在最优热解温度下,通过吸附动力学拟合、扫描电镜、红外光谱分析等手段,探索互花米草生物炭对镉的吸附机制。
1 材料与方法 1.1 互花米草原料的采集与热重分析生物炭原材料为互花米草(Spartina alterniflora Loisel.),禾本科米草属,多年生湿生草本植物。本试验互花米草于2017年3月采自崇明东滩北八滧水闸滩涂处。将互花米草带回实验室,剔除砂砾、石子、尘土等杂物后,用去离子水仔细清洗后切割至2~3 cm。洗净的样品放入烘箱中65 ℃烘干48 h,经研磨式粉碎机磨粉,过100目孔径筛后密封备用。
采用TGA热重分析仪(Pyris 1 TGA,美国)测定样品热重曲线,微商热重曲线由热重数据进行处理绘制[13]。
1.2 互花米草生物炭的制备与表征称取一定质量样品于瓷坩埚中,放入真空管式高温烧结炉(GSL-1600X,中国),分别保持350、400、450、500、550 ℃和600 ℃炭化2 h,自然冷却至室温后取出称重。升温前充入炉腔2倍体积的氮气,加热过程中以1 L·min-1速度充入氮气,以持续保持炉内氮气体积来营造缺氧限氧条件。真空管式高温烧结炉升温速率设置为10 ℃·min-1。
制得不同热解温度生物炭后,分别对其进行表征:采用元素分析仪(VARIO MICRO CUBE,德国)测定生物炭中C、H、N元素含量;pH测定:0.5 g生物炭放入10 mL去离子水中,振荡30 min,静置10 min,pH计测定悬浮液pH值[14];采用比表面积及孔隙测定仪(ASAP2020,美国)测定生物炭比表面积和孔径;生物炭产率和灰分参照文献[15]测定。
1.3 互花米草生物炭对镉的吸附作用研究在350、400、450、500、550、600 ℃ 6种热解温度下,分别取0.5 g制备的生物炭样品于1000 mL烧杯中,添加500 mL Cd2+溶液,背景电解质NaNO3的浓度为0.01 mol·L-1。吸附反应于磁力搅拌器上25 ℃恒温搅拌完成。用一次性无菌注射器取样后过0.45 μm微孔滤膜,利用火焰原子吸收光谱仪(ContrAA 700,德国)测定滤液中Cd2+质量浓度(mg·L-1)[16]。设3个平行处理,并重复2次。
吸附率试验及动力学吸附试验中Cd2+溶液浓度为2.0 mg·L-1,自加入时刻起4 h内每隔15 min取样,4 h后每隔2 h取样,吸附反应总时长为24 h。
等温吸附试验初始浓度分别为0.5、1.0、2.0、4.0、8.0 mg·L-1,吸附反应24 h后取样。
Cd2+的平衡吸附量(q)、吸附率(R)及等温吸附模型方程式由以下公式计算:
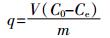 (1)
(1) 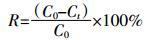 (2)
(2) Langmuir等温吸附模型:
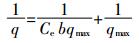 (3)
(3) Freundlich等温吸附模型:
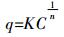 (4)
(4) 式中:C0、Ce和Ct分别为Cd2+的初始浓度、平衡浓度和t时刻浓度,mg·L-1;V为Cd2+溶液体积,L;q和qmax分别为平衡吸附量和最大吸附量,mg·g-1;b是Langmuir常数,表示吸附强度;K是Freundlich吸附系数,表示吸附容量,mg·g-1;n是Freundlich常数,表示吸附强度。
1.4 最优热解温度下互花米草生物炭的吸附性能研究 1.4.1 互花米草生物炭对镉的吸附动力学实验选择吸附性能较为良好的互花米草生物炭,对其Cd2+吸附量随时间的变化进行一级和二级动力学方程拟合[17]:
一级动力学方程:
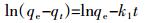 (5)
(5) 二级动力学方程:
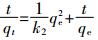 (6)
(6) 式中:qt和qe分别是t时刻的吸附量和平衡时的吸附量,mg·g-1;t为时间,min;k1为一级吸附速率系数,min-1;k2为二级吸附速率系数,g·mg-1·min-1。
1.4.2 互花米草生物炭的形貌与结构表征利用扫描电子显微镜(Hitachi S-4800,日本)对镉吸附前后生物炭的形貌进行表征;利用傅里叶变换红外光谱仪(Nicolet iS5,美国)定性分析生物炭吸附镉前后表面官能团的变化情况。
1.5 数据统计分析所有实验均重复3次,以平均值作为测定结果。用Microsoft Excel 2016软件进行数据处理与分析,用Origin 9.1软件绘图。
2 结果与分析 2.1 互花米草热重分析互花米草的热重曲线如图 1所示。由图 1可知,互花米草的热解过程可以分为三个阶段:失水阶段(0~200 ℃)、热解阶段(200~400 ℃)、炭化阶段(>400 ℃)。其中炭化阶段生物炭表面官能团数量减少,残留下来的表面官能团多为芳环共轭稳定结构,炭的芳香度提高[18]。500 ℃以后,生物炭基本稳定。

|
| 图 1 互花米草的热重曲线 Figure 1 TG/DTG curves of Spartina alterniflora Loisel. |
在热解阶段,互花米草质量损失率为65%以上,在324 ℃处出现最大质量损失峰。林珈羽等[19]对麦秆、稻秆和松木屑进行了热重分析,发现DTG曲线中三者最大峰值对应的温度分别是310、320、360 ℃。由此可见,麦秆、稻秆的热稳定性与互花米草相差不大,但都略低于松木屑。这可能与麦秆、稻秆、互花米草属禾本科,松木屑属木本科有关[20]。此外,互花米草纤维素、半纤维素以及木质素起始热解温度分别在200、294、394 ℃左右[21]。
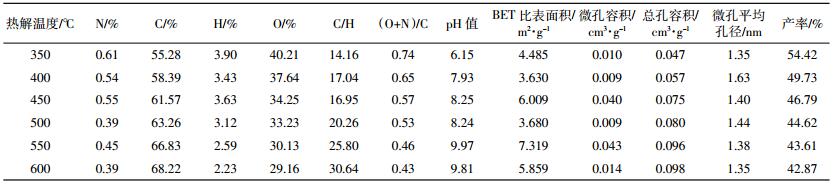
2.2 互花米草生物炭的基本性质不同热解温度下互花米草生物炭的基本性质如表 1所示。350~600 ℃,C含量提高25.51%,O和H含量分别减少了11.5%和6.13%,这是由于原料中纤维素、半纤维素和木质素在热解过程中发生脱水、脱羧基等反应,失去大量的O和H元素。C/H和(O+N)/C可分别用于描述生物炭的芳香性和极性[22]。随温度变化,本研究生物炭的C/H增大,(O+N)/C减小。生物炭pH值随热解温度的升高而增大,与酸性基团变化趋势一致[23]。同时,生物炭产率随着热解温度的升高不断下降,其中350~450 ℃产率下降明显,这是由于互花米草的主要成分纤维素、半纤维素等物质大多在低温阶段分解。
国际纯粹与应用化学联合会(IUPAC)把吸附剂的孔径按照大小分为三类:微孔(D < 2 nm)、中孔(2 nm < D < 50 nm)和大孔(D>50 nm)[24]。如表 1所示,BET比表面积与微孔容积存在一致性,热解温度为450 ℃和550 ℃下制备互花米草生物炭具有较大BET比表面积和微孔容积。随着温度的升高,微孔壁可能会发生一定程度坍塌,生物炭中支链碳原子结构断裂,微孔扩展成中孔,使得微孔平均孔径略微减小,但增加了总孔体积[20, 25]。由不同热解温度制备互花米草生物炭的BET比表面积和孔径表现可见,450 ℃制备的生物炭具备较强的吸附潜力。
2.3 互花米草生物炭对镉的吸附作用图 2为不同温度互花米草生物炭对Cd2+吸附率。不同热解温度的生物炭对镉吸附效果存在较大差异。在吸附实验初始40 min,350、400、600 ℃热解温度下的吸附速率大,450 ℃次之,500、550 ℃相对较弱。24 h后吸附相对平衡,350、400、450 ℃吸附率高,550 ℃次之,500、600 ℃吸附效果差。350、400 ℃吸附较快且吸附平衡量大,可能是因为350、400 ℃制备生物炭比表面积、微孔容积小,但含氧官能团丰富,因此40 min内吸附速率大[23];600 ℃吸附快,可能与所制备的生物炭pH较高有关。生物炭表面负电荷增加,H+减少,H+与Cd2+之间竞争作用减弱,生物炭与Cd2+静电作用增强,因此短时吸附量大[26],但吸附量极低可能与含氧官能团贫乏有关;450 ℃吸附相对稳定,500 ℃吸附效果不理想。
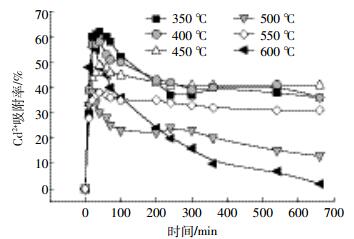
|
| 图 2 不同热解温度下生物炭对Cd2+的吸附率 Figure 2 Adsorption rate of Cd2+ on biochar produced at different temperatures |
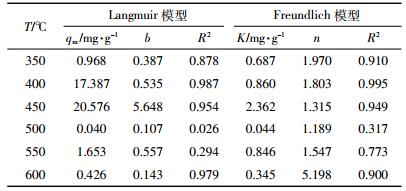
表 2为不同热解温度互花米草生物炭吸附镉的Langmuir模型和Freundlich模型的相关参数,可见350、400、450 ℃互花米草生物炭对Cd2+的吸附均能较好地用Langmuir和Freundlich方程拟合,以表面吸附为主。qmax是吸附性能的重要指标,不同热解温度互花米草对应qmax趋势与镉吸附率一致。与其他原材料生物质对比发现,400、450 ℃互花米草生物炭最大吸附量明显高于棉花秸秆生物炭[16]、小麦秸秆生物炭[26]、板栗皮[27]、杏仁壳[28]等材料对镉的的吸附量,且具有较大吸附强度和吸附容量。
结合生物炭本身稳定性及基本性质分析结果,本文认为450 ℃为制备互花米草生物炭的最优热解温度,因而,进一步分析了最优热解温度下的生物炭吸附性能。
2.4 最优热解温度下互花米草生物炭的吸附性能图 3为450 ℃制备互花米草生物炭对Cd2+的吸附动力学方程拟合结果,其中一级动力学曲线的R2为0.984 3,二级动力学曲线的R2为0.999 7。由式(1)及式(2)分别计算得到一级动力学和二级动力学速率常数值k1和k2,分别为0.009 min-1和0.287 9 g· mg-1·min-1。
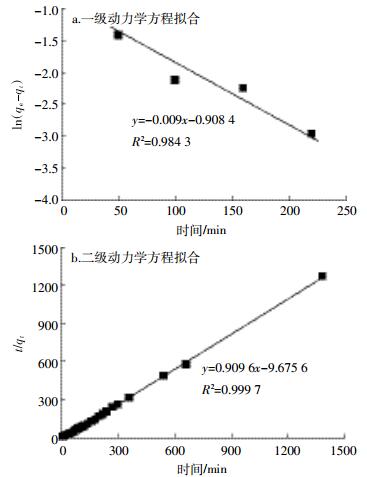
|
| 图 3 生物炭对Cd2+的吸附动力学方程拟合 Figure 3 Kinetics of biochar adsorption on Cd2+ |
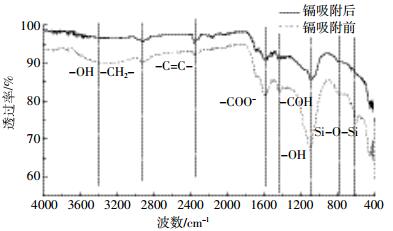
|
| 图 4 生物炭吸附Cd2+前后的红外光谱图 Figure 4 FTIR spectra of biochar before and after adsorption of Cd2+ |
由此可见,在最优热解温度下制备的互花米草生物炭对Cd2+的吸附更符合二级动力学方程,表明此吸附过程以化学吸附为主。这与Tay等[29]和Rao等[30]的结果相一致。
对比最优热解温度下制备生物炭对镉吸附前后的红外光谱图发现:镉吸附后,波数为3400 cm-1附近的宽峰为羟基(-OH)的伸缩振动,波数为1435 cm-1的醇(-COH)面内弯曲移动到1459 cm-1,波数为1103 cm-1的-OH伸缩移动到1098 cm-1,并且波峰减弱[31]。2925 cm-1和2854 cm-1为亚甲基(-CH2-)的伸缩振动,吸附后吸收峰均减弱甚至消失,说明吸附过程中其表面的长链饱和烷烃断裂,-CH2-发挥了作用[32]。1595 cm-1处代表反对称的-COO-或者芳香C=C键存在。在波数为799、781 cm-1处的吸收峰为无机矿物Si-O-Si振动峰[31]。因此,生物炭在吸附过程中,Cd2+与生物炭表面的某些基团,特别是羧基、羟基发生了一定的化学作用。
对镉吸附前后的生物炭进行SEM形貌表征,如图 5所示。可以发现,吸附前生物炭表面较为光滑,聚集物少且存在较多孔隙;吸附后的生物炭表面及孔径内部有明显的粒状凸起,说明发生表层吸附[27]。
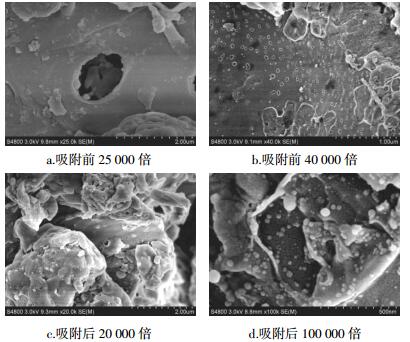
|
| 图 5 生物炭的SEM形貌表征 Figure 5 SEM morphology of biochar |
热解温度是影响生物炭炭化的主要因素。由热重曲线可见,互花米草中木质素自394 ℃起发生脱水反应,部分羟基、羰基等官能团发生化学键断裂过程,生成小分子化合物,或发生如环化、芳构化等热缩聚反应,进一步形成多环芳香化结构[18]。生物炭的芳香性增大,稳定性提高;而极性相应减小,含氧官能团分解和损失[33],这与Cantrell等[34]的研究一致。因此,随着热解温度的升高,生物炭芳香性、pH上升,极性、产率下降,官能团种类减少。
BET比表面积和孔径是表征生物炭吸附性能的重要指标[35]。结合图 2、表 2总体来看,试验初始20 min内生物炭对Cd2+的吸附量随着时间增加尤其明显,吸附速率与微孔平均孔径呈一定正相关。40 min后,吸附达到一定程度的平衡,吸附速率明显减小,甚至出现吸附量下降的情况,这可能是由于Cd2+在吸附开始时只是附着于生物炭外表面且未发生较为稳固的结合,使得Cd2+易从生物炭外表面脱落重新回到溶液中。这类吸附属物理吸附,较不稳定[16]。随着吸附的进行,Cd2+逐渐由外表面进入大孔,再由过渡孔深入到微孔中,重金属在内孔中传质速度逐渐减慢,吸附速率下降[36]。吸附实验开始1 d后,吸附量相对稳定。相比而言,BET比表面积、微孔容积对最终镉吸附量影响更大。微孔容积越大,吸附量越大,可能是因为对镉的吸附主要是表层吸附,与总孔容积关系不大[27]。
热解温度通过改变生物炭理化性质影响其吸附性能。BET比表面积和微孔容积提高,吸附性能提高。因此,随着热解温度的升高,生物炭的吸附性能先提升后下降。
3.2 互花米草生物炭吸附镉的机理探索动力学拟合结果显示,互花米草对镉的吸附类型属于化学吸附。红外扫描结果显示,羟基和羧基对镉吸附发挥主要作用。Yang等[37]将生物炭运用于土壤中FeCl3、AlCl3等的吸附,经SEM分析同样发现生物炭表面及孔结构内部有粒状物质存在;进一步经仪器测定分析,发现粒状凸起中包括Fe8O8(OH)8C11.35和AlCl3·6H2O结构的存在。由此推测,本实验中生物炭表面及孔结构内部存在的表面凸起可能是Cd2+复合体。
4 结论(1)热解温度可明显改变互花米草生物炭理化性质。随着热解温度的升高,生物炭芳香性、pH上升,极性、产率下降,官能团种类减少。
(2)不同热解温度通过改变生物炭理化性质及表面孔隙,进而影响其对镉吸附性能。
(3)本试验在450 ℃时制备互花米草生物炭对镉的吸附效果最佳,反应过程满足二级动力学方程。羟基及羧基对生物炭吸附镉发挥主要作用。镉在生物炭表面发生表层吸附,且有可能形成Cd2+复合体。
| [1] |
Hale S E, Lehmann J, Rutherford D, et al. Quantifying the total and bioavailable polycyclic aromatic hydrocarbons and dioxins in biochars[J]. Environmental Science & Technology, 2017, 46(5): 2830-2838. |
| [2] |
Lu X, Romero-Vargas C S, Shaffer D L, et al. In situ surface chemical modification of thin-film composite forward osmosis membranes for enhanced organic fouling resistance[J]. Environmental Science & Technology, 2017, 47(21): 12219-12228. |
| [3] |
Xin H, Ding Z H, Zimmerman A R, et al. Batch and column sorption of arsenic onto iron-impregnated biochar synthesized through hydrolysis[J]. Water Research, 2015, 68: 206-216. DOI:10.1016/j.watres.2014.10.009 |
| [4] |
Komkiene J, Baltrenaite E. Biochar as adsorbent for removal of heavy metal ions[Cadmium(Ⅱ), Copper(Ⅱ), Lead(Ⅱ), Zinc(Ⅱ)] from aqueous phase[J]. International Journal of Environmental Science & Technology, 2016, 13(2): 471-482. |
| [5] |
高译丹, 梁成华, 裴中健, 等. 施用生物炭和石灰对土壤镉形态转化的影响[J]. 水土保持学报, 2014, 28(2): 258-261. GAO Yi-dan, LIANG Cheng-hua, PEI Zhong-jian, et al. Effects of biochar and lime on the fraction transform of cadmium in contaminated soil[J]. Journal of Soil and Water Conservation, 2014, 28(2): 258-261. |
| [6] |
Li H Y, Ye X X, Geng Z G, et al. The influence of biochar species on long-term stabilization for Cd and Cu in contaminated paddy soils[J]. Journal of Hazardous Materials, 2015, 304: 40-48. |
| [7] |
陈正勇, 刘金娥. 互花米草与江苏海滨土著植物相对竞争力研究[D]. 南京: 南京师范大学, 2011: 7-17. CHEN Zheng-yong, LIU Jin-e. Study on the relative competitiveness of Spartina alterniflora and Jiangsu coastal aboriginal plants[D]. Nanjing: Nanjing Normal University, 2011: 7-17. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1922024 |
| [8] |
段琳琳. 互花米草与两种本地红树植物竞争的生理生态机理研究[D]. 桂林: 广西师范大学, 2015: 3-6. DUAN Lin-lin. Physiological and ecological mechanism of Spartina alterniflora competition with two kinds of native mangrove plants[D]. Guilin: Guangxi Normal University, 2015: 3-6. http://d.wanfangdata.com.cn/Thesis_Y2846308.aspx |
| [9] |
胡忠健, 马强, 曹浩冰, 等. 长江口滨海湿地原生海三棱藨草种群恢复的实验研究[J]. 生态科学, 2016, 35(5): 1-7. HU Zhong-jian, MA Qiang, CAO Hao-bing, et al. A trial study on revegetation of the native Scirpus mariqueter population in the coastal wetland of the Yangtze Estuary[J]. Ecological Science, 2016, 35(5): 1-7. |
| [10] |
Lonard R I, Judd F W, Stalter R. The biological flora of coastal dunes and wetlands:Spartina patens(W. Aiton) G. H. Muhlenberg[J]. Journal of Coastal Research, 2017, 26(5): 935-946. |
| [11] |
Yang W, Qiao Y J, Li N, et al. Seawall construction alters soil carbon and nitrogen dynamics and soil microbial biomass in an invasive Spartina alterniflora, salt marsh in eastern China[J]. Applied Soil Ecology, 2017, 110: 1-11. DOI:10.1016/j.apsoil.2016.11.007 |
| [12] |
陈中义, 付萃长, 王海毅, 等. 互花米草入侵东滩盐沼对大型底栖无脊椎动物群落的影响[J]. 湿地科学, 2005, 3(1): 1-7. CHEN Zhong-yi, FU Cui-chang, WANG Hai-yi, et al. Effects of Spartina alterniflora invasions on the benthic macro-onvertebrates community at Dongtan of Chongming Salt Marsh, the Yangtze River Estuary[J]. Wetland Science, 2005, 3(1): 1-7. |
| [13] |
Datta S, Antos J, Stocek R. Characterisation of ground tyre rubber by using combination of FT-IR numerical parameter and DTG analysis to determine the composition of ternary rubber blend[J]. Polymer Testing, 2017, 59: 308-315. DOI:10.1016/j.polymertesting.2017.02.019 |
| [14] |
孟梁, 侯静文, 郭琳, 等. 芦苇生物炭制备及其对Cu2+的吸附动力学[J]. 实验室研究与探索, 2015, 34(1): 5-8. MENG Liang, HOU Jing-wen, GUO Lin, et al. Preparation of reed derived-biochar and its adsorption kinetic of Cu2+[J]. Research and Exploration in Laboratory, 2015, 34(1): 5-8. |
| [15] |
简敏菲, 高凯芳, 余厚平. 不同裂解温度对水稻秸秆制备生物炭及其特性的影响[J]. 环境科学学报, 2016, 36(5): 1648-1654. JIAN Min-fei, GAO Kai-fang, YU Hou-ping. Effects of different pyrolysis temperatures on the preparation and characteristics of bio-char from rice straw[J]. Acta Scientiae Circumstantiae, 2016, 36(5): 1648-1654. |
| [16] |
郭文娟, 梁学峰, 林大松, 等. 土壤重金属钝化修复剂生物炭对镉的吸附特性研究[J]. 环境科学, 2013, 34(9): 3716-3721. GUO Wen-juan, LIANG Xue-feng, LIN Da-song, et al. Adsorption of Cd2+ on biochar from aqueous solution[J]. Environmental Science, 2013, 34(9): 3716-3721. |
| [17] |
Tu Y J, You C F, Chang C K. Kinetics and thermodynamics of adsorption for Cd on green manufactured nano-particles[J]. Journal of Hazardous Materials, 2012, 235(2): 116-122. |
| [18] |
Brewer C E, Schmidt-Rohr K, Satrio J A, et al. Characterization of biochar from fast pyrolysis and gasification systems[J]. Environmental Progress & Sustainable Energy, 2009, 28(3): 386-396. |
| [19] |
林珈羽, 张越, 刘沅, 等. 不同原料和炭化温度下制备的生物炭结构及性质[J]. 环境工程学报, 2016, 10(6): 3200-3206. LIN Jia-yu, ZHANG Yue, LIU Yuan, et al. Structure and properties of biochar under different materials and carbonization temperatures[J]. Chinese Journal of Environmental Engineering, 2016, 10(6): 3200-3206. DOI:10.12030/j.cjee.201501107 |
| [20] |
Liu W J, Jiang H, Yu H Q. Development of biochar-based functional materials:Toward a sustainable platform carbon material[J]. Chemical Reviews, 2015, 115(22): 12251-12285. DOI:10.1021/acs.chemrev.5b00195 |
| [21] |
Yoder J, Galinato S, Granatstein D, et al. Economic tradeoff between biochar and bio-oil production via pyrolysis[J]. Biomass and Bioenergy, 2011, 35(5): 1851-1862. DOI:10.1016/j.biombioe.2011.01.026 |
| [22] |
黄华, 王雅雄, 唐景春, 等. 不同烧制温度下玉米秸秆生物炭的性质及对萘的吸附性能[J]. 环境科学, 2014, 35(5): 1884-1890. HUANG Hua, WANG Ya-xiong, TANG Jing-chun, et al. Properties of maize stalk biochar produced under different pyrolysis temperatures and its sorption capability to naphthalene[J]. Environmental Science, 2014, 35(5): 1884-1890. |
| [23] |
席志楠, 李增波, 王聪颖, 等. 磁性生物质炭对水体中芘的去除效果研究[J]. 农业环境科学学报, 2017, 36(1): 176-182. XI Zhi-nan, LI Zeng-bo, WANG Cong-ying, et al. The removal effect of magnetic biochar on pyrene in aqueous phase[J]. Journal of Agro-Environment Science, 2017, 36(1): 176-182. DOI:10.11654/jaes.2016-0922 |
| [24] |
Deng H, Li G X, Yang H B, et al. Preparation of activated carbons from cotton stalk by microwave assisted KOH and K2CO3, activation[J]. Chemical Engineering Journal, 2010, 163(3): 373-381. DOI:10.1016/j.cej.2010.08.019 |
| [25] |
Bruun E W, Ambus P, Egsgaard H, et al. Effects of slow and fast pymlysis biochar on soil C and N tumover dynamics[J]. Soil Biology and Biochemistry, 2012, 46(1): 73-79. |
| [26] |
马锋锋, 赵保卫, 刁静茹, 等. 牛粪生物炭对水中氨氮的吸附特性[J]. 环境科学, 2015, 36(5): 1678-1685. MA Feng-feng, ZHAO Bao-wei, DIAO Jing-ru, et al. Ammonium adsorption characteristics in aqueous solution by dairy manure biochar[J]. Environmental Science, 2015, 36(5): 1678-1685. |
| [27] |
丁洋, 靖德兵, 周连碧, 等. 板栗内皮对水溶液中镉的吸附研究[J]. 环境科学学报, 2011, 31(9): 1933-1941. DING Yang, JING De-bing, ZHOU Lian-bi, et al. The adsorption of aquatic cadmium(Ⅱ) by chestnut inner shell[J]. Acta Scientiae Circumstantiae, 2011, 31(9): 1933-1941. |
| [28] |
Mehrasbi M R, Farahmandkia Z, Taghibeigloo B, et al. Adsorption of lead and cadmium from aqueous solution by using almond shells[J]. Water, Air, & Soil Pollution, 2009, 199(1/2/3/4): 343-351. |
| [29] |
Tay T, Candan M, Erdem M, et al. Biosorption of cadmium ions from aqueous solution onto non-living lichen Ramalina fraxinea biomass[J]. Cleaned:Soil, Air, Water, 2009, 37(3): 249-255. DOI:10.1002/clen.v37:3 |
| [30] |
Rao K S, Anand S, Venkateswarlu P. Adsorption of cadmium(Ⅱ) ions from aqueous solution by Tectona grandis L.F.(teak leaves powder)[J]. Bio Resources, 2010, 5(1): 438-454. |
| [31] |
翁诗甫. 傅里叶变换红外光谱分析[M]. 2版. 北京: 化学工业出版社, 2010, 377-388. WENG Shi-fu. Fourier translation infrared spectroscopy[M]. Second Edition. Beijing: Chemical Industry Press, 2010, 377-388. |
| [32] |
潘丽萍. 生物质炭对镉-阿特拉津复合污染土壤的修复研究[D]. 南宁: 广西大学, 2014: 35-40. PAN Li-ping. Study on remediation of cadmium and atrazine combined pollution soil by biochars[D]. Nanning: Guangxi University, 2014: 35-40. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=D524673 |
| [33] |
杨兴, 黄化刚, 王玲, 等. 烟秆生物质炭热解温度优化及理化性质分析[J]. 浙江大学学报(农业与生命科学版), 2016, 42(2): 245-255. YANG Xing, HUANG Hua-guang, WANG Ling, et al. Pyrolysis temperature optimization of biochar from tobacco stalk and its physicochemical characterization[J]. Journal of Zhejiang University(Agriculture & Life Sciences), 2016, 42(2): 245-255. DOI:10.3785/j.issn.1008-9209.2015.09.101 |
| [34] |
Cantrell K B, Hunt P G, Uchimiya M, et al. Impact of pyrolysis temperature and manure source on physicochemical characteristics of biochar[J]. Bioresource Technology, 2012, 107(2): 419-428. |
| [35] |
Feng Y, Zhang S H, Wu J, et al. Biochar modified by amine improving its adsorption of SO2[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 32(12): 195-200. |
| [36] |
任爱玲, 王启山, 郭斌. 污泥活性炭的结构特征及表面分形分析[J]. 化学学报, 2006, 64(10): 1068-1072. REN Ai-ling, WANG Qi-shan, GUO Bin. Structure characterization and surface fractal analysis of sludge activated carbon[J]. Acta Chimica Sinica, 2006, 64(10): 1068-1072. DOI:10.3321/j.issn:0567-7351.2006.10.017 |
| [37] |
Yang F, Zhao L, Gao B, et al. The interfacial behavior between biochar and soil minerals and its effect on biochar stability[J]. Environmental Science & Technology, 2016, 50(5): 2264-2271. |
 2018, Vol. 37
2018, Vol. 37