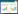文章信息
- 蒋梦蝶, 何志龙, 孙赟, 周维, 胡荣桂, 林杉
- JIANG Meng-die, HE Zhi-long, SUN Yun, ZHOU Wei, HU Rong-gui, LIN Shan
- 尿素和生物质炭对茶园土壤pH值及CO2和CH4排放的影响
- The effect of wheat-straw derived biochar on the soil pH and emissions of CO2 and CH4 from tea garden soil
- 农业环境科学学报, 2018, 37(1): 196-204
- Journal of Agro-Environment Science, 2018, 37(1): 196-204
- http://dx.doi.org/10.11654/jaes.2017-0876
文章历史
- 收稿日期: 2017-06-20
- 录用日期: 2017-08-14
2. 华中农业大学环境生态中心, 武汉 430070
2. Ecological Environment Center, Huazhong Agricultural University, Wuhan 430070, China
茶树是我国重要的经济作物,我国茶树的种植面积和茶叶产量均居世界首位[1]。截止到2012年,我国茶园种植总面积已突破200万hm2,茶叶产量接近200万t,并仍保持着较高的增长速率。茶树属多年生草本植物,由于茶农对茶叶产量和品质的追求,会定期施加大量肥料。茶园的特殊管理模式,肥料的大量施用,使得茶园成为一个有别于其他农业系统的特殊的生态系统。茶树起源于西南地区,对生长环境有着特殊的要求,具有喜酸怕碱的生长习性,土壤pH值在4~6.5之间茶树才能正常生长。由于茶树的聚铝性加上肥料的大量使用,茶园土壤逐渐酸化,有些酸化严重的地区土壤pH值甚至达到4以下,严重制约了茶树的生长。据调查,重庆市80%以上的茶园地区土壤pH处于非最佳范围内,福建茶园土壤pH值小于4的占到30%左右,而江西省茶园土壤pH值均在4.5以下[2],其他省份茶园土壤酸化情况也十分严重,已经到了严重制约我国茶产业发展的地步。
生物质炭是有机物料在限氧条件下经高温热解产生的一种富碳难溶性固态有机物质[3]。其作为土壤改良剂和固碳物质受到科技工作者的广泛关注[4]。生物质炭中的灰化碱等碱性物质可提高土壤pH值,一定程度上起到缓解土壤酸化作用,另外,生物质炭对增强土壤肥力、减缓农业面源污染也具有积极作用[5-6]。我国是秸秆生产大国,农业部数据显示我国秸秆年产生量已达9亿t,其中小麦秸秆是我国常见的一种生物质材料,把小麦秸秆制成生物质炭施加到土壤中可缓解土壤酸化问题并有效利用生物质材料。以往研究关于向土壤中添加生物质炭后对土壤温室气体排放的影响至今尚无定论,增加或减少某一种或多种温室气体排放或无影响[7-8]。而以往的研究多为单一因素对茶园土的影响,对肥料与生物质炭等的复合作用效果仍然不清楚。因此,本试验以湖北咸宁地区植茶年限为50年的茶园土壤为研究材料,在施氮和不施氮的情况下,探讨添加不同比例的生物质炭对茶园土壤改良和温室气体排放的影响,以期为试验土壤采集地确定合适的生物质炭添加比例,为酸化茶园土壤改良和固碳减排提供理论依据。
1 材料与方法 1.1 供试土壤和生物质炭供试土壤取自湖北省咸宁市(29°02′~30°18′N,133°31′~144°58′E)贺胜桥镇,植茶年限50年左右的茶园。当地多年平均气温16.8 ℃,多年平均降水量1 577.4 mm,气候温和,降水充沛,属于中亚热带向北亚热带过渡的气候区。采集茶园0~20 cm表层土壤,剔除根系有机残体和石子后带回实验室,同时取环刀土测量容重。取部分鲜土样用于测定土壤铵态氮和硝态氮等指标,其余土样风干后磨细过2 mm筛,用于室内培养试验。供试土壤基本理化性质:全碳24.20 g·kg-1,总氮1.37 g·kg-1,容重1.31 g·cm-3,pH 4.44。
生物质炭由小麦秸秆在缺氧环境中600 ℃热裂解2 h制备而成,过2 mm筛。生物质炭基本理化性质:有机碳415.27 g·kg-1,总氮11.80 g·kg-1,pH 8.63。
1.2 实验设计室内培养试验于2016年3-4月进行。通过添加生物质炭和尿素来研究生物质炭和氮肥对茶园土壤pH值、CO2和CH4排放的影响。试验共设置施氮(N1,150 mg N·kg-1干土)和不施氮(N0)2个施氮水平;生物质炭设不施、低、中和高4个水平(记为B0、B1、B2、B3),分别为0、10、30、50 g·kg-1,分别相当于田间施用量的0、22.5、67.5、112.5 t·hm-2。共组成8个处理,分别为:氮肥和生物质炭均不施的对照(CK)、不施氮低生物质炭(N0B1)、不施氮中生物质炭(N0B2)、不施氮高生物质炭(N0B3)、施氮不施生物质炭(NB0)、施氮低生物质炭(NB1)、施氮中生物质炭(NB2)、施氮高生物质炭(NB3)。
称350 g风干过筛土样,置于一组规格为1000 mL培养瓶中,并调节土壤含水量至40%土壤孔隙含水率(WFPS)后置于恒温箱暗培养7 d,以活化土壤微生物并消除干湿效应[9],培养温度设置为25±1 ℃;预培养结束后生物质炭和氮肥按照设计比例与活化土壤充分搅拌混合,调节土壤含水量至60% WFPS。用中间带有两个小孔的硅橡胶塞塞住瓶口,其中一孔中插入套有三通阀软管的玻璃管,作为气体取样口和交换口,另一孔中插入绑有气球的玻璃管,用于平衡培养瓶中的压强。检查密封性后将培养瓶放入恒温培养箱中好氧培养47 d,每隔1 d用称重法补充因蒸发散失的水分,以保持土壤含水量的恒定。每个处理设6个重复,3个用于温室气体的采集测定,3个用于土壤NH4+-N、NO3--N含量和土壤pH值等指标的动态变化分析,并于试验的第1、3、5、9、13、19、25、32、39、47 d采集土样测定。
在培养的第1、2、3、4、5、6、9、10、11、12、13、15、17、19、22、25、28、31、40、47 d采集气体样品。采样前,培养瓶敞口30 min,使得培养瓶中气体和大气间充分交换,之后密闭培养瓶,并采集培养瓶上部空间气体,作为初始气体浓度,记录采样时间,密闭静置培养1 h后,反复推拉注射器以混匀瓶中气体,然后立即抽气并移至预真空的集气瓶中,再次记录采样时间。
1.3 气体及土壤样品分析CO2和CH4浓度由气相色谱仪(Agilent 7890A)测定;硝态氮、铵态氮采用1 mol·L-1 KCl振荡浸提,流动分析仪测定(德国Seal Analytical AA3);土壤pH采用酸度计电位法测定(1:2.5土水比);土壤DOC含量采用超纯水振荡浸提,德国Elementer Vario TOC仪测定[10];土壤MBC含量采用氯仿熏蒸0.5 mol·L-1 K2SO4溶液浸提测定[10];容重采用环刀法[11]测定。
1.4 数据计算与统计CO2和CH4排放通量计算公式:
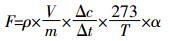
式中:F为CO2(mg·kg-1·h-1)和CH4排放通量(μg·kg-1·h-1),正值为排放,负值为吸收;ρ为标准状况下气体的密度;V是培养瓶顶空体积,L;m为土样干重,g;Δc/Δt为在一特定时间内的气体浓度变化速率;T为绝对温度;α分别为CO2换算到C(12/44)、CH4换算到C(12/16)的转换因子。
CO2和CH4累积排放量计算公式:
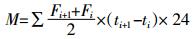
式中:M为土壤气体累积排放量(mg·kg-1或μg·kg-1);F为气体排放通量(μg·kg-1·h-1或mg·kg-1·h-1),i为采样次数;t为采样时间,d。
实验结果均以3次重复的平均值±标准误来表示,实验数据用Excel软件进行处理后,使用SPSS16.0软件进行单因素方差分析,采用Pearson方法分析CO2和CH4排放通量与环境因子以及CO2和CH4累积排放量与生物质炭添加量之间的相关性,显著性水平P=0.05,并用Origin8.0软件进行图形绘制。
2 结果与分析 2.1 土壤pH值变化特征培养期间,添加生物质炭后土壤pH值随着生物质炭添加量的增加而提高(图 1),土壤pH平均值(表 1)显著高于对照CK(P < 0.05)。随着试验时间的延长,各处理土壤pH值逐渐降低,最终趋于平缓。施加氮肥后,土壤pH先升高并于试验的第5 d达到峰值,之后快速下降直至试验结束时仍保持较高的降速。氮肥添加及与生物质炭共施显著提高了土壤平均pH值(P < 0.05)。试验结束时处理N0B1、N0B2、N0B3、NB0、NB1、NB2和NB3土壤pH值较对照组CK分别提高了0.04、0.33、0.74、0.31、0.32、0.53、0.69个单位。
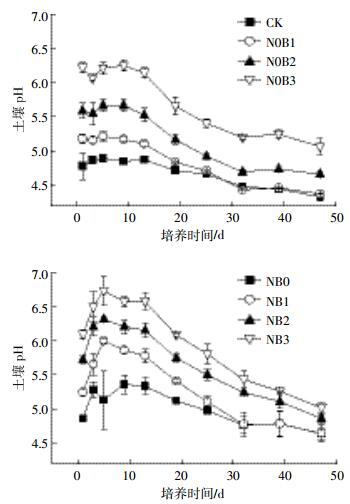
|
| 图 1 土壤pH动态变化 Figure 1 Temporal dynamics of soil pH |
|
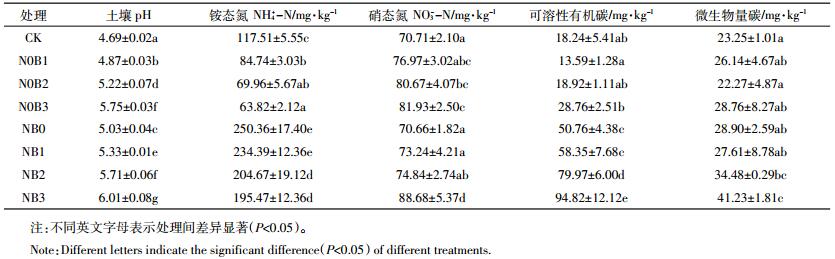
对照CK和N0B1、N0B2、N0B3处理土壤NH4+-N含量前期保持稳定,在培养的第19 d其含量有所下降,之后一直稳定在较低水平至试验结束(图 2)。添加生物质炭后土壤中NH4+-N平均含量(表 1)显著低于对照CK(P < 0.05),且生物质炭添加量越高土壤NH4+-N含量越低。施氮后处理组NB0、NB1、NB2和NB3土壤中NH4+-N含量先快速上升,于试验的第9 d达到峰值,至试验的第19 d一直处于较高水平,之后快速下降至试验结束。与处理组NB0相比较,氮肥与生物质炭共施可降低土壤NH4+-N含量,生物质炭添加比例越高,土壤NH4+-N含量下降幅度越大,除NB1处理土壤NH4+-N平均含量下降幅度较小外,其他处理NH4+-N平均含量均显著(P < 0.05)减少。
|
| 图 2 土壤NH4+-N和NO3--N含量动态变化 Figure 2 Temporal dynamics of soil NH4+-N and NO3--N |
各处理组中土壤NO3--N含量在整个培养期间变化趋势一致,试验开始至第9 d,土壤中NO3--N含量基本稳定,之后快速升高至试验的第25 d,之后NO3--N含量增加速率减缓。土壤NO3--N含量提高幅度随着生物质炭施加比例的增加而增大,处理N0B2和N0B3土壤NO3--N平均含量显著增加(P < 0.05)。添加氮肥对土壤NO3--N含量影响较小,只在NB3处理土壤中NO3--N平均含量增加达到显著(P < 0.05)水平。
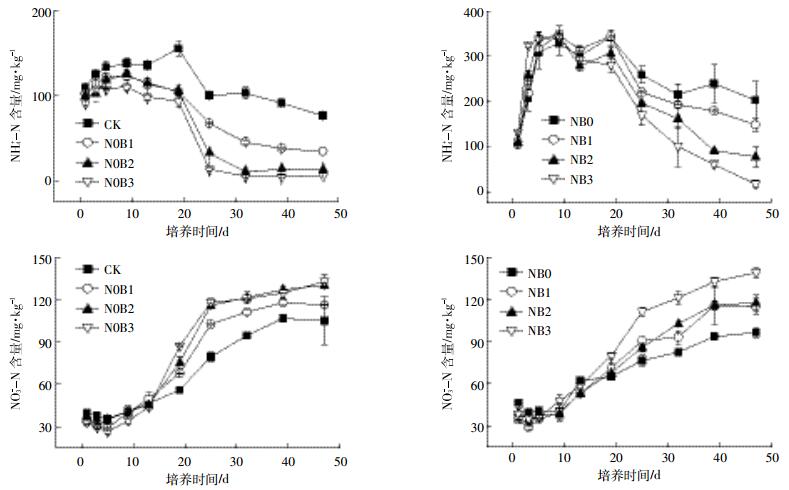
2.3 土壤可溶性有机碳(DOC)和微生物量碳(MBC)变化特征图 3所示各处理组中土壤DOC含量在培养试验的第1 d出现最大值,之后快速下降,在试验的中后期基本稳定,一直处于较低水平。添加生物质炭提高了土壤中DOC的含量,并且生物质炭添加量越大效果越明显,但未达到显著水平(P < 0.05)。施肥处理土壤中DOC含量显著(P < 0.05)高于对应的不施肥处理。CK、N0B1、N0B2、N0B3、NB0、NB1、NB2和NB3处理组土壤DOC平均含量分别为18.24、13.59、18.92、28.76、50.76、58.35、79.97、94.82 mg·kg-1(表 1)。
|
| 图 3 土壤DOC和MBC含量动态变化 Figure 3 Temporal dynamics of soil DOC and MBC |
各处理中土壤MBC含量动态变化趋势相似,前期MBC含量呈波动式变化特征,试验的中期各处理组MBC含量快速下降直至培养的第32 d,之后至试验结束土壤中MBC含量基本保持稳定且一直处于较低水平。CK、N0B1、N0B2、N0B3、NB0、NB1、NB2和NB3处理组土壤MBC平均含量分别为23.25、26.14、22.27、28.76、28.90、27.61、34.48、41.23 mg·kg-1(表 1)。单施中低量生物质炭对土壤MBC含量影响较小,而单施氮肥以及生物质炭与氮肥共施可显著提高土壤中MBC含量(P < 0.05)。
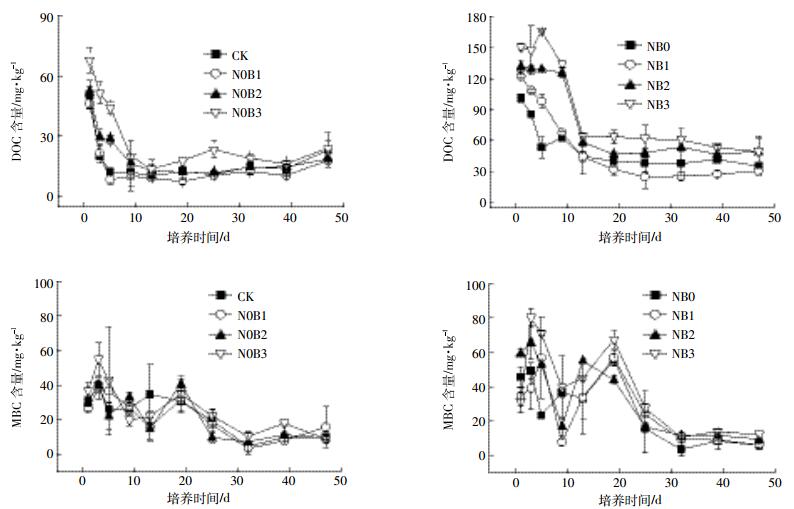
2.4 土壤CO2和CH4的排放 2.4.1 土壤CO2和CH4排放通量变化特征培养期间,各处理CO2排放通量随着培养试验的进行,均表现出快速下降至较低水平,之后至实验结束基本保持稳定的变化趋势(图 4)。与CK处理相比,添加生物质炭、氮肥及生物质炭与氮肥共施均显著促进初期CO2的排放,CO2排放通量明显增大。各处理组CO2排放峰值均出现在第1 d,CK、N0B1、N0B2、N0B3、NB0、NB1、NB2和NB3排放峰值分别为0.77、2.72、5.09、6.85、1.43、2.74、4.02、5.51 mg·kg-1·h-1,第9 d后各处理CO2排放通量均较低且各处理间差异缩小。
|
| 图 4 土壤CO2和CH4排放通量动态变化 Figure 4 Temporal dynamics of CO2 and CH4 fluxes |
各处理组CH4排放通量变化趋势与CO2排放通量变化趋势相似,随着培养试验的进行,土壤CH4排放通量快速下降至较低水平后保持稳定至试验结束。生物质炭及生物质炭与氮肥共施提高了初期CH4的排放通量,N0B1、N0B2、N0B3、NB1、NB2和NB3在培养试验的第1 d出现排放峰值,分别为0.17、0.35、0.55、0.10、0.23、0.34 μg·kg-1·h-1,而对照组CK和单施氮肥处理组NB0在整个培养期间CH4排放通量一直处于较低水平。
2.4.2 土壤CO2和CH4累积排放量及其与生物质炭添加量间的关系与对照组CK相比,添加生物质炭显著促进了土壤CO2的排放,生物质炭添加量越高,CO2累积排放量增加效果越明显,不同生物质炭添加比例间土壤CO2累积排放量差异显著(P < 0.05)。施氮后进一步提高了CO2累积排放量且显著高于对应的未施氮处理组(图 5)。实验结束时N0B1、N0B2、N0B3、NB0、NB1、NB2和NB3处理组CO2累积排放量分别为对照组CK的1.55、1.99、2.51、1.43、1.93、2.45、2.81倍。
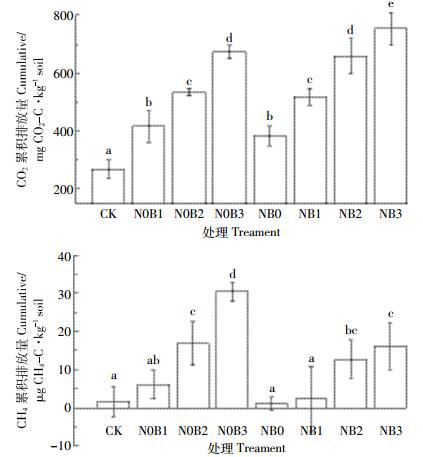
|
| 图中不同英文字母表示处理间差异显著(P < 0.05) Different letters on the chart indicate mean significant differences(P < 0.05) 图 5 土壤CO2和CH4累积排放量 Figure 5 Cumulative CO2 and CH4 emissions |
对照组CK和氮肥处理组土壤CH4累积排放量较小,与对照组相比,单施低量生物质炭(N0B1)对CH4累积排放量影响较小,未达到显著水平(P>0.05),而添加中(N0B1)高(N0B1)量生物质炭可显著增加CH4的累积排放量(P < 0.05)。生物质炭与氮肥共施可抑制CH4的排放,CH4累积排放量低于相应的单施生物质炭处理组。各处理组CH4累积排放量大小顺序为:N0B3>B2>NB3>NB2>N0B1>NB1>CK>NB0。
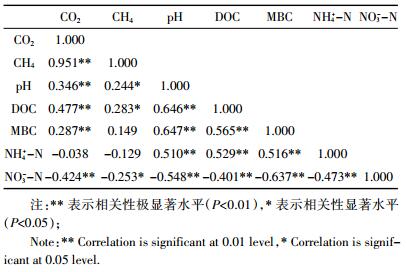
茶园土壤CO2和CH4排放通量与各指标间的相关性分析结果如表 2所示。CO2排放通量与土壤pH值、DOC含量、MBC含量和NO3--N含量间均表现出极显著的相关关系(P < 0.01);CH4排放通量则与土壤pH值、DOC和NO3--N之间关系显著(P < 0.05)。pH、DOC和NO3--N是CO2和CH4的共同影响因子。
|
添加生物质炭显著提高了土壤平均pH值(P < 0.05),试验中N0B1、N0B2和N0B3处理土壤平均pH值较对照CK分别增加了0.18、0.53、1.06个单位。开始阶段土壤中有机氮的矿化、有机阴离子的脱羧作用和生物质炭中灰化碱的释放综合作用,生物质炭处理土壤pH值显著增加,之后由于硝化作用释放H+[12-13]以及土壤的缓冲作用,pH值逐渐下降。试验结束时,生物质炭处理土壤pH值仍高于对照CK,短期内生物质炭对改良酸化土壤提高土壤pH值具有积极作用。施氮后,尿素水解过程中消耗大量的H+,导致土壤pH值在培养前期呈上升趋势,当与生物质炭共施时,生物质炭中的碱性物质与氮肥共同作用,土壤pH值得到进一步提高,之后,由于尿素水解产生的NH4+在转化为亚硝酸盐或硝酸盐的过程中产生H+,土壤pH值快速下降且下降速率快于不施加氮肥处理组。NB0、NB1、NB2和NB3处理组土壤平均pH值分别较CK增加了0.34、0.64、1.02、1.32个单位。试验结果与周细红等[14]的研究结果一致,施用尿素短期内显著提高了土壤pH值。但值得注意的是本试验培养时间较短,因为若是延长培养时间,尿素的酸化作用可能会体现出来。
生物质炭处理后均于试验初期排放大量CH4,高量(N0B3)生物质炭处理CH4累积排放量显著(P < 0.05)大于中(N0B2)低(N0B1)量生物质炭处理,对照CK在整个试验期间CH4排放通量均处于较低水平。有研究报道,施加生物质炭可增加土壤中甲烷氧化菌的丰度,提高甲烷氧化菌和产甲烷菌的丰度比[15],或增加土壤中氧气含量直接或间接抑制了产甲烷菌的活性或提高甲烷氧化菌的活性[16],从而降低CH4的排放量。而本试验结果表明,添加生物质炭显著促进了CH4的排放。生物质炭中的灰化碱等碱性物质可提高土壤pH值,而土壤pH值的升高可增强产甲烷菌的活性[17],促进土壤排放CH4,试验结果显示CH4排放通量与土壤pH之间呈显著的正相关关系(表 2);氨和甲烷都能够竞争单氧化酶(MMO)上的活性结合点,高浓度的氨可驱离结合位点上的CH4,降低CH4的氧化量,添加生物质炭可显著降低土壤中NH4+-N含量,并提高NO3--N的含量(表 1),从而削弱了NH4+-N对CH4的氧化抑制作用[18]。另外,生物质炭中存在诸如重金属等有毒有害化学物质,可抑制土壤中甲烷氧化菌的活性[19],生物质炭施加到土壤中造成土壤水分分布不均,局部出现厌氧环境[20],同样有利于CH4的排放。但也有研究表明,生物质炭对土壤CH4排放的影响不显著[21-22],不同的试验结果可能由具体试验所用生物质炭的原材料、热解温度、施加量或土壤性质间的差异引起的。试验中,氮肥与生物质炭共施抑制了CH4的排放。有研究发现施加氮肥会影响CH4氧化菌的群落结构[23],可能是因为施加氮肥促进了CH4的氧化或对产甲烷菌的生长产生了抑制作用[24],从而减少了CH4累积排放量。
试验结果表明,添加生物质炭显著促进了CO2的排放,且生物质炭添加量越高,CO2累积排放量越大。土壤排放的CO2主要是由土壤中微生物的呼吸作用所产生,生物质炭富含有机碳,添加到土壤中会影响土壤有机碳组分和微生物活性[25]进而影响土壤中有机碳的分解和CO2的排放。目前,关于生物质炭对CO2排放影响的观点并不统一。有研究表明施用生物质炭能降低CO2的排放[26],而陈玉真等[27]的研究则得出添加低量生物质炭对土壤CO2排放无显著影响,高量生物质炭显著促进CO2排放的结果;刘玉学等[16]将生物质炭对土壤CO2排放的影响作了更为详细的分时段分析,结果发现添加稻壳生物质炭可促进初期CO2的排放,但后期和整个试验期间CO2累积排放量并未表现出显著差异。本试验中,生物质炭对CO2排放的影响与刘玉学等的研究结果相似,施用生物质炭显著促进了土壤初期CO2的排放,所不同的是整个试验期间CO2累积排放量也表现出了显著差异。生物质炭是生物质经高温厌氧裂解而成的顽固性固态物质,大部分短时间内难被微生物利用,但生物质在裂解过程中也会产生部分可被微生物利用的可溶性有机碳和诸如磷、钾和钙等速效养分,一定程度上会增强土壤中微生物的活性[28-30]。本试验中,添加生物质炭对MBC含量的影响并不显著,可能是因为土壤中的微生物只是在组成结构上变化较大,但对微生物的总量并无显著的影响。同时,生物质炭在裂解时会产生灰化碱等碱性物质,引起土壤pH值的改变,进而影响微生物的呼吸作用,改变CO2的排放。另外,有研究表明,当生物质炭施加到土壤中时,会对土壤中原有的炭产生激发效应,促进原有炭的分解[31]。生物质炭虽含有一定量的可溶性有机碳,但当生物质炭施用量较少时,由生物质炭携带的DOC的量小于其激发作用引起的土壤DOC分解的量时,土壤中DOC的含量则会有所降低。试验中添加中(N0B2)低(N0B1)量的生物质炭时,土壤中DOC平均含量较对照组有所减少或基本保持不变,而当生物质炭施加比例达到5%时(N0B3),在一定程度上增加了土壤中DOC的含量。相关性分析结果表明,土壤中DOC和MBC含量以及土壤pH值与CO2排放通量间均有极显著的正相关关系(P < 0.01)。氮肥与生物质炭共施与单施生物质炭相比大幅度提高了土壤中DOC和MBC含量。单施生物质炭导致土壤C/N过高,微生物由于氮素的匮乏,活性受到抑制,施氮为微生物提供了氮源,从而增强了微生物活性并促进有机质的矿化,另外尿素属于小分子有机化合物,分解后也会产生CO2,二者共同作用,引起CO2排放量的增加。
4 结论(1)添加生物质炭显著提高了茶园土壤pH值,且生物质炭施加比例越大土壤pH值增加幅度越大,生物质炭在改善酸化茶园土壤方面有较大潜力。施加尿素在短期内显著提高了土壤pH值,但试验中后期土壤酸化速度较快。
(2)生物质炭显著促进了土壤CO2和CH4的排放,CO2和CH4的累积排放量随生物质炭施加量的增加而增加。氮肥促进了有机质的矿化,其本身分解也会产生CO2,二者共同显著促进了CO2的排放,但氮肥对CH4的排放无明显影响。
(3)与单施生物质炭相比,当生物质炭与尿素共施时显著促进了CO2的排放,但对CH4的排放具有一定的抑制作用。
生物质炭提高土壤pH值的同时促进了CO2和CH4的排放,当茶园酸化状况较轻时,可适当施加低量生物质炭,在缓解土壤酸化状况的同时尽可能地降低温室气体的排放。
| [1] |
马建堂. 中国统计现代化探索实践发展[M]. 北京: 中国统计出版社, 2012. MA Jian-tang. China statistical modern exploration practice development[M]. Beijing: China Statistical Publishing House, 2012. |
| [2] |
杨向德, 石元值, 伊晓云, 等. 茶园土壤酸化研究现状和展望[J]. 茶叶学报, 2015, 56(4): 189-197. YANG Xiang-de, SHI Yuan-zhi, YI Xiao-yu, et al. Research progress and prospects on soil acidification at tea plantations[J]. Acta Tea Sinica, 2015, 56(4): 189-197. |
| [3] |
Standardized product definition and product testing guidelines for biochar that is used in soil[J]. IBI Biochar Standards, 2012. http://www.biochar-international.org/sites/default/files/Guidelines_for_Biochar_That_Is_Used_in_Soil_Final.pdf
|
| [4] |
何绪生, 耿增超, 佘雕, 等. 生物炭生产与农用的意义及国内外动态[J]. 农业工程学报, 2011, 27(2): 1-7. HE Xu-sheng, GENG Zeng-chao, SHE Diao, et al. Implications of production and agricultural utilization of biochar and its international dynamics[J]. Transactions of the CSAE, 2011, 27(2): 1-7. |
| [5] |
Asai H, Samson B K, Stephan H M, et al. Biochar amendment techniques for upland rice production in Northern Laos:1. Soil physical properties, leaf SPAD and grain yield[J]. Field Crops Research, 2009, 111(Suppl 1/2): 81-84. |
| [6] |
花莉, 张成, 马宏瑞, 等. 秸秆生物质炭土地利用的环境效益研究[J]. 生态环境学报, 2010, 19(10): 2489-2492. HUA Li, ZHANG Cheng, MA Hong-rui, et al. Environmental benefits of biochar made by agricultural straw when applied to soil[J]. Ecology and Environmental Sciences, 2010, 19(10): 2489-2492. DOI:10.3969/j.issn.1674-5906.2010.10.040 |
| [7] |
Wu F, Jia Z, Wang S, et al. Contrasting effects of wheat straw and its biochar on greenhouse gas emissions and enzyme activities in a Chernozemic soil[J]. Biology and Fertility of Soils, 2013, 49(5): 555-565. DOI:10.1007/s00374-012-0745-7 |
| [8] |
Spokas K A, Reicosky D C. Impacts of sixteen different biochars on soil greenhouse gas production[J]. Annals of Environmental Science, 2009(1). |
| [9] |
Dick J, Skiba U, Wilson J. The effect of rainfall on NO and N2O emissions from Ugandan agroforest soils[J]. Phyton, 2001, 41(3): 73-80. |
| [10] |
Lin S, Iqbal J, Hu R, et al. Nitrous oxide emissions from yellow brown soil as affected by incorporation of crop residues with different carbon-to-nitrogen ratios:A case study in central China[J]. Archives of Environmental Contamination & Toxicology, 2013, 65(2): 183-192. |
| [11] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2000, 25-109. BAO Shi-dan. The method of soil agrochemistry analysis[M]. Beijing: China Agriculture Press, 2000, 25-109. |
| [12] |
王磊, 汪玉, 杨兴伦, 等. 有机物料对强酸性茶园土壤的酸度调控研究[J]. 土壤, 2013, 45(3): 430-436. WANG Lei, WANG Yu, YANG Xing-lun, et al. Use of crop residues to ameliorate soil acidity in a tea garden soil[J]. Soils, 2013, 45(3): 430-436. |
| [13] |
Wrage N, Velthof G L, Beusichem M L V, et al. Role of nitrifier denitrification in the production of nitrous oxide[J]. Soil Biology & Biochemistry, 2001, 33(1): 1723-1732. |
| [14] |
周细红, 曾清如, 蒋朝辉, 等. 尿素施用对土壤pH值和模拟温室箱内NH3和NO2浓度的影响[J]. 土壤通报, 2004, 35(3): 374-376. ZHOU Xi-hong, ZENG Qing-ru, JIANG Zhao-hui, et al. Effects of urea on soil pH and the accumulation of NH3 and NO2 in a simulative greenhouse[J]. Chinese Journal of Soil Science, 2004, 35(3): 374-376. |
| [15] |
Feng Y, Xu Y, Yu Y, et al. Mechanisms of biochar decreasing methane emission from Chinese paddy soils[J]. Soil Biology & Biochemistry, 2012, 46(1): 80-88. |
| [16] |
刘玉学, 王耀锋, 吕豪豪, 等. 生物质炭化还田对稻田温室气体排放及土壤理化性质的影响[J]. 应用生态学报, 2013, 24(8): 2166-2172. LIU Yu-xue, WANG Yao-feng, LÜ Hao-hao, et al. Effects of biochar application on greenhouse gas emission from paddy soil and its physical and chemical properties[J]. Chinese Journal of Applied Ecology, 2013, 24(8): 2166-2172. |
| [17] |
韦梦, 马兰, 胡越航, 等. 高温下两种不同pH水稻土甲烷产生及古菌群落的比较[J]. 生态学杂志, 2015, 34(6): 1667-1674. WEI Meng, MA Lan, HU Yue-hang, et al. Comprison of methane production and archaeal community of two rice paddy soils with different pH under high temperature[J]. Chinese Journal of Ecology, 2015, 34(6): 1667-1674. |
| [18] |
许欣, 陈晨, 熊正琴. 生物炭与氮肥对稻田甲烷产生与氧化菌数量和潜在活性的影响[J]. 土壤学报, 2016, 53(6): 1517-1527. XU Xin, CHEN Chen, XIONG Zheng-qin. Effects of biochar and nitrogen fertilizer amendment on abundance and potential activity of methanotrophs and methanogens in paddy field[J]. Acta Pedologica Sinica, 2016, 53(6): 1517-1527. |
| [19] |
Spokas K A, Koskinen W C, Baker J M, et al. Impacts of woodchip biochar additions on greenhouse gas production and sorption/degradation of two herbicides in a Minnesota soil[J]. Chemosphere, 2009, 77(4): 574-581. DOI:10.1016/j.chemosphere.2009.06.053 |
| [20] |
Malghani S, Gleixner G, Trumbore S E. Chars produced by slow pyrolysis and hydrothermal carbonization vary in carbon sequestration potential and greenhouse gases emissions[J]. Soil Biology & Biochemistry, 2013, 62(5): 137-146. |
| [21] |
Wu F, Jia Z, Wang S, et al. Contrasting effects of wheat straw and its biochar on greenhouse gas emissions and enzyme activities in a Chernozemic soil[J]. Biology and Fertility of Soils, 2013, 49(5): 555-565. DOI:10.1007/s00374-012-0745-7 |
| [22] |
Zhang A, Liu Y, Pan G, et al. Effect of biochar amendment on maize yield and greenhouse gas emissions from a soil organic carbon poor calcareous loamy soil from Central China Plain[J]. Plant and Soil, 2012, 351(1): 263-275. |
| [23] |
丁维新, 蔡祖聪. 氮肥对土壤氧化大气甲烷影响的机制[J]. 生态与农村环境学报, 2001, 17(3): 30-34. DING Wei-xin, CAI Zu-cong. Mechanisms of nitrogen fertilizer suppressing atmospheric methane oxidation by methanotrophs in soils[J]. Rural Eco-Environment, 2001, 17(3): 30-34. |
| [24] |
丁维新, 蔡祖聪. 氮肥对土壤氧化甲烷的影响研究[J]. 中国生态农业学报, 2003, 11(2): 50-53. DING Wei-xin, CAI Zu-cong. Effect of nitrogen fertilizers on methane oxidation in soils by methanotrophs[J]. Chinese Journal of Eco-Agriculture, 2003, 11(2): 50-53. |
| [25] |
陈心想, 耿增超, 王森, 等. 施用生物炭后塿土土壤微生物及酶活性变化特征[J]. 农业环境科学学报, 2014, 33(4): 751-758. CHEN Xin-xiang, GENG Zeng-chao, WANG Sen, et al. Effects of biochar amendment on microbial biomass and enzyme activities in loess soil[J]. Journal of Agro-Environment Science, 2014, 33(4): 751-758. DOI:10.11654/jaes.2014.04.019 |
| [26] |
柯跃进, 胡学玉, 易卿, 等. 水稻秸秆生物炭对耕地土壤有机碳及其CO2释放的影响[J]. 环境科学, 2014, 35(1): 93-99. KE Yue-jin, HU Xue-yu, YI Qing, et al. Impacts of rice straw biochar on organic carbon and CO2 release in arable soil[J]. Environmental Science, 2014, 35(1): 93-99. |
| [27] |
陈玉真, 王峰, 尤志明, 等. 添加生物黑炭对茶园土壤CO2、N2O排放的影响[J]. 农业环境科学学报, 2015, 34(5): 1009-1016. CHEN Yu-zhen, WANG Feng, YOU Zhi-ming, et al. Effects of biochar on CO2 and N2O emissions from tea garden soils[J]. Journal of Agro-Environment Science, 2015, 34(5): 1009-1016. DOI:10.11654/jaes.2015.05.026 |
| [28] |
胡雲飞, 李荣林, 杨亦扬. 生物炭对茶园土壤CO2和N2O排放量及微生物特性的影响[J]. 应用生态学报, 2015, 26(7): 1954-1960. HU Yun-fei, LI Rong-lin, YANG Yi-yang, et al. Effects of biochar on CO2 and N2O emissions and microbial properties of tea garden soils[J]. Chinese Journal of Applied Ecology, 2015, 26(7): 1954-1960. |
| [29] |
Bruun S, Jensen E S, Jensen L S. Microbial mineralization and assimilation of black carbon:Dependency on degree of thermal alteration[J]. Organic Geochemistry, 2008, 39: 839-845. DOI:10.1016/j.orggeochem.2008.04.020 |
| [30] |
Cross A, Sohi S P. The priming potential of biochar products in relation to labile carbon contents and soil organic matter status[J]. Soil Biology and Biochemistry, 2011, 43: 2127-2134. DOI:10.1016/j.soilbio.2011.06.016 |
| [31] |
Luo Y, Durenkamp M, Nobili M D, et al. Short term soil priming effects and the mineralisation of biochar following its incorporation to soils of different pH[J]. Soil Biology & Biochemistry, 2011, 43(11): 2304-2314. |
 2018, Vol. 37
2018, Vol. 37