2. 四川眉山市彭山区水务局河道管理处, 四川 眉山 620860;
3. 临邛工业园区管理委员会, 四川 邛崃 611530;
4. 四川省冶金地质勘查局 605大队分析测试中心, 四川 眉山 620860
2. River Management Office of Pengshan Water Supplies Bureau, Meishan 620860, China;
3. Linqiong Industrial Park Management Committee, Qionglai 611530, China;
4. Analysis and Test Center, 605 Group of Metallurgical Geological Prospecting Bureau, Meishan 620860, China
由于碳纳米材料具有比表面积大、弹性高、绝热性好、红外吸收性好等优点,被广泛应用于电池能源、运动产品、汽车部件、农业生产等领域[1-2]。据市场研究公司Lux Research的分析,近年全球碳纳米管(CNTs)年需求量超过2000 t,碳纳米管逐步走向产业化将导致它们进入环境的量越来越多。据文献报道,碳纳米管可能促进也可能抑制植物的生长发育。如Khodakovskaya等[3]发现10~40 mg·L-1 CNTs会穿透种皮,促进西红柿种子吸水,刺激种子发芽生长;Mi⁃ ralles等[4]发现40~2560 mg·L-1 CNTs可促进苜蓿和小麦根生长。Lin等[5]发现10~600 mg·L-1多壁碳管(MWCNTs)会使拟南芥悬浮细胞发生过敏反应,导致细胞干重、活性、叶绿素含量和超氧化物歧化酶(SOD)活性降低,并且MWCNTs团聚物的粒径越小越明显。此外,据全国土壤污染调查公报显示,六六六、滴滴涕、多环芳烃等多种有机污染物在我国耕地、林地、草地等类型土壤中出现。这些持久性有机污染物(如多环芳烃)也会对植物生长发育产生影响。有研究表明多环芳烃菲会对植物产生氧化胁迫,引起机体内氧化应激反应,导致膜脂过氧化损伤[6-7]。碳纳米材料能通过疏水作用和π键共轭等与有机污染物发生较强的吸附作用,并且碳纳米材料在土壤溶液和水环境中具有一定的迁移性,因此有机污染物在环境中的存在形态、迁移转化规律将受到影响[8-10]。周传辉等[11]在菲从四种CNTs上的吸附解吸行为中发现了解吸迟滞现象,推断菲的环境毒性会减小。因此,有理由认为碳纳米管与污染物的作用会影响两者的生态风险。
关于碳纳米材料和有机污染物的复合暴露研究主要集中在对细胞、微生物和水生动物的毒性效应方面[12-13],也有学者研究了碳纳米材料与有机污染物共存时,碳纳米材料对污染物在植物中的累积效应的影响[14]。如Ma等[15]研究发现在植物修复过程中,随着C60浓度增加,三叶杨对三氯乙烯的吸收增加了26%~ 82%。但Torreroche等[16]发现,当MWCNT、C60分别与农药氯丹和DDx(滴滴涕及其代谢物)共存时,MW⁃ CNT可使西葫芦、玉米、西红柿、大豆四种植物对农药氯丹和DDx的吸收减少了21%~80%;C60抑制玉米和西红柿对DDx的吸收,却促进西红柿和大豆对氯丹的吸收。他们将碳纳米材料对这些污染物在植物内积累的影响归因于碳纳米材料与污染物间的强吸附作用。C60的影响多变与其迁移性有关,对不同污染物影响不同与污染物构型和不同植物细胞膜转移蛋白的特异性有关。
然而,碳纳米材料与有机污染物同时存在和它们分别独立存在对植物是否会产生不同的毒害作用?会如何影响植物本身的生理生化指标?相关研究还比较少,植物毒性的表现形式及如何诱发植物毒性尚不清楚[17]。在碳纳米材料应用推广于多个领域、产量逐年提升的情况下,研究碳纳米材料与有机污染物复合污染的影响可以为评估它们共存时的生态风险提供依据。因此,以我国重要的粮食作物水稻为受试植物,研究了多壁碳纳米管与多环芳烃代表物菲分别及共同存在对水稻种子发芽率、幼苗生长及生理生化的影响,比较了单一和复合胁迫下水稻的响应。
1 材料与方法 1.1 实验材料及试剂多壁碳纳米管(MWCNT,直径10~20 nm,长度 < 2 μm,纯度 > 97%),购自深圳纳米港;菲(Phen,纯度 > 97%;30 ℃时水溶解度为1.3 mg·L-1),购自TCI公司;水稻种子(川香3号),购于温江区种子站。抗氧化系统酶(超氧化物歧化酶SOD、过氧化氢酶CAT、过氧化物酶POD)的活性及过氧化产物丙二醛(MDA)测定试剂盒购自南京建成生物工程研究所。实验所用有机溶剂,如丙酮、甲醇,均为色谱纯,其他药品和试剂均为分析纯,实验用水均为蒸馏水。
1.2 碳纳米管的处理和表征对MWCNT进行纯化处理,除去无定型碳和催化金属等杂质[18],排除杂质对植物的影响。将MWCNT在马弗炉内加热至300 ℃恒温处理1 h;取出冷却后用6 mol·L-1的盐酸浸泡搅拌4 h,然后用蒸馏水冲洗至中性。最后将纯化后的MWCNT置于恒温干燥箱,在105 ℃下烘干装瓶,存于干燥器内备用。用高分辨透射电镜Libra200(Carl Zeiss,GER)观察MWCNT的形貌。将MWCNT超声分散在1/2Hogland营养液中,通过测吸光度确定其分散稳定性,并用ZetaPALs粒度分析仪(Brookhaven,US)分析悬浮碳管的粒径和zeta电位。
1.3 水稻污染胁迫实验 1.3.1 污染液的配制称取一定量纯化后的MWCNT用1/2Hogland营养液配制成浓度为60 mg·L-1的碳管污染液,并用超声仪在80 W、40 kHz条件下超声30 min,使其充分分散,即可得MWCNT污染液。将菲先溶在甲醇中配成高浓度菲储备液,-4 ℃冷冻保存。用微量注射器将一定体积菲储备液注入1/2Hogland营养液中(甲醇与营养液体积比 < 0.1%以避免甲醇影响),经超声并搅拌溶解2 h后得到浓度约为1.2 mg·L-1的菲污染液,存于棕色试剂瓶中,现配现用。以微量注射器取一定体积的菲储备液注入已配制好的MWCNT污染液中,搅拌吸附平衡2 h后,得到1.2 mg·L-1菲与60 mg·L-1碳管的菲+MWCNT混合污染液,现配现用。
1.3.2 水稻发芽实验选取颗粒饱满的水稻种子用10%的双氧水浸泡30 min,再用蒸馏水反复洗净。然后,将种子放入准备好的放有滤纸的培养皿中,每个培养皿放入20粒并加入一定量的MWCNT、菲以及菲+MWCNT污染液,以污染液漫过种子一半为宜,将培养皿放入恒温培养箱中于25 ℃黑暗条件下避光发芽,适时添加对应污染液保持水分,4 d后记录种子发芽数。以根长至少等于种子长度,芽长至少等于种子一半长度为发芽标准[19]。发芽率=发芽种子数/供试种子总数× 100%。每种处理设置6个平行,并设置蒸馏水处理的样品作为对照。
1.3.3 幼苗实验将石英砂用稀硝酸洗净并用蒸馏水反复冲洗至中性后烘干,作为水稻幼苗实验的支撑基质。将适量石英砂装入烧杯,并加入一定量对应污染液。把污染胁迫发芽后的种子小心转移到对应烧杯中,每烧杯10株,于光照培养箱中继续培养。培养条件为白天光照14 h,光照强度为9000 lx,温度28±1 ℃,湿度为70%;夜间黑暗10 h,温度24±1 ℃,湿度为75%。期间每日观察并及时补充对应污染液,每隔3 d用针管吸出全部污染液并注入新鲜污染液。每种处理设置8个平行,并用未添加污染物的营养液组作为对照。
培养15 d后收获样品,去除没有脱掉的谷粒,用蒸馏水洗去根上残留污染物,用剪刀将幼苗根和冠分开。其中4组平行用于测生物量:用吸水纸将植物表面的水吸干,快速测根及地上部分湿质量;之后分别放入培养皿中置于恒温干燥箱在105 ℃条件下杀青30 min,然后在70 ℃条件下烘干至恒质量,称其干质量,计算其根冠比[20]。其余4组平行用于测生理生化指标:将幼苗根和冠洗净分开后,在冰浴条件下用生理盐水将其分别研磨制备成组织匀浆液,然后使用对应试剂盒,分别测定SOD、CAT、POD活性及MDA含量。试剂盒方法原理依次为氮蓝四唑(NBT)光还原法、紫外分光光度法、愈创木酚法和硫代巴比妥酸法。SOD以在1 mL反应体系中,每毫克组织蛋白抑制率达50%时的SOD量为一个SOD活力单位;CAT以每毫克组织蛋白每分钟分解的H2O2的毫克数表示;POD以每毫克组织蛋白在37 ℃每分钟催化1 μg底物的POD量为一个POD活力单位。
1.4 混合污染液中游离态菲的测定按上述制得菲+MWCNT混合污染液的方法完成MWCNT对菲的吸附实验,设置3个平行,同时以未加MWCNT的菲污染液作为对照。每个样品经超声并搅拌2 h后,取少量液体过0.45 μm滤膜分离悬浮MWCNT,并用配有荧光检测器的HPLC(Perkin Elmer,US)测定滤液中菲的浓度,即未被碳管吸附的菲浓度。以对照估算菲在瓶壁上的损失以及过膜损失。
1.5 数据分析所有数据均采用平行实验的平均值±标准偏差来表示。采用DPS统计分析软件在95%的置信度下作方差分析,进行不同处理组间差异显著性检验。用Origin 8.5进行数据绘图。
2 结果与分析 2.1 多壁碳纳米管的表征现制碳管悬浮液中MWCNT团聚颗粒的水力学直径为359±9 nm,zeta电位为-7.5±0.5 mV。图 1A中图例长为50 nm,可见MWCNT外径在10~20 nm左右,与厂家描述一致。尽管通过超声分散,MWCNT仍大多呈管束形态,彼此缠绕。从图 1B可见,分散在营养液中的MWCNT,无论是否与菲共存,在125 h的静置过程中,均逐渐团聚沉淀,5 d后浓度均约为初始碳管浓度C0的55%,因此,制得的碳管悬浮污染液具有一定的稳定性。
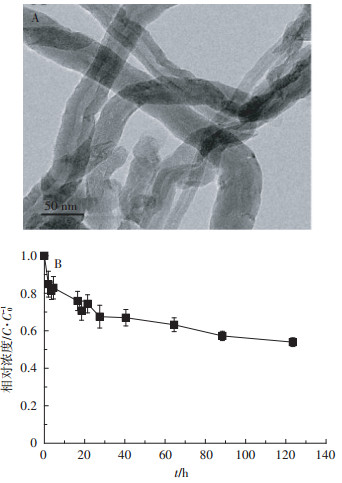
|
图 1 MWCNT透射电镜图(A)及其在营养液中的悬浮性(B) Figure 1 TEM image of MWCNT(A) and stability of MWCNT in nutrient solution(B) |
水稻种子发芽率结果见表 1。MWCNT处理组和菲+MWCNT处理组的发芽率与对照组相比未见显著差异;而菲处理组的发芽率显著低于对照组(P < 0.05)。几种处理与对照组相比,发芽过程没有明显的提前或推迟。MWCNT悬浮液处理没有改变种子的发芽率,这与袁刚强等在研究分散在Hoagland营养液中的10~40 mg·L-1 SWCNT对水稻种子的发芽率影响时结果类似[21]。但研究认为分散在MS培养基中的50~100 mg·L-1碳管能提高水稻种子发芽率并缩短萌发时间[22]。报道中不同的实验现象可能是碳管浓度、尺寸、所含杂质等,培养基质物理状态、离子浓度,水稻品种等因素不同所造成的[23]。多环芳烃菲对种子有毒害作用,其发芽率比空白组降低了20%左右,类似现象已多见报道[24-25]。然而,菲+MWCNT处理组的种子发芽率与菲处理组相比有显著提高。由此可见,MWCNT的存在降低了菲对种子的毒害作用。罗春燕等在研究富勒烯与菲对水稻种子发芽率的影响时也有类似发现[26]。可见,由于碳管可通过疏水作用等与疏水性有机污染物菲产生较强的吸附作用,当有碳管共存时水溶态的菲大量减少;同时由图 1B可知Phen+MWCNT中的悬浮碳管在营养液中逐渐团聚形成较大的聚集颗粒,甚至脱离悬浮体系(4 d时间悬浮碳管浓度降低了40%左右)。因此,部分吸附态的菲也随碳管的沉淀而离开溶液体系。溶解态菲的减少与吸附态菲的离开溶液使菲对种子的毒害作用降低。
|
|
表 1 菲与/或碳管对水稻种子发芽及幼苗生物量的影响 Table 1 Effect of phenanthrene and/or MWCNT on the germination and biomass of rice seedlings |
从水稻幼苗生长15 d后的生物量鲜质量来看,与对照组相比,各处理组对根生物量的影响均没有显著差异。与根生物量不同,各处理组下的幼苗冠生物量均与对照组差异显著(P < 0.05)。如MWCNT处理使幼苗冠生物量增加了29.3%,菲处理导致幼苗冠生物量大幅下降(降低43.8%),而菲+MWCNT处理的结果与仅MWCNT处理的结果类似,比对照组冠生物量增加了18.9%。可见,60 mg·L-1 MWCNT不影响幼苗根生长,却能促进冠生长,类似的发现已见报道[3, 27]。也有研究者认为碳管能促进幼苗根生长,如Wang等[28]发现MWCNT使根生物量增加,并发现MWCNT会被小麦根吸收穿透根细胞壁进入细胞质中,刺激根系的细胞伸长,增加根细胞中脱氢酶活性,从而导致根生长得更快。还有研究者发现单壁碳管将抑制幼苗生长[21]。碳管对幼苗生长的抑制和促进均有报道,碳管的不同影响与碳管种类、植物类型、培养或暴露方法均有关系。
实验中,菲对幼苗生长表现出抑制作用,这与PAH对植物会产生毒害作用的观点一致[24, 29]。菲和MWCNT同时暴露下,与菲处理相比,幼苗根和冠的生物量均有所增加,尤其是冠的生物量增加显著(P < 0.05)。可见同时暴露时,MWCNT会降低甚至抵消菲对植物生长的抑制作用。与同时暴露对种子发芽的影响类似,对菲毒害的减缓应与菲被吸附后其生物有效性显著降低有关。由于MWCNT在营养液中的团聚体粒径较大,而植物细胞壁的孔径约为5~20 nm[20],因此被吸附的菲将难以进入植物细胞对植物造成毒害。有研究报道显示纳米碳材料的存在将减少有机污染物进入植物体的量[11, 16]。如,周传辉等[11]认为碳管吸附菲后,菲不能完全解吸,可降低菲的生物有效性。Torreroche等[16]发现MWCNT可使西葫芦、玉米、西红柿、大豆四种植物对农药氯丹和DDx的吸收减少了21%~80%,C60也能显著抑制玉米和西红柿对DDx的吸收。也有研究认为纳米碳材料能降低有机污染物进入植物根后向地上部分的转移量。如常海伟[30]发现磺化石墨烯与多氯联苯同时存在时,会增大玉米幼苗根部对多氯联苯的吸收,减少多氯联苯向植物地上部分的转移。可见,碳管与有机污染物的相互作用是同时暴露不同于单一暴露的主要原因。
2.3 污染物对水稻幼苗根冠比的影响水稻幼苗根冠比如图 2。在MWCNT胁迫下,水稻幼苗根冠比比对照组降低了3.4%;而菲胁迫或同时暴露下,根冠比与对照组相比分别略有上升或下降,但差异均不显著。根冠比是由生物量干质量计算得出,而各处理下根和冠干质量的高低趋势与其湿质量基本一致,因此图 2所示的是各种处理下根生物量变化不大而冠生物量变化显著的结果。如MWCNT对幼苗的影响主要表现为促进了冠的生长;而菲对幼苗根和冠生长的抑制更多体现在对冠生长的抑制。菲+MWCNT同时暴露与菲单一处理相比,根冠比降低了6.0%。因为同时暴露下,菲对冠生长的抑制并不显著,而MWCNT对冠生长的促进却得以体现,所以同时暴露比菲单一暴露时冠生物量显著增高,又由于根生物量无显著差异,因此同时暴露根冠比显著低于菲单一暴露组。
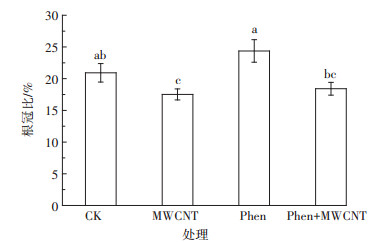
|
图 2 菲与/或碳管对水稻幼苗根冠比的影响 Figure 2 Effect of phenanthrene and/or MWCNT on root-shoot ratio of rice seedlings |
抗氧化酶SOD、POD、CAT常被用来作为研究逆境环境胁迫的影响和生态毒理的指标。实验所得的三种酶活性数据均分别以对照组根的相应酶活(U0)为参照,其他处理组的根或冠的酶活以相对活性U/U0来表示。在各处理下培养15 d后,水稻幼苗根与冠的抗氧化酶相对活性如图 3所示。
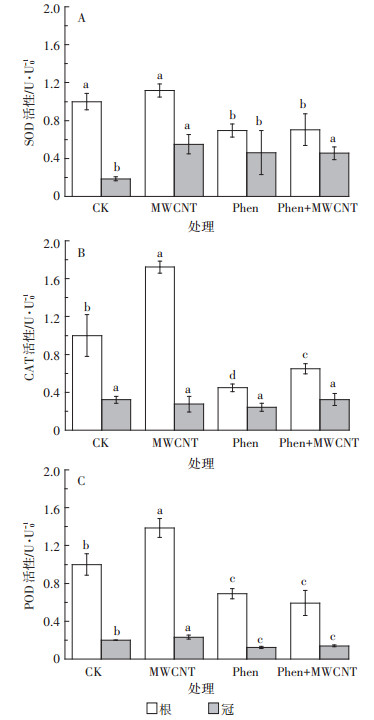
|
图 3 菲与/或碳管对水稻幼苗抗氧化系统酶相对活性的影响 Figure 3 Effect of phenanthrene and/or MWCNT on relative antioxidase activities of rice seedlings |
研究发现,MWCNT单独暴露明显激发了水稻幼苗的抗氧化酶活性(P < 0.05),仅根SOD酶活和冠CAT酶活与对照组差异不显著。这说明纳米碳管会引起植物产生氧化应激[31-32],从而激发抗氧化酶的活性。如郭敏等[32]发现水稻在100 mg·L-1的MWCNT胁迫下,CAT和SOD酶活性显著升高。而根SOD酶活和冠CAT酶活与对照组差异不显著可能与胁迫培养的时间和不同抗氧化酶的作用程序有关。如作为抗氧化应激第一道防线的SOD在受到氧化胁迫之初被激发,并对碳管胁迫产生的有害物进行消除,生成歧化产物;胁迫15 d后,根中SOD反应底物的有害物浓度降低,SOD活性也相应降低;而后续的POD和CAT需要处理前面环节生成的各种中间物,故仍处于激发状态。
与对照相比,菲单独暴露会抑制水稻幼苗的酶活,尤其显著抑制根的酶活(P < 0.05),仅冠SOD活性有所升高。酶活大多低于对照,这可能是因为高浓度的菲(1.2 mg·L-1,接近其溶解度)胁迫下,诱导植物内产生大量ROS,超出了植物承受能力,对植物造成一定损伤从而损害了酶功能。类似现象在PAH对植物的胁迫研究中屡见报道[24, 29, 33]。菲对冠SOD的激活可能与有害物只能从水稻根向上传递到冠有关。根在已经受损的情况下传递给冠的有害物的量有限;同时受损的根能吸收及传递给植物冠生长的必需营养物质也减少,导致了菲暴露下水稻幼苗冠生物量的显著减少。
菲+MWCNT同时暴露下的酶活性与菲单独暴露下类似(除同时暴露下根CAT略高外,这两种处理下的酶活无显著差异),均表现为显著抑制抗氧化酶活性。可见,MWCNT虽能削弱菲对水稻幼苗生长的抑制作用,但却缓解不了菲对幼苗酶活的抑制。同时也可看出抗氧化酶活性对菲胁迫十分敏感。
2.5 污染物对水稻幼苗体内MDA累积的影响水稻幼苗MDA测定结果如图 4所示。与空白相比,MWCNT单独暴露下水稻幼苗中MDA略有增加,与其抗氧化酶被激活的现象一致,进一步说明MW CNT暴露能对水稻幼苗产生氧化胁迫。但虽然脂质过氧化产物有所增加,然而幼苗的生长并没有受抑制,甚至得到促进,可见MWCNT单独暴露在植物可承受的氧化胁迫强度范围内,对植物的伤害并不显著。菲单独暴露下,幼苗MDA的含量也高于对照,冠MDA含量均值约为对照的34倍。上述提到菲的胁迫产生的ROS超出了植物承受能力,损害了酶功能。因此抗氧化系统酶无法正常清除ROS,导致了过氧化产物在植物中的积累。所以,无论从氧化损伤还是植物生长状况来看,菲对植物均产生显著的不利影响。
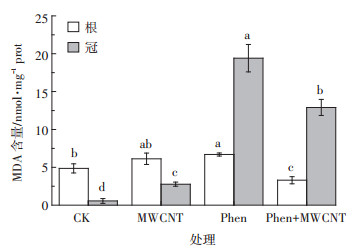
|
图 4 菲与/或碳管对水稻幼苗MDA含量的影响 Figure 4 Effect of phenanthrene and/or MWCNT on MDA content of rice seedlings |
菲+MWCNT同时暴露下的MDA积累情况与对照相比,根MDA含量变化不明显,而冠MDA含量明显增加。与MWCNT或菲单独暴露下的情况相比,可以看出菲+MWCNT同时暴露下冠中过氧化产物的累积与菲的贡献密不可分。但与菲单独暴露相比,根和冠的MDA含量均显著降低(分别低50%和34%)。可见,与菲单独暴露相比,MWCNT虽对复合污染下的酶活改变不大,却能减少幼苗根和冠中氧化产物累积。MDA被视为植物受到氧化伤害的指标之一,因此有理由认为MWCNT缓和了菲对幼苗的伤害。上述提到同时暴露时,MWCNT会降低菲对植物发芽和生长的抑制作用。因此,当环境中存在MWCNT时,菲对植物的毒害将减弱。
2.6 菲+MWCNT同时暴露对幼苗的影响机理分析通过对菲+MWCNT混合污染液中游离态菲的测定,发现除去8%~13%的瓶壁损失,2 h搅拌完成后被MWCNT吸附的菲可达到菲初始浓度的50%以上,而游离态菲不超过0.45 mg·L-1。当吸附达到平衡(约5 d)后,MWCNT吸附的量可达(83±3)%,未被吸附的游离态菲仅为0.06~0.08 mg·L-1。在菲+MWCNT同时暴露实验中,菲与MWCNT的预先接触使大部分菲已被吸附。由于5 d内约半数MWCNT在营养液中逐渐团聚脱离悬浮液体系(图 1B),大量吸附态菲将同时离开悬浮液体系。有文献报道MWCNT能够进入植物体,但碳管可从植物根系向地上部分转移的量非常少[34-35]。又因为菲在碳管上存在迟滞解吸[11],被吸附的菲难以重新释放,所以不论MWCNT是否能进入植物,吸附态菲的生物有效性都将降低。综上所述,MWCNT对菲的吸附和解吸迟滞作用是复合胁迫实验中菲对植物的毒害得以减缓的主要原因。因此,碳纳米材料的存在对缓和持久性环境有机污染物的生态风险有一定作用。
3 结论(1)单一污染暴露时,60 mg·L-1的MWCNT对植物发芽无影响,但对冠的生长有明显促进作用,同时也会激发抗氧化酶活性,导致轻微程度的氧化损伤;而1.2 mg·L-1菲明显抑制植物发芽与生长,并且降低抗氧化酶活性,对植物造成严重的氧化损伤。
(2)1.2 mg·L-1菲+60 mg·L-1 MWCNT同时暴露时,菲对种子发芽和植物生长的抑制作用会被缓解,对酶活有一定影响,但可减轻菲对植物产生的氧化损伤。这是因为菲和MWCNT共存时,MWCNT对菲的吸附和解吸迟滞使菲的生物有效性降低。
| [1] |
Mauter M S, Menachem E. Environmental applications of carbon-based nanomaterials[J]. Environmental Science & Technology, 2008, 42(16): 5843-5859. |
| [2] |
De Volder M F, Tawfick S H, Baughman R H, et al. Carbon nanotubes:Present and future commercial applications[J]. Science, 2013, 339(6119): 535-539. DOI:10.1126/science.1222453 |
| [3] |
Khodakovskaya M, Dervishi E, Mahmood M, et al. Carbon nanotubes are able to penetrate plant seed coat and dramatically affect seed germination and plant growth[J]. ACS Nano, 2009, 3(10): 3221-3227. DOI:10.1021/nn900887m |
| [4] |
Miralles P, Johnson E, Church T L, et al. Multiwalled carbon nanotubes in alfalfa and wheat:Toxicology and uptake[J]. Journal of the Royal Society Interface, 2012, 9(77): 3514-3527. DOI:10.1098/rsif.2012.0535 |
| [5] |
Lin C, Fugetsu B, Su Y, et al. Studies on toxicity of multi-walled carbon nanotubes on arabidopsis T87 suspension cells[J]. Journal of Hazardous Materials, 2009, 170(2/3): 578-583. |
| [6] |
高曦.多环芳烃对植物的基因毒性及氧化胁迫[D].南京: 南京农业大学, 2014. GAO Xi. PAHs induced genotoxicity and oxidative stress in cells of plant[D]. Nanjing: Nanjing Agricultural University, 2014. |
| [7] |
马丽, 何春光, 盛连喜, 等. 松前水稻(Oryza sativa cv. Matsumae)对土壤菲污染的生理生态响应[J]. 生态环境学报, 2010, 19(10): 2435-2440. MA Li, HE Chun-guang, SHENG Lian-xi, et al. The physiological and ecological responses of Oryza sativa cv. Matsumae to phenanthrene polluted soils[J]. Ecology and Environmental Sciences, 2010, 19(10): 2435-2440. DOI:10.3969/j.issn.1674-5906.2010.10.030 |
| [8] |
方婧, 温蓓. TX100悬浮的多壁纳米碳管在土壤中运移及其对菲迁移的影响[J]. 环境科学学报, 2011, 31(2): 334-340. FANG Jing, WEN Bei. Transport of TX100 suspended multi-walled carbon nanotubes (MWCNT) and its effect on the mobility of phenanthrene in soils[J]. Acta Scientiae Circumstantiae, 2011, 31(2): 334-340. |
| [9] |
陈光才, 沈秀娥. 碳纳米管对污染物的吸附及其在土水环境中的迁移行为[J]. 环境化学, 2010, 29(2): 159-168. CHEN Guang-cai, SHEN Xiu-e. Adsorption of environmental contaminants onto carbon nanotubes and their transport in water and soils[J]. Environmental Chemistry, 2010, 29(2): 159-168. |
| [10] |
徐磊, 段林, 陈威. 碳纳米材料的环境行为及其对环境中污染物迁移归趋的影响[J]. 应用生态学报, 2009, 20(1): 205-212. XU Lei, DUAN Lin, CHEN Wei. Carbon nanomaterials:Their environmental behavior and effects on the transport and fate of pollutants in environment[J]. Chinese Journal of Applied Ecology, 2009, 20(1): 205-212. |
| [11] |
周传辉, 夏星辉, 李辛, 等. 菲在四种碳纳米管上的解吸行为研究[J]. 环境科学学报, 2011, 31(11): 2459-2466. ZHOU Chuan-hui, XIA Xing-hui, LI Xin, et al. Desorption of phenanthrene sorbed on multi-walled carbon nanotubes[J]. Acta Scientiae Circumstantiae, 2011, 31(11): 2459-2466. |
| [12] |
Yan L Q, Feng M B, Liu J Q, et al. Antioxidant defenses and histological changes in Carassius auratus after combined exposure to zinc and three multi-walled carbon nanotubes[J]. Ecotoxicology & Environmental Safety, 2015, 125: 61-71. |
| [13] |
Hu X, Liu J, Zhou Q, et al. Bioavailability of organochlorine compounds in aqueous suspensions of fullerene:Evaluated with medaka (Oryzias latipes) and negligible depletion solid-phase microextraction[J]. Chemosphere, 2010, 80(7): 693-700. DOI:10.1016/j.chemosphere.2010.05.042 |
| [14] |
Card J W, Jonaitis T S, Tafazoli S, et al. An appraisal of the published literature on the safety and toxicity of food-related nanomaterials[J]. Critical Reviews in Toxicology, 2011, 41(1): 22-49. |
| [15] |
Ma X, Wang C. Fullerene nanoparticles affect the fate and uptake of trichloroethylene in phytoremediation systems[J]. Environmental Engineering Science, 2010, 27(11): 989-992. DOI:10.1089/ees.2010.0141 |
| [16] |
Torre-roche R D L, Hawthorne J, Deng Y, et al. Multiwalled carbon nanotubes and C60 fullerenes differentially impact the accumulation of weathered pesticides in four agricultural plants[J]. Environmental Science & Technology, 2013, 47(21): 12539-12547. |
| [17] |
李小康, 胡献刚, 周启星. 碳纳米颗粒诱发植物毒性效应及其机理的研究进展[J]. 农业环境科学学报, 2015, 34(11): 2041-2047. LI Xiao-kang, HU Xian-gang, ZHOU Qi-xing. Research progress in phytotoxicity of carbon nanoparticles and its mechanisms[J]. Journal of Agro-Environment Science, 2015, 34(11): 2041-2047. DOI:10.11654/jaes.2015.11.001 |
| [18] |
Panchakarla L S, Govindaraj A, Rao C N R. Nitrogen-and borondoped double-walled carbon nanotubes[J]. Acs Nano, 2007, 1(5): 494-500. DOI:10.1021/nn700230n |
| [19] |
刘尚杰.石墨烯对水稻种子萌发及幼苗生长的影响[D].荆州: 长江大学, 2013. LIU Shang-jie. The effects of graphene on the germination and seedling growth in rice[D]. Jingzhou: Yangtze University, 2013. |
| [20] |
马兵兵, 姜昭, 叶思源, 等. 狼尾草典型生理生化特征对阿特拉津胁迫的响应[J]. 农业环境科学学报, 2015, 34(11): 2083-2088. MA Bing-bing, JIANG Zhao, YE Si-yuan, et al. Typical physiological and biochemical characteristics of Pennisetum americanum L. under atrazine stresses[J]. Journal of Agro-Environment Science, 2015, 34(11): 2083-2088. DOI:10.11654/jaes.2015.11.007 |
| [21] |
袁刚强, 龚继来, 曾光明. 单壁碳纳米管材料对水稻幼苗的毒性效应[J]. 环境科学学报, 2015, 12(35): 4143-4149. YUAN Gang-qiang, GONG Ji-lai, ZENG Guang-ming. Phytotoxicity of single-walled carbon nanotubes to rice seedling (Oryza sativa L.)[J]. Acta Scientiae Circumstantiae, 2015, 12(35): 4143-4149. |
| [22] |
Zuverza-Mena N, Martínez-Fernández D, Du W, et al. Exposure of engineered nanomaterials to plants:Insights into the physiological and biochemical responses:A review[J]. Plant Physiology & Biochemistry, 2016, 110: 236-264. |
| [23] |
姜余梅, 刘强, 赵怡情, 等. 碳纳米管对水稻种子萌发和根系生长的影响[J]. 湖北农业科学, 2014, 53(5): 1010-1012. JIANG Yu-mei, LIU Qiang, ZHAO Yi-qing, et al. Effects of carbon nanotubes on seed germination and root growth of rice[J]. Hubei Agricultural Sciences, 2014, 53(5): 1010-1012. DOI:10.3969/j.issn.0439-8114.2014.05.005 |
| [24] |
Wei H Y, Song S J, Tian H L, et al. Effects of phenanthrene on seed germination and some physiological activities of wheat seedling[J]. Comptes Rendus Biologies, 2014, 337(2): 95-100. DOI:10.1016/j.crvi.2013.11.005 |
| [25] |
Henner P, Schiavon M, Druelle V, et al. Phytotoxicity of ancient gaswork soils. Effect of polycyclic aromatic hydrocarbons (PAHs) on plant germination[J]. Organic Geochemistry, 1999, 30(8): 963-969. DOI:10.1016/S0146-6380(99)00080-7 |
| [26] |
罗春燕, 徐文冰, 陈红春, 等. 胶体富勒烯与菲对水稻发芽及幼苗生长的影响[J]. 环境化学, 2016, 35(5): 1076-1083. LUO Chun-yan, XU Wen -bing, CHEN Hong-chun, et al. Effect of nC60 colloids and phenanthrene on germination and seedling growth of rice[J]. Environmental Chemistry, 2016, 35(5): 1076-1083. |
| [27] |
Tiwari D K, Dasgupta-Schubert N, Cendejas L M V, et al. Interfacing carbon nanotubes (CNT) with plants:Enhancement of growth, water and ionic nutrient uptake in maize (Zea mays) and implications for nanoagriculture[J]. Applied Nanoscience, 2014, 4(5): 577-591. DOI:10.1007/s13204-013-0236-7 |
| [28] |
Wang X, Han H, Liu X, et al. Multi-walled carbon nanotubes can enhance root elongation of wheat (Triticum aestivum) plants[J]. Journal of Nanoparticle Research, 2012, 14(6): 841-850. DOI:10.1007/s11051-012-0841-5 |
| [29] |
Liu H, Weisman D, Ye Y B, et al. An oxidative stress response to polycyclic aromatic hydrocarbon exposure is rapid and complex in Arabidopsis thaliana[J]. Plant Science, 2009, 176(3): 375-382. DOI:10.1016/j.plantsci.2008.12.002 |
| [30] |
常海伟.石墨烯吸附多氯联苯及其对植物毒性的影响研究[D].贵阳: 贵州大学, 2016. CHANG Hai-wei. Effects of the adsorption of polychlorinated biphenyls (PCBs) by graphene on plant toxicity[D]. Guiyang: Guizhou University, 2016. |
| [31] |
Begum P, Fugetsu B. Phytotoxicity of multi-walled carbon nanotubes on red spinach (Amaranthus tricolor L.) and the role of ascorbic acid as an antioxidant[J]. Journal of Hazardous Materials, 2012, 243(4): 212-222. |
| [32] |
郭敏, 龚继来, 曾光明. 多壁碳纳米管对水稻幼苗的植物毒性研究[J]. 生态毒理学报, 2016, 11(5): 94-102. GUO Min, GONG Ji-lai, ZENG Guang-ming. Comprehensive phytotoxicity assessment of multi-wall carbon nanotubes on rice seedlings[J]. Asian Journal of Ecotoxicology, 2016, 11(5): 94-102. |
| [33] |
Mei X, Lin D, Xu Y, et al. Effects of phenanthrene on chemical composition and enzyme activity in fresh tea leaves[J]. Food Chemistry, 2009, 115(2): 569-573. DOI:10.1016/j.foodchem.2008.12.053 |
| [34] |
Larue C, Pinault M, Czamy B, et al. Quantitative evaluation of multiwalled carbon nanotube uptake in wheat and rapeseed[J]. Journal of Hazardous Materials, 2012, 227-228(43): 155-163. |
| [35] |
Cano A M, Kohl K, Deleon S, et al. Determination of uptake, accumulation, and stress effects in corn (Zea mays L.) grown in single-wall carbon nanotube contaminated soil[J]. Chemosphere, 2016, 152: 171-122. |
 2018, Vol. 37
2018, Vol. 37



