2. 天津农学院农学与资源环境学院, 天津 300384
2. College of Agriculture and Environmental Resources, Tianjin Agriculture University, Tianjin 300384, China
土地利用方式变化对全球气候、生物多样性以及生态系统服务功能造成极大影响[1-4]。在过去的几十年中,以砍伐森林为代价的农业面积增加现象在亚洲、南美洲和非洲尤为普遍[5-6]。自二十世纪五十年代以来,我国东北地区土地利用状况同样发生显著变化,主要表现为耕地面积不断增加,而森林等其他类型土地面积不断减少[7]。土地利用方式变化对土壤生态系统的影响已引起全世界的广泛关注[8-9]。
森林转变为耕地是土地利用方式转变的主要类型,这一过程改变了土壤的物理、化学和生物学性质,从而影响土壤质量[10-11]。研究表明,热带和亚热带森林转变为农田后,土壤有机质减少,土壤微生物生物量和酶活性发生显著变化[9, 12],土壤微生物群落结构和功能也发生改变[13]。土壤微生物作为土壤生态系统最为活跃的组成部分,能够灵敏地反映土壤生态环境的变化,已广泛用于指示土壤质量变化和探究不同土地利用方式对土壤特征的影响[12, 14]。土壤微生物生物量和代谢特征作为微生物重要的生物学表征,能够反映土壤中参与调控能量和养分循环的数量及其代谢情况的变化[15-16],受土地利用方式的影响显著[13, 17-18]。在我国东北地区,由于对粮食供应需求的加大,一部分林地已经转变为耕地[7]。虽然土地利用方式转变带来了粮食产量的大幅增加,但是对这种转变下土壤生态系统的变化,特别是土壤微生物群落的变化缺乏研究。同时,在开垦林地的过程中一小部分空地逐渐发展成为天然草地,这种土地利用方式的转变是否为东北地区生态重建提供新的参考以及其土壤生态系统变化情况同样需要相关研究以提供理论依据。
本研究以我国东北丘陵地区白浆土的3种利用方式——林地、耕地以及草地为研究对象,通过测定土壤微生物生物量碳、活性以及群落代谢特征等指标,比较不同土地利用方式土壤微生物生物量碳和群落结构的差异,并耦合理化分析探讨驱动微生物群落代谢特征变化的主要影响因子,探索土壤微生物群落对土地利用方式变化的响应机制,为我国东北丘陵地区白浆土的可持续利用及生态环境重建提供科学依据和理论指导。
1 材料与方法 1.1 研究区概况和研究对象研究区位于吉林省四平市伊通满族自治县,地处长白山脉向松辽平原过渡的丘陵地带。自二十世纪五十年代以来,该地区进行了大量的开垦和采伐,形成了林地、耕地和草地等多样的土地利用类型。本研究的土壤样品采自吉林省四平市伊通满族自治县的西苇镇西苇林场和北京大北农生物技术有限公司吉林省试验示范基地,试验示范基地的耕地由林地转型而来。试验地(125°20′E,43°15′N)属于中温带湿润季风气候区,年平均气温4.6 ℃,无霜期约138 d,年平均降雨量627.8 mm,土壤为白浆土,是吉林省分布面积最大的代表性土壤类型之一[20]。
试验设3个处理:林地(F)、耕地(A)及草地(M)。其中,林地为红松林(Pinus koraiensis),为当地林场的典型林分,林龄已达50年以上;耕地为农用坡耕地,紧邻林地,出于扩大耕地面积的需要,23 a前林场将部分林地树木砍伐后用作农业生产,其耕作制度为玉米连作,常年使用化肥,不施有机肥,近3 a化肥(N: P:K=15:15:15复合肥)施用量平均为750 kg·hm-2,以基肥形式一次性施入,由于丘陵区的地理特征造成玉米生产无法采用机械化作业,只能采用人工种植和收获,玉米播种后喷施乙莠合剂封闭处理,全生育期不喷施农药及不采取其他农事操作。而草地则是在林地树木砍伐后,由一小部分未用于农业生产及其他用途的空地而逐渐形成的天然草地,其以野艾蒿(Artemisia lavandulifolia)、一年逢(Erigeron annuus)、突节老鹤草(Geranium krameri)等草本植物为主,同样已有23 a之久。
1.2 土壤样品采集于2017年6月在各处理样地中采集土壤样品。在林地和草地中分别选取15 m×15 m的3个样方,每个样方中各设15个采样点,采样时去除表层的枯枝落叶,采用W形多点采样法采集0~15 cm的表层土壤。在试验基地中选取3个小区作为耕地样地,小区面积为10 m×15 m,同样采用W形多点采样法在每个小区中随机选取15个采样点,采集0~15 cm的表层土壤。将同一处理同一小区(样方)的土壤充分混匀形成一个混合样品,装入1个自封袋中,放入低温样品储藏箱中带回实验室。土壤样品分为2份,1份存放在4 ℃用于测定微生物生物量碳和功能多样性;1份风干磨细后用于分析理化性质。各处理的土壤基本理化性质见表 1。
|
|
表 1 不同处理的土壤理化性质变化 Table 1 Changes in physical-chemical characteristics of soil in different treatments |
土壤微生物生物量碳采用氯仿熏蒸-硫酸钾提取法[22],称取10 g土壤样品,在真空干燥器中使用氯仿熏蒸培养24 h后,反复抽真空,去除土样中残留的氯仿,每一份土壤样品需要无熏蒸对照。用40 mL 0.5 mol·L-1的硫酸钾溶液浸提30 min,过滤,用TOC测定提取液中的有机碳含量。微生物商用土壤微生物生物量碳含量与有机碳含量的比值表示。
1.4 土壤微生物群落代谢特征微生物群落代谢特征分析采用Biolog微生物自动分析系统(Biolog,Hayward,CA,USA)[23]。称取5 g土壤于三角瓶中,加入45 mL灭菌NaCl溶液(0.85%,下同),恒温培养振荡器中180 r·min-1振荡30 min。取振荡后的土壤溶液加入NaCl溶液稀释至1000倍,吸取150 μL稀释液加到Biolog-Eco微平板孔中,每个样品1板,每板3次重复。Biolog-Eco微平板加盖封好后,置于生化培养箱中28 ℃恒温避光连续培养168 h,每隔24 h读取波长在590 nm(颜色+浊度)和750 nm(浊度)的吸光值。选取Biolog-Eco微平板培养96 h的吸光值进行微生物群落功能多样性指数和微生物碳源利用能力分析。
平均颜色变化率(AWCD)用于描述土壤微生物代谢活性,用590 nm下的相对吸光值减去750 nm下的相对吸光值表示,计算公式如下:

|
式中:Ci(590-750)=(Ai-A0)-(Bi-B0),Ai为第i孔在590 nm处的吸光度值,A0为对照孔在590 nm处的吸光度值,Bi为第i孔在750 nm处的吸光度值,B0为对照孔在750 nm处的吸光度值。n为培养基碳源的种类数,本研究中n值为31。
采用Shannon指数(H’)、Simpson指数(D)和McIntosh指数(U)表征土壤微生物群落功能多样性的变化[16, 20]。计算公式如下:
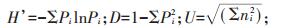
|
式中,Pi为第i孔的相对吸光值与整个平板相对吸光值总和的比值;ni是第i孔的相对吸光值Ci(590-750)。
1.5 数据统计分析采用SPSS 22.0软件中one-way ANOVA的Duncan多重比较方法及Data Reduction工具进行差异显著性分析(P < 0.05)和主成分分析(Principle component analysis,PCA)。采用软件Origin 9.0绘图。通过冗余分析(Redundancy analysis,RDA)确定土壤微生物群落碳源利用模式与环境因子之间的关系。
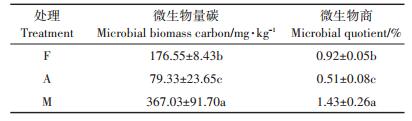
2 结果与分析 2.1 土壤微生物生物量碳和微生物商变化由表 2可见,耕地的微生物生物量碳为79.33 mg·kg-1,比例为林地的0.45(P < 0.01),说明林地转型为耕地后,微生物生物量碳显著降低。而草地的微生物生物量碳达到367.03 mg·kg-1,分别是耕地和林地的4.63倍和2.08倍,差异极显著(P < 0.01),说明草地的微生物生物量碳显著升高。土壤微生物商是指土壤微生物生物量碳占土壤有机碳含量的百分比,反映土壤中活性有机碳所占的比例[25]。微生物商的变化情况与微生物生物量碳相同,即草地>林地>耕地,3种土地利用方式间差异显著。
|
|
表 2 不同处理的微生物量碳和微生物商变化 Table 2 Changes in soil microbial biomass carbon and microbial quotient in different treatments |
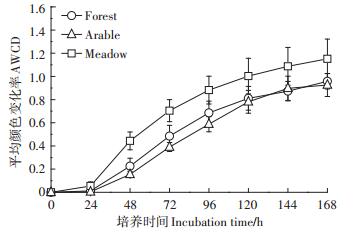
AWCD表征微生物群落碳源利用率,是土壤微生物群落利用单一碳源能力的一个重要指标,反映了土壤微生物代谢活性和群落生理功能多样性[16],数值越高,微生物代谢活性就越高[24]。不同处理土壤AWCD值如图 1所示,随培养时间的延长AWCD值逐渐升高,培养24 h前,各处理土壤的AWCD值无明显变化,培养24 h后,林地、耕地和草地的AWCD值均明显升高。在整个培养过程中,草地的AWCD值明显高于林地和耕地,除培养144 h外,林地的AWCD值均高于耕地。
|
图 1 不同处理土壤平均颜色变化率(AWCD)变化 Figure 1 Changes in AWCD in different treatments |
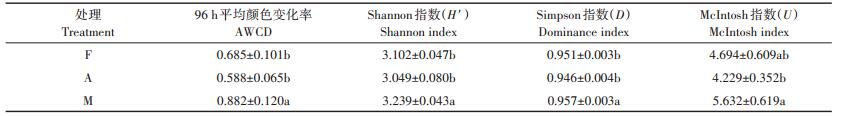
本研究采用96 h的吸光值计算获得微生物群落AWCD值和功能多样性指数。如表 3所示,草地的AWCD值最高,林地次之,耕地最低;草地显著高于林地和耕地(P < 0.05),而林地和耕地间差异不显著(P> 0.05),说明草地土壤微生物对碳源消耗量最大,微生物活性最高,林地次之,而耕地土壤微生物对碳源消耗最少,微生物活性最小。草地的Shannon指数显著高于林地和耕地(P < 0.05),而林地高于耕地,林地和耕地的差异同样不显著(P>0.05),Simpson指数和McIntosh指数的分析结果与Shannon指数相同。以上结果表明,不同处理的微生物群落Shannon指数、Simpson指数和McIntosh指数的变化表现出与AWCD相似的规律,说明林地转型为耕地降低了土壤微生物群落代谢活性和利用底物碳源的微生物种类,而草地土壤微生物群落代谢活性和多样性指数均显著升高。
|
|
表 3 不同处理土壤微生物群落AWCD和多样性指数变化 Table 3 Changes in AWCD and functional diversity indices of soil microbial community in different treatments |
Biolog-Eco微平板上共有31种单一碳源,可分为6大类,包括糖类(12种)、氨基酸类(6种)、羧酸类(5种)、聚合物类(4种)、胺类(2种)和酚酸类(2种)。由图 2可见,3种土地利用方式土壤微生物对各类碳源相对利用率最高的是糖类,占总碳源利用率的44.63%~53.61%,其次为氨基酸类,占总碳源利用率的21.09%~25.45%,羧酸类次之,占总碳源利用率的8.31%~15.16%,而对其他3类碳源的相对利用率较低。耕地土壤微生物对糖类、酚酸类和氨基酸类碳源的相对利用率高于林地,其中对氨基酸的相对利用率显著高于林地(P < 0.05),而对羧酸类、聚合物类和胺类碳源的相对利用率低于林地,对聚合物类的相对利用率差异显著(P < 0.05)。而草地土壤微生物对羧酸类、酚酸类和胺类利用率在3种土地利用方式中最高,而对糖类和氨基酸类碳源的相对利用率最低,对聚合物类的相对利用率介于林地和耕地之间。说明土地利用方式变化改变了土壤微生物对碳源利用的偏好。
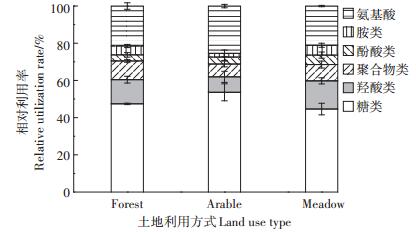
|
图 2 不同处理土壤微生物群落相对利用率的变化 Figure 2 Changes of relative utilization rate by soil microbial community in different treatments |
主成分分析可以清晰反映各处理在碳源利用上的具体差异。主成分个数的提取原则一般要求其累积方差贡献率达到85.0%[25],本研究共提取7个主成分,累积方差贡献率达到96.9%。选取累积方差贡献率为48.9%的前2个主成分PC1和PC2来分析土壤微生物群落功能多样性。一般认为,位于同一象限的各处理在第1、2主成分得分值离散较小,没有显著性差异,说明这些处理土壤的微生物碳代谢功能群结构相似;位于不同象限的各处理在第1、2主成分得分值差异较大,说明不同处理土壤微生物碳代谢功能群结构存在较大差异[25]。由图 3可以看出,耕地位于第三象限,林地位于第三和第四象限,而草地位于第一、二和四象限。耕地和林地间的距离要小于耕地、林地与草地的距离。说明林地转型为耕地后,土壤微生物对底物碳源的代谢特征发生明显变化,而草地土壤微生物对底物碳源的代谢特征显著不同,与草地相比,耕地与林地土壤微生物群落功能结构较为相似。

|
图 3 不同处理微生物碳源利用类型的主成分分析 Figure 3 Principal components analysis of carbon utilization of microbial community in different treatments |
对3种土地利用方式土壤微生物群落对不同碳源利用的相对吸光值进行RDA分析,确定环境因子对土壤微生物群落碳源利用模式的影响。结果(图 4)表明,前两轴可以解释土壤微生物代谢特征变化的67.9%,耕地、林地和草地土壤微生物群落代谢特征明显发生分离,且分别聚为一类。速效磷、铵态氮和硝态氮与耕地土壤微生物代谢特征变化显著相关;全氮和全磷与草地土壤微生物代谢特征显著相关;有机质和土壤pH与林地土壤微生物代谢特征相关。经蒙特卡洛检验发现,土壤pH(P=0.004)、全氮TN(P=0.004)、有机质OM(P=0.014)、速效磷AP(P=0.026)和硝态氮NO-3-N(P=0.026)与土壤微生物代谢特征变化显著相关,说明土地利用方式变化后土壤微生物群落代谢特征变化是这5种环境因子共同作用的结果。

|
TP、AP、TN、NH4、NO3、OM和pH分别代表总磷、速效磷、总氮、铵态氮、硝态氮、有机质和pH TP, AP, TN, NH4, NO3, OM and pH present total phosphorus, available phosphorus, total nitrogen, NH4+-N, NO3--N, organic matter, pH 图 4 不同处理土壤微生物代谢特征的RDA分析 Figure 4 RDA analysis of soil microbial community metabolic characteristics in different treatments |
土壤微生物不仅是土壤养分转化与循环的动力,本身也是土壤养分的储存库,对土壤养分的转化与供应起到重要作用[32]。本研究发现林地土壤微生物生物量碳显著高于耕地,而草地的微生物生物量碳显著高于林地,说明耕地和草地土壤微生物生物量较林地向相反的方向变化。相关分析发现,土壤微生物生物量碳与土壤pH(R=0.733,P=0.025)和有机质(R=0.900,P=0.001)分别呈显著正相关和极显著正相关关系。本研究中林地转变为耕地后,土壤pH显著降低(表 1),这与长期施用化肥导致农田土壤酸化加剧有关[26-27]。微生物生长受到土壤酸化加剧的抑制,其活性也相应降低[32]。耕地的有机质含量低于林地(表 1),这与Fang等[30]研究结果一致。土壤有机质含量取决于碳输入和降解速率的平衡,而农田向土壤输入碳的量低于自然生态系统[31],随着其自身碳源的不断消耗,有机质含量逐渐降低。土壤中多数微生物是异养型的,受到有机质的影响显著,其分布和活性均依赖于有机质[33-34],因此微生物生物量碳与有机质含量表现为正相关。但是本试验地为丘陵地,其独特的地理特征也决定了其耕作制度,由于无法采用机械化,因此玉米的种植和收获均采用人工方式,这导致收获后,除玉米地上部分移出农田外,其根茬仍全部保留在农田里,这可能是耕地土壤中有机质含量较林地下降不显著的原因,但不同土地利用类型下返还到土壤中碳源类型的改变可能造成微生物数量的显著变化,其生物量碳也发生显著变化。由于草地在树木砍伐后受到人为的扰动较少,且不同植物交错叠加,根系分泌物丰富,有机质含量和pH最高,为微生物的生存和繁殖提供了所需的营养和能源物质以及适宜的生存环境,因此其微生物生物量碳也最高。同时,本研究中反映土壤中活性有机碳所占比例的微生物商的变化情况与微生物生物量碳相同,表明土地利用方式变化改变了土壤微生物商,土壤活性有机碳的周转发生了相应改变。
耕地的AWCD值和多样性指数均低于林地,说明林地转变为耕地后加之长期化肥施加,土壤微生物主要代谢类群发生改变,微生物群落的多样性指数降低和利用碳源能力下降。与Bossio等[37]研究发现在热带地区森林土壤微生物群落多样性指数高于连续种植玉米的农田及Brackin等[38]研究发现农田土壤碳源底物利用水平低于桉树林的研究结果一致。同时发现草地的AWCD值和多样性指数均显著高于耕地和林地,分析认为草地与耕地和林地相比,其地表植被发生明显改变,这导致了根系分泌物的变化,已有研究表明根系分泌物对土壤微生物的分布有重要作用,直接影响土壤微生物的数量、活性和群落结构[38],同时其土壤理化性质也有明显改变,这些方面差异的综合作用造成了草地微生物的活性和多样性明显变化。
微生物对不同类型碳源的相对利用程度可以反映微生物的代谢功能类群[39]。本研究显示,耕地对氨基酸、酚酸类和糖类的相对利用率高于林地,而对羧酸类、聚合物类和胺类碳源的相对利用率低于林地,这6种碳源中,对糖类和氨基酸类的相对利用率(累计79.1%)明显高出林地(68.9%),这些易于代谢的高能量底物最容易被农田土壤中的微生物代谢[38]。而Biolog-Eco微平板所提供的31种单一碳源中的18种为糖类和氨基酸类,符合耕地土壤微生物群落对碳源的偏好,因此耕地微生物群落在碳源充足的条件下,生长繁殖速度加快,代谢能力提高。林地土壤微生物群落对氨基酸类、糖类和羧酸类碳源的相对利用率相对较高,这与胡婵娟等[40]的研究结果一致,而且林地对羧酸类碳源的相对利用率明显提升,符合Brackin等[38]研究羧酸类碳源是森林土壤微生物利用的重要碳源的结果。而草地对糖类和氨基酸类碳源的相对利用率在3种土地利用方式中最低,而对羧酸类、酚酸类和胺类利用率最高,对聚合物类的相对利用率介于林地和草地之间,说明其土壤微生物对碳源利用的偏好同样发生了明显变化。PCA分析结果发现林地转变为耕地后,土壤微生物碳源的利用发生改变,而草地土壤微生物对底物碳源的代谢特征显著不同于林地和耕地。通过RDA分析,进一步发现土壤pH、总氮、有机质、速效磷和硝态氮与微生物功能多样性密切相关,说明土地利用方式变化改变了土壤的理化性质,进而导致了土壤微生物功能群落的不同。
4 结论(1)土壤微生物生物量碳、微生物商、代谢活性和功能多样性变化情况相同,均表现为草地>林地>耕地。
(2)土壤微生物对碳源利用的偏好因土地利用方式而改变。3种土地利用方式土壤微生物群落结构不同,但与草地相比,耕地与林地土壤微生物群落结构较为相似。
(3)土壤理化性质的改变是导致微生物群落代谢特征变化的主要原因,其代谢特征变化主要受土壤pH、总氮、有机质、速效磷和硝态氮等因子共同影响。
(4)虽然草地土壤微生物活性和多样性等指标均明显高于林地和耕地,但按照因地制宜的环境改善策略,在吉林省丘陵区采用退耕还林的生态重建方案更符合当地实际。
| [1] |
Tilman D, Fargione J, Wolff B, et al. Forecasting agriculturally driven global environmental change[J]. Science, 2001, 292(5515): 281-284. DOI:10.1126/science.1057544 |
| [2] |
Foley J A, De Fries R, Asner G P, et al. Global consequences of land use[J]. Science, 2005, 309(5734): 570-574. DOI:10.1126/science.1111772 |
| [3] |
Turner B L, Lambin E F, Reenberg A. The emergence of land change science for global environmental change and sustainability[J]. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(52): 20666-20671. DOI:10.1073/pnas.0704119104 |
| [4] |
Meyer K M, Klein A M, Rodrigues J L, et al. Conversion of Amazon rainforest to agriculture alters community traits of methane-cycling organisms[J]. Molecular Ecology, 2017, 26: 1547-1556. DOI:10.1111/mec.14011 |
| [5] |
Food and Agriculture Organization of the United Nations. State of the world' s forests, 2012[R]. Rome: Food and Agriculture Organization of the United Nations, 2012.
|
| [6] |
Achard F, Beuchle R, Mayaux P, et al. Determination of tropical deforestation rates and related carbon losses from 1990 to 2010[J]. Global Change Biology, 2014, 20(8): 2540-2554. DOI:10.1111/gcb.2014.20.issue-8 |
| [7] |
王慧杰.建国以来东北地区耕地演化及其生态环境后效[D].长春: 东北师范大学, 2006. WANG Hui-jie. Cultivated land evolution of Northeast and its ecological environment result after founding of the nation[D]. Changchun: Northeast Normal University, 2006. http://cdmd.cnki.com.cn/Article/CDMD-10200-2006099108.htm |
| [8] |
Nguyen M L, Haynes R J, Goh K M. Nutrient budgets and status in three pairs of conventional and alternative mixed cropping farms in Canterbury, New Zealand[J]. Agriculture Ecosystems and Environment, 1995, 52(2/3): 149-162. |
| [9] |
Maharjan M, Sanaullah M, Razavi B S, et al. Effect of land use and management practices on microbial biomass and enzyme activities in subtropical top-and sub-soils[J]. Applied Soil Ecology, 2017, 113: 22-28. DOI:10.1016/j.apsoil.2017.01.008 |
| [10] |
Schloter M, Dilly O, Munch J C. Indicators for evaluating soil quality[J]. Agriculture Ecosystems and Environment, 2003, 98(1/2/3): 255-262. |
| [11] |
Lagomarsino A, Benedetti A, Marinari S, et al. Soil organic C variability and microbial functions in a Mediterranean agro-forest ecosystem[J]. Biology and Fertility of Soils, 2011, 47(3): 283-291. DOI:10.1007/s00374-010-0530-4 |
| [12] |
Mganga K Z, Razavi B S, Kuzyakov Y. Land use affects soil biochemical properties in Mt. Kilimanjaro region[J]. Catena, 2016, 141: 22-29. DOI:10.1016/j.catena.2016.02.013 |
| [13] |
Tosi M, Correa O S, Soria M A, et al. Land-use change affects the functionality of soil microbial communities:A chronosequence approach in the Argentinian Yungas[J]. Applied Soil Ecology, 2016, 108: 118-127. DOI:10.1016/j.apsoil.2016.08.012 |
| [14] |
Yao Z Y, He Z L, Huang C Y. Effect of land use history on microbial diversity in red soils[J]. Journal of Soil and Water Conversion, 2003, 17(2): 51-54. |
| [15] |
王宁, 王美菊, 李世兰, 等. 降水变化对红松阔叶林土壤微生物生物量生长季动态的影响[J]. 应用生态学报, 2015, 26(5): 1297-1305. WANG Ning, WANG Mei-ju, LI Shi-lan, et al. Effects of precipitation variation on growing seasonal dynamics of soil microbial biomass in broadleaved Korean pine mixed forest[J]. Chinese Journal of Applied Ecology, 2015, 26(5): 1297-1305. |
| [16] |
曹永昌, 谭向平, 和文祥, 等. 秦岭地区不同林分土壤微生物群落代谢特征[J]. 生态学报, 2016, 36(10): 2978-2986. CAO Yong-chang, TAN Xiang-ping, HE Wen-xiang, et al. The metabolism characteristics of microbial community in different forest soil in Qinling Mountains Area[J]. Acta Ecologica Sinica, 2016, 36(10): 2978-2986. |
| [17] |
周正虎, 王传宽. 帽儿山地区不同土地利用方式下土壤-微生物-矿化碳氮化学计量特征[J]. 生态学报, 2017, 37(7): 2428-2436. ZHOU Zheng-hu, WANG Chuan-kuan. Soil-microbe-mineralization carbon and nitrogen stoichiometry under different land -uses in the Maoershan region[J]. Acta Ecologica Sinica, 2017, 37(7): 2428-2436. |
| [18] |
蔡进军, 董立国, 李生宝, 等. 黄土丘陵区不同土地利用方式土壤微生物功能多样性特征[J]. 生态环境学报, 2016, 25(4): 555-562. CAI Jin-jun, DONG Li-guo, LI Sheng-bao, et al. The characteristics of soil microbe function diversity in semi- arid Loess Hilly region[J]. Ecology and Environmental Sciences, 2016, 25(4): 555-562. |
| [19] |
孟庆英, 张春峰, 贾会彬, 等. 不同机械改土方式对白浆土物理特性及酶活性的影响[J]. 土壤学报, 2016, 53(2): 552-559. MENG Qing-ying, ZHANG Chun-feng, JIA Hui-bin, et al. Effects of mechanical soil amelioration method on physical properties of and enzyme activity in planosol[J]. Acta Pedologica Sinica, 2016, 53(2): 552-559. |
| [20] |
孙元宏, 高雪莹, 赵兴敏, 等. 添加玉米秸秆对白浆土重组有机碳及团聚体组成的影响[J]. 土壤学报, 2017, 54(4): 1009-1017. SUN Yuan-hong, GAO Xue-ying, ZHAO Xing-min, et al. Effects of corn stalk incorporation on organic carbon of heavy fraction and composition of soil aggregates in albic soil[J]. Acta Pedologica Sinica, 2017, 54(4): 1009-1017. |
| [21] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2008. BAO Shi-dan. Soil analysis[M]. The third edition. Beijing: China Agriculture Press, 2008. |
| [22] |
吴金水, 林启美, 黄巧云, 等. 土壤微生物生物量测定方法及其应用[M]. 北京: 气象出版社, 2006. WU Jin-shui, LIN Qi-mei, HUANG Qiao-yun, et al. Method for measuring soil microbial biomass and its application[M]. Beijing: China Meteorological Press, 2006. |
| [23] |
邹春娇, 齐明芳, 马建, 等. Biolog-ECO解析黄瓜连作营养基质中微生物群落结构多样性特征[J]. 中国农业科学, 2016, 49(5): 942-951. ZOU Chun-jiao, QI Ming-fang, MA Jian, et al. Analysis of soil microbial community structure and diversity in cucumber continuous cropping nutrition medium by biolog-ECO[J]. Scientia Agricultura Sinica, 2016, 49(5): 942-951. |
| [24] |
顾美英, 唐光木, 刘洪亮, 等. 施用棉秆炭对新疆连作棉花根际土壤微生物群落结构和功能的影响[J]. 应用生态学报, 2016, 27(1): 173-181. GU Mei- ying, TANG Guang- mu, LIU Hong- liang, et al. Effects of cotton stalk biochar on microbial community structure and function of continuous cropping cotton rhizosphere soil in Xinjiang, China[J]. Chinese Journal of Applied Ecology, 2016, 27(1): 173-181. |
| [25] |
刘满强, 胡锋, 何园球, 等. 退化红壤不同植被恢复下土壤微生物量季节动态及其指示意义[J]. 土壤学报, 2003, 40(6): 937-944. LIU Man-qiang, HU Feng, HE Yuan-qiu, et al. Seasonal dynamics of soil microbial biomass and its significance to indicate soil quality under different vegetations restored on degraded red soils[J]. Acta Pedologica Sinica, 2003, 40(6): 937-944. DOI:10.3321/j.issn:0564-3929.2003.06.020 |
| [26] |
Malhi S S, Nyborg M, Harapiak J T. Effects of long-term N fertilizerinduced acidification and liming on micronutrients in soil and in bromegrass hay[J]. Soil and Tillage Research, 1998, 48(1): 91-101. |
| [27] |
Zhou J, Xia F, Liu X, et al. Effects of nitrogen fertilizer on the acidification of two typical acid soils in South China[J]. Journal of Soils and Sediments, 2014, 14(2): 415-422. DOI:10.1007/s11368-013-0695-1 |
| [28] |
Cai Z J, Wang B R, Xu M G, et al. Intensified soil acidification from chemical N fertilization and prevention by manure in an 18-year field experiment in the red soil of southern China[J]. Journal of Soils and Sediments, 2015, 15(2): 260-270. DOI:10.1007/s11368-014-0989-y |
| [29] |
Zhou J, Jiang X, Zhou B, et al. Thirty four years of nitrogen fertilization decreases fungal diversity and alters fungal community composition in black soil in northeast China[J]. Soil Biology and Biochemistry, 2016, 95: 135-143. DOI:10.1016/j.soilbio.2015.12.012 |
| [30] |
Fang X, Wang Q, Zhou W, et al. Land use effects on soil organic carbon, microbial biomass and microbial activity in Changbai Mountains of northeast China[J]. Chinese Geographical Science, 2014, 24(3): 297-306. DOI:10.1007/s11769-014-0670-9 |
| [31] |
Huang J Y, Song C C. Effects of land use on soil water soluble organic C and microbial biomass C concentrations in the Sanjiang Plain in northeast China[J]. Acta Agriculturae Scandinavica, Section B-Plant Soil Science, 2010, 60(2): 182-188. |
| [32] |
宋蒙亚, 李忠佩, 吴萌, 等. 不同种植年限设施菜地土壤微生物量和群落结构的差异[J]. 中国农业科学, 2015, 48(18): 3635-3644. SONG Meng-ya, LI Zhong-pei, WU Meng, et al. Changes in soil microbial biomass and community structure with cultivation chronosequence of greenhouse vegetables[J]. Scientia Agricultura Sinica, 2015, 48(18): 3635-3644. DOI:10.3864/j.issn.0578-1752.2015.18.007 |
| [33] |
Moscatelli M C, Di Tizio A, Marinari S, et al. Microbial indicators related to soil carbon in Mediterranean land use systems[J]. Soil and Tillage Research, 2007, 97(1): 51-59. DOI:10.1016/j.still.2007.08.007 |
| [34] |
Yang K, Zhu J J, Zhang M, et al. Soil microbial biomass carbon and nitrogen in forest ecosystems of northeast China: A comparison between natural secondary forest and larch plantation[J]. Journal of Plant Ecology, 2010, 3(3): 175-182. DOI:10.1093/jpe/rtq022 |
| [35] |
Bottner P. Response of microbial biomass to alternate moist and dry conditions in a soil incubated with 14C and 15N-labelled plant-material[J]. Soil Biology and Biochemistry, 1985, 17(3): 329-337. DOI:10.1016/0038-0717(85)90070-7 |
| [36] |
Devi N B, Yadava P S. Seasonal dynamics in soil microbial biomass C, N and P in a mixed-oak forest ecosystem of Manipur, North-east India[J]. Applied Soil Ecology, 2006, 31(3): 220-227. DOI:10.1016/j.apsoil.2005.05.005 |
| [37] |
Bossio D A, Girvan M S, Verchot L, et al. Soil microbial community response to land use change in an agricultural landscape of western Kenya[J]. Microbial Ecology, 2005, 49(1): 50-62. DOI:10.1007/s00248-003-0209-6 |
| [38] |
Brackin R, Robinson N, Lakshmanan P, et al. Microbial function in adjacent subtropical forest and agricultural soil[J]. Soil Biology and Biochemistry, 2013, 57(3): 68-77. |
| [39] |
张红, 吕家珑, 曹莹菲, 等. 不同植物秸秆腐解特性与土壤微生物功能多样性研究[J]. 土壤学报, 2014, 51(4): 743-752. ZHANG Hong, LÜ Jia-long, CAO Ying-fei, et al. Decomposition characteristics of different plant straws and soil microbial functional diversity[J]. Acta Pedologica Sinica, 2014, 51(4): 743-752. |
| [40] |
胡婵娟, 傅伯杰, 刘国华, 等. 黄土丘陵沟壑区典型人工林下土壤微生物功能多样性[J]. 生态学报, 2009, 29(2): 727-733. HU Chan-juan, FU Bo-jie, LIU Guo-hua, et al. Soil microbial functional and diversity under typical artificial woodlands in the hilly area of the Loess Plateau[J]. Acta Ecologica Sinica, 2009, 29(2): 727-733. DOI:10.3321/j.issn:1000-0933.2009.02.022 |
 2018, Vol. 37
2018, Vol. 37