2. 中国科学院南京地理与湖泊研究所, 南京 210008;
3. 中国科学院武汉植物园, 武汉 430074
2. Institute of Geography and Limnology, Chinese Academy of Sciences, Nanjing 210008, China;
3. Botanical Garden, Chinese Academy of Sciences, Wuhan 430074, China
随着我国工业等点源污染不断得到治理,以农田养分流失、分散型农村生活污水以及养殖业废水无序排放为主要特征的农业面源污染逐渐成为我国环境污染的主要问题,农业源氮、磷的排放已成为我国江河、湖泊、水库水体富营养化的主要因素[1-2]。目前对于污水和污染水体的治理技术主要包括生态滤池、稳定塘、生物膜等生态治理技术[3],利用水生植物吸收水体氮磷的人工湿地治理技术具有低成本、低能耗、无污染、资源循环等特点,是当前世界各国倡导的生态治污技术研发方向[4]。但不同植物的生态习性差异较大,物种的选择与管理是该技术的关键[5]。常见的湿地植物美人蕉、菖蒲、芦苇等对水体净化有一定的效果[6],但普遍存在生长周期短、地上部不能正常越冬、不易在高浓度废水环境下生长等缺陷[7-8]。近年来中国科学院亚热带农业生态研究所筛选出了浮水植物绿狐尾藻(Myriophyllum elatinoides),将其用于南方地区农村高负荷养殖废水、分散型生活污水以及富营养化水体的生态治理,取得了显著效果[9-10],而且该植物具有蛋白质含量高、氨基酸组成均衡、矿物质丰富等特点,可适用于猪、牛、鸡、鸭、鹅、鱼等多种畜禽水产的饲料加工[11],具有很强的资源化利用潜力。但是鉴于绿狐尾藻原产于南美洲地区[12-13],是一种典型的外来物种[14-15],尽管作为景观植物已经引入我国数十年[16-17],但是大范围应用于治污还少见报道,且公众出于以往引入水花生(Alternanthera philoxeroides)、水葫芦(Eichhornia crassipes)等外来植物导致生物入侵问题的教训[18-20],尤其是科研人员对进一步推广应用绿狐尾藻开展生态治污的生态风险存有疑虑[21-22]。基于此,本文依托中国科学院位于全国不同区域的11个野外观测台站,对绿狐尾藻生长的主要影响因素及其与其他植物的生态竞争关系等开展了多点比较研究,以期为明确绿狐尾藻生态治污技术的区域适应范围,并对其可能存在的生态风险作出客观评价。
1 材料与方法 1.1 研究区域本研究以长江流域以南的亚热带地区为主开展绿狐尾藻生态适应性试验,研究区南北跨度1600 km,东西跨度1800 km,涉及8个省(市、区)的9个地貌类型区域。气候类型包括温带(山东禹城)、北亚热带(湖北丹江口,江苏无锡、常熟)、中亚热带(江西万年,湖南长沙、岳阳、桃源,重庆忠县,四川盐亭)和南亚热带(广西环江)等。年均气温变化范围为12.0~ 18.2 ℃,年均降水量为555.5~1808 mm(表 1),基本涵盖了我国绿狐尾藻可能应用的主要气候与地貌类型区域。
|
|
表 1 绿狐尾藻生态适应性试验区自然条件 Table 1 Nature condition of ecological adaptability of M. elatinoides test site |
本研究以绿狐尾藻(M. elatinoides)为主要试验材料。绿狐尾藻为小二仙草科(Haloragidaceae)狐尾藻属浮水或沉水植物,原产地为南美洲,雌雄异花,在中国只开雌花,不能正常结实,主要为无性繁殖[23-24]。植株对水体中养分的吸收能力强,可用于水体污染治理[25-27]。11个台站试验材料均来自中国科学院亚热带农业生态研究所长沙农业环境观测研究站,最初的种源为研究人员在长沙的花卉市场购买,然后在试验站进行了扩繁。
1.3 研究方法 1.3.1 绿狐尾藻生长适应性试验在中国科学院太湖湖泊生态系统研究站(以下简称“太湖站”),开展绿狐尾藻生长限制因子控制性试验,试验共设置了水位波动、底泥养分含量、风浪条件及蓝藻爆发4个环境因子的控制性试验。
(1)水位深度和底泥类型对绿狐尾藻生长影响试验:试验设3个水深(30、60 cm和90 cm)和2种底泥(黄泥土和黑泥土,前者较瘦而后者较肥)共6个处理,白色塑料圆桶规格为直径40 cm、深度100 cm。首先分别在每个桶中加入20 kg风干黄泥土或黑泥土作为底泥,再放水至要求的水深,然后直接在底泥上栽种绿狐尾藻(种苗用量为4 kg·m-2,下同),每周测定绿狐尾藻生长情况,连续观测3周(21 d),观测指标包括高(长)度与新鲜生物量。
(2)风浪对绿狐尾藻生长影响试验:在太湖边设置3组1 m×1 m的样框(距离岸边分别为0、50、150 m),放置绿狐尾藻(种苗用量为4 kg·m-2),每周测定绿狐尾藻生长情况,并计算生长速率,连续观测2个月(60 d)。
(3)蓝藻爆发影响试验:通过添加营养盐(氯化铵、磷酸钙)模拟河道污水,使水体氨氮浓度达到25 mg·L-1,总磷浓度达到3 mg·L-1,以促进蓝藻水华的爆发,每2周观测一次蓝藻水华爆发(水体叶绿素a含量)与绿狐尾藻生长状况,连续观测6周(42 d)。
1.3.2 绿狐尾藻生态竞争力试验(1)香蒲、莲群落竞争试验:在丹江口水库流域生态试验站(以下简称为“丹江口站”,位于丹江口市习家店镇五龙池村),分别选取当地典型代表性挺水植物香蒲(Typha orientalis)和莲(Nelumbo nucifera)构成的天然人工池塘各一个,面积均为400 m2左右。于2015年4月在香蒲和莲未长出之前种植绿狐尾藻,种苗用量为4 kg·m-2,于5月开始每个月定期观测群落物种组成及其盖度变化,分析绿狐尾藻与香蒲、莲的竞争关系。
(2)绿狐尾藻湿地群落自然演替试验:在长沙农业环境观测研究站(以下简称“长沙站”,位于长沙县金井镇脱甲村)进行,选取生长良好的绿狐尾藻生态湿地,样地长83 m、宽64 m。从2015年4月开始不再进行收割、清除杂草等人工管理,任由群落自然演替,分别于4、8、12月在样地内设置样方进行群落调查,沿湿地样地对角线方向设置10个1 m×1 m的样方,调查各样方内所有植物的种类和盖度。
(3)物种综合竞争试验:该试验为湿地小区控制试验,在长沙站进行,设置7个处理,每处理设置3个重复,随机排列。7个处理分别为当地常见的7种水生植物,包括水花生(Alternanthera Philoxeroides)、水葫芦(Eichhornia crassipes)、水稻(Oryza sativa)、梭鱼草(Pontederia cordata)、黑三棱(Sparganium stoloniferum)、红萍(Azolla imbircata)、铜钱草(Hydrocotyle chinensis),将每种植物分别与绿狐尾藻进行混种,观测其植物盖度的变化。试验小区长30 m、宽4 m,水深10~20 cm(水稻小区除外,要根据水稻管理要求控制水深)。2016年3月开始试验,每种植物的初始盖度约为50%,试验阶段为3—11月,在5、7月和11月进行调查和采样,主要测定指标包括水稻籽粒产量和植物冠层盖度。
1.3.3 绿狐尾藻虫害观测在11个台站的每一个试验点均观测记录当地绿狐尾藻生长过程中害虫的发生和危害情况,记录并鉴定害虫的种类,并拍照留存。观测时间为一年(2015年全年)。
1.4 数据处理及分析采用Excel软件进行一般性数据计算和作图,用SPSS 18.0统计软件包进行方差分析与Duncan′s多重比较。
2 结果与分析 2.1 绿狐尾藻在不同区域的生长与虫害情况11个野外站点的观测结果表明,在生长季节绿狐尾藻在各试验区域均可以正常生长,尤其在高浓度(氨氮浓度为50~300 mg·L-1)养殖废水中也能生长良好,其生物质产量一般可达300~450 t·hm-2(鲜质量,含水量85%~90%)。从全国多地(不仅限于这11个站点)的观测来看,绿狐尾藻生育期具有明显的气候地带性:在南亚热带地区(广西富川、环江),绿狐尾藻全年可以生长,3—4月初开花;在中亚热带(湖南)和北亚热带地区(湖北、江苏、浙江)则在3—12月上旬生长,在4月初—5月中旬开花,在12月上旬—2月下旬以浮水状态休眠(不沉水),此时在绿狐尾藻表层会覆盖一层厚度为3~5 cm的干枯植株,但在水面附近及水下植株则依然保持为翠绿色的活体状态;在亚热带地区的西部(云南昆明和贵州贵阳),其生长期与长沙接近,但是花期有明显滞后,从5月中旬开始一直会延续到7月;在温带地区(山东禹城)其生长期缩短到4月初—11月中旬(霜冻前),花期为5月,冬季如果不采取保温措施,则植株会被全部冻死甚至腐烂,但是在温室大棚中可以良好生长。因此绿狐尾藻在北方地区不能正常越冬。
全国不同区域虫害的观察结果表明,绿狐尾藻从南到北其生长过程中均有虫害发生,大部分试验区害虫主要为斜纹夜蛾(Prodenia litura,图 1A),而在长沙站还发现有造桥虫(Ascotis selenaria,图 1B),这些均为食叶性害虫,在夏季(7—8月)繁衍迅速,以爆发态势快速发展,仅需几天时间绿狐尾藻叶子就会被害虫吞噬殆尽,严重时会造成绿狐尾藻植株死亡。

|
图 1 绿狐尾藻害虫危害状况 Figure 1 The damaged status of M. elatinoides by pests |
太湖站的试验结果表明,水位、底泥、风浪及蓝藻爆发等因子对绿狐尾藻生长均有不同程度的影响(图 2)。由图 2A结果可见,离岸0 m和50 m,观测期绿狐尾藻净生长率分别为39.0%和24.2%,绿狐尾藻生物量均有不同程度的增加,但是净生长率呈明显下降趋势,在离岸较远的150 m区域绿狐尾藻生物量则出现负增长,其净生长率为-48.8%,表明随离岸距离的延长,风浪扰动会显著抑制狐尾藻的生长。

|
A.风浪试验;B.蓝藻爆发试验:水体叶绿素a含量变化;C.水位和底泥影响试验 A.Stormy wave; B.Cyanobacteria bloom; C.Water level and sediments types 图 2 环境因子对绿狐尾藻生长的影响 Figure 2 Effect of environmental factors on the growth of M. elatinoides |
蓝藻爆发试验结果表明,在模拟试验的前14 d,水体中浮游植物蓝藻的生物量较低,绿狐尾藻生长迅速,特定生长率较高,为0.07 g·d-1,总生物量增加了195.4%,而从第14 d到第42 d绿狐尾藻特定生长率较低,仅为0.01~0.02 g·d-1,生物量仅增加了23.3%(图 2B)。可见,水体营养过剩导致的蓝藻水华会显著抑制绿狐尾藻的生长。
在不同水位条件下,不论底质是黑泥还是黄泥,绿狐尾藻株高均随水深的增加而显著增加(图 2C1),但是地上部生物量(图 2C2)、根系生物量(图 2C3)以及根长(图 2C4)则均随水深的增加而减小。另外,在同一水位下,养分条件较好的黑泥底质中株高的长势优于养分较差的黄泥底质。试验进行至21 d,在水深分别为30、60、90 cm的条件下,黄泥底质中绿狐尾藻株高生长率分别为231.7%、378.3%、441.7%,而养分条件较好的黑泥底质中绿狐尾藻株高生长率则为373.3%、443.3%、546.7%(图 2C2)。生物量、根长也都表现出相同的变化趋势。总体而言,低水位且肥沃的底质条件更有利于绿狐尾藻的生长。
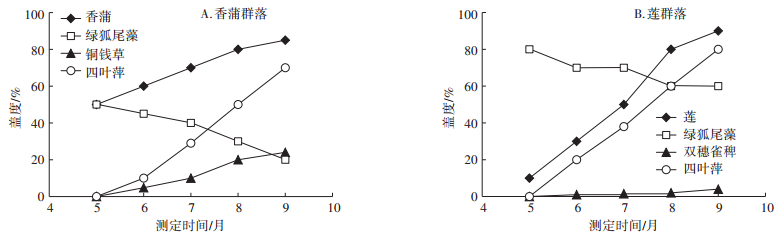
2.3 绿狐尾藻生态竞争力丹江口站的试验结果表明,从2015年5月开始,随着香蒲和莲两个群落优势种盖度的不断增加,绿狐尾藻的盖度均呈显著的下降趋势,到9月在莲群落中绿狐尾藻的盖度从80%降低到60%左右,且长势明显减弱(图 3B),而在香蒲群落中其盖度的降低更为明显,从50%降至20%左右(图 3A)。两个群落中还分别增加了诸多其他伴生植物,主要有四叶萍(Marsilea quadrifolia)、双穗雀稗(Paspalum distichum)和铜钱草(Hydrocotyle chinensis)等,这些伴生种的盖度也呈明显的增加趋势。可见,绿狐尾藻在香蒲和莲两个典型本土挺水植物群落中的生态竞争力明显偏弱。
|
图 3 绿狐尾藻在香蒲与莲群落中的生长动态 Figure 3 The growth dynamics of M. elatinoides in the communities dominated by T. orientalis and N. nucifera, respectively |
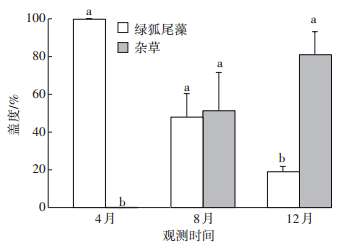
长沙站绿狐尾藻湿地群落自然演替试验结果表明,在人为管理条件下,试验初期(2016年4月)湿地中绿狐尾藻为单一优势种,且长势良好,盖度达到100%。在样地进入自然演替状态之后,随着时间推移,湿地内逐渐出现本地强优势植物辣蓼(Polygonum hydropiper)、双穗雀稗(Paspalum distichum)和水竹叶(Murdannia triguetra)等10余种水生或湿生植物(表 2),绿狐尾藻的优势度不断降低,到8月本地杂草已经取代绿狐尾藻成为湿地的优势物种,绿狐尾藻盖度降到50%以下,到12月杂草的盖度已经达到81.2%,而绿狐尾藻仅为18.8%(图 4)。
|
|
表 2 绿狐尾藻自然演替湿地群落中的主要植物 Table 2 The main plant species in natural succeeding community of M. elatinoides wetland |
|
同一月份标有相同字母的表示其统计差异不显著(P > 0.05) Columns signed by the same letter in the same month indicate the differences are non-significant (P > 0.05) 图 4 自然演替群落绿狐尾藻与杂草盖度的变化 Figure 4 Changes in the coverage of M. elatinoides and weeds in natural succeeding communities |
综合生态竞争试验结果(图 5)表明,试验初期绿狐尾藻与其他7种植物的盖度基本相等,均为50%左右,但随时间的推移,无论是农作物(水稻)、挺水植物(黑三棱、梭鱼草、水花生、铜钱草)还是浮水植物(水葫芦、红萍),其夏季(7月)盖度均占据明显优势,一般都在70%以上。秋季(11月)除了红萍和铜钱草群落与绿狐尾藻的盖度差异较小以外,其他处理绿狐尾藻均处于明显的竞争劣势。稻田内的绿狐尾藻尽管在试验初期盖度高达50%左右,但是随着水稻的生长,绿狐尾藻会很快消退,到水稻收获季节其盖度一般不到10%,而且生长十分瘦弱。水稻产量的观测结果表明,种有绿狐尾藻的稻田水稻产量会略有降低,早稻与晚稻的总产量分别为(11.0 ± 0.2)t·hm-2和(11.4±0.3)t·hm-2,减产率为3.3%,统计差异不显著(P > 0.05)。

|
同一月份或者同一类型作物标有相同字母的表示其统计差异不显著(P > 0.05) Columns signed by the same letter in the same month or crop types indicate the differences are non-significant (P > 0.05) 图 5 绿狐尾藻与其他植物的盖度变化及水稻产量 Figure 5 Changes in the coverage of M. elatinoides and other plants as well the grain yields of rice |
11个野外台站的试验结果表明,绿狐尾藻在中国长江流域以南的南方亚热带地区均可以正常生长,且从南到北、从东到西随着年均气温的降低及海拔的升高,绿狐尾藻表现出生育期缩短和花期延后的特点,表现出热带起源短日照植物的水平地带性特征,这与原产地相同的粉绿狐尾藻(M. aquiticum)近似[21, 28]。绿狐尾藻能适应高浓度养殖废水的显著特点,为其应用于高负荷农村污水的生态治理奠定了良好的生理学基础[2, 27]。在南方地区绿狐尾藻可以自然越冬,因此其应用具有得天独厚的优势,但是在北方地区的应用则需要考虑冬季越冬保苗的问题。绿狐尾藻全年表现为浮水状态,这与水葫芦、水花生、菱角等多数浮水植物冬季枯死以后会沉底的特性明显不同[3, 5],这会大幅度降低打捞的难度,加之绿狐尾藻粗蛋白含量在18%左右,营养价值高,可作为畜禽饲料进行加工利用[11],因此在治理水体污染方面也具有明显的资源化经济效益优势。
本试验结果表明,绿狐尾藻虫害主要发生在夏季高温季节(7—8月),其害虫种类主要以斜纹夜蛾和造桥虫为主,其中斜纹夜蛾可对绿狐尾藻生长造成毁灭性危害。斜纹夜蛾为典型的非专一性害虫,其寄主植物多达109科389种[29-30],而造桥虫以啃食植株芽叶及嫩茎为主,其在暴食期能将植物吃成光杆[31]。绿狐尾藻的害虫全部为非专一的食叶害虫,害虫的种源分布广泛,可对绿狐尾藻自然散布构成制约,因此种植绿狐尾藻不会像水葫芦、水花生一样因无天敌噬食而肆意泛滥[19]。
3.2 绿狐尾藻的竞争能力与生物入侵风险绿狐尾藻在高水位、大风浪以及蓝藻爆发区生长都会受到强烈抑制(图 2),表明绿狐尾藻更适合在营养丰富的浅水性静水水面生长,在水位波动强烈的大水面区域绿狐尾藻则难以正常生长,这与水葫芦在太湖、滇池等大湖地区出现的爆发情况截然不同,可以判断绿狐尾藻在湖区不会造成大面积的自然扩散,这与陈修文等[32]发现的绿狐尾藻在高水位波动下生态适应能力较弱的结果基本一致。但是在浅水湿地,物种的竞争较为激烈,物种的生活型和种群密度是关键影响因素[33]。从丹江口和长沙的竞争试验结果可以看出,由于绿狐尾藻为典型的匍匐型浮水植物,其利用空间资源的优势偏弱,在大型挺水植物(如香蒲、莲、梭鱼草、黑三棱、水稻等)群落中,其竞争优势明显偏弱,甚至会逐渐消亡(图 5),光照条件可能是限制绿狐尾藻在挺水植物群落中正常生长的主要因素[34-36],因此绿狐尾藻不会成为稻田杂草,从其对水稻产量影响不显著可以得以佐证(图 5)。在生态位相对接近的四叶萍、双穗雀稗、铜钱草、浮萍、水葫芦、水花生等小型挺水或浮水植物群落中,尽管没有光照限制的因素,但是绿狐尾藻的竞争力除了在个别阶段(春季和秋季末)占明显优势以外,在主要生长季节其竞争力也表现偏弱,这意味着绿狐尾藻在水体中的资源竞争能力总体上较弱。原因可能在于其生态位相对狭窄,绿狐尾藻主要通过利用春季和秋季末其他植物尚未生长的低温阶段快速繁殖个体,以避开与其他物种的竞争。因此,可以判断在一般的营养限制条件下绿狐尾藻的自然扩散能力十分有限,会受到众多物种竞争的制约[37]。水花生和水葫芦之所以成为我国的重要入侵生物,主要原因在于其生态位较宽,如水花生能够在水位波动甚至水旱变化等多种生境条件下快速繁殖[32, 38]。本研究也发现绿狐尾藻在浓度较高(氨氮50~250 mg·L-1)的养殖废水中依然能良好生长[9, 39],表明绿狐尾藻是一种能忍耐高养分浓度的强耐性水生植物,另外在高浓度废水中其他水生植物分布较少,因此绿狐尾藻的种间竞争压力小,也更有利于其自身的繁殖。总体而言,绿狐尾藻具有竞争力弱和耐高养分浓度的特点,生态位较窄,在我国大陆地区构成生物入侵的风险不大,且具有应用于富营养化水体生态治理的天然优势。当然,植物的生态竞争力是其对生长环境长期适应条件下形成的,尽管绿狐尾藻在中国出现已有多年,但是关于其群落生态竞争力的研究还少有报道,本研究仅是一个开端,希望今后的研究能够逐步深入,为生态环境保护积累更为丰富的数据资料。
3.3 关于绿狐尾藻的种名绿狐尾藻的学名目前尚不完全统一,国内很多情况下常与粉绿狐尾藻[Myriophyllum aquaticum(Vell.)Verdc]混用。从1993年起,美国植物分类学家认为M. elatinoides与M. aquaticum(粉绿狐尾藻)是同一物种,两者形态十分相似,因此将二者都归于同一种M. aquaticum。可能由于这一原因,从2000年以后有关M. elatinoides的文献已基本很少见到。在国内,《中国植物志》及一些地方植物志等主要植物分类学文献也都沿用M. aquaticum这一名称。尽管如此,也依然还是有一些文献坚持认为M. elatinoides与M. aquaticum不是一种,如张金锋[40]在《观赏水草的分类与繁殖方法》中分别称之为“绿狐尾”和“青狐尾”。根据我们在全国多地的观察,发现粉绿狐尾藻叶面暗绿,植株茎叶表面经常覆有一层明显的“白粉”,而绿狐尾藻则叶色亮绿,表面也没有明显的白粉。笔者在云南大理洱海地区见到的M. aquaticum白粉尤其明显。经与中国科学院武汉植物园研究员、《中国水生植物图鉴》主编赵家荣先生交流,一致认为二者应该不属于同一物种,因此我们这里暂时沿用学名M. elatinoides,但是分类学依据尚不充分,还需进一步(如从分子水平)的深入鉴定。
4 结论(1)绿狐尾藻在我国亚热带地区可以良好生长并顺利越冬,但在中国北方温带地区则不能自然越冬。
(2)绿狐尾藻生长受到多种因素的影响,其中风浪、水深、蓝藻爆发以及香蒲(Typha orientalis)、莲(Nelumbo nucifera)、双穗雀稗(Paspalum distichum)、辣蓼(Polygonum hydropiper)、水竹叶(Murdannia triquetra)、水稻等本土水生植物竞争等多种因素均会对绿狐尾藻的正常生长产生显著抑制作用,绿狐尾藻的生态竞争力均处于明显的弱势。
(3)绿狐尾藻存在非专一性天敌,主要包括斜纹夜蛾(Spodoptera litura)、造桥虫(Anomis flava)等食叶性昆虫,其主要爆发期在夏季7—8月的高温阶段。
因此,从生长适应性、群落竞争力、天敌危害等方面来看,初步认为绿狐尾藻在我国大陆地区大范围自然扩张的可能性十分有限。
致谢 本研究主要得到中科院科技服务网络计划(STS)项目(KFJ-EW-ZY-006)的经费支持。项目执行期间,项目组其他成员及中科院11个野外台站的部分工作人员均先后参与或给予本文试验大力支持和帮助,在此一并表示衷心感谢!
| [1] |
David M B, Wall L G, Royer T V, et al. Denitrification and the nitrogen budget of a reservoir in an agricultural landscape[J]. Ecological Applications, 2006, 16(6): 2177-2190. DOI:10.1890/1051-0761(2006)016[2177:DATNBO]2.0.CO;2 |
| [2] |
吴永红, 胡正义, 杨林章. 农业面源污染控制工程的"减源-拦截-修复"(3R)理论与实践[J]. 农业工程学报, 2011, 27(5): 1-6. WU Yong-hong, HU Zheng-yi, YANG Lin-zhang. Strategies for controlling agricultural non-point source pollution:Reduce-retain-restoration (3R) theory and its practice[J]. Transactions of the CSAE, 2011, 27(5): 1-6. DOI:10.3969/j.issn.1002-6819.2011.05.001 |
| [3] |
杨林章, 冯彦房, 施卫明, 等. 我国农业面源污染治理技术研究进展[J]. 中国生态农业学报, 2013, 21(1): 96-101. YANG Lin-zhang, FENG Yan-fang, SHI Wei-ming, et al. Review of the advances and development trends in agricultural non-point source pollution control in China[J]. Chinese Journal of Eco-Agriculture, 2013, 21(1): 96-101. |
| [4] |
Zhang D Q, Jinadasa K B S N, Gersberg R M, et al. Application of constructed wetlands for wastewater treatment in developing countries:A review of recent developments (2000-2013)[J]. Journal of Environmental Management, 2015, 30: 30-46. |
| [5] |
陈永华, 吴晓芙. 人工湿地植物配置与管理[M]. 北京: 中国林业出版社, 2012. CHEN Yong-hua, WU Xiao-fu. Constructed wetland plant configuration and management[M]. Beijing: China Forestry press, 2012. |
| [6] |
韩例娜, 李裕元, 石辉, 等. 水生植物对农田排水沟渠氮磷迁移生态阻控效果比较研究[J]. 农业现代化研究, 2012, 33(1): 117-120. HAN Li-na, LI Yu-yuan, SHI Hui, et al. Study on comparison of different aquatic plant on nitrogen and phosphorus ecological control measures in drainage ditch of farmland in southern China[J]. Research of Agricultural Modernization, 2012, 33(1): 117-120. DOI:10.3969/j.issn.1000-0275.2012.01.026 |
| [7] |
刘学燕, 代明利, 刘培斌. 人工湿地在我国北方地区冬季应用的研究[J]. 农业环境科学学报, 2004, 23(6): 1077-1081. LIU Xue-yan, DAI Ming-li, LIU Pei-bin. Application of subsurface flow constructed wetland in north area of China in winter[J]. Journal of Agro-Environment Science, 2004, 23(6): 1077-1081. DOI:10.3321/j.issn:1672-2043.2004.06.010 |
| [8] |
黄蕾, 翟建平, 王传瑜, 等. 4种水生植物在冬季脱氮除磷效果的试验研究[J]. 农业环境科学学报, 2005, 24(2): 366-370. HUANG Lei, ZHAI Jian-ping, WANG Chuan-yu, et al. Removals of nitrogen and phosphorus in Taihu Lake water by four hydrophytes in winter season[J]. Journal of Agro-Environment Science, 2005, 24(2): 366-370. DOI:10.3321/j.issn:1672-2043.2005.02.035 |
| [9] |
Liu F, Xiao R L, Wang Y, et al. Effect of a novel constructed drainage ditch on the phosphorus sorption capacity of ditch soils in an agricultural headwater catchment in subtropical central China[J]. Ecological Engineering, 2013, 58: 69-76. DOI:10.1016/j.ecoleng.2013.06.008 |
| [10] |
Li X, Zhang M M, Liu F, et al. The significance of Myriophyllum elatinoides for swine wastewater treatment:Abundance and community structure of ammonia-oxidizing microorganisms in sediments[J]. PLoS One, 2015, 10(10): e0139778. DOI:10.1371/journal.pone.0139778 |
| [11] |
肖润林, 吴金水, 刘锋, 等.一种绿狐尾藻饲料及制备方法和应用: CN105211541A[P]. 2016-01-06. XIAO Run-lin, WU Jin-shui, LIU Feng, et al. A Myriophyllum elatinoides feed, preparation and application: CN105211541A[P]. 2016-01-06. |
| [12] |
Orchard A E. A revision of south American Myriophyllum (Haloragaceae), and its repercussion on some Australian and north American species[J]. Brunonia, 1981, 4(1): 27-65. DOI:10.1071/BRU9810027 |
| [13] |
赵家荣, 刘艳玲. 水生植物图鉴[M]. 武汉: 华中科技大学出版社, 2009. ZHAO Jia-rong, LIU Yan-ling. Aquatic plant atlas[M]. Wuhan: Huazhong University of Science and Technology Press, 2009. |
| [14] |
Bazyli C, Bozenna M, Anna G, et al. Aquatic fungi growing on dead fragments of submerged plants[J]. Limnologica, 2005, 35(4): 283-297. DOI:10.1016/j.limno.2005.07.002 |
| [15] |
Thiebaut G. Invasion success of non-indigenous aquatic and semiaquatic plants in their native and introduced ranges. A comparison between their invasiveness in north America and France[J]. Biological Invasion, 2007, 9(1): 1-12. |
| [16] |
Yu D, Wang D, Li Z Q. Two species of the genus Myriophyllum L. (Haloragaceae) newly recorded in China[J]. Acta Phytotaonomica Sinica, 2001, 39: 575-578. |
| [17] |
Xie D, Yu D, Yu L F, et al. Asexual propagations of introduced exotic macrophytes Elodea nuttallii, Myriophyllum aquaticum, and M. propinquum are improved by nutrient-rich sediments in China[J]. Hydrobiologia, 2010, 655(1): 37-47. DOI:10.1007/s10750-010-0402-9 |
| [18] |
Galatowitsch S M, Whited D C, Lehtinen R, et al. The vegetation of wet meadows in relation to their land use[J]. Environmental Monitoring and Assessment, 2000, 60(2): 121-144. DOI:10.1023/A:1006159028274 |
| [19] |
万方浩, 郑小波, 郭建英. 重要农林外来入侵物种的生物学与控制[M]. 北京: 科学出版社, 2005. WAN Fang-hao, ZHENG Xiao-bo, GUO Jian-ying. Agriculture and forest biology and control of invasive species[M]. Beijing: Science Press, 2005. |
| [20] |
Traveset A, Richardson D M. Biological invasions as disruptors of plant reproductive mutualisms[J]. Trends in Ecology and Evolution, 2006, 21(4): 208-216. DOI:10.1016/j.tree.2006.01.006 |
| [21] |
柴伟纲, 谌江华, 孙梅梅, 等. 外来水生植物大聚藻的生态安全性初探[J]. 生态科学, 2013, 32(3): 355-358. CAI Wei -gang, SHEN Jiang-hua, SUN Mei-mei, et al. Ecological safety of exotic aquatic plant Myriophyllum aquaticum[J]. Ecological Science, 2013, 32(3): 355-358. DOI:10.3969/j.issn.1008-8873.2013.03.016 |
| [22] |
赵广琦, 崔心红, 张群, 等. 水生植物引种的生态安全评价[J]. 广西植物, 2009, 29(4): 488-492. ZHAO Guang-qi, CUI Xin-hong, ZHANG Qun, et al. Ecological security assessment of introducing aquatic macrophytes[J]. Guihaia, 2009, 29(4): 488-492. DOI:10.3969/j.issn.1000-3142.2009.04.014 |
| [23] |
Ruiz G M, Fofonoff P, Hines A H, et al. Non-indigenous species as stressors in estuarine and marine communities:Assessing invasion impacts and interactions[J]. Limnology and Oceanography, 1999, 44(3): 950-972. |
| [24] |
Li W, Friedrich R. In situ removal of dissolved phosphorus in irrigation drainage water by planted floats:Preliminary results from growth chamber experiment[J]. Agriculture, Ecosystems and Environment, 2002, 90: 9-15. DOI:10.1016/S0167-8809(01)00292-4 |
| [25] |
Hussner A, Meyer C, Busch J. The influence of water level and nutrient availability on growth and root system development of Myriophyllum aquaticum[J]. Weed Research, 2009, 49(1): 73-80. DOI:10.1111/wre.2009.49.issue-1 |
| [26] |
Liu M M, Liu J L, Zhang Z M, et al. Wastewater treatability potential of floating and submerged macrophytes[J]. Journal of Food, Agriculture and Environment, 2013, 11(2): 1426-1431. |
| [27] |
王文国, 苏小红, 汤晓玉, 等. 用于农村生活污水处理的常见外来湿地植物的环境风险评估与管理[J]. 生态与农村环境学报, 2013, 29(2): 191-196. WANG Wen-guo, SU Xiao-hong, TANG Xiao-yu, et al. Environmental risk assessment and management of exotic wetland plants used for treatment of rural domestic[J]. Journal of Ecology and Rural Environment, 2013, 29(2): 191-196. DOI:10.3969/j.issn.1673-4831.2013.02.009 |
| [28] |
崔心红, 熊秉红, 蒲云海, 等. 5种沉水植物无性繁殖和定居能力的比较研究[J]. 植物生态学报, 2000, 24(4): 502-505. CUI Xin-hong, XIONG Bing-hong, PU Yun-hai, et al. Comparative study of regeneration and colonization ability in five submersed macrophytes[J]. Acta Phytoecologica Sinica, 2000, 24(4): 502-505. DOI:10.3321/j.issn:1005-264X.2000.04.021 |
| [29] |
王瑞龙, 孙玉林, 梁笑婷, 等. 6种植物次生物质对斜纹夜蛾解毒酶活性的影响[J]. 生态学报, 2012, 32(16): 5191-5198. WANG Rui-long, SUN Yu-lin, LIANG Xiao-ting, et al. Effects of six plant secondary metabolites on activities of detoxification enzymes in Spodoptera litura[J]. Acta Ecologica Sinica, 2012, 32(16): 5191-5198. |
| [30] |
武承旭, 杨茂发, 曾昭华, 等. 斜纹夜蛾成虫在不同寄主上的繁殖行为日节律[J]. 植物保护学报, 2015, 42(2): 210-216. WU Cheng-xu, YANG Mao-fa, ZENG Zhao-hua, et al. Diurnal rhythm of reproductive behavior of cotton leafworm Spodoptera litura (Fabricius) (Lepidoptera:Noctuidae) feeding on different hosts[J]. Journal of Plant Protection, 2015, 42(2): 210-216. |
| [31] |
董易之, 陈炳旭, 徐淑, 等. 荔枝大造桥虫幼虫龄数的划分[J]. 环境昆虫学报, 2011, 33(4): 552-550. DONG Yi-zhi, CHEN Bing-xu, XU Shu, et al. Division of larval instars of the litchi giant looper, Ascotis selenaria (Lepidoptera:Geometridae)[J]. Journal of Environmental Entomology, 2011, 33(4): 552-550. |
| [32] |
陈修文, 于丹, 刘春花. 秋季水位波动频率对喜旱莲子草、粉绿狐尾藻和水龙的影响[J]. 植物生态学报, 2016, 40(5): 493-501. CHEN Xiu-wen, YU Dan, LIU Chun-hua. Effect of water level fluctuation frequency on Alternanthera philoxeroides, Myriophyllum aquaticum and Ludwigia adscendens in autumn[J]. Chinese Journal of Plant Ecology, 2016, 40(5): 493-501. |
| [33] |
Keddy P, Nielsen K, Weiher E, et al. Relative competitive performance of 63 species of terrestrial herbaceous plants[J]. Journal of Vegetation Science, 2002, 13(1): 5-16. DOI:10.1111/j.1654-1103.2002.tb02018.x |
| [34] |
Pavia H, Toth G B. Influence of light and nitrogen on the phlorotannin content of the brown seaweeds Ascophyllum nodosum and Fucus vesiculosus[J]. Hydrobiologia, 2000, 440: 299-305. DOI:10.1023/A:1004152001370 |
| [35] |
Hilt S, Gross E M. Can allelopathically active submerged macrophytes stabilise clear-water states in shallow eutrophic lakes[J]. Basic and Applied Ecology, 2008, 9(4): 422-432. DOI:10.1016/j.baae.2007.04.003 |
| [36] |
Martin G D, Coetzee J A. Competition between two aquatic macrophytes, Lagarosiphon major (Ridley) Moss (Hydrocharitaceae) and Myriophyllum spicatum Linnaeus (Haloragaceae) as influenced by substrate sediment and nutrients[J]. Aquatic Botany, 2014, 114: 1-11. DOI:10.1016/j.aquabot.2013.11.001 |
| [37] |
Wolfer S R, Straile D. Spatio-temporal dynamics and plasticity of clonal architecture in Potamogeton perfoliatus[J]. Aquatic Botany, 2004, 78(4): 307-318. DOI:10.1016/j.aquabot.2003.11.005 |
| [38] |
Sainty G, Mccorkelle G, Julien M. Control and spread of alligator weed Alternanthera philoxeroides (Mart.) Griseb., in Australia:Lessons for other regions[J]. Wetlands Ecology and Management, 1997, 5(3): 195-210. DOI:10.1023/A:1008248921849 |
| [39] |
李远航, 刘洋, 刘铭羽, 等. 稻草-绿狐尾藻复合人工湿地技术处理养猪废水综合效益分析[J]. 农业现代化研究, 2018, 39(2): 325-334. LI Yuan-hang, LIU Yang, LIU Ming-yu, et al. Integrated benefit analysis of a combined constructed wetland using ricestraw and Myriophyllum elatinoides to treat swine wastewater[J]. Research of Agricultural Modernization, 2018, 39(2): 325-334. |
| [40] |
张金锋. 观赏水草的分类与繁殖方法[J]. 现代农业科技, 2009(3): 82-85. ZHANG Jin-feng. Classification and breeding of ornamental waterweed[J]. Modern Agricultural Science and Technology, 2009(3): 82-85. DOI:10.3969/j.issn.1007-5739.2009.03.049 |
 2018, Vol. 37
2018, Vol. 37




