2. 山西省市政工程研究生教育创新中心, 山西 晋中 030600
2. Innovation Center for Postgraduate Education in Municipal Engineering of Shanxi Province, Jinzhong 030600, China
氮素是作物生长必需的营养元素,也是农业生产可持续发展的根本要素。农田氮素的维持主要靠化学氮肥的施入,但是过量施用氮肥,引起土壤氨挥发增加,造成土壤氮素损失和空气污染。全世界每年农田施用氮肥和有机肥氮素的10%~30%以氨挥发形式损失[1]。我国秸秆资源丰富,但秸秆还田可能加重病虫害,甚至造成农业减产[2],且增加氮肥氨挥发损失[3]。生物炭是农业有机废弃物(如秸秆)在无氧或缺氧条件下,高温热解产生的性质稳定、难溶于水、含碳量高的固体物质;生物炭可以提高土壤持水能力,减少土壤养分淋失,增进土壤肥力,农业应用前景广阔[4]。然而,生物炭多呈碱性[4],其农田施用对土壤氨挥发的影响将直接影响土壤氮素损失率。
一些研究表明,生物炭施入土壤可以促进土壤氨挥发。Feng等[5]研究发现,500 ℃和700 ℃制得小麦秸秆生物炭使淹水稻田土壤(pH=6.38)的氨挥发累积量增加40.8%~70.9%,其原因为生物炭提高了土壤pH值(0.26~0.45),以及抑制了土壤硝化作用;类似地,500 ℃制得小麦秸秆生物炭使海岸带高盐冲积土(pH =8.0)70 d的氨挥发累积量增加25.6%~53.6%,其原因为生物炭提高了土壤pH值(0.53~0.88)[6]。然而也有研究表明,生物炭抑制土壤氨挥发。Mandal等[7]在南澳大利亚农业和非农业土壤中的研究发现,家禽垃圾生物炭(pH=8.66)和澳洲坚果壳生物炭(pH=10.84)使土壤氨挥发累积量减少70%左右,主要原因为生物炭较高的比表面积和含氧官能团数量使其拥有较强的NH3/NH4+吸附能力,以及生物炭促进土壤微生物对NH4+的固定。Taghizadeh-Toosi等[8]利用15N同位素示踪技术研究发现350 ℃制得松木条生物炭(pH=7.80)使草地土壤的氨挥发累积量减少45%,主要由于生物炭对NH3的吸附作用,以及植物对该部分NH3的吸收作用。以上研究之所以呈现不同结果,主要由于生物炭制备材料和温度、土壤类型和酸碱性等不同,导致影响土壤氨挥发的主导因素不同。然而,玉米秸秆生物炭对黄土高原石灰性农田土壤氨挥发的影响如何、相关机理探索尚未见报道。
另一方面,生物炭农田施用过程中,会与空气、土壤、微生物和植物根系发生相互作用,从而引起生物炭老化[9]。为探究生物炭农田施用的长期效应,有必要开展老化生物炭的土壤环境效应研究。然而,目前关于生物炭对土壤氨挥发影响的研究多以新鲜生物炭为主,较少报道老化生物炭的研究,如Esfandbod等[10]研究发现,由于森林大火产生的、经过44年老化的酸性生物炭(pH=3.86)显著降低了铝土矿废弃地土壤(pH=11.8)的氨挥发,其将原因归结为生物炭的酸碱性和强大的NH4+吸附能力;董玉兵等[11]在稻麦轮作土壤(pH=6.40)中的研究表明,与老化生物炭处理相比,追施新鲜生物炭处理显著增加了小麦季氨挥发累积量,其分析原因为生物炭经过老化,其表面的含氧官能团增加,从而增强了对NH4+的吸附能力。
因此,本文以玉米秸秆为原料,自制新鲜生物炭,并模拟其自然老化、高温老化和冻融循环老化过程,制备老化生物炭。采用室内静态土壤培养实验,探究新鲜和老化玉米秸秆生物炭对黄土高原石灰性农田土壤氨挥发的影响及相关机理,为生物炭在黄土高原的农业工程应用提供理论依据。
1 材料与方法 1.1 土壤实验所用土壤采自山西农业大学校内试验田表层(0~20 cm),该区域位于黄土高原东南边缘,土壤类型为褐土。剔除植物根等杂质后,将土壤风干,然后过筛(2 mm),密封保存备用。土壤pH值为8.14±0.02,属石灰性土壤;有机质含量为(21.5±4.13)g·kg-1;总氮含量为(0.91±0.05)g·kg-1;NH4+-N、NO3--N和NO2--N含量分别为(37.5±1.08)、(26.8±0.50)、(0.40±0.03)mg·kg-1。
1.2 生物炭 1.2.1 新鲜生物炭的制备以农业废弃生物质玉米秸秆为原料制备生物炭。玉米秸秆采集后,将杂质去除,50 ℃烘干,粉碎成粉末备用。将预制的玉米秸秆粉末置于管式电阻炉(SK-G10123K,天津中环实验电炉)中,升温前预先通入高纯氮气20 min(流速150 mL·min-1),以形成无氧环境;然后以5 ℃·min-1的升温速率升温至400 ℃,恒温2 h。将生物炭冷却至室温(25±2 ℃)后过筛(2 mm),便得新鲜玉米秸秆生物炭。
1.2.2 生物炭的老化处理采用自然老化、高温老化和冻融循环老化3种方式制备老化生物炭。将新鲜玉米秸秆生物炭置于敞口容器,老化培养过程中,采用称重法保持其质量含水率为77.7%,避光培养50 d。自然老化和高温老化分别在25±2 ℃(室温)和50 ℃条件下(LRH-150型生化培养箱,上海一恒)进行。冻融循环老化每天采用5 h(-18 ℃,BC-86A型冰箱,合肥美菱)+19 h(25± 2 ℃,室温)模式进行。培养结束后,将生物炭置于阴凉干燥处自然风干,便得自然老化、高温老化和冻融循环老化玉米秸秆生物炭。
1.2.3 玉米秸秆粉末及其生物炭的特性表征玉米秸秆粉末及其生物炭的pH值用pH计测定(炭水比1:15(m/V,g/mL),Mettler Toledo Delta 320);酸(碱)性含氧官能团数量采用Boehm滴定法测定[12];比表面积、总孔容和平均孔径采用N2吸附BET法测定(Quadrasorb SI,美国康塔)。玉米秸秆粉末、新鲜和老化玉米秸秆生物炭的基本特性见笔者前期研究[13]。
1.3 室内培养实验采用室内静态土壤培养实验,研究玉米秸秆粉末及以其为原料制得生物炭对石灰性农田土壤氨挥发的影响。实验共设置7个处理(每个处理3次重复),分别为:灭菌土壤(Sterilized soil,SS)、土壤(Soil,S)、土壤+2%玉米秸秆粉末(Soil+maize-straw powder,SMP)、土壤+2%新鲜玉米秸秆生物炭(Soil+fresh bio⁃ char,SFB)、土壤+2%自然老化玉米秸秆生物炭(Soil+ spontaneous aged biochar,SSAB)、土壤+2%高温老化玉米秸秆生物炭(Soil+high-temperature aged biochar,SHAB)和土壤+2%冻融循环老化玉米秸秆生物炭(Soil+freeze-thaw cycles aged biochar,SFAB)。将玉米秸秆粉末或玉米秸秆生物炭与土壤充分混匀(质量比,2%),并等量装入密闭的培养袋(28 cm×20 cm、PE塑料),每个培养袋装有240 g土壤和4.80 g生物炭/秸秆粉末。
采用稀H2SO4吸收法测定土壤氨挥发[14-15]。首先向培养袋中加入20 mL蒸馏水,并与土壤充分混匀,预先在室温(25±2 ℃)条件下避光培养7 d。预培养结束后,向每个培养袋中分别均匀喷洒12.84 mL 0.1 mol·L-1的(NH4)2SO4溶液(149.8 mg·kg-1干土,按大田用量约300 kg·hm-2,以N计),并与土壤充分混匀,同时补充蒸馏水调整土壤质量含水率为18.5%。采集48.35 g鲜土(干质量40.80 g)作为培养初态样品后,将预先装有30 mL H2SO4(0.01 mol·L-1)的平底蒸发皿(直径6.0 cm、高3.5 cm)放入密闭培养袋中,在室温(25±2 ℃)、避光条件下培养。于每天下午16:00,更换装有30 mL稀H2SO4的平底蒸发皿,并使培养袋内外空气充分交换,同时采用称重法补充土壤水分散失量。当天采用纳氏试剂比色法测定稀H2SO4的NH4+-N吸收量,并计算土壤氨挥发速率(mg·kg-1·d-1,以N计)和氨挥发累积量(mg·kg-1,以N计)。连续培养29 d后,将培养袋内土壤充分混匀,然后从每个培养袋中随机采集30.0 g土壤样品,作为培养终态土壤样品,并及时测定培养初态和终态土壤样品的无机氮含量、氨氧化速率、氨氧化细菌(AOB)数量和pH值。鉴于氨氧化作用的另一参与者氨氧化古菌(AOA)通常在偏酸性土壤中占主导地位[16],本文并未对AOA进行论述。
氨氧化速率的测定采用Kurola等[17]提出的氯酸钾抑制法(nmol·g-1·h-1,以N计);AOB数量的测定采用稀释平板法(个·g-1)[18];采用2 mol·L-1 KCl浸提、比色法测定土壤NH4+ - N、NO3- - N和NO2-- N含量(mg ·kg-1)[19];土壤pH值用pH计测定(土水比1:2.5(m/V,g/mL),Mettler Toledo Delta 320)[20]。
1.4 吸附实验 1.4.1 吸附动力学为探明玉米秸秆粉末及以其为原料制得生物炭对NH4+-N的吸附性能,开展不同材料对水中NH4+-N的吸附动力学和吸附等温线研究。向27个(9个采样时间点×3次重复)20 mL样品瓶中均加入0.15 g(干质量)同一吸附材料(玉米秸秆粉末、新鲜玉米秸秆生物炭、自然老化玉米秸秆生物炭、高温老化玉米秸秆生物炭或冻融循环老化玉米秸秆生物炭)和15 mL NH4Cl溶液(100 mg·L-1,以N计),旋紧瓶塞后在恒温(25±1 ℃)条件下振荡(170 r·min-1);分别于0、1、5、20、40、60、90、150、240 min取出3个样品瓶,采集混匀悬浮液,过滤后(0.45 μm),采用纳氏试剂比色法测定其NH4+-N含量。采用下式计算不同材料对NH4+-N的吸附量:
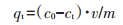
|
式中:qt为t时刻吸附材料的吸附量,mg·g-1;v为混合液体积,L;c0和ct分别为初始和t时刻混合液中NH4+-N的浓度,mg·L-1;m为吸附材料投加量,g。
1.4.2 吸附等温线首先向21个(7个不同浓度×3次重复)20 mL样品瓶中均加入0.15 g(干质量)同一吸附材料(玉米秸秆粉末、新鲜玉米秸秆生物炭、自然老化玉米秸秆生物炭、高温老化玉米秸秆生物炭或冻融循环老化玉米秸秆生物炭);然后依次分别加入15 mL浓度为100、150、200、250、300、350、400 mg·L-1(以N计)的NH4Cl溶液;恒温(25± 1 ℃)振荡(170 r·min-1)4.0 h后,取样过滤(0.45 μm),然后采用纳氏试剂比色法测定其NH4+-N含量。实验设3次重复。
用Langmuir和Freundlich等温吸附方程对实验数据进行拟合,Langmuir和Freundlich方程常用来描述离子在吸附剂上的吸附作用,其吸附方程分别为:
Langmuir方程:ce/qe=1/(qmaxb)+1/qmax·ce
式中:ce为吸附平衡时混合液中NH4+-N的浓度,mg· L-1;qe为吸附平衡时吸附材料的吸附量,mg·g-1;qmax为吸附材料的最大吸附量,mg·g-1;b为表征吸附剂与吸附质间亲和力的参数,L·mg-1;b值越大,吸附亲和力越大。
Freundlich方程:lnqe=lnKf+1/n·lnce
式中:ce为吸附平衡时混合液中NH4+-N的浓度,mg· L-1;qe为吸附平衡时吸附材料的吸附量,mg·g-1;Kf为Freundlich吸附常数,mg1-1/n·L1/n·g-1;1/n为Freundlich指数。
1.5 数据分析实验数据是平均值与三次重复的标准偏差,采用Microsoft Excel进行平均值和标准偏差的计算,采用OriginPro 8.5进行绘图和方程拟合。
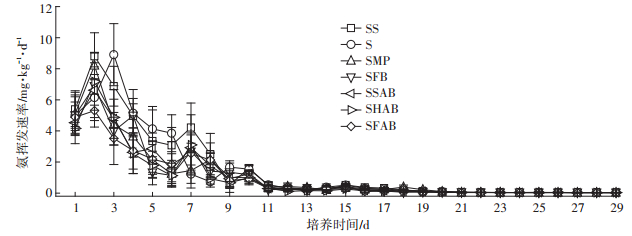
2 结果与讨论 2.1 不同外源添加材料对土壤氨挥发的影响 2.1.1 土壤氨挥发速率施肥后第2 d,除S处理外,其他处理的氨挥发速率均达到最大值;S处理在第3 d达到最大值。添加玉米秸秆生物炭各处理的氨挥发速率最大值(SFB,6.89 mg·kg-1·d-1;SSAB,6.62 mg·kg-1·d-1;SHAB,7.17 mg· kg-1·d-1;SFAB,5.31 mg·kg-1·d-1)均低于S和SMP处理(S,8.91 mg·kg-1·d-1;SMP,8.21 mg·kg-1·d-1)。土壤氨挥发主要发生在施肥后1~10 d,第11 d之后,各处理氨挥发速率逐渐降低(图 1)。
|
图 1 添加玉米秸秆粉末及其生物炭条件下土壤氨挥发速率的动态变化 Figure 1 Changes of NH3 volatilization rate of the soil amended with maize-straw powder and its derived biochars |
SS、S、SMP、SFB、SSAB、SHAB、SFAB处理1~10 d的氨挥发累积量分别为41.3、38.4、30.4、30.0、29.8、27.3、26.9 mg·kg-1,呈逐渐降低趋势,且均占整个培养过程氨挥发累积量的90%以上。整个培养过程中,与S处理相比,SMP处理的氨挥发累积量减少了19%,SFB和SSAB处理的氨挥发累积量减少了23%,SHAB和SFAB处理的氨挥发累积量减少了30%。另外,在整个培养过程中,S处理的氨挥发累积量较SS处理低2.97 mg·kg-1(图 2)。
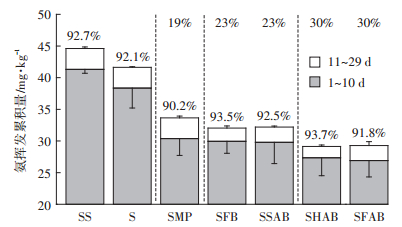
|
柱子顶端的百分数为1~10 d氨挥发累积量占1~29 d氨挥发累积量的百分数;19%、23%、23%、30%和30%分别为与S处理相比,SMP、SFB、SSAB、SHAB和SFAB处理氨挥发累积量(1~29 d)减少的百分数 The percentage at the column top represents the ratio of the cumulative NH3 volatilization in the period of 1~10 days to that in the period of 1~29 days; 19%, 23%, 23%, 30%, and 30% means the decreased percentage of the cumulative NH3 volatilization (1~29 days) in treatments of SMP, SFB, SSAB, SHAB, and SFAB compared with the treatment of S, respectively 图 2 玉米秸秆粉末及其生物炭对土壤氨挥发累积量的影响 Figure 2 Impact of maize-straw powder and its derived biochars on the cumulative NH3 volatilization of the soil |
研究表明,在不施氮肥条件下,酸性红壤(pH= 5.90)中添加水稻秸秆生物炭使其7周氨挥发累积量增加201%[21]。而本研究发现,在石灰性农田土壤中(pH=8.14),玉米秸秆粉末及以其为原料制得生物炭均使土壤氨挥发累积量降低(19%~30%)。与Chen等[22]的研究结果一致,发现在调整铝土矿废弃地土壤pH值为7和8条件下,450 ℃制得农业废弃物生物炭使其63 d的氨挥发累积量显著降低。李琦等[23]通过田间试验发现,在施氮450 kg·hm-2(以N计)条件下,450 ℃制得棉花秸秆生物炭使灌耕灰漠土(pH=7.80)的氨挥发累积量较对照降低40.6%。武岩等[24]在盐化潮土(pH=8.20)的研究表明,生物炭使玉米生长季土壤氨挥发累积量显著降低41.2%。上述不同结果,可能由于土壤酸碱性不同所致。
另外,本研究发现,不同材料对石灰性农田土壤氨挥发的抑制作用程度为:冻融循环老化生物炭/高温老化生物炭>自然老化生物炭/新鲜生物炭>玉米秸秆粉末,该结果可能与材料自身的酸碱性有关。与生物炭自然老化相比,高温老化和冻融循环老化过程中存在外界因素加速其氧化,氧化程度较高[25]。生物炭氧化程度越高,其表面酸性含氧官能团数量越多,pH值越低[26]。我们前期研究表明,冻融循环老化生物炭、高温老化生物炭、自然老化生物炭、新鲜生物炭和玉米秸秆粉末的pH值分别为9.61、10.1、10.3、10.6、6.60,表面羧基数量分别为0.558、0.418、0.213、0.182、0.168 mmol·g-1[13],此酸性含氧官能团可使NH3质子化为NH4+,进而使NH4+更易吸附在生物炭阳离子交换位点上,从而降低NH3挥发量[27]。玉米秸秆粉末的pH值较低,但其比表面积(0.720 m2·g-1)却远低于各种生物炭材料(2.42~5.85 m2·g-1)[13],导致其对NH4+的吸附能力较弱,该处理的氨挥发量较高。
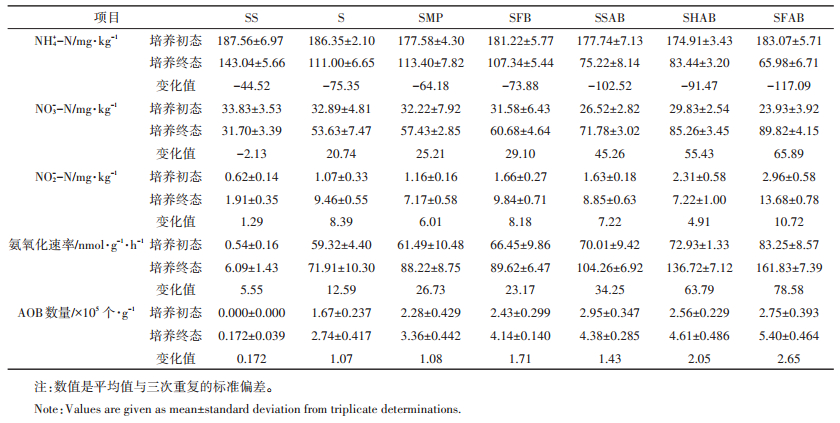
2.2 培养前后土壤无机氮含量、氨氧化速率和氨氧化细菌数量的变化与培养初态相比,培养终态各处理土壤NH4+-N含量呈降低趋势;NO3--N、NO2--N含量、氨氧化速率和AOB数量呈增加趋势;表明在施肥后29 d培养时段内,不同处理土壤存在不同程度的氨氧化作用。不同处理NO3--N含量、氨氧化速率和AOB数量的增加值呈如下趋势:SFAB>SHAB>SSAB/SFB>SMP>S(表 1)。
|
|
表 1 培养前后土壤无机氮含量、氨氧化速率和氨氧化细菌数量的变化 Table 1 Changes of inorganic nitrogen content, ammonia oxidation rate, and ammonia-oxidizing bacteria amount of the soil before and after incubation |
另外,与S处理相比,SMP、SFB、SSAB、SHAB、SFAB处理培养终态的NO3--N含量分别增加3.80、7.05、18.15、31.63、36.19 mg·kg-1,氨氧化速率分别增加16.31、17.71、32.35、64.81、89.92 nmol·g-1·h-1,AOB数量分别增加6.20×104、1.40×105、1.64×105、1.87×105、2.66×105个·g-1(表 1)。以上结果均表明,不同外源添加材料对土壤氨氧化作用的促进程度为:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭/新鲜生物炭>玉米秸秆粉末。
氨氧化作为硝化过程的第一步,是整个氮循环过程的速率控制步骤[28]。与我们的研究一致,Prommer等[29]研究表明,木材生物炭促进了石灰质黑钙土(pH= 7.50)的氨氧化速率,使其由对照处理的2.40 mg·g-1· d-1增至10.2 mg·g-1·d-1(以N计)。在酸性土壤中的研究也发现,生物炭显著促进了土壤氨氧化速率和氨氧化微生物数量[30-31]。本研究表明,正是由于不同材料对土壤氨氧化作用的促进程度不同,导致土壤NH4+-N消耗程度不同,进而导致土壤氨挥发量的差异。另外,培养终态S处理的AOB数量是SS处理的15.9倍;之所以S处理29 d的氨挥发累积量低于SS处理,可能由于S处理中氨氧化微生物对NH4+-N的消耗量较大,进而降低其氨挥发量。
2.3 玉米秸秆粉末及其生物炭对NH4+-N的吸附 2.3.1 吸附动力学为进一步探究不同外源添加材料对石灰性农田土壤氨挥发影响的机理,研究了玉米秸秆粉末及其生物炭对水中NH4+-N的吸附性能。新鲜生物炭和自然老化生物炭对水中NH4+-N的吸附约在60 min达到吸附平衡,高温老化生物炭约在40 min达到吸附平衡,冻融循环老化生物炭约在20 min达到吸附平衡。新鲜生物炭、自然老化生物炭、高温老化生物炭和冻融循环老化生物炭在240 min时的吸附量分别为4.02、4.19、4.76、5.38 mg·g-1,分别是玉米秸秆粉末的2.16、2.25、2.56、2.89倍(图 3)。

|
图 3 玉米秸秆粉末及其生物炭对NH4+-N的吸附量随时间的变化 Figure 3 Kinetics of NH4+-N adsorbed onto maize-straw powder and its derived biochars |
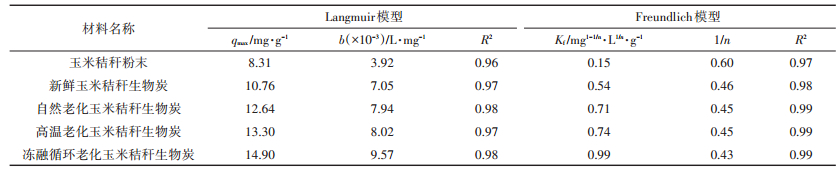
玉米秸秆粉末及其生物炭对水中NH4+-N的吸附用Langmuir和Freundlich等温吸附方程进行拟合(图 4、图 5)。Langmuir模型中最大吸附量qmax的拟合结果表明,冻融循环老化生物炭对NH4+-N的最大吸附量最高(14.9 mg·g-1),玉米秸秆粉末最低(8.31 mg·g-1)。Langmuir模型中b为表征吸附剂与吸附质间亲和力的参数,b值越大,吸附亲和力越大[32];本研究中b值的拟合结果为:冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭>玉米秸秆粉末。因此,Langmuir模型拟合分析表明,不同材料对水中NH4+-N的吸附能力从大到小依次为冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭>玉米秸秆粉末(表 2)。

|
图 4 玉米秸秆粉末及其生物炭对NH4+-N的Langmuir等温吸附模型拟合曲线 Figure 4 Langmuir adsorption isotherms of NH4+-N adsorbed by maize-straw powder and its derived biochars |

|
图 5 玉米秸秆粉末及其生物炭对NH4+-N的Freundlich等温吸附模型拟合曲线 Figure 5 Freundlich adsorption isotherms of NH4+-N adsorbed by maize-straw powder and its derived biochars |
|
|
表 2 玉米秸秆粉末及其生物炭对NH4+-N的吸附等温曲线Langmuir和Freundlich模型拟合参数 Table 2 Langmuir and Freundlich model parameters for NH4+-N adsorbed by maize-straw powder and its derived biochars |
Freundlich模型中吸附常数Kf反映吸附剂吸附能力的强弱,Freundlich指数1/n反映吸附剂吸附位点能量分布的特征。Kf值越大,表明吸附能力越强;1/n值越小,表明吸附强度越大,尤其当0.1 < 1/n < 1时,表明其易于吸附[33]。拟合结果表明,不同材料的Kf值从大到小依次为冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭>玉米秸秆粉末;1/n值从小到大亦呈同样趋势。因此,Freundlich模型拟合分析也表明,不同材料对水中NH4+-N的吸附能力从大到小依次为冻融循环老化生物炭>高温老化生物炭>自然老化生物炭>新鲜生物炭>玉米秸秆粉末(表 2)。
Langmuir模型描述吸附质在吸附剂表面呈单分子层分布,而Freundlich模型描述的是多分子层吸附[34]。本研究中两种模型的决定系数(R2)均大于0.96,但Freundlich模型对数据的拟合程度更高,对同一材料而言,其决定系数(R2)均高于Langmuir模型拟合结果。因此,玉米秸秆粉末及其生物炭对水中NH4+-N的吸附更符合Freundlich模型,为多分子层吸附过程。
生物炭对NH4+-N的吸附,是影响氨挥发的主要因素[22]。Steiner等[35]研究表明,在家禽垃圾42 d堆肥过程中,添加20%松木屑生物炭使其氨挥发浓度降低64%,主要原因为生物炭对NH3/NH4+的吸附。Cao等[36]的研究也表明,生物炭表面积巨大,孔隙结构丰富,并带有负电荷,具有较强的吸附能力和离子交换能力,施入土壤后可以吸附大量的NH4+-N,使土壤氨挥发量降低。
本研究对不同材料进行的吸附动力学和吸附等温线实验均表明,冻融循环老化生物炭和高温老化生物炭对水中NH4+-N的吸附能力较强,将其施入土壤后,较多的NH4+被吸附,而NH4+作为氨氧化微生物的底物,通过氨氧化作用转化为NO2-,从而降低土壤氨挥发量。与其他材料相比,冻融循环老化生物炭和高温老化生物炭较强的NH4+-N吸附能力,与其表面较高的羧基数量(分别为0.558、0.418 mmol·g-1)和酸性含氧官能团数量(分别为1.247、1.142 mmol·g-1)有关[13]。通过不同温度制得玉米秸秆和玉米芯生物炭对水中NH4+-N的吸附实验也表明,与600 ℃制得生物炭相比,400 ℃制得生物炭较强的NH4+-N吸附能力,与其表面较多的酸性含氧官能团数量有关[37]。Nguyen等[38]研究也表明,老化生物炭和低温热解制备生物炭较强的NH4+-N吸附能力与其表面较高的酸性含氧官能团数量有关。另外,施用生物炭抑制土壤氨挥发的其他原因还包括NH3与生物炭的羧基反应形成NH4+或酰胺基团[39],以及生物炭吸附的NH3可被植物有效利用等[40]。
3 结论(1)不同外源添加材料对石灰性农田土壤氨挥发的抑制作用程度为:冻融循环老化玉米秸秆生物炭/高温老化玉米秸秆生物炭>自然老化玉米秸秆生物炭/新鲜玉米秸秆生物炭>玉米秸秆粉末。
(2)冻融循环老化玉米秸秆生物炭和高温老化玉米秸秆生物炭较强的氨挥发抑制作用与其较强的土壤氨氧化促进作用以及NH4+-N吸附能力有关。
(3)施氮肥后1~10 d为土壤氨挥发的主要阶段,该阶段氨挥发累积量占整个培养过程氨挥发累积量的90%以上。
| [1] |
Bouwman A F, Boumans L J M, Batjes N H. Estimation of global NH3 volatilization loss from synthetic fertilizers and animal manure applied to arable lands and grasslands[J]. Global Biogeochemical Cycles, 2002, 16(2): 1024. DOI:10.1029/2000GB001389 |
| [2] |
李正东, 李懋, 潘根兴, 等. 作物秸秆还田的新问题[J]. 中国农学通报, 2013, 29(32): 204-208. LI Zheng-dong, LI Mao, PAN Gen-xing, et al. Challenges for crop straw return[J]. Chinese Agricultural Science Bulletin, 2013, 29(32): 204-208. |
| [3] |
王德建, 常志州, 王灿, 等. 稻麦秸秆全量还田的产量与环境效应及其调控[J]. 中国生态农业学报, 2015, 23(9): 1073-1082. WANG De-jian, CHANG Zhi-zhou, WANG Can, et al. Regulation and effect of 100% straw return on crop yield and environment[J]. Chinese Journal of Eco-Agriculture, 2015, 23(9): 1073-1082. |
| [4] |
Lehmann J, Joseph S. Biochar for environmental management:Science and technology[M]. 2nd Edition. London: Earthscan Publications Ltd., 2009: 1-12.
|
| [5] |
Feng Y F, Sun H J, Xue L H, et al. Biochar applied at an appropriate rate can avoid increasing NH3 volatilization dramatically in rice paddy soil[J]. Chemosphere, 2017, 168: 1277-1284. DOI:10.1016/j.chemosphere.2016.11.151 |
| [6] |
Sun H J, Lu H Y, Chu L, et al. Biochar applied with appropriate rates can reduce N leaching, keep N retention and not increase NH3 volatilization in a coastal saline soil[J]. Science of the Total Environment, 2017, 575: 820-825. DOI:10.1016/j.scitotenv.2016.09.137 |
| [7] |
Mandal S, Thangarajan R, Bolan N S, et al. Biochar-induced concomitant decrease in ammonia volatilization and increase in nitrogen use efficiency by wheat[J]. Chemosphere, 2016, 142: 120-127. DOI:10.1016/j.chemosphere.2015.04.086 |
| [8] |
Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. A wood based low-temperature biochar captures NH3-N generated from ruminant urine-N, retaining its bioavailability[J]. Plant and Soil, 2012, 353(1/2): 73-84. |
| [9] |
Joseph S D, Camps-Arbestain M, Lin Y, et al. An investigation into the reactions of biochar in soil[J]. Australian Journal of Soil Research, 2010, 48(6/7): 501-515. |
| [10] |
Esfandbod M, Phillips I R, Miller B, et al. Aged acidic biochar increases nitrogen retention and decreases ammonia volatilization in alkaline bauxite residue sand[J]. Ecological Engineering, 2017, 98: 157-165. DOI:10.1016/j.ecoleng.2016.10.077 |
| [11] |
董玉兵, 吴震, 李博, 等. 追施生物炭对稻麦轮作中麦季氨挥发和氮肥利用率的影响[J]. 植物营养与肥料学报, 2017, 23(5): 1258-1267. DONG Yu-bing, WU Zhen, LI Bo, et al. Effects of biochar reapplication on ammonia volatilization and nitrogen use efficiency during wheat season in a rice -wheat annual rotation system[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(5): 1258-1267. |
| [12] |
Zhang G X, Zhang Q, Sun K, et al. Sorption of simazine to corn straw biochars prepared at different pyrolytic temperatures[J]. Environmental Pollution, 2011, 159(10): 2594-2601. DOI:10.1016/j.envpol.2011.06.012 |
| [13] |
王朝旭, 陈绍荣, 张峰, 等. 老化玉米秸秆生物炭对碱性农田土壤氨氧化作用的影响[J]. 生态环境学报, 2018, 27(1): 31-39. WANG Chao-xu, CHEN Shao -rong, ZHANG Feng, et al. Effects of aged maize straw-derived biochars on ammonia oxidation in an alkaline farmland soil[J]. Ecology and Environmental Sciences, 2018, 27(1): 31-39. |
| [14] |
Guiziou F, Beline F. In situ measurement of ammonia and greenhouse gas emissions from broiler houses in France[J]. Bioresource Technology, 2005, 96(2): 203-207. DOI:10.1016/j.biortech.2004.05.009 |
| [15] |
周伟, 田玉华, 曹彦圣, 等. 两种氨挥发测定方法的比较研究[J]. 土壤学报, 2011, 48(5): 1090-1095. ZHOU Wei, TIAN Yu-hua, CAO Yan-sheng, et al. A comparative study on two methods for determination of ammonia volatilization[J]. Acta Pedologica Sinica, 2011, 48(5): 1090-1095. |
| [16] |
Zhang L M, Hu H W, Shen J P, et al. Ammonia-oxidizing archaea have more important role than ammonia-oxidizing bacteria in ammonia oxidation of strongly acidic soils[J]. The ISME Journal, 2012, 6(5): 1032-1045. DOI:10.1038/ismej.2011.168 |
| [17] |
Kurola J, Salkinoja-Salonen M, Aarnio T, et al. Activity, diversity and population size of ammonia-oxidising bacteria in oil-contaminated landfarming soil[J]. FEMS Microbiology Letters, 2005, 250(1): 33-38. DOI:10.1016/j.femsle.2005.06.057 |
| [18] |
林先贵. 土壤微生物研究原理与方法[M]. 北京: 高等教育出版社, 2010: 32-52. LIN Xian-gui. Principles and methods of soil microbiology research[M]. Beijing: Higher Education Press, 2010: 32-52. |
| [19] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002: 258-285. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2002: 258-285. |
| [20] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 1999: 12-13. LU Ru-kun. Soil agrochemistry analysis methods[M]. Beijing: China Agricultural Science and Technology Press, 1999: 12-13. |
| [21] |
何飞飞, 梁云姗, 荣湘民, 等. 培养条件下生物炭对红壤菜地土氨挥发和土壤性质的影响[J]. 云南大学学报(自然科学版), 2014, 36(2): 299-304. HE Fei-fei, LIANG Yun-shan, RONG Xiang-min, et al. Effects of biochar on ammonia volatilisation and soil properties of vegetableplanting red soil in a laboratory[J]. Journal of Yunnan University (Natural Sciences Edition), 2014, 36(2): 299-304. |
| [22] |
Chen C R, Phillips I R, Condron L M, et al. Impacts of greenwaste biochar on ammonia volatilisation from bauxite processing residue sand[J]. Plant and Soil, 2013, 367(1): 301-312. |
| [23] |
李琦, 廖娜, 张妮, 等. 棉花秸秆及其生物炭对滴灌棉田氨挥发的影响[J]. 农业环境科学学报, 2014, 33(10): 1987-1994. LI Qi, LIAO Na, ZHANG Ni, et al. Effects of cotton stalk and its biochar on ammonia volatilization from a drip irrigated cotton field[J]. Journal of Agro-Environment Science, 2014, 33(10): 1987-1994. DOI:10.11654/jaes.2014.10.016 |
| [24] |
武岩, 红梅, 林立龙, 等. 不同施肥措施对河套灌区盐化潮土氨挥发及氧化亚氮排放的影响[J]. 土壤, 2017, 49(4): 745-752. WU Yan, HONG Mei, LIN Li-long, et al. Influence of different fertilization measures on NH3 volatilization and N2O emission in salined flavo-aquic soil of Hetao irrigation area[J]. Soils, 2017, 49(4): 745-752. |
| [25] |
苗微.生物炭陈化对土壤养分和水稻生长的影响[D].沈阳: 沈阳农业大学, 2014. MIAO Wei. Ageing effect of biochar on soil nutrients and growth of rice[D]. Shenyang: Shenyang Agricultural University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10157-1014295071.htm |
| [26] |
Cheng C, Lehmann J. Ageing of black carbon along a temperature gradient[J]. Chemosphere, 2009, 75(8): 1021-1027. DOI:10.1016/j.chemosphere.2009.01.045 |
| [27] |
Bandosz T J. Chapter 5: Desulfurization on activated carbons[M]//Bandosz T J. Interface science and technology. Amsterdam: Elsevier, 2006: 231-292.
|
| [28] |
Kowalchuk G A, Stephen J R. Ammonia-oxidizing bacteria:A model for molecular microbial ecology[J]. Annual Review of Microbiology, 2001, 55(1): 485-529. DOI:10.1146/annurev.micro.55.1.485 |
| [29] |
Prommer J, Wanek W, Hofhansl F, et al. Biochar decelerates soil organic nitrogen cycling but stimulates soil nitrification in a temperate arable field trial[J]. PloS One, 2014, 9: e86388. DOI:10.1371/journal.pone.0086388 |
| [30] |
He L L, Zhao X, Wang S Q, et al. The effects of rice-straw biochar addition on nitrification activity and nitrous oxide emissions in two Oxisols[J]. Soil & Tillage Research, 2016, 164: 52-62. |
| [31] |
王晓辉, 郭光霞, 郑瑞伦, 等. 生物炭对设施退化土壤氮相关功能微生物群落丰度的影响[J]. 土壤学报, 2013, 50(3): 624-631. WANG Xiao-hui, GUO Guang-xia, ZHENG Rui-lun, et al. Effect of biochar on abundance of N-related functional microbial communities in degraded greenhouse soil[J]. Acta Pedologica Sinica, 2013, 50(3): 624-631. |
| [32] |
Raji C, Anirudhan T S. Batch Cr(Ⅵ) removal by polyacrylamidegrafted sawdust:Kinetics and thermodynamics[J]. Water Research, 1998, 32(12): 3772-3780. DOI:10.1016/S0043-1354(98)00150-X |
| [33] |
Malandrino M, Abollino O, Giacomino A, et al. Adsorption of heavy metals on vermiculite:Influence of pH and organic ligands[J]. Journal of Colloid and Interface Science, 2006, 299(2): 537-546. DOI:10.1016/j.jcis.2006.03.011 |
| [34] |
Coelho G F, Goncalves Jr A C, Tarley C R T, et al. Removal of metal ions Cd(Ⅱ), Pb(Ⅱ), and Cr(Ⅲ) from water by the cashew nut shell Anacardium occidentale L.[J]. Ecological Engineering, 2014, 73: 514-525. DOI:10.1016/j.ecoleng.2014.09.103 |
| [35] |
Steiner C, Das K C, Melear N, et al. Reducing nitrogen loss during poultry litter composting using biochar[J]. Journal of Environmental Quality, 2010, 39(4): 1236-1242. DOI:10.2134/jeq2009.0337 |
| [36] |
Cao X D, Harris W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology, 2010, 101(14): 5222-5228. DOI:10.1016/j.biortech.2010.02.052 |
| [37] |
武丽君, 王朝旭, 张峰, 等. 玉米秸秆和玉米芯生物炭对水溶液中无机氮的吸附性能[J]. 中国环境科学, 2016, 36(1): 74-81. WU Li-jun, WANG Chao-xu, ZHANG Feng, et al. The adsorption characters of inorganic nitrogen in aqueous solution by maize strawand corn cob -derived biochars[J]. China Environmental Science, 2016, 36(1): 74-81. DOI:10.3969/j.issn.1000-6923.2016.01.012 |
| [38] |
Nguyen T T N, Xu C Y, Tahmasbian I, et al. Effects of biochar on soil available inorganic nitrogen:A review and meta-analysis[J]. Geoderma, 2017, 288: 79-96. DOI:10.1016/j.geoderma.2016.11.004 |
| [39] |
Spokas K A, Novak J M, Venterea R T. Biochar's role as an alternative N-fertilizer:ammonia capture[J]. Plant and Soil, 2012, 350(1/2): 35-42. |
| [40] |
Taghizadeh-Toosi A, Clough T J, Sherlock R R, et al. Biochar adsorbed ammonia is bioavailable[J]. Plant and Soil, 2012, 350(1/2): 57-69. |
 2018, Vol. 37
2018, Vol. 37