2. 生猪健康养殖(湖北省)协同创新中心, 武汉 430070
2. The Cooperative Innovation Center for Sustainable Pig Production(Hubei Province), Wuhan 430070, China
近年来,我国年产各类抗生素21万t,居世界首位,其中46.1%用于畜禽养殖。进入畜禽体内的抗生素约有60%~90%以母体和代谢物的形式排出体外,且部分代谢物在环境中又可转化为活性母体,被认为是生态安全风险极高的新型污染物,成为近年来公众关注的焦点和国内外科学研究的热点[1]。同时,畜禽排出的代谢物应用于沼气工程的厌氧发酵中,沼渣沼液作为“优质高效的无公害有机肥料”也已应用于多种作物的生产中,但沼渣沼液的处理还存在着许多问题,如沼液被直接灌溉,其中的抗生素可在植物体内富集,同时由于食物链传递,也会对生物及人体产生危害。抗生素对人体的伤害表现为毒性损伤、过敏反应以及“三致”作用等[2-4]。据报道,沼液中抗生素含量较高的有四环素类和磺胺类抗生素,其含量可达几十到几百微克每升[5-7]。目前,处理工业废水中抗生素的主要方法有:生物法、膜分离法、吸附法。其中生物法很难有效地去除微量物质,膜分离法在沼液这类有较大杂质的非均相体系中应用时极易被堵塞,吸附法又很难找到较为廉价且对水质选择性小的吸附剂[8-9]。为了满足工艺上的切实要求,寻找能快速、高效地去除沼液中抗生素,同时又保证沼液中的养分(TN、TP、TK)能够基本保留的方法已迫在眉睫。
Fenton法作为高级氧化技术的代表,有着较强的氧化能力。近年来,因其对水质的选择性小,且反应速率高,被广泛应用于工业废水中苯酚、硝基酚等有机物的去除[10-11],但用其直接处理沼液中的抗生素还鲜有报道[12]。本文将通过Fenton去除沼液中三种四环素类和三种磺胺类抗生素的单因素实验,确定最优的去除条件,并通过最优Fenton作用条件下各抗生素的去除率和主要养分氮、磷、钾的保留率来评判Fenton法去除沼液中抗生素的可行性。
1 材料与方法 1.1 实验材料装置包括SC-3610低速离心机(安徽中科中佳科学仪器有限公司)、SHB-Ⅲ循环水式多用真空泵(武汉亨泰达仪器设备有限公司)、FE28 pH计(梅特勒-托利多仪器(上海)有限公司)、Cleanert PEP-2固相萃取柱(Bonna-Agela Technologies)、HX-NC12金属浴氮吹仪(武汉恒信世纪科技有限公司)、Agilent1260高效液相色谱仪(美国,安捷伦公司)、高效液相色谱柱Shim-Pack,VP-ODS(250 mm×4.6 mm,5 μm,日本,岛津公司)。
试剂包括:甲醇、乙腈、甲酸均为色谱纯;30%(质量分数)H2O2、H2SO4、HCl、NaOH均为分析纯;四环素(TC)纯度≥95%、土霉素(OTC)纯度≥98%、金霉素(CTC)纯度≥90%、磺胺甲恶唑(SMZ)纯度≥98%、磺胺甲基嘧啶(SMR)纯度≥98%、磺胺嘧啶(SDZ)纯度≥ 98%的标准样品(均购于上海源叶生物科技有限公司)。沼液采自湖北金林原种畜牧有限公司,带回实验室后避光保存其理化性质见表 1。为突出实验效果,向沼液中添加了一定含量的抗生素作为实验样品。
|
|
表 1 沼液主要理化性质 Table 1 The main physicochemical properties of biogas slurry |
取40 mL沼液于锥形瓶中,向其中添加一定含量的抗生素,用稀H2SO4、NaOH溶液调节pH后,加入FeSO4溶液5 mL和30%(质量分数)H2O2溶液5 mL,2 h后取出5 mL用来检测TN、TP、TK。再对样品进行5000 r·min-1离心,然后通过0.45 μm的水系滤膜,加入0.2 g乙二胺四乙酸二钠以抑制重金属的螯合,用H2SO4调节样品pH在4左右,滤液以1 mL·min-1的速率通过Cleanert PEP固相萃取柱进行富集,固相萃取柱使用前依次用3×2 mL甲醇、3×2 mL超纯水、3×2 mL HCl(pH=4)进行预处理,萃取富集后,用6 mL超纯水清洗固相萃取柱,并真空干燥30 min,最后用3× 2 mL甲醇缓慢洗脱到10 mL离心管中,将收集的洗脱液用氮气吹干,再用2 mL甲醇复溶。以上溶液均过0.22 μm水系滤膜后放入2 mL的棕色玻璃瓶待测。
1.2.2 各因素对抗生素去除特性影响实验基准条件:pH为4.0、H2O2浓度为0.4 mol·L-1、摩尔比n(H2O2)/n(Fe2+)=5:1。
在探究pH最优条件时,保证H2O2浓度和n(H2O2)/ n(Fe2+)为基准条件,pH分别设置为2、3、4、5、6,从而确定最优pH值;在探究H2O2浓度最优条件时,保证pH和n(H2O2)/n(Fe2+)为基准条件,H2O2浓度分别为0.1、0.2、0.3、0.4、0.5 mol·L-1,从而确定最优H2O2浓度;在探究n(H2O2)/n(Fe2+)最优条件时,保证pH和H2O2为基准条件,设置n(H2O2)/n(Fe2+)分别为3:1、5:1、10: 1、15: 1、20: 1,从而确定最优n(H2O2)/n(Fe2+)。
1.3 测试分析方法抗生素采用高效液相色谱-紫外检测器检测,测定条件:色谱柱柱温25 ℃,流动相为0.1%甲酸-乙腈(81:19,V/V)等度洗脱,流速1.0 mL·min-1;进样量20 μL;紫外检测器检测波长270 nm[5]。TN采用碱性过硫酸钾消解紫外分光光度法(GB/T 1894—1989),TP采用钼酸铵分光光度法(GB/T 11893—1989),TK采用H2O2-HNO3消解火焰分光光度法。
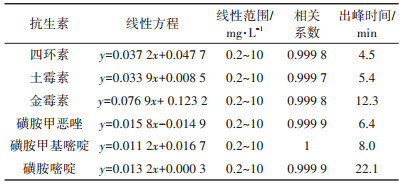
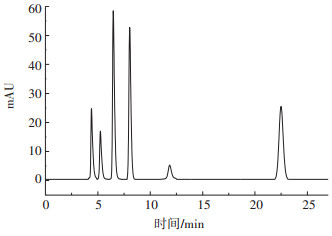
2 结果与讨论 2.1 抗生素标准溶液的测定配制六种抗生素的混标溶液,根据抗生素的测定方法,对六种抗生素进行了检测。由表 2可知,六种标准物质相关系数良好。由图 1可知,六种物质色谱峰完全分离。
|
|
表 2 六种目标物质对应线性方程及出峰时间 Table 2 The linear equations and peak time of the six target substances |
|
从左至右分别为TC、OTC、SMZ、SMR、CTC、SDZ 图 1 三种四环素和三种磺胺类抗生素的5 mg·L-1标准物质色谱图 Figure 1 Standard substance chromatogram of three kinds of tetracycline and three kinds of sulfa antibiotics with concentration of 5 mg·L-1 |
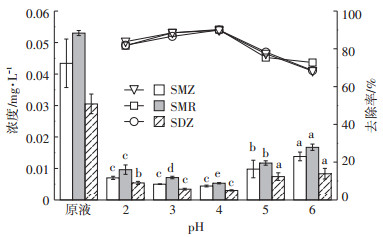
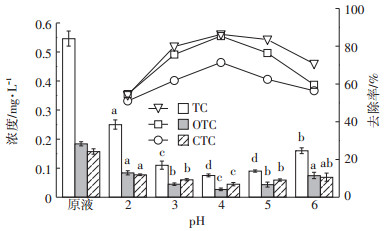
图 2和图 3分别为在H2O2浓度为0.4 mol·L-1,n(H2O2)/n(Fe2+)=5:1,pH为2、3、4、5、6条件下沼液水样中磺胺类抗生素和四环素类抗生素去除前后的浓度及去除率。由图可知,沼液样品中初始pH对抗生素去除率影响较大,pH为4时,抗生素去除率最大。pH降低过程中,目标物质的去除率呈先上升后下降的趋势。因为铁盐在弱酸性条件下最大限度水解,最有利于催化羟基自由基的产生,方程式为:
|
不同小写字母表示不同处理在0.05水平下差异显著,折线表示去除率,柱表示浓度。下同 图 2 不同pH下沼液经Fenton氧化后磺胺类抗生素浓度及去除率 Figure 2 The concentration and removal rates of sulfa antibiotics in biogas slurry after Fenton oxidation with different pH |
|
图 3 不同pH下沼液经Fenton氧化后四环素类抗生素浓度及去除率 Figure 3 The concentration and removal rates of tetracycline antibiotics in biogas slurry after Fenton oxidation with different pH |
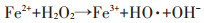
|
(1) |
弱酸环境可以促进反应向右进行,增加羟基自由基的产量。过低的pH值环境会抑制羟基自由基的产生,过高的pH值也会抑制羟基自由基的产生,并且使三价铁离子沉淀,而失去催化氧化能力,如下式:
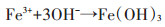
|
(2) |
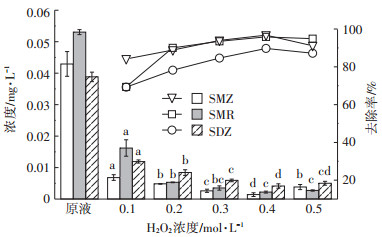
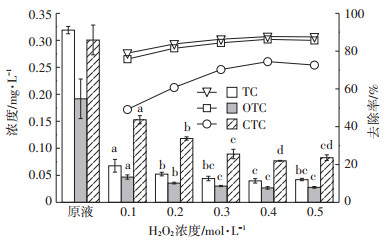
图 4和图 5分别为在pH为4.0,n(H2O2)/n(Fe2+)=5: 1,H2O2投加量分别为0.1、0.2、0.3、0.4、0.5 mol·L-1条件下沼液水样中磺胺类抗生素和四环素类抗生素去除前后的浓度及去除率。从图中可以看出,H2O2浓度为0.4 mol·L-1时,抗生素去除率最大。
|
图 4 不同H2O2投加量下沼液经Fenton氧化后磺胺类抗生素浓度及去除率 Figure 4 The concentration and removal rates of sulfa antibiotics in biogas slurry after Fenton oxidation with different H2O2 input |
|
图 5 不同H2O2投加量下沼液经Fenton氧化后四环素类抗生素浓度及去除率 Figure 5 The concentration and removal rates of tetracycline antibiotics in biogas slurry after Fenton oxidation with different H2O2 input |
由图 4和图 5可知,随着H2O2浓度不断升高,各类抗生素去除率均呈现先升高后平缓的趋势,并在0.5 mol·L-1时出现了下降,这是因为Fe2+催化H2O2产生·OH,随着H2O2浓度的增加,·OH也增加,即:
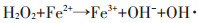
|
(3) |
而当H2O2过量时,H2O2会在反应初期与·OH反应生成氧化能力较弱的·HO2,·HO2进一步与·OH反应释放氧气,即:
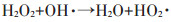
|
(4) |

|
(5) |
这一过程不利于反应持续进行,从而降低了对抗生素的去除。
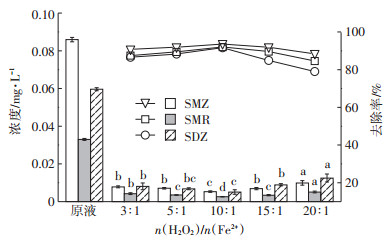
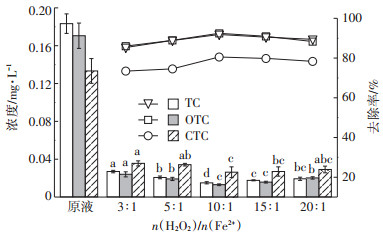
2.2.3 n(H2O2)/n(Fe2+)对抗生素去除率的影响图 6和图 7分别为在pH为4.0,H2O2浓度为0.4 mol·L-1,n(H2O2)/n(Fe2+)为3:1、5:1、10:1、15:1、20:1的条件下实验样品中磺胺类抗生素和四环素类抗生素去除前后的浓度及去除率。从图中可以看出,n(H2O2)/n(Fe2+)为10:1时,抗生素去除率最大。
|
图 6 不同n(H2O2)/n(Fe2+)下沼液经Fenton氧化后磺胺类抗生素浓度及去除率 Figure 6 The concentration and removal of sulfa antibiotics in biogas slurry after Fenton oxidation with different n (H2O2) /n (Fe2+) |
|
图 7 不同n(H2O2)/n(Fe2+)下沼液经Fenton氧化后四环素类抗生素的浓度及去除率 Figure 7 The concentration and removal of tetracycline antibiotics in biogas slurry after Fenton oxidation with different n (H2O2) /n (Fe2+) |
由图 6和图 7可知,当n(H2O2)/n(Fe2+)过小时,Fe2+剩余过多,缺少反应所需的H2O2。多余的Fe2+会与H2O2或·OH发生氧化还原反应,消耗体系内产生的·OH,同时,因大量Fe2+的催化,生成的·OH还未氧化抗生素就先自身发生了反应:
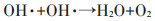
|
(6) |
而当n(H2O2)/n(Fe2+)过大时,Fe2+过少,抑制了H2O2生成·OH的速率,使得氧化能力变弱,导致抗生素去除率降低。
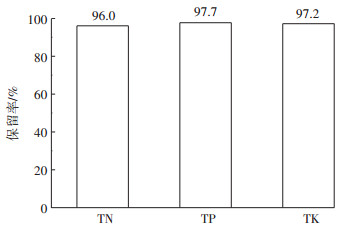
2.3 TN、TP、TK保留率在探究养分保留率时通常TP、TK原则上不会流失,而TN可能会以氮气的形式流失。本研究在pH为4.0,H2O2浓度为0.4 mol ·L-1,n(H2O2)/n(Fe2+)=10:1最优条件下,对沼液中抗生素去除前后沼液中TN、TP、TK进行测定。由图 8可知,TN、TP、TK的保留率分别为96.0%、97.7%、97.2%,说明Fenton在氧化沼液抗生素前后,养分基本没有流失。
|
图 8 Fenton氧化沼液中抗生素后TN、TP、TK保留率 Figure 8 The retention rate of TN, TP and TK in biogas slurry after antibiotics oxidation by Fenton |
(1)Fenton氧化沼液中三种四环素类和三种磺胺类抗生素的最佳反应条件:pH为4.0、H2O2投加量为0.4 mol·L-1、n(H2O2)/n(Fe2+)=10:1,此条件下四环素、土霉素、金霉素、磺胺甲恶唑、磺胺甲基嘧啶、磺胺嘧啶的去除率分别为91.83%、92.38%、80.52%、93.60%、91.97%、91.60%。
(2)Fenton试剂的添加基本不会影响沼液中养分的含量,沼液中的养分TN、TP、TK保留率分别为96.0%、97.7%、97.2%。
(3)Fenton氧化技术去除沼液中的抗生素是一种行之有效的方法,这为农业上沼液中抗生素的处理提供了一条可能的途径。
| [1] |
靳红梅, 黄红英, 管永祥, 等. 规模化猪场废水处理过程中四环素类和磺胺类抗生素的降解特征[J]. 生态与农村环境学报, 2016, 32(6): 978-985. JIN Hong-mei, HUANG Hong-ying, GUAN Yong-xiang, et al. Characteristics of degradation tetracyclines and sulfonamides during wastewater treating processes in an intensive swine farm[J]. Journal of Ecology & Rural Environment, 2016, 32(6): 978-985. |
| [2] |
Baran W, Adamek E, Jajko M, et al. Removal of veterinary antibiotics from wastewater by electrocoagulation[J]. Chemosphere, 2017, 194: 381-389. |
| [3] |
Zheng J, Chen T, Chen H, et al. Antibiotic resistome promotion in drinking water during biological activated carbon treatment:Is it influenced by quorum sensing?[J]. Science of the Total Environment, 2018, 612: 1-8. DOI:10.1016/j.scitotenv.2017.08.072 |
| [4] |
Rysz M, Alvarez P J J. Amplification and attenuation of tetracycline resistance in soil bacteria:Qauifer column experiments[J]. Water Research, 2004, 38(17): 3705-3712. DOI:10.1016/j.watres.2004.06.015 |
| [5] |
贺南南, 管永祥, 梁永红, 等. 固相萃取-高效液相色谱同时测定沼液中3种四环素类和6种磺胺类抗生素[J]. 分析科学学报, 2017, 33(3): 373-377. HE Nan-nan, GUAN Yong-xiang, LIANG Yong-hong, et al. Simultaneous determination of 3 TCs and 6 SAs in biogas slurry by solid phase extraction and high performance liquid chromatography[J]. Journal of Analytical Science, 2017, 33(3): 373-377. |
| [6] |
Sarmah A K, Meyer M T, Boxal A B A, et al. A global perspective on the use sales exposure pathways occurrence fate and effects of veterinary antibiotics(VAs)in the environment[J]. Chemosphere, 2006, 65(5): 725-759. DOI:10.1016/j.chemosphere.2006.03.026 |
| [7] |
陈永山, 章海波, 骆永明, 等. 典型规模化养猪场废水中兽用抗生素污染特征与去除效率研究[J]. 环境科学学报, 2010, 30(11): 2205-2212. CHEN Yong-shan, ZHANG Hai-bo, LUO Yong-ming, et al. A preliminary study on the occurrence and dissipation of antibiotics in swine wastewater[J]. Acta Scientiae Circumstantiae, 2010, 30(11): 2205-2212. |
| [8] |
李宁, 戴庆武, 王军, 等. 升流式厌氧污泥床处理抗生素制药废水[J]. 化工环保, 2010, 30(4): 48-51. LI Ning, DAI Qing-wu, WANG Jun, et al. Treatment of antibiotic production wastewater by UASB[J]. Environmental Protection of Chemical Industry, 2010, 30(4): 48-51. |
| [9] |
曲晓妍, 刘建广, 李鼎, 等. 臭氧生物活性炭深度处理饮用水中抗生素的研究[J]. 水科学与工程技术, 2010(5): 33-35. QU Xiao-yan, LIU Jian-guang, LI Ding, et al. Removal of antibiotics from drinking water by using ozone and biological activated carbon advanced waste treatment[J]. Water Sciences & Engineering Technology, 2010(5): 33-35. DOI:10.3969/j.issn.1672-9900.2010.05.015 |
| [10] |
Khan E, Babcock R W, Hsu T M, et al. Mineralization and biodegradability enhancement of low level p-nitrophenol in water using Fenton's reagent[J]. Journal of Environmental Engineering, 2005, 131: 327-331. DOI:10.1061/(ASCE)0733-9372(2005)131:2(327) |
| [11] |
黄昱, 李小明, 杨麒, 等. 高级氧化技术在抗生素废水处理中的应用[J]. 工业水处理, 2006, 26(8): 13-17, 65. HUANG Yu, LI Xiao-ming, YANG Qi, et al. Application of advanced oxidation processes to antibiotic wastewater treatment[J]. Industrial Water Treatment, 2006, 26(8): 13-17, 65. DOI:10.3969/j.issn.1005-829X.2006.08.004 |
| [12] |
林于廉, 田伟, 杨志敏, 等. 微波-Fenton对沼液中抗生素和激素的高级氧化[J]. 环境工程学报, 2013, 7(1): 164-168. LIN Yu-lian, TIAN Wei, YANG Zhi-min, et al. Advanced oxidation of olaquindox and tetracydline antibiotics in biogas slurry by microwave-Fenton[J]. Chinese Journal of Environmental Engineering, 2013, 7(1): 164-168. |
 2018, Vol. 37
2018, Vol. 37