2. 华南农业大学资源环境学院, 广州 510642
2. College of Natural Resources and Environment, South China Agricultural University, Guangzhou 510642, China
乙草胺是中国用量最大的三大除草剂之一[1],是一种选择性芽前处理剂,广泛应用于玉米、大豆、棉花等作物的田间除草。一直以来乙草胺被认为是一种低毒除草剂而广泛使用,但有研究显示,乙草胺对土壤微生物的数量与活性有明显的抑制作用,而且由于乙草胺施用频繁,能够对土壤微生物群落产生不可逆的影响[2-4]。蚯蚓是土壤中生物量最大的无脊椎动物,被誉为“土壤生态系统工程师”,蚯蚓的掘洞、排泄和分泌黏液的行为能够改变土壤理化性质,为微生物提供良好的生长环境,促进微生物活性和数量的提高;蚯蚓肠道微生物随粪便排入土壤,可以增加土壤中氨化细菌、磷细菌和纤维素降解菌的数量,改变土壤养分转化情况[5-6]。蚯蚓的这些性质使其成为了改善土壤质量的有效工具。此外,研究发现蚯蚓能够强化有机氯杀虫剂[7-8]和阿特拉津[9]等多种有机污染物的生物降解。但这些研究大都只关注污染物的降解过程,对蚯蚓在此过程中对土壤微生物群落的影响和修复作用尚未深入探究。
土壤微生物是土壤生态系统中的重要组成部分,通过土壤微生物的结构与状态评价土壤质量和安全一直是科学研究的热点问题。传统的微生物培养法仅能够对自然土壤中1%~5%的可培养微生物进行研究,具有明显的局限性[10];基于生物遗传多样性的新型分子生物学技术则能够根据基因序列对难培养微生物进行定性与定量分析,其中高通量测序作为新一代测序技术的典型代表,因其能够全面、准确地反映土壤微生物群落结构,对不同因素导致的土壤微生物群落变化予以客观研究和评价而被广泛应用[11]。现阶段关于乙草胺对土壤中微生物群落影响只停留在对微生物数量和土壤酶活性的研究阶段,研究手段也较为传统,无法将乙草胺对土壤微生物种群的影响精确到属。本实验利用土壤酶测定法、传统微生物培养法和高通量测序法等多种手段,表征蚯蚓对乙草胺污染土壤在微生物数量、活性、群落结构和具体物种组成等方面的直接和间接影响,旨在为乙草胺的合理使用和蚯蚓对土壤质量的修复改善提供一定的理论参考依据。
1 材料与方法 1.1 实验材料实验土壤采自天津西北部某农场的表层土壤(0~ 20 cm)。新鲜土样在室内自然风干,充分混匀后粉碎,过2 mm筛备用。供试土壤基本理化性质:pH值为8.32、有机质含量为23.97 g·kg-1、全氮含量为1.4 g· kg-1、速效磷含量0.94 mg·kg-1。本研究选用的受试生物为赤子爱胜蚓(Eisenia fetida),购于贾立明蚯蚓养殖有限公司(中国天津)。实验蚯蚓选取重0.3 g左右具有环带的成年赤子爱胜蚓,实验前在实验土壤中驯化两周,取出用无菌水清洗干净放置于装有湿润滤纸的烧杯中,在黑暗培养箱中25 ℃培养24 h,使其排出体内粪便。
1.2 实验设计本实验设置自然土壤(S)、土壤加乙草胺(SA)和土壤加乙草胺加蚯蚓(SAE)3个处理,每个处理3个重复。取200 g供试土壤置于250 mL玻璃烧杯中,SA和SAE处理组土壤中乙草胺的浓度为5 mg·kg-1(田间推荐使用剂量),SAE处理组中蚯蚓密度为5条/ 100 g土壤,所有处理外层包裹带气孔黑色塑料膜,为蚯蚓提供黑暗环境并防止逃逸。整个培养于恒温培养箱内进行,保持在25 ℃黑暗条件下,实验期间每隔7 d加一次灭菌蒸馏水以保持土壤含水量为23%(m/ m)不变,培养持续30 d。于第0、3、7、14、23 d和30 d进行土壤取样,土样置于-20 ℃下保存,测定土壤中乙草胺浓度及微生物数量,取部分第0、14 d和30 d土样进行土壤酶测定。另将少量第30 d土样于-80 ℃条件下保存用于土壤DNA提取与测序。
1.3 土壤酶活性测定土壤酶根据《土壤酶及其研究法》进行测定[12],具体方法如下:
(1)土壤过氧化氢酶采用高锰酸钾滴定法:基本原理是用高锰酸钾溶液滴定剩余过氧化氢的量,来表征过氧化氢酶的活性。将2 g土壤样品加入三角瓶中,加入40 mL蒸馏水和5 mL 0.3%的H2O2溶液,将三角瓶密封起来。振荡20 min后加入1 mL饱和铝钾矾,放入盛有5 mL 1.5 mol·L-1硫酸的三角瓶中过滤,滤干后,吸取滤液25 mL,用0.02 mol·L-1高锰酸钾滴定至紫红色,同时做无土对照。
(2)土壤脱氢酶采用氯化三苯基四氮唑(TTC)比色法:利用TTC作为受氢体,无色的TTC受氢后变成红色的TF(三苯基甲鐟),根据吸光度值计算TPF的生成量,求出脱氢酶的活性。将0.1 g新鲜土壤样品加入10 mL离心管中,加入0.5 mL 1%的TTC溶液充分混匀。置于37 ℃恒温培养箱中避光培养6 h。培养结束后立即冰浴5 min,加入0.5 mL甲醇,反复振荡数次,37 ℃保温10 min后进行离心(10 000 r·min-1,10 min,4 ℃),取上清液在485 nm下测定吸光度值。
(3)土壤蔗糖酶采用3,5-二硝基水杨酸比色法:蔗糖酶酶解所生成的还原糖与3,5-二硝基水杨酸反应而生成橙色的3-氨基-5-硝基水杨酸,根据吸光度值计算3-氨基-5-硝基水杨酸的生成量,求出蔗糖酶的活性。将0.1 g土壤样品加入10 mL离心管中,向其中加入15 μL甲苯,振荡混匀使土样全部湿润,37 ℃水浴15 min。再向其中加入0.25 mL 8%的蔗糖溶液和0.75 mL磷酸缓冲液。混合均匀后,放入37 ℃恒温培养箱培养24 h。培养结束后进行离心(10 000 r· min-1,10 min,4 ℃)。取0.2 mL上清液,加入0.5 mL DNS试剂,充分混匀95 ℃水浴5 min,然后用自来水冷却样品。在分光光度计上于508 nm处进行比色。
(4)土壤脲酶采用靛蓝比色法:称取0.25 g土样于10 mL离心管中,加125 μL甲苯。振荡混匀,使土样全部润湿,室温放置15 min。加625 μL 10%尿素6溶液和1250 μL pH 6.7的柠檬酸盐缓冲溶液,摇匀后在37 ℃恒温培养箱中培养24 h。培养结束后进行离心(10 000 r·min-1,10 min,25 ℃),取上清液。取0.1 mL上清液加入0.9 mL蒸馏水稀释10倍。向稀释液中加入200 μL苯酚钠溶液和150 μL次氯酸钠溶液,添加溶液过程中不断摇匀。充分混匀,室温放置20 min。1 h内于分光光度计上578 nm处进行比色。
(5)土壤碱性磷酸酶是根据酶促生成的有机基团酚的量计算磷酸酶活性:称取0.1 g土样于10 mL离心管中,加入50 μL甲苯,轻摇15 min后,加入400 μL 0.5%的硼酸盐缓冲液,摇匀后放入37 ℃恒温培养箱中培养24 h。培养结束后加入1 mL 0.3%的硫酸铝溶液,混匀以终止酶催化反应。离心(8000 r·min-1,10 min,25 ℃)取上清液于分光光度计660 nm处比色。
1.4 土壤微生物数量测定土壤中细菌和真菌的数量测定采用平板计数法。具体实验步骤如下:
(1)土壤稀释液制备:取待测土壤样品10 g于含90 mL灭菌水的锥形瓶中,橡胶塞密封后充分振荡5 min,获得土壤的10-1稀释液。用灭菌移液管取10 mL土壤稀释液到含90 mL灭菌水的锥形瓶中,振荡均匀获得10-2稀释液。再依次配制土壤的10-3、10-4、10-5、10-6、10-7和10-8的土壤稀释液。全部操作在超净工作台上进行,保证无菌操作。
(2)平板涂布:将培养基融化灭菌后制成平板,细菌采用牛肉膏蛋白胨培养基,真菌采用孟加拉红马丁培养基。细菌选取10-6、10-7和10-8的土壤稀释液,真菌选取10-3、10-4和10-5的土壤稀释液。每个培养皿加入0.1 mL的土壤稀释液,并用玻璃刮铲涂布均匀。每组稀释液设置3个重复。
(3)培养:细菌平板倒置培养于37 ℃培养箱中,真菌平板倒置培养于28 ℃培养箱中。培养时间为48 h。
(4)计数:选取菌落数量为30~300的平板进行计数。微生物数量(CFUs/g)=M×D/W,M表示平板中群落的个数,D表示稀释倍数,W表示用于测定的干土质量。
1.5 土壤微生物群落高通量分析(1)DNA提取:全部土壤DNA提取使用土壤样品DNA提取试剂盒:PowerSoil DNA extraction kit(Mo Bio Laboratories,USA),提取方法按照说明书执行。DNA提取后使用Thermo Nano Drop 2000核酸蛋白定量检测仪测定样品DNA的浓度和检查DNA的纯度。
(2)扩增:对纯化后的DNA样品进行扩增,细菌引物为16S rRNA基因V4区的515F和806R,真菌引物为ITS1F和ITS4。
(3)纯化:PCR扩增产物用DNA纯化试剂盒:Micro Elute DNA Clean-Up Kit(Omega Bio-Tek)进行纯化,纯化步骤按照说明书执行。
(4)分析:纯化后DNA的测序与分析由天津诺禾致源公司完成。
1.6 土壤理化性质测定土壤pH用pH计进行测定[13],具体方法为称取2 g待测土壤于50 mL离心管中,加入10 mL超纯水,混合均匀后进行离心(15 min,4000 r·min-1),取上清液进行测定。土壤总有机碳使用CN分析仪进行测定(Vario Max CN,Elementar,Hanau,Germany)[14]。土壤可溶性有机碳和可溶性无机碳使用TOC分析仪进行测定(Analytik jena multi N/C 3100,Germany)[13]。
1.7 数据处理统计分析使用SPSS(Version 22.0)进行处理。使用单向方差分析进行各处理间的差异显著性比较。经过统计分析的数据使用OriginPro 9.0作图。土壤微生物α多样性使用QIIME软件分析。PCoA(principal co-ordinates analysis)分析利用R软件完成。
2 结果与讨论 2.1 土壤酶变化分析土壤酶参与土壤中各种生物化学过程,能够反映某一种土壤生物化学过程的相对强度和土壤微生物活性。未添加乙草胺的自然土壤中五种酶的活性在30 d的培养过程中变化幅度很小(图 1)。在SA处理中过氧化氢酶的活性在第14 d和30 d时均明显下降(P < 0.05),第30 d时土壤过氧化氢酶的活性从59.4 μmol·d-1·g-1减少到了54.6 μmol·d-1·g-1。SAE处理中过氧化氢酶的活性同样呈现下降趋势,但下降过程相对减缓(图 1A)。土壤脱氢酶的活性与过氧化氢酶类似,乙草胺的加入使得第14 d时SA处理中脱氢酶活性显著下降(P < 0.05),但第30 d时SA处理中脱氢酶的活性已恢复到原有程度。蚯蚓的加入能在一定程度上促进脱氢酶活性的提高,在第14 d和30 d时,SAE处理中脱氢酶的活性分别提高了14%和7%(图 1B)。土壤过氧化氢酶和脱氢酶的活性反映了土壤中氧化还原过程的活跃程度,因此常被作为指示土壤微生物活性的指标[15-16],乙草胺对这两种酶的抑制作用说明乙草胺对土壤微生物有一定的毒害作用,会导致微生物活性的降低。蚯蚓活动对土壤理化性质的改善作用在促进微生物生长的同时也对土壤酶的活性有促进作用,蚯蚓对有机质的利用则直接影响了与营养物质循环相关的微生物。乙草胺的加入同样可以抑制土壤中蔗糖酶的活性,SA处理中第14 d和30 d时土壤中蔗糖酶的活性从77 μg·d-1·g-1下降到了48~52 μg·d-1·g-1范围内。蚯蚓对蔗糖酶的活性有明显促进作用(P < 0.05),第14 d和30 d时,SAE中蔗糖酶的活性分别提高了14%和53%(图 1C)。赤子爱胜蚓作为表层蚓以动植物残体和新鲜有机质为食,与土壤有机质的降解和转化有密切联系[17],蚯蚓对有机质的利用刺激了与土壤碳循环相关的蔗糖酶的活性。与上述三种酶不同的是,乙草胺的加入会对土壤中脲酶的活性有促进作用,SA处理中第14 d和第30 d的脲酶活性分别提高了84%和210%(图 1D)。各处理中碱性磷酸酶的活性变化与脲酶类似,乙草胺能够促进土壤碱性磷酸酶活性的提高,且磷酸酶的活性在培养周期内呈不断上升趋势。蚯蚓的加入对土壤脲酶和碱性磷酸酶没有明显影响(图 1E)。土壤脲酶和碱性磷酸酶分别是土壤氮和磷循环速率的指示酶[18-19],SA处理中这两种酶活性的升高说明乙草胺对土壤氮、磷循环起促进作用。

|
ANOVA,Duncan’ s test,P < 0.05。误差线代表基于三个平行实验的标准差。下同 ANOVA, Duncan' s test, P < 0.05. Error bars represent of the standard deviations of three parallel samples. The same below 图 1 蚯蚓对乙草胺污染土壤酶活性的影响 Figure 1 The impact of earthworm on soil enzyme activities |
综上,对本实验测定的5种酶而言,蚯蚓对土壤酶的促进作用仅限于受到乙草胺抑制的三种酶(过氧化氢酶、脱氢酶和蔗糖酶),对另两种被乙草胺促进的酶没有明显影响,因此蚯蚓对土壤微生物的影响主要表现在对土壤微生物的修复作用,当土壤中微生物受到乙草胺毒害而活性或数量受抑制时,蚯蚓能够缓解毒害、提高微生物活性。
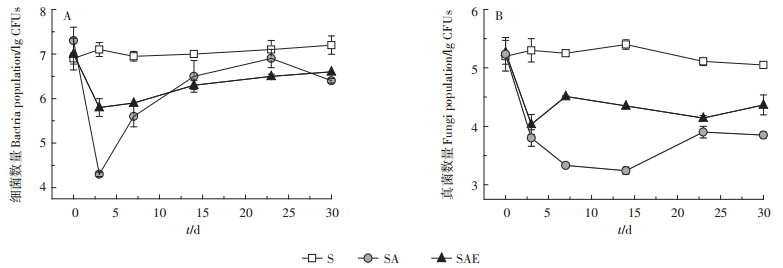
2.2 土壤微生物数量变化分析从图 2可以看出,在不添加乙草胺时,培养周期内自然土壤(S)中微生物的数量略有增长但变化并不明显。添加乙草胺后,SA处理中细菌和真菌的数量都呈现先下降后上升的趋势,但两者的变化规律并不完全一致。培养第3 d时SA中细菌数量级从开始时的107下降到了104(图 2A)。之后细菌数量迅速回升,在实验结束时细菌的CFUs已接近初始的数量值,达到了106。对真菌而言,加入乙草胺后,SA处理中真菌数量逐渐下降,在第14 d时达到最低点,土壤中真菌的数量级从最初的105下降到了103,14 d后土壤真菌数量逐渐上升,在第30 d培养结束时,土壤中真菌数量接近于104(图 2B)。土壤细菌和真菌数量的下降说明乙草胺对土壤微生物具有一定的毒性,这与前人的研究结果基本保持一致[20-21]。乙草胺的生物毒害作用对细菌来说是暂时性的,土壤中细菌数量的减少能够迅速自行恢复,而对真菌来说毒害作用持续时间较长。这表明一方面细菌对乙草胺的耐受性可能高于真菌;另一方面,真菌数量恢复速率较慢可能与细菌的快速增长有关,有实验表明部分细菌能够对真菌产生拮抗作用[22]。
|
图 2 蚯蚓对乙草胺污染土壤细菌(A)和真菌(B)数量的影响 Figure 2 The impact of earthworm on soil bacteria(A) and fungi (B)population |
在加入蚯蚓的SAE处理中,培养第3 d时,土壤细菌数量比不添加蚯蚓时要高35%(P < 0.05),而其他时间点蚯蚓作用不明显。对真菌来说,不同时间点SAE处理中真菌的数量均高于SA,在蚯蚓的作用下SAE中真菌数量要比SA高5%~39%,说明蚯蚓的加入能够加快乙草胺污染土壤中细菌、真菌数量的恢复速率。蚯蚓在土壤中通过掘洞、吞食土壤和排泄蚓粪等方式改变土壤的理化性质,直接或间接地促进土壤中微生物数量和活性的提高[23]。
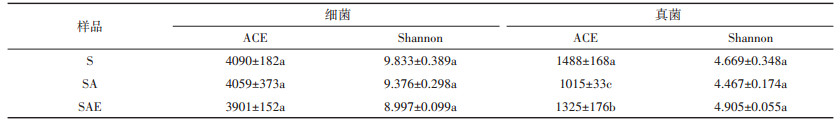
2.3 土壤微生物群落结构丰富度和多样性变化分析ACE和Shannon指数分别表征微生物群落的丰富度和多样性,这两个值越高分别表示微生物的多样性和丰富度越大。从表 1中可以看出,30 d培养结束时,乙草胺对土壤细菌的丰富度没有明显影响,但使得真菌丰富度降低了31.8%;蚯蚓的加入对细菌丰富度影响不明显,但使得真菌丰富度上升了30.5%。这与平板计数测定的微生物数量结果基本一致,进一步证明了乙草胺对土壤微生物的毒害作用和蚯蚓对乙草胺毒害的修复作用。对微生物多样性而言,SA中细菌的多样性与S处理组相比减少了4.6%,蚯蚓的加入进一步减少了土壤细菌的多样性。这可能源于蚯蚓消化过程对细菌的选择性消化,使得蚓粪中细菌的多样性低于土壤环境(蚓粪样品细菌的Shannon指数值为8.710±0.115),蚯蚓活动将蚓粪与土壤混合使土壤中细菌多样性相对减少。30 d培养结束时,SA中真菌的多样性与S处理组相比减少了4.3%,SAE中真菌的多样性指标相较于SA提高了9.8%。蚯蚓对土壤多样性影响具有两面性,一方面蚯蚓能够将肠道特有的微生物带入到土壤环境中,使其多样性增加[24],另一方面蚯蚓的消化过程会使得蚓粪中微生物多样性减少。本实验中,第30 d时真菌仍明显受到乙草胺的抑制作用,蚯蚓对土著微生物的刺激作用能够使其多样性提升,而此时细菌已几乎恢复到正常状态,蚯蚓对土著微生物细菌丰富度的作用不明显,蚓粪与土壤的混合会使得细菌多样性下降。
|
|
表 1 培养第30 d时不同处理组土壤中微生物的丰富度(ACE)和多样性(Shannon)指数(ANOVA,Duncan’ s test,P < 0.05) Table 1 Shannon and ACE indices of soil microbial community after 30 days incubation (ANOVA, Duncan' s test, P < 0.05) |
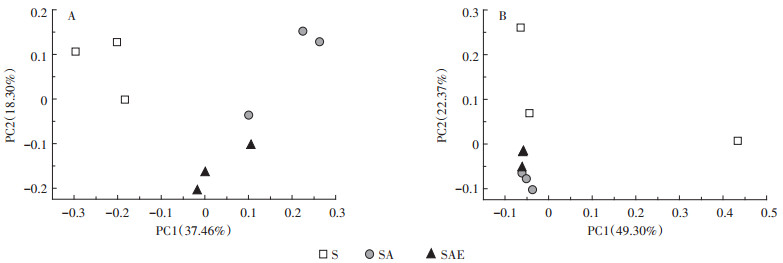
蚯蚓对土壤中受抑制微生物的恢复作用也可以从不同处理土壤中细菌和真菌的群落结构分布图(图 3)中看出。图中不同处理组样品点之间的距离越远,说明它们的群落结构相差越大。第30 d时,三个不同处理的细菌和真菌群落结构均有明显差异,说明乙草胺和蚯蚓都能够对土壤微生物群落产生影响,这与前面的实验结果基本一致,SAE处理组群落结构位于S和SA之间,说明蚯蚓能够促使土壤微生物恢复到接近未被污染的状态。
|
图 3 培养第30 d时蚯蚓对乙草胺污染土壤细菌(A)和真菌(B)群落结构的影响 Figure 3 The impact of earthworm on soil bacteria(A) and fungi (B)community structure after 30 days incubation |
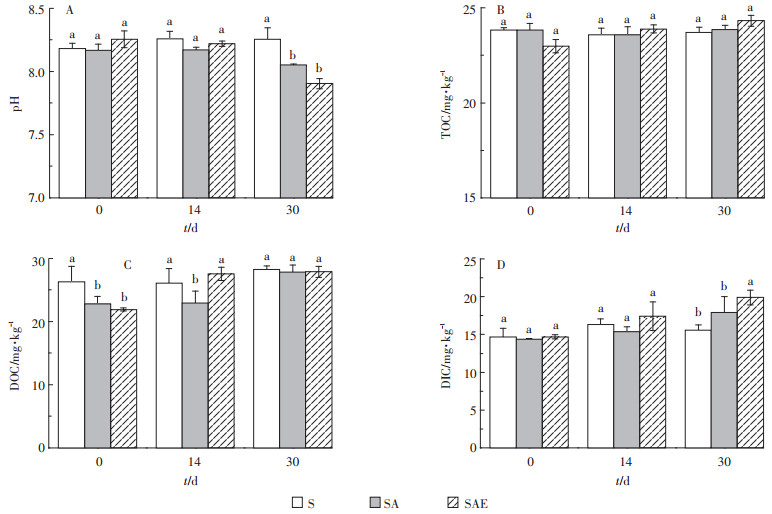
蚯蚓对乙草胺污染土壤理化性质的影响如图 4所示。从图 4A中可以看出,S处理组的各项理化性质在整个培养周期内变化不明显。SA和SAE的pH随时间呈下降趋势,SAE的pH下降趋势更加明显。第30 d时,S、SA和SAE的pH分别为8.25、8.05和7.90,这说明蚯蚓对土壤酸碱性有较强的调节能力。由于蚯蚓体内肠道及体表分泌黏液呈中性,蚯蚓可以通过将蚓粪和分泌物排放到土壤中的方式对土壤酸碱性进行调节[25],从而影响土壤微生物的活性与丰度。本实验使用土壤为碱性土壤,所以蚯蚓起到了降低土壤pH的作用。从图 4B中可以看出,不论是蚯蚓还是乙草胺对土壤中总有机碳的影响都不明显,但蚯蚓处理组能够提高土壤中可溶性有机碳(图 4C)和无机碳(图 4D)的含量。蚯蚓对可溶性有机碳的促进作用主要体现在实验中期(第14 d),SAE的DOC含量比SA高23%,第30 d时两者的DOC含量基本一致。可溶性有机碳易被微生物吸收分解,对土壤养分供应有重要影响[26]。蚯蚓还能促进土壤中可溶性无机碳含量的提升,第30 d时SAE的DIC含量比SA高11%。这说明蚯蚓对土壤中的碳循环有重要影响,与前文中土壤蔗糖酶的测定结果一致(图 1C)。蚯蚓消化过程能够促进土壤中有机质的转化与降解,为微生物提供更多有效态营养物质从而促进土壤土著微生物的生长[27]。
|
图 4 蚯蚓对乙草胺污染土壤理化性质的影响 Figure 4 The impact of earthworm on soil physicochemical properties |
在门水平上土壤中的细菌优势菌群为Proteobacteria、Actinobacteria、Firmicutes、Bacteroidetes和Acidobacteria(图 5A)。这5种细菌占到了整个细菌高通量序列的80%以上。其中Proteobacteria在每组样品中的含量都超过了40%。乙草胺的加入使得SA处理组中Proteobacteria和Actinobacteria的丰度分别下降6%和5%,而Acidobacteria的丰度则上升了6%。蚯蚓的添加能够改善乙草胺污染土壤中细菌的群落结构,SAE处理组中Proteobacteria和Actinobacteria的相对丰度上升了2%和3%,而Acidobacteria的相对丰度则下降了6%,相较于SA处理组更接近于S处理组的物种组成。
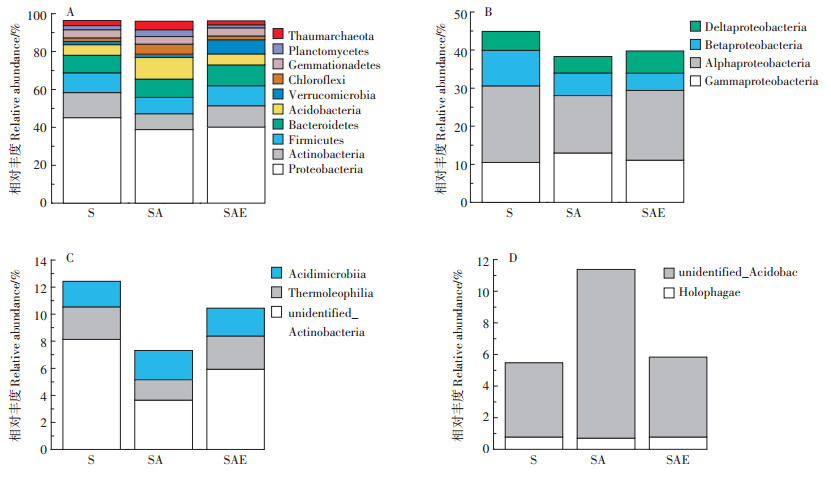
|
(A)细菌门水平物种分布情况;(B)Proteobacteria门中纲水平物种分布情况;(C)Actinobacteria门中纲水平物种分布情况;(D)Acidobacteria门中纲水平物种分布情况 (A)bacteria composition at phylum level; (B)bacteria composition of Proteobacteria at class level; (C)bacteria composition of Actinobacteria at class level; (D)bacteria composition of Acidobacteria at class level. 图 5 蚯蚓对乙草胺污染土壤细菌门与纲水平上物种分布的影响 Figure 5 The impact of earthworm on bacteria composition at phylum and class level |
细菌的Proteobacteria门可以分为Gammaproteobacteria、Alphaproteobacteria、Betaproteobacteria和Deltaproteobacteria四个纲,其中乙草胺对Alphaproteobacteria、Betaproteobacteria和Deltaproteobacteria都有抑制作用,而对Gammaproteobacteria丰度提升有促进作用。对于Actinobacteria门,乙草胺主要对unidentified_Actinobacteria和Thermoleophilia纲有明显的抑制作用,使其丰度分别减少了71%和59%,对Acidimicrobiia纲的作用并不明显。Acidobacteria门中大部分序列都属于unidentified_Acidobacteria纲,乙草胺对其有明显的促进作用,使其序列数量提升了127%,乙草胺对Acidobacteria门丰度提升的促进作用就来源于此。与门水平相似,蚯蚓使得分属不同门的9个纲的物种数量更接近S处理组,蚯蚓处理组中被乙草胺抑制的微生物Alphaproteobacteria、Betaproteobacteria、Deltaproteobacteria、unidentified_Actinobacteria和Thermoleophilia的丰度分别提高了21%、23%、33%、62%和63%,而被乙草胺促进的微生物Gammaproteobacteria和unidentified_Acidobacteria的丰度下降了15%和52%。这就进一步说明了蚯蚓能够修复乙草胺造成的生态毒害,使得土壤的细菌群落结构更接近于未被污染的自然状态。
图 6显示,在门水平上,真菌的群落主要由Ascomycota、Zygomycota以及Chytridiomycota组成,其中Ascomycota是优势物种,占整个真菌序列的60%以上。相比于S处理组,SA组Zygomycota的序列数上升了10%。而Chytridiomycota会明显受到乙草胺的抑制,其相对丰度从10%下降到了2%。蚯蚓能够使得SAE处理组Zygomycota的丰度相较于SA处理组有所下降,但对Chytridiomycota的含量没有明显影响。

|
图 6 蚯蚓对乙草胺污染土壤真菌门水平上物种分布的影响。 Figure 6 The impact of earthworm on fungi composition at phylum level |
真菌Zygomycota门的主要组成为Incertae_sedis_Zygomycota纲,乙草胺使其丰度明显上升,蚯蚓能够使其序列数下降恢复到原有状态。Chytridiomycetes是Chytridiomycota门中最主要的纲,乙草胺对其有明显的抑制作用,而蚯蚓没有明显的促进作用。
2.5.2 属水平上的土壤微生物变化分析图 7显示了细菌、真菌在属水平上丰度前15的物种,这些微生物在整个群落中的占比在10%~20%的范围内。对图中所显示的15种细菌而言,乙草胺对大部分细菌(11种)都有抑制作用,而蚯蚓则能够缓解毒害作用促进其丰度上升,这与门水平的变化情况基本一致。四种被乙草胺促进生长的细菌分别是Sphingomonas、Pseudomonas、Clostridium_sensu_stricto_ 1和Steroidobacter,它们可能能够利用乙草胺作为碳源或氮源,参与到乙草胺的降解过程中。其中Sphingomonas和Pseudomonas已被研究人员从高浓度乙草胺污染(100 mg·kg-1)的土壤中分离纯化出来,并认为它们参与到了乙草胺降解的脱氯、脱烷基和碳氮键断裂过程中[28-30]。Pseudomonas是目前研究较多的真菌拮抗菌之一,具有抑制真菌繁殖生长的能力[31],乙草胺处理组SA中Pseudomonas的丰度上升了36%,这可能加剧了乙草胺对真菌的抑制作用。
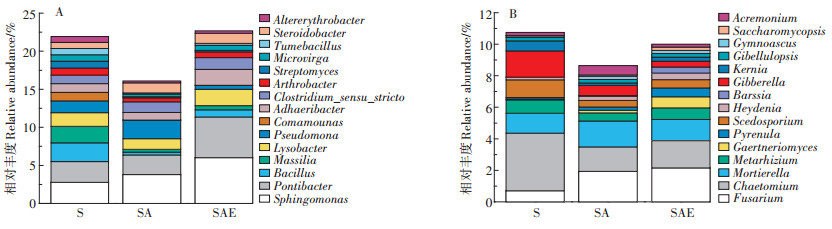
|
图 7 蚯蚓对乙草胺污染土壤细菌(A)和真菌(B)属水平上物种分布的影响 Figure 7 The impact of earthworm on bacteria(A) and fungi (B)composition at genues level |
对真菌而言,丰度前15的物种中有9种会受到乙草胺的刺激作用而相对丰度上升,但乙草胺对其余真菌的抑制作用更加明显,使得SA处理中15种真菌的序列数总和低于S处理(图 7B)。从图中还可以看出,蚯蚓在属层面上使得Chaetomium、Mortierella、Metarhizium和Scedosporium等多种真菌的丰度更接近于S处理,与门水平上结果一致。另外,蚯蚓对Fusarium、Gaertneriomyces和Pyrenula这三种可能的降解菌有促进生长的作用。这三种真菌和乙草胺降解的关系并不明确,但有研究显示Fusarium能够参与到多环芳烃的降解过程中[32]。
3 结论(1)蚯蚓对乙草胺造成的生态毒害有明显的缓解和修复作用。乙草胺对土壤过氧化氢酶、脱氢酶和蔗糖酶活性有抑制作用,蚯蚓能够促进污染土壤中这三种酶活性的提升,从而达到缓解毒害、修复土壤的作用。蚯蚓对乙草胺污染土壤中细菌数量的恢复作用主要发生在实验前期(第3 d),对真菌的恢复作用持续到了整个培养周期结束(30 d)。
(2)蚯蚓能够通过改变土壤理化性质的方式间接影响土壤的微生物群落,本实验中蚯蚓对土壤酸碱性和碳循环有明显的影响,蚯蚓通过改善土壤pH、增加土壤中可溶性碳的方式,为微生物生长提供适宜的生长环境。
(3)乙草胺在门水平上主要对细菌Proteobacteria、Actinobacteria、Acidobacteria和真菌Zygomycota、Chytridiomycota产生影响。蚯蚓能够改善土壤中微生物的群落结构,促使土壤微生物物种组成更接近于未污染状态。
(4)少数微生物包括Sphingomonas、Pseudomonas、Fusarium、Gaertneriomyces和Pyrenula等能够受到乙草胺刺激而丰度增加,这些微生物可能参与到乙草胺的微生物降解过程中。
| [1] |
华乃震. 酰胺类除草剂制剂的研发和进展[J]. 现代农药, 2011(1): 8-15. HUA Nai-zhen. Amide herbicides formulations and their progress of R &D[J]. Modern Agrochemicals, 2011(1): 8-15. DOI:10.3969/j.issn.1671-5284.2011.01.003 |
| [2] |
张惠文, 张倩茹, 周启星, 等. 乙草胺及铜离子复合施用对黑土农田生态系统土著微生物的急性毒性效应[J]. 农业环境科学学报, 2003, 22(2): 129-133. ZHANG Hui-wen, ZHANG Qian-ru, ZHOU Qi-xing, et al. Combined effects of acute toxicity of acetochlor and copper on soil microbial population and biological characteristics in maize-wheat-soybean agroecosystem[J]. Journal of Agro-Environment Science, 2003, 22(2): 129-133. DOI:10.3321/j.issn:1672-2043.2003.02.001 |
| [3] |
邢虎成, 唐映红, 薛丽君, 等. 乙草胺对苎麻农田土壤微生物数量的影响[J]. 作物研究, 2013, 27(2): 131-134. XING Hu-cheng, TANG Ying-hong, XUE Li-jun, et al. Effect of acetochlor on soil microorganism in ramie field[J]. Crop Research, 2013, 27(2): 131-134. DOI:10.3969/j.issn.1001-5280.2013.02.08 |
| [4] |
Li X Y, Su Z C, Li X, et al. Assessing the effects of acetochlor on soil fungal communities by DGGE and clone library analysis[J]. Ecotoxicology, 2010, 19(6): 1111-1116. DOI:10.1007/s10646-010-0493-0 |
| [5] |
Jing Y P, Liu M Q, Yin Q P, et al. Effects of earthworms and ryegrass on the removal of fluoranthene from soil[J]. Pedosphere, 2013, 23(4): 523-531. DOI:10.1016/S1002-0160(13)60045-4 |
| [6] |
Horn M, Schramm A, Drake H. The earthworm gut:an ideal habitat for ingested N2O-Producing microorganisms[J]. Applied & Environmental Microbiology, 2003, 69(3): 1662-1669. |
| [7] |
Lin Z, Zhen Z, Wu Z, et al. The impact on the soil microbial community and enzyme activity of two earthworm species during the bioremediation of pentachlorophenol-contaminated soils[J]. Journal of Hazardous Materials, 2016, 301(15): 35-45. |
| [8] |
Lin Z, Bai J, Zhen Z, et al. Enhancing pentachlorophenol degradation by vermicomposting associated bioremediation[J]. Ecological Engineering, 2016, 87(Suppl C): 288-294. |
| [9] |
Lin Z, Zhen Z, Ren L, et al. Effects of two ecological earthworm species on atrazine degradation performance and bacterial community structure in red soil[J]. Chemosphere, 2018, 196: 467-475. DOI:10.1016/j.chemosphere.2017.12.177 |
| [10] |
Volkov I, Banavar J R, Maritan A. Comment on "Computational improvements reveal great bacterial diversity and high metal toxicity in soil"[J]. Science, 2006, 313(5789): 918. |
| [11] |
Kim M, Lee K H, Yoon S W, et al. Analytical tools and databases for metagenomics in the next-generation sequencing era[J]. Genomics Inform, 2013, 11(3): 102-113. DOI:10.5808/GI.2013.11.3.102 |
| [12] |
关松荫. 土壤酶及其研究法[M]. 北京: 农业出版社, 1986: 260-344. GUAN Song-yin. Soil enzyme and determination method[M]. Beijing: Agriculture press, 1986: 260-344. |
| [13] |
Li X J, Wang X, Zhang Y Y, et al. Salinity and conductivity amendment of soil enhanced the bioelectrochemical degradation of petroleum hydrocarbons[J]. Scientific Reports, 2016, 6: 32861. DOI:10.1038/srep32861 |
| [14] |
Nie X, Li Z, Huang J, et al. Thermal stability of organic carbon in soil aggregates as affected by soil erosion and deposition[J]. Soil and Tillage Research, 2018, 175: 82-90. DOI:10.1016/j.still.2017.08.010 |
| [15] |
Kumar S, Chaudhur S, Maiti S. Soil dehydrogenase enzyme activity in natural and mine soil:A review[J]. Middle-East Journal of Scientific Research, 2013, 7(13): 898-906. |
| [16] |
Stepniewska Z, Wolinska A, Ziomek J. Response of soil catalase activity to chromium contamination[J]. Journal of Environmental Sciences, 2009, 21(8): 1142-1147. DOI:10.1016/S1001-0742(08)62394-3 |
| [17] |
Lin Z, Li X M, Li Y T, et al. Enhancement effect of two ecological earthworm species (Eisenia foetida and Amynthas robustus E. Perrier) on removal and degradation processes of soil DDT[J]. Journal of environmental monitoring:JEM, 2012, 14(6): 1551-1558. DOI:10.1039/c2em30160a |
| [18] |
Paz-Ferreiro J, Fu S L, Mendez A, et al. Interactive effects of biochar and the earthworm Pontoscolex corethrurus on plant productivity and soil enzyme activities[J]. Journal of Soils and Sediments, 2014, 14(3): 483-494. DOI:10.1007/s11368-013-0806-z |
| [19] |
Sun R, Zhang X X, Guo X, et al. Bacterial diversity in soils subjected to long-term chemical fertilization can be more stably maintained with the addition of livestock manure than wheat straw[J]. Soil Biology and Biochemistry, 2015, 88(4): 9-18. |
| [20] |
Bai Z, Xu H J, He H B, et al. Alterations of microbial populations and composition in the rhizosphere and bulk soil as affected by residual acetochlor[J]. Environmental Science and Pollution Research, 2013, 20(1): 369-379. DOI:10.1007/s11356-012-1061-3 |
| [21] |
荆瑞勇, 王丽艳, 王彦杰, 等. 乙草胺对土壤微生物数量和酶活性的影响[J]. 中国生态农业学报, 2010, 18(6): 1302-1305. JING Rui-yong, WANG Li-yan, WANG Yan-jie, et al. Effect of acetochlor application on soil microorganism number and enzymes activities[J]. Chinese Journal of Eco-Agriculture, 2010, 18(6): 1302-1305. |
| [22] |
De Boer W, Verheggen P, Klein Gunnewiek P J A, et al. Microbial community composition affects soil fungistasis[J]. Appl Environ Microbiol, 2003, 69(2): 835-44. DOI:10.1128/AEM.69.2.835-844.2003 |
| [23] |
陶军, 张树杰, 焦加国, 等. 蚯蚓对秸秆还田土壤细菌生理菌群数量和酶活性的影响[J]. 生态学报, 2010, 30(5): 1306-1311. TAO Jun, ZHANG Shu-jie, JIAO Jia-guo, et al. Effects of earthworm on number of soil bacterial physiological groups and enzyme activity in a maize residue amended wheat agro-ecosystem[J]. Acta Ecologica Sinica, 2010, 30(5): 1306-1311. |
| [24] |
Dallinger A, Horn M A. Agricultural soil and drilosphere as reservoirs of new and unusual assimilators of 2, 4-dichlorophenol carbon[J]. Environ Microbiol, 2014, 16(1): 84-100. DOI:10.1111/emi.2014.16.issue-1 |
| [25] |
Bolan N S, Baskaran S. Characteristics of earthworm casts affecting herbicide sorption and movement[J]. Biol Fertil Soils, 1996, 22(4): 367-72. DOI:10.1007/BF00334585 |
| [26] |
魏春兰, 马红亮, 高人, 等. 模拟氮沉降对森林土壤可溶性有机碳的影响[J]. 亚热带资源与环境学报, 2013, 8(4): 16-24. WEI Chun-lan, MA Hong-liang, GAO Ren, et al. Effects of nitrogen deposition on soluble organic carbon:A simulation study in subtropical sorest soils[J]. Journal of Subtropical Resources and Environment, 2013, 8(4): 16-24. DOI:10.3969/j.issn.1673-7105.2013.04.003 |
| [27] |
Dendooven L, Alvarez-Bernal D, Contreras-Ramos S M. Earthworms, a means to accelerate removal of hydrocarbons(PAHs)from soil? A mini-review[J]. Pedobiologia, 2011, 54(Suppl): 187-192. |
| [28] |
Chen K, Chen Q, Wang G X, et al. Sphingomonas chloroacetimidivorans sp. nov., a chloroacetamide herbicide-degrading bacterium isolated from activated sludge[J]. Antonie Van Leeuwenhoek International Journal of General and Molecular Microbiology, 2015, 108(3): 703-710. DOI:10.1007/s10482-015-0526-z |
| [29] |
Wang F, Zhou J, Li Z, et al. Involvement of the cytochrome P450 system EthBAD in the N-deethoxymethylation of acetochlor by Rhodococcus sp. strain T3-1[J]. Appl Environ Microbiol, 2015, 81(6): 2182-2188. DOI:10.1128/AEM.03764-14 |
| [30] |
Xu J, Qiu X, Dai J, et al. Isolation and characterization of a Pseudomonas oleovorans degrading the chloroacetamide herbicide acetochlor[J]. Biodegradation, 2006, 17(3): 219-225. DOI:10.1007/s10532-005-4220-0 |
| [31] |
吴敏娜, 张惠文, 李新宇, 等. 乙草胺胁迫对土壤真菌拮抗功能和假单胞菌以及芽胞杆菌群落结构的影响[J]. 农业环境科学学报, 2008, 27(3): 926-931. WU Min-na, ZHANG Hui -wen, LI Xin-yu, et al. Effects of acetochlor on soil fungistasis and the community structure of Pseudomonas and Bacillus[J]. Journal of Agro-Environment Science, 2008, 27(3): 926-931. DOI:10.3321/j.issn:1672-2043.2008.03.017 |
| [32] |
孙姗姗, 魏然, 倪进治, 等. 多环芳烃降解真菌Fusarium solani对芘的吸收存储和降解特性研究[J]. 环境科学学报, 2016, 36(7): 2408-2414. SUN Shan-shan, WEI Ran, NI Jin-zhi, et al. Sorption and biodegradation characteristics of pyrene by a PAH degradation fungus Fusarium solani[J]. Acta Scientiae Circumstantiae, 2016, 36(7): 2408-2414. |
 2018, Vol. 37
2018, Vol. 37