2. 中国农业科学院农业资源与农业区划研究所, 北京 100081
2. Institute of Agricultural Resources and Regional Planning, Chinese Academy of Agricultural Sciences, Beijing 100081, China
铬(Cr)在自然环境中主要以Cr(Ⅵ)和Cr(Ⅲ)两种价态存在[1-3],其毒性与环境中的存在价态具有密切关系。由于Cr(Ⅵ)迁移能力较强且具有强氧化性[4],因此人们普遍认为Cr(Ⅵ)具有更高的生态毒性[5]。许多研究结果也得出了一致的结论,如Sivakumar等[6]分别研究了Cr(Ⅵ)和Cr(Ⅲ)在10种土壤中对赤子爱胜蚓(Eisenia fetida)的毒性,发现暴露14 d时Cr(Ⅵ)的半数致死浓度(Median lethal concentration,LC50)为222~257 mg·kg-1,Cr(Ⅲ)的LC50为1656~1902 mg·kg-1,Cr(Ⅵ)对赤子爱胜蚓的毒性显著高于Cr(Ⅲ)。梁艳茹[7]研究了Cr(Ⅵ)和Cr(Ⅲ)对塿土、褐土和风沙土脱氢酶活性的影响,发现Cr(Ⅵ)和Cr(Ⅲ)对土壤脱氢酶活性的半数有效剂量(Median effective dose,ED50)分别为50.9~81.0 mg·kg-1和2451~3415 mg·kg-1,表明在这三种土壤中Cr(Ⅵ)对脱氢酶的毒性也显著高于Cr(Ⅲ)。然而有些学者的研究却得出了相反的结果,如Vignati等[8]发现在淡水环境中Cr(Ⅲ)对两种绿藻Pseudokirchneriella subcapitata和Chlorella kessleri的毒性分别大约是Cr(Ⅵ)毒性的10倍和5倍。Samborska等[9]也发现在相同浓度下Cr(Ⅲ)比Cr(Ⅵ)对土壤脲酶具有更强的抑制作用。由此可以看出,Cr的毒性除了与其价态有关之外,还受到生物受体的影响,仅就单一生物受体作为研究目标无法对不同价态Cr的综合毒性进行准确评价。需将当前分散的基于有限物种的Cr(Ⅵ)和Cr(Ⅲ)毒性研究结果整合起来,才能从多生物指标和生态系统水平上对Cr(Ⅵ)和Cr(Ⅲ)的生态毒性差异进行综合比较。
Cr(Ⅵ)和Cr(Ⅲ)的毒性除了因生物受体而异外,环境因子如土壤pH、有机碳含量(OC)、阳离子交换量(CEC)及黏土含量(clay)等也是影响Cr在环境中迁移转化和生物有效性的重要因素,相同含量的同一价态Cr添加到不同类型土壤中对同一种生物和评价终点的毒性常常差异较大,如Cr(Ⅵ)在酸性土壤中对脲酶活性的半数有效浓度(Median effective concentration,EC50)为1093 mg·kg-1,在碱性土壤中的EC50却为27 473 mg·kg-1[10];Cr(Ⅲ)在酸性土壤中对磷酸酶活性的10%有效浓度(10% of effective concentration,EC10)为1089 mg·kg-1,而在碱性土壤中的EC10却仅为370 mg·kg-1[11],因此在对不同价态Cr的生态毒性差异进行分析时,还需建立各价态Cr的生态毒性与土壤性质关系的预测模型,以便于通过归一化处理修正由于土壤性质引起的毒性差异。
在重金属污染物对生态系统毒性的研究中,物种敏感性分布(SSD)法以其简单明确、置信度较高、适用于各个领域以及可预测生态系统的潜在生态效应等优点[12-14],已成为普遍应用的重要方法,该方法假设生态系统中不同物种对于某一污染物的敏感性(EC50或EC10)能够被一个分布所描述,通过生物测试获得的有限物种的毒性阈值是来自于该分布的样本,可用来估算该分布的参数[14]。杜建国等[15]应用SSD方法研究了不同价态Cr对海洋生态系统(包括藻类、鱼类、甲壳类、软体动物、蠕虫和其他无脊椎动物)的毒性,发现Cr(Ⅵ)的生态毒性大于Cr(Ⅲ)的生态毒性,且高浓度(1000 μg·L-1)水平下的Cr(Ⅵ)和Cr(Ⅲ)生态风险差异也比低浓度(<10 μg·L-1)时有所增大。王晓南等[16]以保定市农田潮土为研究对象,通过SSD法分析了Cr(Ⅵ)对8种土壤植物(小麦、莴苣、黄瓜、玉米、白菜、大豆、韭菜和番茄)和2种土壤动物(褐云玛瑙螺和赤子爱胜蚓)的生态毒性,并推导出了保护生态系统中95%生物不受危害的浓度(5% of hazardous concentration,HC5)为6.5 mg·kg-1。而目前关于Cr(Ⅵ)和Cr(Ⅲ)污染对我国土壤生态系统毒性差异的研究尚未见报道。由于土壤生态系统是由土壤植物、动物和微生物三大类群多种生物组成,物种选取上宜涵盖每一类群和营养级[17],且考虑到土壤环境因子对Cr(Ⅵ)和Cr(Ⅲ)毒性的潜在影响,本研究将利用文献检索到的基于我国土壤Cr(Ⅵ)和Cr(Ⅲ)的生态毒理学数据,通过构建生态毒性预测模型修正土壤理化性质引起的Cr毒性差异,构建Cr(Ⅵ)和Cr(Ⅲ)在同一土壤条件下的SSD曲线,明确土壤中Cr(Ⅵ)和Cr(Ⅲ)的生态毒性差异,为不同价态Cr污染土壤的生态风险评价和修复管理等提供参考。
1 材料与方法 1.1 Cr毒理学数据的筛选与处理在中国知网(CNKI)、万方学位论文、Sciencedirect、Web of Science、Wiley Online Library和Springer数据库中以“土壤”和“Cr”或“铬”为关键词,搜索所有基于中国土壤的Cr生态毒理学数据并进行筛选。筛选的数据应满足以下条件:实验有合理的对照;暴露途径均匀合理或随机分布;实验中条件控制始终一致;有足够的重复和浓度梯度,便于统计分析;外源添加污染物,无复合污染等障碍因素;没有其他明显不合理的因素,如缺少土壤性质和评价终点等[13]。从满足条件的文献中直接获取相关生物指标的EC50和EC10或利用有明显剂量-效应关系的原始数据通过Log-logistic函数公式计算获得。由于目前尚没有适宜的关于土壤Cr(Ⅵ)和Cr(Ⅲ)的老化和淋洗模型,无法对不同老化时间和淋洗处理的土壤进行校正,为统一条件以避免不同老化时间和是否进行淋洗处理引起的结果差异,本研究仅选用在污染物添加7 d内进行毒理学试验的非淋洗土壤。考虑到EC50和EC10在不同土壤条件下可能存在较大差异,选取的生物指标应至少具有两种土壤性质的EC50和EC10,但是由于中国土壤Cr对动物生态毒害数据缺乏,因此,一种土壤性质下(包括人工土壤)的动物指标依然采用;对于具有多个评价终点的同一物种,选取最重要或最敏感的评价终点作为该物种的生物毒性评价指标。
1.2 生态毒性预测模型的构建和种间外推研究表明土壤pH、OC及CEC对土壤中重金属元素的生物有效性和毒性有着显著的影响[18-19],因此,以筛选到的生物指标的EC50和EC10作为因变量,以土壤pH、OC或CEC等作为自变量,通过SPSS软件进行多元逐步回归分析建立不同价态Cr的生态毒性预测模型,模型的通用形式为:
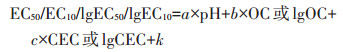
|
(1) |
式中,a、b、c表示相应的土壤参数对Cr的生态毒性的影响程度,截距k则表征该生物指标对Cr毒害的固有敏感性。
有的生物指标因缺乏足够数据无法构建Cr生态毒性预测模型,可与已有的属于同一类型的指标共享Cr模型,即假设Cr对共享模型的所有生物指标的毒性受土壤理化性质的影响程度是相同的,即共享模型的土壤性质参数是恒定的,差异来自于各指标本身的固有敏感性(k)。以EC50或EC10实测值与预测值之间的均方根误差(RMSE)最小为目标,通过规划求解获得对应不同模型的各个指标的截距(k),此为种间外推[13]。通过预测模型计算实测土壤条件下的EC50和EC10预测值,并与实测值进行比较,分析种间外推模型的预测效果。
1.3 归一化处理及种内变异分析利用毒性预测模型将各土壤生物指标的EC50和EC10值归一化到相同土壤条件下,以修正土壤性质的影响。如土壤生物指标的EC10模型为
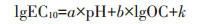
|
(2) |
则归一化后的EC10nor为:

|
(3) |
式中,a、b表示相应的土壤参数对Cr的生态毒性的影响程度,截距k表征该生物指标对Cr毒害的固有敏感性,“nor”表示对应的参数为归一化后的参数。
对于具有多个EC50和EC10(在不同土壤条件下测得)的某一生物指标,如归一化后变异系数降低,则表示进行归一化可在一定程度上修正土壤性质差异的影响[13]。
1.4 SSD曲线的建立对于具有预测模型的生物指标,将不同土壤条件下测得的EC50和EC10值进行归一化,并以归一化后的EC50和EC10的几何平均值表示;对于没有预测模型或模型不适用的生物指标选用实测值的几何均值。由于本研究用于构建SSD曲线的生物指标包括归一化后的预测值和未归一化的实测值,而未归一化生物指标的土壤pH基本接近7,因此,将具有预测模型的生物指标归一化到pH=7.0、OC=1.5%及CEC=15 cmol·kg-1的中性土壤条件下,以消除土壤性质差异产生的影响,便于比较和分析Cr(Ⅵ)和Cr(Ⅲ)对生态系统的毒性差异。采用Burr Ⅲ分布函数对Cr(Ⅵ)和Cr(Ⅲ) EC50和EC10的累积概率分布进行拟合并建立SSD曲线及其95%的置信区间。SSD曲线上某一Cr浓度所对应的累积概率表示该浓度水平Cr对生态系统的潜在影响比例(Potential affected fraction,PAF)[20],也可根据Burr Ⅲ分布函数的反推公式计算已知PAF下的Cr浓度。根据置信区间的宽窄来判断SSD曲线的拟合度,置信区间越窄表明拟合度越高[21]。
Burr Ⅲ分布计算PAF的公式为:
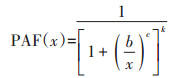
|
(4) |
反推公式为:
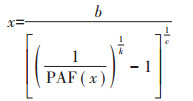
|
(5) |
式中,b、c、k是函数的3个参数。
SSD拟合采用澳大利亚联邦科学和工业研究组织(Commonwealth Scientific and Industrial Research Organization,CSIRO)提供的计算软件BurrliOZ(版本2.0)(http://www.cmis.csiro.au/envir/burrlioz/)进行。
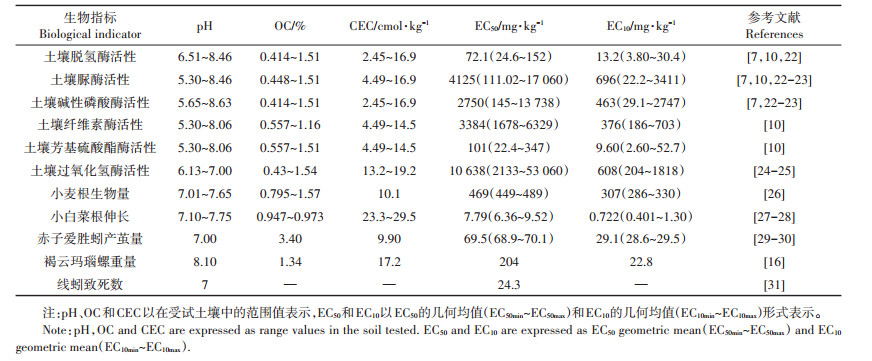
2 结果与讨论 2.1 生态毒性预测模型的建立及种间外推根据以上筛选条件,共获得11个Cr(Ⅵ)生物指标的毒理学数据(表 1)和9个Cr(Ⅲ)生物指标的毒理学数据(表 2);这些数据均基于外源添加Cr污染土壤,EC50和EC10值以外源添加的Cr浓度表示,不包括实验土壤背景值部分。
|
|
表 1 基于中国土壤的Cr(Ⅵ)生态毒理学数据 Table 1 Ecotoxicological data of Cr(Ⅵ) based on Chinese soils |
|
|
表 2 基于中国土壤的Cr(Ⅲ)生态毒理学数据 Table 2 Ecotoxicological data of Cr(Ⅲ) based on Chinese soils |
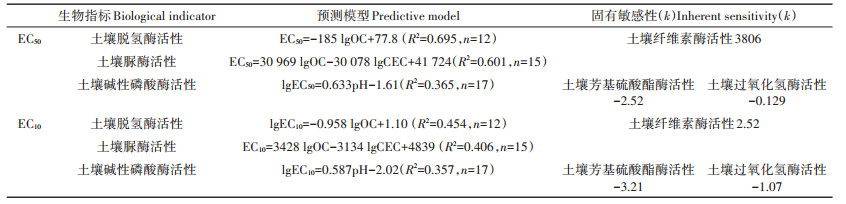
通过多元线性回归构建的Cr(Ⅵ)和Cr(Ⅲ)的生态毒性预测模型及种间外推模型的固有敏感性如表 3和表 4所示。Cr(Ⅵ)对土壤脱氢酶、脲酶和碱性磷酸酶毒性的主控因素分别是土壤OC,土壤OC和CEC,以及土壤pH。对于Cr(Ⅲ)来说,土壤pH是影响其对土壤脲酶和碱性磷酸酶毒性的主控因素,土壤OC和CEC是影响其对土壤脱氢酶毒性的主控因素。表 3和表 4中Cr(Ⅵ)和Cr(Ⅲ)生态毒性预测模型的部分相关系数(R2)较小及土壤性质参数的正负号不统一,这可能是由于构建预测模型的数据来自不同的文献,其土壤培养时间和测定方法之间存在差异。
|
|
表 3 Cr(Ⅵ) EC50和EC10生态毒性预测模型及生物指标固有敏感性 Table 3 Ecotoxicity prediction models of EC50 and EC10 values of Cr(Ⅵ) and inherent sensitivity of extrapolated biological indicators |
|
|
表 4 Cr(Ⅲ) EC50和EC10生态毒性预测模型及生物指标固有敏感性 Table 4 Ecotoxicity prediction models of EC50 and EC10 values of Cr(Ⅲ) and inherent sensitivity of extrapolated biological indicators |
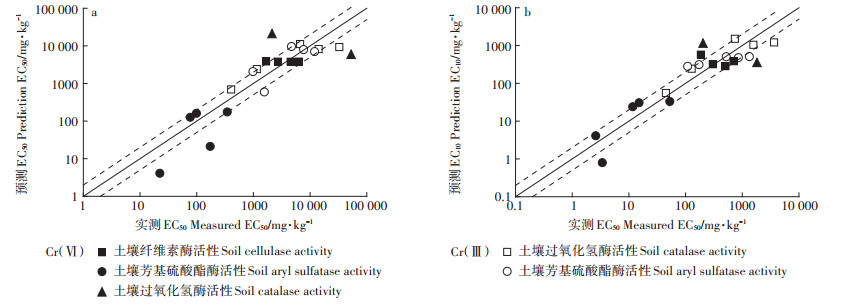
利用选用的生态毒性预测模型及对应的固有敏感性计算各外推指标的EC50和EC10预测值,其实测值与预测值的关系见图 1a和图 1b。除Cr(Ⅵ)对土壤过氧化氢酶活性的EC50与EC10值超出了2倍预测区间外,其余的生物指标的实测值与预测值比值均全部或基本处于2倍预测区间内,表明这些生物指标种间外推模型的预测效果较好,可用于接下来的归一化处理和SSD曲线构建。对于模型预测效果不理想的Cr(Ⅵ)土壤过氧化氢酶活性的EC50与EC10值以及没有预测模型的土壤植物和动物指标的EC50和EC10值,采用实测值的几何均值进行SSD曲线的构建。
|
实线代表1:1的直线,虚线表示两倍的预测区间 Solid lines represent 1:1 straight lines, and dashed lines represent 2-fold prediction intervals 图 1 基于种间外推模型的Cr(Ⅵ)和Cr(Ⅲ)的实测EC50与预测EC50(a)和实测EC10与预测EC10(b)的相关性 Figure 1 Correlation between measured and predicted EC50 (a) and EC10 (b) of Cr(Ⅵ) and Cr(Ⅲ) based on interspecies extrapolation models |
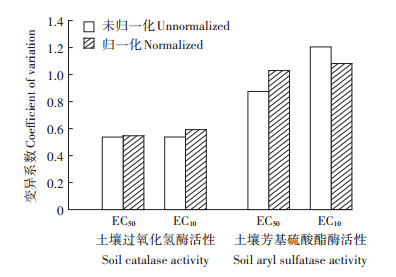
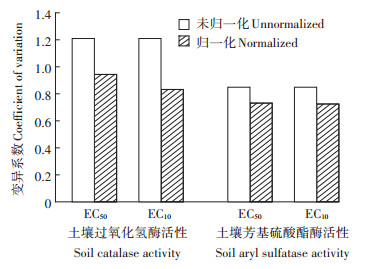
利用表 3和表 4中的模型将各土壤生物指标的EC50和EC10值归一化到中性土壤条件下,各生物指标的种内变异结果见图 2和图 3。除Cr(Ⅵ)土壤纤维素酶活性的EC50和EC10值及芳基硫酸酯酶活性的EC50值,经毒性预测模型归一化后变异系数略有增加,其余Cr(Ⅵ)和Cr(Ⅲ)生物指标的变异系数均显著降低,表明通过归一化处理可以有效消除由于土壤性质差异引起的毒性变异[13]。
|
图 2 归一化前后Cr(Ⅵ)对各生物指标的EC50和EC10的种内变异 Figure 2 Intraspecific variation of EC50 and EC10 of Cr(Ⅵ) for various biological indicators before and after their normalization |
|
图 3 归一化前后Cr(Ⅲ)对各生物指标的EC50和EC10的种内变异 Figure 3 Intraspecific variation of EC50 and EC10 of Cr(Ⅲ) for various biological indicators before and after their normalization |
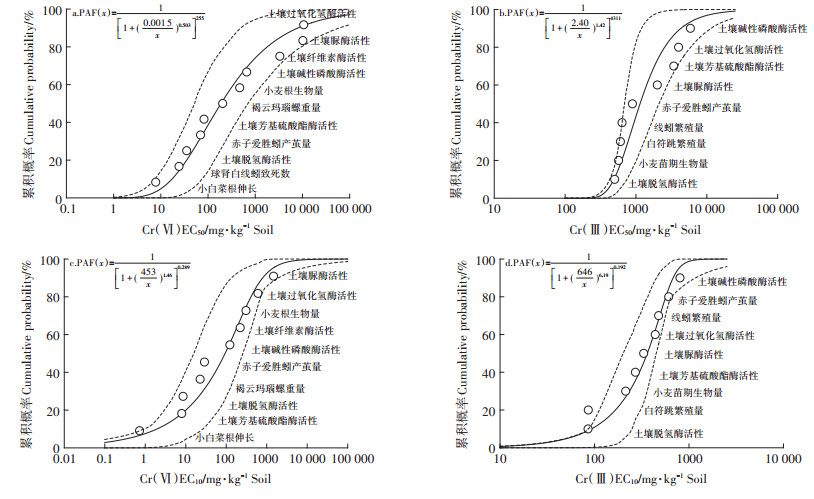
通过Burr Ⅲ函数分别拟合得到Cr(Ⅵ)和Cr(Ⅲ)在中性土壤条件下的SSD曲线,见图 4。Cr(Ⅵ)和Cr(Ⅲ)各生物指标的EC50和EC10的几何均值基本都在95%置信区间内,但存在曲线的部分区间拟合度相对较差、置信区间较宽的情况,原因可能是:这些生物指标的数据来自不同的文献,实验条件不统一;部分生物指标存在非归一化等,这些都会对SSD曲线的拟合度产生影响。
|
虚线表示95%的置信区间 The dotted lines indicate 95% confidence intervals 图 4 中性土壤情景下Cr(Ⅵ)和Cr(Ⅲ)的SSD曲线 Figure 4 SSD curves of Cr(Ⅵ) and Cr(Ⅲ) in the neutral soil scenario |
总体来说,在构建的Cr(Ⅵ)和Cr(Ⅲ) SSD曲线中,从生物大类即土壤植物、动物和微生物的敏感性顺序上来说,没有表现出明显的规律。但在Cr(Ⅵ)对各生物指标的EC50和EC10值构建的SSD曲线中(见图 4a,图 4c),小白菜根伸长指标均位于曲线的最底端,表明小白菜根伸长可作为土壤Cr(Ⅵ)对生态系统毒性的敏感指标,用于土壤Cr(Ⅵ)污染的生物监测和预警。而在Cr(Ⅲ)的SSD曲线中(图 4b,图 4d),土壤脱氢酶活性较其他指标更为敏感,可作为土壤Cr(Ⅲ)污染的早期诊断指标之一。相对于土壤植物和动物,土壤微生物酶活性受Cr毒性的影响表现出了更大的变异,在SSD曲线的上、中、下端均有分布,这可能与不同酶类执行的功能不同以及Cr与微生物种群间存在着复杂的相互作用有关。过氧化氢酶可促使H2O2分解为分子氧和水[35];脱氢酶在有机物氧化中发挥着重要作用,可将氢由电子供体传递给受体[36];纤维素酶、脲酶、芳基硫酸酯酶、碱性磷酸酶分别在土壤碳、氮、硫、磷循环中发挥着重要作用[37]。重金属Cr可以通过抑制微生物的生长繁殖或与酶分子的巯基、氨基和羧基结合从而抑制酶的合成和活性[38];也能够通过选择性富集Cr耐受菌或作为酶的辅基,从而促进酶的合成和活性[39]。微生物还可以通过溶解、吸附、沉淀和氧化还原等作用影响Cr的生物有效性,从而改变Cr对微生物及其酶活性的毒性[40-41]。
本研究对SSD曲线中共有生物指标的Cr(Ⅵ)和Cr(Ⅲ)毒性进行了比较分析,见表 5。根据不同价态Cr对赤子爱胜蚓产茧量的EC50和EC10值,得出Cr(Ⅵ)对赤子爱胜蚓产茧量的毒性是Cr(Ⅲ)的12.8倍和21.0倍,原因可能是:在中性pH条件下,Cr(Ⅵ)是水溶性的且较Cr(Ⅲ)离子更小,因此更容易穿透细胞膜表现出毒害,而Cr(Ⅲ)较难穿过细胞膜以及少量的Cr(Ⅲ)是动物必需的微量元素[6]。研究发现Cr(Ⅵ)对土壤脱氢酶活性、芳基硫酸酯酶活性和碱性磷酸酶活性的毒性也高于Cr(Ⅲ) 6.53~41.7倍,这可能与Cr(Ⅵ)具有强氧化性、移动性强和不容易被土壤颗粒吸附等有关[42]。而对于土壤脲酶活性和过氧化氢酶活性,其Cr(Ⅲ)的毒性是Cr(Ⅵ)毒性的1.38~5.10倍,表明土壤脲酶活性和过氧化氢酶活性对Cr(Ⅲ)的毒害更敏感。由于过氧化氢酶可清除Cr(Ⅵ)等氧化剂在还原过程中形成的自由基[43],脲酶可将尿素分解成CO32-和氨,增加土壤pH和固化重金属,因此当存在移动性较强的Cr(Ⅵ)时,可能会进一步刺激这两类酶的活性,以抵御重金属对微生物的伤害[44]。
|
|
表 5 中性土壤情景下Cr(Ⅵ)和Cr(Ⅲ) EC50与EC10的预测值 Table 5 Predicted values of EC50 and EC10 of Cr(Ⅵ) and Cr(Ⅲ) in neutral soil scenario |
此外,对于同一价态的Cr来说,在由EC50和EC10数据构建的SSD曲线中,其共有指标的排列顺序也是不同的,如在由Cr(Ⅵ)的EC50值构建的SSD曲线中(图 4a),土壤脱氢酶活性较芳基硫酸酯酶活性对Cr(Ⅵ)的毒害更敏感,而在Cr(Ⅵ)的EC10值构建的SSD曲线中(图 4c),土壤芳基硫酸酯酶活性较脱氢酶活性更为敏感。由于EC50和EC10值分别对应着对某个生物指标的50%和90%保护水平,因此这说明物种的敏感性顺序与对各物种的保护水平有关,这也促使我们进一步分析不同保护水平下的Cr(Ⅵ)和Cr(Ⅲ)对生态系统的毒性差异。
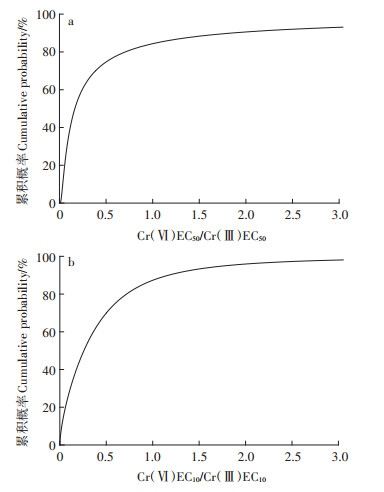
基于在中性土壤条件下Cr(Ⅵ)和Cr(Ⅲ)的SSD曲线和PAF公式(图 4),反推出了不同PAF下Cr(Ⅵ)与Cr(Ⅲ)的EC50和EC10值(见表 6)及其两种价态Cr的EC50比值(图 5a)和EC10比值(图 5b),以反映Cr(Ⅵ)与Cr(Ⅲ)的毒性差异随生态系统保护水平的变化。当PAF较低(即较高的生态系统保护水平)时,基于EC50和EC10值得到的Cr(Ⅵ)和Cr(Ⅲ)的浓度比值均小于1,表明Cr(Ⅵ)较Cr(Ⅲ)具有更高的生态毒性;随着PAF的增大,Cr(Ⅵ)和Cr(Ⅲ)的浓度比值逐渐增大,当基于EC50和EC10值构建的SSD曲线的PAF分别达到84.4%和87.3%(对应的EC50和EC10值分别为3076和642 mg·kg-1)时,Cr(Ⅵ)和Cr(Ⅲ)的浓度比值为1,此时Cr(Ⅵ)和Cr(Ⅲ)的生态毒性相等;此后随着PAF和Cr浓度水平的进一步提高,Cr(Ⅲ)将较Cr(Ⅵ)具有更高的生态毒性。由此可以看出,Cr(Ⅵ)高于Cr(Ⅲ)毒性的SSD曲线的跨度远大于Cr(Ⅲ)高于Cr(Ⅵ)毒性的SSD曲线的跨度,在较大的PAF和Cr浓度范围内,Cr(Ⅵ)的生态毒性显著高于Cr(Ⅲ)。由于在生态风险评价和安全性阈值制定中通常选择95%的保护水平(即PAF为5%),在此水平下基于EC50和EC10值得到的Cr(Ⅵ)的浓度分别为10.2和0.376 mg·kg-1,而Cr(Ⅲ)的浓度分别为406 mg·kg-1和51.8 mg·kg-1,Cr(Ⅵ)的毒性分别是Cr(Ⅲ)毒性的39.8倍和138倍,表明在通常的保护要求和污染水平下,Cr(Ⅵ)对生态系统的毒性也显著高于Cr(Ⅲ)。
|
|
表 6 中性土壤情景中不同PAF下Cr(Ⅵ)和Cr(Ⅲ)的浓度 Table 6 Concentrations of Cr(Ⅵ) and Cr(Ⅲ) under different PAFs in the neutral soil scenario |
|
图 5 中性土壤情景中不同PAF下Cr(Ⅵ)与Cr(Ⅲ)的EC50比值(a)与EC10比值(b) Figure 5 Ratios of Cr(Ⅵ) and Cr(Ⅲ) EC50s (a) and EC10s (b) under different PAFs in the neutral soil scenario |
在今后对我国土壤Cr污染的生态毒性研究中,应进一步完善不同土壤类型下不同价态Cr对多种生物指标的毒理学数据库,以建立每一生物指标与土壤性质关系的毒性预测模型,构建不同土壤情景下不同价态Cr的SSD曲线,并发展土壤外源添加Cr的淋洗和老化模型,以进一步为不同土壤情景下不同价态Cr的生态毒性差异比较和生态安全阈值的制定提供科学依据。
3 结论(1) 根据Cr(Ⅵ)和Cr(Ⅲ)在中性土壤情景下的SSD曲线,发现小白菜根伸长和土壤脱氢酶活性分别是对土壤Cr(Ⅵ)和Cr(Ⅲ)污染最敏感的生物指标,可作为土壤Cr(Ⅵ)和Cr(Ⅲ)污染的早期生物诊断和预警的潜在指标之一。
(2) 通过对Cr(Ⅵ)和Cr(Ⅲ) SSD曲线中共有生物指标的比较,发现对于不同的物种来说,Cr(Ⅵ)和Cr(Ⅲ)的毒性强弱有质的区别:对于赤子爱胜蚓产茧量、土壤脱氢酶活性、芳基硫酸酯酶活性和碱性磷酸酶活性而言,Cr(Ⅵ)具有更高的毒性;而对于土壤脲酶活性和过氧化氢酶活性来说,Cr(Ⅲ)具有更高的毒性。
(3) 根据PAF的反推公式,发现在较大的PAF和Cr浓度范围内,即基于EC50和EC10值构建的SSD曲线的PAF分别在84.4%和87.3%以下或对应的EC50和EC10值分别低于3076 mg·kg-1和642 mg·kg-1时,Cr(Ⅵ)的生态毒性显著高于Cr(Ⅲ);在通常的保护水平(即PAF为5%)下,Cr(Ⅵ)对生态系统的毒性也显著高于Cr(Ⅲ)。
| [1] |
Lee D Y, Shih Y N, Zheng H C, et al. Using the selective ion exchange resin extraction and XANES methods to evaluate the effect of compost amendments on soil chromium(Ⅵ) phytotoxicity[J]. Plant & Soil, 2006, 281(1/2): 87-96. |
| [2] |
Chen C P, Kaiwei J, Lin T H, et al. Assessing the phytotoxicity of chromium in Cr(Ⅵ)-spiked soils by Cr speciation using XANES and resin extractable Cr(Ⅲ) and Cr(Ⅵ)[J]. Plant & Soil, 2010, 334(1/2): 299-309. |
| [3] |
Ding W, Stewart D I, Humphreys P N, et al. Role of an organic carbonrich soil and Fe(Ⅲ) reduction in reducing the toxicity and environmental mobility of chromium(Ⅵ) at a COPR disposal site[J]. Science of the Total Environment, 2015, 541: 1191-1199. |
| [4] |
Somasundaram V. Laboratory scale column studies on transport and biotransformation of Cr(Ⅵ) through porous media in presence of CRB, SRB and IRB[J]. Chemical Engineering Journal, 2011, 171(2): 572-581. DOI:10.1016/j.cej.2011.04.032 |
| [5] |
Shanker A K, Cervantes C, Lozatavera H, et al. Chromium toxicity in plants[J]. Environment International, 2005, 31(5): 739-753. DOI:10.1016/j.envint.2005.02.003 |
| [6] |
Sivakumar S, Subbhuraam C V. Toxicity of chromium(Ⅲ) and chromium(Ⅵ) to the earthworm Eisenia fetida[J]. Ecotoxicology & Environmental Safety, 2005, 62(1): 93-98. |
| [7] |
梁艳茹.不同价态铬对土壤生物化学活性影响的研究[D].杨凌: 西北农林科技大学, 2010. LIANG Yan-ru. The research on soil biochemical activity affected by different valence of chromium[D]. Yangling: Northwest A&F University, 2010. http://cdmd.cnki.com.cn/Article/CDMD-10712-2010148983.htm |
| [8] |
Vignati D A L, Dominik J, Beye M L, et al. Chromium(Ⅵ) is more toxic than chromium(Ⅲ) to freshwater algae:a paradigm to revise?[J]. Ecotoxicology & Environmental Safety, 2010, 73(5): 743-749. |
| [9] |
Samborska A, Stepniewska Z, Stepniewski W. Influence of different oxidation states of chromium(Ⅵ, Ⅲ) on soil urease activity[J]. Geoderma, 2004, 122(2): 317-322. |
| [10] |
李天, 来航线, 和文祥, 等. Cr6+的土壤酶效应研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(8): 171-178. LI Tian, LAI Hang-xian, HE Wen-xiang, et al. Effects of Cr6+ on soil enzyme activity[J]. Journal of Northwest A&F University(Natural Science Edition), 2012, 40(8): 171-178. |
| [11] |
胡一, 孔龙, 和文祥, 等. Cr3+的土壤酶效应研究[J]. 西北农林科技大学学报(自然科学版), 2012, 40(5): 166-172. HU Yi, KONG Long, HE Wen-xiang, et al. Effects of Cr3+ on soil enzyme activity[J]. Journal of Northwest A&F University(Natural Science Edition), 2012, 40(5): 166-172. |
| [12] |
李波.外源重金属铜、镍的植物毒害及预测模型研究[D].北京: 中国农业科学院, 2010. LI Bo. The phytotoxicity of added copper and nickel to soils and predictive models[D]. Beijing: Chinese Academy of Agricultural Sciences, 2010. http://cdmd.cnki.com.cn/Article/CDMD-82101-2010170796.htm |
| [13] |
王小庆.中国农业土壤中铜和镍的生态阈值研究[D].北京: 中国矿业大学, 2012. WANG Xiao-qing. Ecological thresholds for copper and nickel in Chinese agricultural soils[D]. Beijing: China University of Mining & Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-11413-1013131997.htm |
| [14] |
Posthuma L, Traas T P, Suter G W. General introduction to species sensitivity distributions[J]. Proceedings of the Royal Society B-Biological Sciences, 2002, 141(905): 510-523. |
| [15] |
杜建国, 赵佳懿, 林彩, 等. 应用物种敏感性分布法评估不同形态Cr对海洋生物的生态风险[J]. 海洋环境科学, 2013, 32(4): 570-575. DU Jian-guo, ZHAO Jia-yi, LIN Cai, et al. Assessing ecological risks of different valence states of Cr to marine organisms by species sensitivity distributions[J]. Marine Environmental Science, 2013, 32(4): 570-575. |
| [16] |
王晓南, 刘征涛, 王婉华, 等. 重金属铬(Ⅵ)的生态毒性及其土壤环境基准[J]. 环境科学, 2014, 35(8): 3155-3161. WANG Xiao-nan, LIU Zheng-tao, WANG Wan-hua, et al. Ecotoxicological effect and soil environmental criteria of the heavy metal chromium(Ⅵ)[J]. Environmental Science, 2014, 35(8): 3155-3161. |
| [17] |
USEPA. Guidelines for ecological risk assessment EPA/630/R-95/002F[S]. Washington: Federal Register, 1998.
|
| [18] |
Smolders E, Oorts K, Van S P, et al. Toxicity of trace metals in soil as affected by soil type and aging after contamination:using calibrated bioavailability models to set ecological soil standards[J]. Environmental Toxicology & Chemistry, 2010, 28(8): 1633-1642. |
| [19] |
李波, 马义兵, 刘继芳, 等. 西红柿铜毒害的土壤主控因子和预测模型研究[J]. 土壤学报, 2010, 47(4): 665-673. LI Bo, MA Yi-bing, LIU Ji-fang, et al. Major soil factors controlling copper toxicity to tomato in a wide range of Chinese soils and the predictable models[J]. Acta Pedologica Sinica, 2010, 47(4): 665-673. |
| [20] |
孔祥臻, 何伟, 秦宁, 等. 重金属对淡水生物生态风险的物种敏感性分布评估[J]. 中国环境科学, 2011, 31(9): 1555-1562. KONG Xiang-zhen, HE Wei, QIN Ning, et al. Assessing acute ecological risks of heavy metals to freshwater organisms by species sensitivity distributions[J]. China Environmental Science, 2011, 31(9): 1555-1562. |
| [21] |
刘永生, 李瑞敏. 稻谷安全种植土壤重金属限值的基于置信区间评价法[J]. 地质通报, 2006, 25(5): 616-620. LIU Yong-sheng, LI Rui-min. Method of evaluating the threshold values of heavy metals in soils based on the confidence interval for safe rice growth[J]. Geological Bulletin of China, 2006, 25(5): 616-620. DOI:10.3969/j.issn.1671-2552.2006.05.014 |
| [22] |
蔡少华.土壤Cr(Ⅵ)与土壤生化活性关系研究[D].杨凌: 西北农林科技大学, 2008. CAI Shao-hua. Study on the relations between soil hexavalent chromium and soil biochemically activity[D]. Yangling: Northwest A&F University, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1285138 |
| [23] |
王娟.铬和铜对土壤生物化学活性影响的研究[D].杨凌: 西北农林科技大学, 2007. WANG Juan. The research on soil biochemical activity affected by chromium and copper[D]. Yangling: Northwest A&F University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10712-2007188568.htm |
| [24] |
汪杏, 沈根祥, 胡双庆, 等. 铬(Ⅵ)和菲单一及复合污染对土壤微生物酶活性的影响[J]. 农业环境科学学报, 2016, 35(7): 1300-1307. WANG Xing, SHEN Gen-xiang, HU Shuang-qing, et al. Effects of single and joint pollution of chromium(Ⅵ) and phenanthrene on microbiological enzyme activities insoil[J]. Journal of Agro-Environment Science, 2016, 35(7): 1300-1307. |
| [25] |
Peng B, Huang S H, Yang Z H, et al. Inhibitory effect of Cr(Ⅵ) on activities of soil enzymes[J]. Journal of Central South University, 2009, 16(4): 594-598. DOI:10.1007/s11771-009-0099-y |
| [26] |
邵云, 刘会娟, 胡永娟, 等. 土壤质地对铬胁迫下小麦灌浆期形态与旗叶光合特性的影响[J]. 麦类作物学报, 2012, 32(6): 1150-1155. SHAO Yun, LIU Hui-juan, HU Yong-juan, et al. Effects of soil textures on morphology and photosynthetic characteristics of flag leaves of wheat during filling stage in chromium polluted soils[J]. Journal of Triticeae Crops, 2012, 32(6): 1150-1155. |
| [27] |
王丹, 魏威, 王松山, 等. 铜、铬单一及复合污染对小白菜种子萌发及根长的生态毒性[J]. 西北农林科技大学学报(自然科学版), 2010, 38(12): 63-68. WANG Dan, WEI Wei, WANG Song-shan, et al. Single and combined toxicity of chromium and copper to seed germination and root elongation of Pakchoi (Brasicachinensis) in soils[J]. Journal of Northwest A&F University (Natural Science Edition), 2010, 38(12): 63-68. |
| [28] |
王毅.土壤环境中铬对陆生高等植物毒性效应及土壤质量基准限值研究[D].天津: 南开大学, 2013. WANG Yi. Toxic effects of chromium on terrestrial plants and relevant soil-quality criteria[D]. Tianjin: Nankai University, 2013. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2409506 |
| [29] |
王婉华, 陈丽红, 方征, 等. 土壤铬(Ⅵ)对赤子爱胜蚓的生态毒性效应[J]. 环境科学研究, 2013, 26(6): 653-657. WANG Wan-hua, CHEN Li-hong, FANG Zheng, et al. Ecotoxicity of chromium(Ⅵ) to Eisenia fetida in soil[J]. Research of Environmental Sciences, 2013, 26(6): 653-657. |
| [30] |
陈丽红, 刘征涛, 李政, 等. 老化土壤中铬(Ⅵ)对赤子爱胜蚓繁殖及抗氧化酶活性的影响[J]. 环境化学, 2013, 32(12): 2364-2369. CHEN Li-hong, LIU Zheng-tao, LI Zheng, et al. Effects of Cr(Ⅵ) on the reproduction and antioxidant enzyme activities of Eisenia fetida with aged soils[J]. Environmental Chemistry, 2013, 32(12): 2364-2369. DOI:10.7524/j.issn.0254-6108.2013.12.021 |
| [31] |
崔春燕.铬(Ⅵ)和菲复合污染对土壤生物的毒性效应及危害性评价研究[D].上海: 东华大学, 2016. CUI Chun-yan. Study on ecotoxicological effects of chromium(Ⅵ) and phenanthrene combined pollution on soil biont and its hazard assessment methods[D]. Shanghai: Donghua University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10255-1016707987.htm |
| [32] |
张国庆.土壤-小麦系统中汞和铬生态毒理效应的研究[D].杨凌: 西北农林科技大学, 2013. ZHANG Guo-qing. Eco-toxicological effects of mercury and chromium in soil-wheat sysyem[D]. Yangling: Northwest A&F University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10712-1013345454.htm |
| [33] |
刘会娟. Cr、As胁迫下土壤-小麦系统对不同土壤质地的响应及生物有效性评价[D].新乡: 河南师范大学, 2012. LIU Hui-juan. Response of soil-wheat system to different soil texures under chromium and arsenic stress and the evaluation of bioavailability[D]. Xinxiang: Henan Normal University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10476-1012421516.htm |
| [34] |
Lock K, Janssen C R. Ecotoxicity of chromium(Ⅲ) to Eisenia fetida, Enchytraeusalbidus, and Folsomia candida[J]. Ecotoxicology & Environmental Safety, 2002, 51(3): 203-205. |
| [35] |
曹汶龙.枯草芽孢杆菌过氧化氢酶分子改造及发酵优化[D].无锡: 江南大学, 2014. CAO Wen -long. Molecular modification and fermentation optimization of catalase from Bacillus subtilis[D]. Wuxi: Jiangnan University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10295-1014380789.htm |
| [36] |
贾蓉.不同碳源模式下水稻土中脱氢酶活性与微生物铁还原的关系[D].杨凌: 西北农林科技大学, 2012. JIA Rong. Relationship between dehydrogenase activity and microbial iron reduction with different carbon sources in paddy soil[D]. Yangling: Northwest A&F University, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10712-1012435809.htm |
| [37] |
孙亚男, 李茜, 李以康, 等. 氮、磷养分添加对高寒草甸土壤酶活性的影响[J]. 草业学报, 2016, 25(2): 18-26. SUN Ya-nan, LI Qian, LI Yi-kang, et al. The effect of nitrogen and phosphorus applications on soil enzyme activities in Qinghai-Tibetan alpine meadows[J]. Acta Prataculturae Sinica, 2016, 25(2): 18-26. |
| [38] |
陈海燕.镉污染土壤的生物修复: 热化学研究耐镉菌株抗性机制[D].武汉: 中国地质大学, 2009. CHEN Hai-yan. Bioremediation of Cd-contaminated soil: Thermochemical study of the mechanism of Cd-resistent microbes[D]. Wuhan: China University of Geosciences, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10491-2009153682.htm |
| [39] |
肖文丹, 叶雪珠, 孙彩霞, 等. 铬耐性菌对土壤中六价铬的还原作用[J]. 中国环境科学, 2017, 37(3): 1120-1129. XIAO Wen-dan, YE Xue-zhu, SUN Cai-xia, et al. The effect of chromium-resistant bacteria on reduction of hexavalent chromium in soils[J]. China Environmental Science, 2017, 37(3): 1120-1129. |
| [40] |
Camargo F A, Bento F M, Okeke B C, et al. Chromate reduction by chromium-resistant bacteria isolated from soils contaminated with dichromate[J]. Journal of Environmental Quality, 2003, 32(4): 1228-1233. DOI:10.2134/jeq2003.1228 |
| [41] |
魏斐, 杨丽荣, 薛保国, 等. 还原六价铬细菌及其还原酶的研究[J]. 中国生物工程杂志, 2012, 32(4): 53-59. WEI Fei, YANG Li-rong, XUE Bao-guo, et al. Study on the restore hexavalent chromium bacteria and its reductase[J]. China Biotechnology, 2012, 32(4): 53-59. |
| [42] |
贡晓飞, 鄂尔丁夫, 王琪, 等. 不同价态铬在不同水分条件下的生物有效性及其对水稻的毒性[J]. 生态毒理学报, 2015, 10(4): 170-176. GONG Xiao-fei, ER Ding-fu, WANG Qi, et al. Bioavailability and toxicity of Cr(Ⅲ) and Cr(Ⅵ) to Rice (Oryza sativa L.) as influenced by water management[J]. Asian Journal of Ecotoxicology, 2015, 10(4): 170-176. |
| [43] |
陈军.壳聚糖固定化过氧化氢酶在清除卷烟烟气自由基等有害物质中的应用[D].无锡: 江南大学, 2006. CHEN Jun. Application of catalase immobilized by chitosan in scavenging toxicants as free radicals in cigarette smoke[D]. Wuxi: Jiangnan University, 2006. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y968095 |
| [44] |
李萌, 郭红仙, 程晓辉. 土壤中产脲酶微生物分离及对重金属的固化[J]. 湖北农业科学, 2013, 52(14): 3280-3282. LI Meng, GUO Hong-xian, CHENG Xiao-hui. Isolation of urease producing bacteria from soil and its mineralization on heavy metal[J]. Hubei Agricultural Sciences, 2013, 52(14): 3280-3282. DOI:10.3969/j.issn.0439-8114.2013.14.016 |
 2018, Vol. 37
2018, Vol. 37