随着集约化养殖在我国的快速发展,每年有大量的畜禽粪便产生。据统计,2010年我国畜禽粪便产生量为22.35亿t,远超工业废弃物的排放量[1-3]。而且出于经济利益的追求,一些重金属元素如Cu、Zn等被广泛应用于饲料添加剂以促进畜禽的生长,未被吸收的重金属在畜禽粪便中大量积累,导致畜禽粪便施入土壤后对生态环境造成污染[4]。Zhou等[5]调查研究表明,长期施用富含Cu、Zn的粪肥将导致土壤Cu、Zn浓度升高,并进一步在种植的萝卜和白菜中富集,部分萝卜的地上部分Zn(28.7 mg·kg-1)的浓度超过了我国食品重金属限量标准(20 mg·kg-1)。此外,当用猪粪和鸡粪作为鱼类饲料添加剂时,鱼组织中重金属的含量随着添加量的升高而升高,最终导致鱼蛋白的含量显著降低[6]。因此,畜禽粪便重金属污染问题已成为其资源化利用过程中亟需解决的问题。
源于微生物湿法冶金的生物沥浸技术以其耗能少,运行成本低,去除效果好,实用性强等特点[9],已被广泛地应用于污泥[10-11]、垃圾焚烧飞灰[12]、电子废弃物[13]、土壤[14]、河床底泥[15]等污染物中重金属的处理[16]。生物沥浸重金属的机理主要包括沥浸微生物的直接代谢氧化和间接产酸将重金属浸出[17-18]。但是目前采用生物沥浸法去除畜禽粪便重金属的研究较少,并且都只是在摇瓶中进行,且沥浸周期较长[17-19]。此外,气提式反应器以气源作为动力,使液体混合与循环流动,具有能耗低、结构简单、易于放大等特点,已被广泛应用于生物沥浸去除污泥中的重金属[20-21],但是关于采用气提式反应器生物沥浸处理畜禽粪便重金属的研究还未见报道。
本研究以猪粪为基质,通过摇瓶批式试验考察了初始pH值、接种量以及反应温度对土著硫杆菌生物沥浸去除猪粪重金属的影响;同时研究了采用气提式反应器去除猪粪中重金属的可行性,为生物沥浸技术工程化应用于畜禽粪便重金属处理提供理论参考依据。
1 材料与方法 1.1 供试猪粪本研究所用的猪粪取自天津某养殖场。现场采集的新鲜猪粪用塑料桶盛装运至实验室置于4 ℃冰箱保存备用。经测定,猪粪的基本理化性质如下:含固率23.57%,pH值8.72,有机质(以TOC计)589.5 mg·kg-1,总氮(TN)31.7 g·kg-1,总磷(TP)30.2 g·kg-1,总钾(TK)15.1 g·kg-1,Cu 252.5 mg kg-1,Zn 1 277.68 mg · kg-1,Mn 533.5 mg · kg-1,As 6.75 mg · kg-1,Cd 2.2 mg·kg-1(除pH值外,其余指标均以干物质计)。Cu、Zn、Mn的形态分析结果见表 1。
|
|
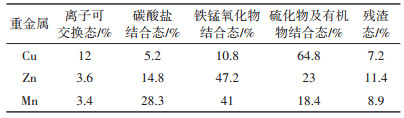
表 1 猪粪中重金属形态分布 Table 1 Existing forms of heavy metals in pig manure |
重金属不同的结合形态代表不同的能量状态。一般认为,离子可交换态、碳酸盐结合态和铁锰氧化物结合态不稳定,易溶出,生物可利用性高,而硫化物/有机物结合态、残渣态比较稳定,不易溶出,生物可利用性低[22-23]。表 1的结果表明,猪粪中Cu主要以稳定态存在,其中硫化物/有机物结合态占64.8%;而Zn和Mn主要以不稳定态存在,不稳定态(离子可交换态,碳酸盐结合态和铁锰氧化物结合态)分别占65.6%和76.7%。
1.2 接种液的制备以养殖场收集的新鲜猪粪作为接种源富集和培养硫杆菌[17]。取稀释至含固率为2%(质量/体积)的新鲜猪粪混合液100 mL和10 g·L-1硫粉加入250 mL锥形瓶,然后置于摇床28 ℃、180 r·min-1培养。每日检测培养液pH值的变化。当培养液pH值降至2左右时,取10 mL酸化粪液转移至90 mL新的猪粪混合液中并加入10 g·L-1硫粉,相同条件下继续培养。经过4次转移之后,土著氧化硫硫杆菌在猪粪中的酸化速率达到最大,接种液制备完成。
1.3 猪粪生物沥浸实验 1.3.1 初始pH值影响实验在一系列500 mL锥形瓶中加入300 mL含固率为2%的新鲜猪粪混合液和10 g·L-1单质硫粉,并按体积比10%加入接种液。用1:1硫酸和1 mol·L-1 NaOH调节混合液的初始pH值为3、4、5、6、7。不调初始pH值的猪粪混合液作为对照组。所有锥形瓶置于28 ℃、180 r·min-1摇床振荡培养。
1.3.2 接种量影响实验在一系列500 mL锥形瓶中加入300 mL含固率为2%的新鲜猪粪混合液和10 g·L-1单质硫粉。然后按体积比分别接种2%、5%、10%的土著硫细菌接种液。投加硫粉但不接种的作为生物实验对照组,不加硫粉且不接种的作为化学对照组。所有锥形瓶置于28 ℃、180 r·min-1摇床振荡培养。
1.3.3 温度影响实验在一系列500 mL锥形瓶中加入300 mL含固率为2%的新鲜猪粪混合液和10 g·L-1单质硫粉,并按体积比10%加入接种液。将锥形瓶分别置于23、28、33、38、45 ℃摇床180 r·min-1振荡培养。
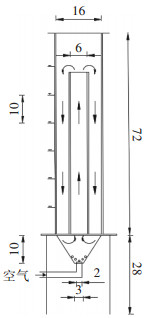
1.3.4 气提式反应器实验实验装置:气提式反应器由有机玻璃制成,猪粪体积为8 L,猪粪固体浓度20 g·L-1,反应器结构图见图 1。
|
图 1 气提式生物反应器(cm) Figure 1 Air-lift bioreactor (cm) |
反应器运行条件:按体积比5%加入接种液,硫粉投加量10 g·L-1,系统温度控制在30 ℃±2 ℃,曝气量2 L·min-1。
1.4 分析方法猪粪含固率采用105 ℃烘干称重法测定。猪粪中重金属形态分析采用Tessier五步连续提取法[24]进行测定。烘干猪粪样品中有机质含量采用德国Multi N/C 300型TOC分析仪测定。总氮、总磷和总钾根据国标法将猪粪进行消解后分别采用碱性过硫酸钾消解-紫外分光光度法,钼酸铵分光光度法和火焰原子吸收法测定。在生物沥浸过程中,用HI8424型笔式酸度计测定猪粪的pH值。每日取10 mL猪粪样品,12 000 r·min-1离心15 min,然后过0.45 μm滤膜,滤液中SO42-采用铬酸钡分光光度法测定,Cu、Zn、Mn直接采用TAS-990型原子吸收分光光度计测定。
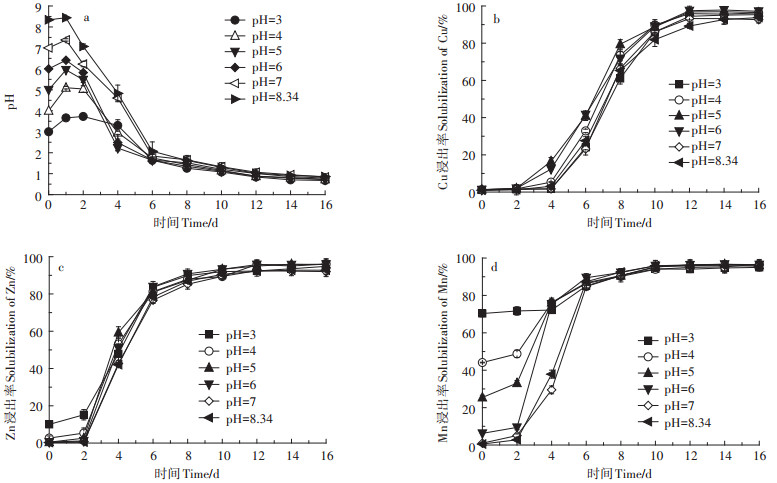
2 结果与讨论 2.1 土著硫细菌去除猪粪中重金属摇瓶实验 2.1.1 初始pH值对猪粪生物沥浸的影响不同初始pH值猪粪生物沥浸过程中pH值变化及Cu、Zn、Mn浸出效果见图 2。从图 2a中可以看出,初始pH值为3、4、5、6、7及未调pH(8.34)猪粪中pH值略有上升,这主要是因为猪粪中缓冲物质的释放[17, 25]。除初始pH值为3和4外,随着硫杆菌的大量繁殖,其余反应系统pH从第2 d开始快速下降。初始pH值由8.34降至5时,初始pH值越低,反应系统pH值下降速率越快,继续调节初始pH值至4和3,反应系统pH降低速率反而变慢。生物沥浸4 d,初始pH值为3、4、5、6、7及未调pH(8.34)的猪粪pH值分别为3.3、2.96、2.22、2.48、4.61、4.83。生物沥浸6 d后,所有系统pH值降至2以下。生物沥浸16 d,所有系统最终pH值分别为0.68(pH=3)、0.73(pH=4)、0.72(pH= 5)、0.79(pH=6)、0.84(pH=7)、0.86(pH=8.34)。
|
图 2 不同初始pH值猪粪生物沥浸中pH值及Cu、Zn、Mn的浸出率变化 Figure 2 Changes in pH and leaching rate of Cu, Zn and Mn for different initial pH during bioleaching |
不同初始pH值猪粪生物沥浸过程中Cu的浸出率见图 2b。如图 2b所示,不同初始pH值猪粪中的Cu的浸出都存在迟滞期。pH为3、4、7和8.34的粪液中Cu在第4 d后才开始大量浸出。初始pH值为5和6的粪液中Cu在2 d后即开始快速浸出。经过16 d的生物沥浸,不同初始pH值的猪粪中Cu的浸出均达到90%以上,分别为95.3%(pH=3)、96.3%(pH=4)、96.4%(pH=5)、97%(pH=6)、92.6%(pH=7)、93.8%(pH=8.34)。这主要是因为,初始pH为5和6时,系统pH值的下降速率最快,系统中的pH值更低,有利于Cu的浸出。Chartier等[26]研究表明生物沥浸过程中低pH值和大量沥浸微生物存在的环境有利于Cu的浸出。Wong等[27]采用生物沥浸法处理厌氧消化污泥的研究结果表明,初始pH值为6时Cu的浸出效果最佳。这些文献报道结果有效地支持了本文的研究结果。
图 2c展示了不同初始pH值粪液中Zn的浸出率。由图 2c可知,Zn的浸出受初始pH值的影响较小,也存在迟滞期,但浸出速率明显快于Cu,2 d后所有实验组中Zn均开始大量浸出。经过16 d的生物沥浸后,不同初始pH值猪粪中Zn的浸出率均达到90%以上,分别为94.8%(pH=3)、96.1%(pH=4)、95.8%(pH= 5)、96.0%(pH=6)、92.0%(pH=7)、92.8%(pH=8.34)。据研究报道,在生物沥浸过程中,随着硫酸根浓度的增加,易溶性硫酸锌的浓度也会相应增加[28]。这可能是导致不同初始pH值粪液中Zn浸出率不同的原因。
图 2d展示了不同初始pH值粪液中Mn的浸出率。由图 2d可知,Mn初始的浸出率受猪粪初始pH值的影响很大。在调节粪液初始pH值过程中即有大量Mn浸出,pH值越低,Mn浸出量越大。调节初始pH至3时,Mn的浸出率已接近70%。在所有实验组pH都降至2以下时,Mn的浸出率趋于一致。经过16 d的生物沥浸,不同初始pH值的粪液中Mn的浸出率均超过95%,分别为95.0%(pH=3)、96.7%(pH=4)、96.2%(pH=5)、96.5%(pH=6)、96.3%(pH=7)、95.7%(pH=8.34)。不同初始pH值猪粪中Mn的最终浸出率并无明显差别。这主要是因为Mn在猪粪中主要以易于浸出的不稳定态(75%)存在(见表 1)。Zhou等[28]研究表明,猪粪中的Mn在pH低于5时即可大量浸出。杜丽琼等[29]用硫酸浸提猪粪中重金属,pH值调至2时Mn的浸出率达到83.3%。这些文献报道结果与本文的研究结果一致。
综上实验结果表明,猪粪中Cu、Zn、Mn的浸出与pH值紧密相关。这一结果与之前的报道采用氧化硫硫杆菌去除猪粪、污泥或其他废弃物中的金属结果相似[17, 30]。不同初始pH值猪粪生物沥浸16 d后最终的pH值和Cu、Zn、Mn的浸出率并无明显的差别。这一结果说明,采用土著氧化硫硫杆菌去除猪粪中Cu、Zn、Mn等金属可以不需要进行预酸化处理。
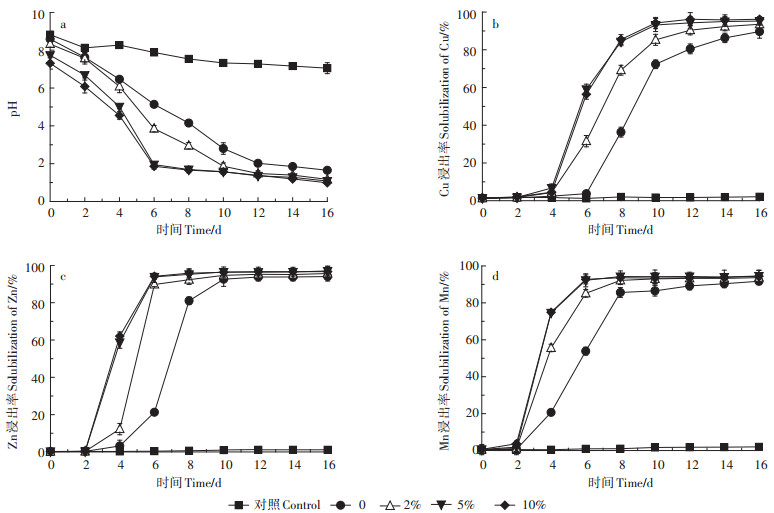
2.1.2 接种量对猪粪生物沥浸的影响不同接种量猪粪生物沥浸过程中pH值变化及Cu、Zn、Mn浸出效果见图 3。如图 3a所示,不加硫粉且不接种化学对照组中pH值略微下降,摇床培养16 d,pH值由8.82降至7.05。投加硫粉但不接种生物对照组中pH下降趋势与接种硫细菌实验组pH降低趋势相同,但降低速率不同。生物沥浸6 d,仅加硫粉未接种猪粪的pH值为5.12,接种量2%猪粪的pH为3.85,而接种量为5%和10%猪粪的pH值分别为1.95和1.86.生物沥浸16 d,接种量0(未接种)、2%、5%、10%的猪粪最终pH值分别为1.65、1.17、1.08、0.99。
|
图 3 不同接种量猪粪生物沥浸pH值及Cu、Zn、Mn浸出率变化 Figure 3 Changes in pH and leaching rate of Cu, Zn and Mn for different inoculum volume during bioleaching |
不同接种量猪粪中Cu的浸出效果见图 3b。结果表明,不加硫粉且不接种对照组反应16 d,Cu浸出率基本没有变化,仅为2.1%。然而,在投加硫粉作为能源物质的实验组中,Cu的浸出速率随着接种量的增加而显著增加。仅加硫粉不接种猪粪生物沥浸6 d,Cu的浸出率为3.7%,而接种量2%、5%和10%猪粪中Cu的浸出率分别达到31.6%、59.1%和56.4%。接种量5%和10%的猪粪生物沥浸10 d浸出率即达到90%以上,接种量2%的猪粪沥浸12 d后Cu浸出率达到90%。生物沥浸16 d,接种量0(未接种)、2%、5%、10%的猪粪中Cu的浸出率分别为89.6%、92.8%、95.2%、95.8%。
不同接种量猪粪中Zn的浸出效果见图 3c。结果表明,不加硫粉且不接种化学对照组反应16 d,Zn基本没有浸出。投加硫粉作为能源物质,Zn的浸出速率随着接种量的增加而显著增加。接种量为5%和10%时,Zn的浸出速率最快,在第6 d即达到了90%以上。接种量2%的猪粪中Zn的浸出率在沥浸第8 d达到90%以上,而未接种但投加硫粉的猪粪在第10 d才达到90%以上。最终生物沥浸16 d,接种量0(未接种)、2%、5%、10%的猪粪中Zn的浸出率分别为94.0%、96.6%、97.0%、97.7%。
不同接种量猪粪中Mn的浸出效果见图 3d。结果表明,不加硫粉且不接种化学对照组反应16 d,Mn的浸出率基本没有变化,仅为2.0%。投加硫粉作为能源物质,Mn的浸出速率随着接种量的增加而显著增加。接种量为5%和10%的猪粪中Mn的浸出速率最快,在第6 d即达到90%以上。2%接种量的猪粪中Mn的浸出率在第8 d达到90%以上。生物沥浸16 d,接种量0(未接种)、2%、5%、10%的猪粪中Mn的浸出率分别为91.7%、93.6%、94.5%、94.5%。
综上实验结果表明,接种量对生物沥浸过程中猪粪的酸化速率和重金属浸出速率影响显著。接种量由0增加到5%,猪粪酸化速率和重金属浸出速率显著提高,继续增加接种量至10%,重金属浸出速率增加不明显。因此,为保证猪粪中重金属的浸出效率,硫细菌接种量应不低于5%。
2.1.3 温度对猪粪生物沥浸的影响不同温度下猪粪生物沥浸过程中pH变化及Cu、Zn、Mn的浸出效果见图 4。图 4a展示了不同温度下生物沥浸过程中pH值的变化。生物沥浸6 d,33、28 ℃和38 ℃猪粪pH分别降至1.81、2.16、3.04,而23 ℃和45 ℃猪粪的pH值分别为4.99和5.99。生物沥浸16 d,23、28、33、38、45 ℃处理猪粪最终的pH值分别为1.36、0.98、0.71、1.09、3.54。该结果表明,在28~33 ℃范围内pH的降低速率远大于23 ℃和45 ℃下pH的降低速率,且33 ℃下pH降低速率最快。生物沥浸过程中pH值的变化反映了氧化硫硫杆菌的生长活动[25],即土著氧化硫硫杆菌最佳的生长温度在33 ℃左右,温度过高(>38 ℃)或过低(< 28 ℃)都会抑制其生长活动从而影响其利用硫粉产生硫酸,最终影响重金属的浸出效率。这一结果与杨慧敏等[17]的研究结果一致。
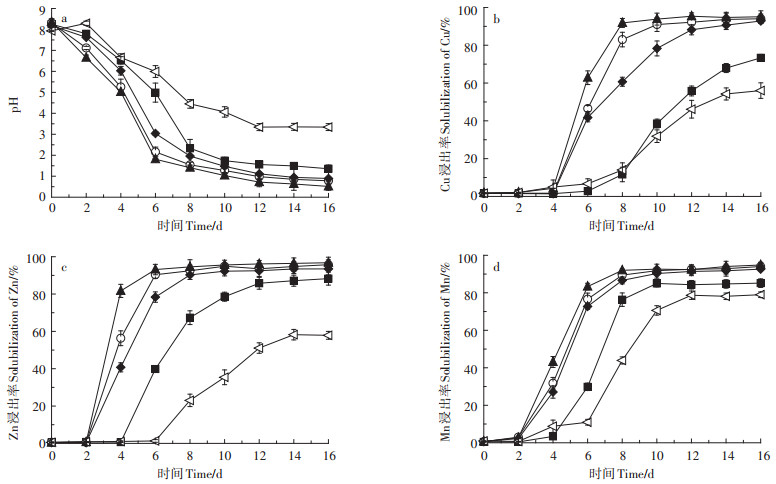
|
图 4 不同温度猪粪生物沥浸中pH值及Cu、Zn、Mn浸出率变化 Figure 4 Changes in pH and leaching rate of Cu, Zn and Mn for different temperatures during bioleaching |
不同温度下猪粪中Cu的浸出效果见图 4b。由图 4b可以看出,温度对Cu的浸出影响显著,在28、33、38 ℃三个温度下,经过4 d的迟滞期后,Cu的浸出率快速升高,且33 ℃的浸出速率明显快于28 ℃和38 ℃,在生物沥浸8 d后,猪粪中Cu的浸出率即达到90%以上,28 ℃和38 ℃猪粪分别在第10 d和12 d达到90%。而在23 ℃和45 ℃时,生物沥浸反应仍然能够进行,但是反应启动过程较慢。经过16 d的生物沥浸,23、28、33、38、45 ℃处理猪粪中Cu最终的浸出率分别为73.3%、94.0%、95.4%、92.8%、56.0%。很显然,温度过低或过高都限制了硫细菌的生长活动,最终影响了Cu的浸出。
不同温度对猪粪中Zn浸出率的影响见图 4c。Zn浸出的迟滞期比Cu短,在生物沥浸2 d后,Zn的浸出率即开始急剧增加,33 ℃下浸出速率最快,28 ℃和38 ℃次之。23 ℃和45 ℃分别在第4 d和第6 d后才开始浸出。这是因为Zn主要以不稳定态存在,且Zn开始浸出的pH阈值(< 5.0)比Cu高(< 3.8)[28]。最终经过16 d的生物沥浸,不同温度下Zn的浸出率分别为88.3%(23 ℃)、95.75%(28 ℃)、96.8%(33 ℃)、93.5%(38 ℃)、57.9%(45 ℃)。
由图 4d可以看出,在设定的实验条件下,温度对Mn的浸出影响最小。在28、33、38 ℃三个温度下,Mn在第2 d后开始大量浸出,且三个温度下Mn的浸出速率接近一致。在经过16 d的生物沥浸后,浸出率分别达到了94%(28 ℃)、94.8%(33 ℃)、92.6%(38 ℃)。温度为23 ℃和45 ℃的系统中,Mn分别在第4 d和第6 d后开始大量浸出,生物沥浸16 d后浸出率分别达到了85.2%和79.0%。实验结果表明,Mn在较低和较高温度下仍能达到较高的浸出率。这主要是因为Mn在猪粪中主要以不稳定态(75%)存在(见表 1),所以更容易被浸出。
综上所述,温度显著影响了猪粪生物沥浸过程中土著氧化硫硫杆菌的生长活动,最终导致反应系统中pH值及Cu、Zn、Mn浸出率差异显著。土著硫杆菌适宜的温度范围为28~38 ℃,在该范围内,生物沥浸16 d重金属的浸出速率均超过90%,要远高于23 ℃和45 ℃下的浸出率。但温度对三种金属浸出的影响存在一定差别,按重金属浸出率受温度影响的程度降序排列依次为Cu>Zn>Mn。另外,实验结果还表明,土著硫杆菌最佳的生长温度在33 ℃左右,而28 ℃更接近室温,因此从经济的角度考虑,采用土著硫杆菌生物沥浸的适宜温度范围为28~33 ℃。
2.2 土著硫细菌去除猪粪中重金属反应器实验图 5a显示了气提式反应器在运行期间pH值和氧化还原电位(ORP)的变化。pH值和ORP被认为是影响生物沥浸中重金属浸出的最重要参数,因而也是决定反应器实验成功与否的关键。结果表明,气提式反应器在运行过程中pH值和ORP的变化与摇床实验相差不大,pH值在第6 d即降到2以下,随后降低速率放缓,在第10 d降至1.45。与pH值降低的趋势相同,随着硫粉不断被硫细菌氧化利用,系统的ORP不断升高,在第6 d升至200 mV以上,随后继续缓慢升高,在第10 d升至227 mV。

|
图 5 气提式反应器生物沥浸过程中pH值、ORP及Cu、Zn、Mn浸出率的变化 Figure 5 Changes in pH, ORP and leaching rate of Cu, Zn and Mn during bioleaching process in air-lift bio-reactor |
气提式反应器生物沥浸过程中猪粪重金属的浸出效果见图 5b。结果表明,在设定的实验条件下,反应器运行状况良好,生物沥浸10 d,猪粪中重金属的浸出率均达到90%以上。Mn的迟滞期最短,第2 d后就开始大量浸出,第6 d浸出率即达到90%以上,生物沥浸10 d后浸出率达到97.8%。Zn在第4 d后开始大量浸出,第7 d浸出率超过90%,生物沥浸10 d浸出率达到94.9%。Cd在第3 d后开始大量浸出,第8 d浸出率达到90%以上,生物沥浸10 d浸出率达到92.5%。由于Cu主要以稳定态存在,迟滞期比Zn和Mn长,第5 d后才开始大量浸出,生物沥浸10 d后浸出率为91.9%。
气提式反应器生物沥浸前后猪粪中营养物质浓度变化见图 6。结果表明,生物沥浸处理后,猪粪中有机物、总氮、总磷、总钾均有一定程度的损失。总氮由31.7 g·kg-1降至28.4 g·kg-1,损失率约为10.4%。有机物(TOC)的损失率约为43.2%,总磷和总钾在生物沥浸过程中损失量较大,损失率分别为62.1%和65.3%。这主要是因为氮在猪粪中主要以有机态氮存在,不容易被浸出,而磷和钾在猪粪中主要以水溶性状态存在,一定时间的沥浸易溶解于沥浸液中而损失[31]。另外,生物沥浸过程中pH值的降低也有利于将化学结合态的磷和钾溶出。尽管如此,沥浸猪粪中总氮和总磷的含量仍然明显高于全国土壤中总氮(1~2 g·kg-1)、总磷(0.44~0.85 g·kg-1)的含量[32],具有较高的肥力。
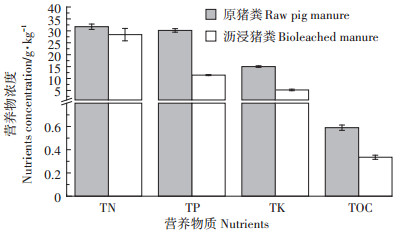
|
图 6 气提式反应器生物沥浸前后猪粪中营养物质浓度变化 Figure 6 Changes of nutrients concentration in pig manure before and after bioleaching in air-lift bio-reactor |
综上实验结果表明,气提式反应器生物沥浸可以有效去除猪粪中的Cu、Zn、Mn等重金属。这与摇瓶实验结果一致,且生物沥浸后的猪粪仍然保有较高的肥力。因此,这一方法可以进行更大规模的试验。
3 结论(1)不同初始pH值猪粪中Cu、Zn、Mn的浸出率分别为92.6%~95.3%、92%~96.1%、95%~96.7%。初始pH值降至4以下对猪粪中重金属的最终浸出率并无明显的促进作用。这些结果还表明,猪粪生物沥浸过程中预酸化并不是土著氧化硫硫杆菌生长和产酸的必要条件。过低的pH值环境(pH=3、4)对土著硫杆菌生长并没有明显的促进作用。
(2)接种量显著影响猪粪生物沥浸过程中的酸化速率和重金属浸出速率,适当增加接种量可以有效缩短生物沥浸周期,加快重金属的溶出。从经济的角度考虑,最佳的接种量为体积比5%。
(3)温度对土著硫杆菌的生长活动影响显著。土著硫杆菌适宜的温度生长范围为28~38 ℃,最佳的生长温度为33 ℃。在适宜的温度范围内,Cu、Zn、Mn的去除率分别为92.8%~95.4%、93.5%~96.8%、92.6%~ 94.8%。
(4)采用气提式反应器生物沥浸可以有效去除猪粪中的Cu、Zn、Mn、Cd。反应器生物沥浸10 d,Cu、Zn、Mn、Cd的去除率均超过90%,猪粪的毒性极大降低,为生物沥浸法工程化应用于猪粪重金属的去除提供了理论参考依据。
| [1] |
侯月卿, 赵立欣, 孟海波, 等. 生物炭和腐植酸类对猪粪堆肥重金属的钝化效果[J]. 农业工程学报, 2014, 30(11): 205-215. HOU Yue-qing, ZHAO Li-xin, MENG Hai-bo, et al. Passivating effect of biochar and humic acid materials on heavy metals during composting of pig manure[J]. Transactions of the Chinese Society of Agricultural Engineering, 2014, 30(11): 205-215. DOI:10.3969/j.issn.1002-6819.2014.11.026 |
| [2] |
耿维, 胡林, 崔建宇, 等. 中国区域畜禽粪便能源潜力及总量控制研究[J]. 农业工程学报, 2013, 29(1): 171-179. GENG Wei, HU Lin, CUI Jian-yu, et al. Biogas energy potential for livestock manure and gross control of animal feeding in region level of China[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(1): 171-179. |
| [3] |
仇焕广, 廖绍攀, 井月, 等. 我国畜禽粪便污染的区域差异与发展趋势分析[J]. 环境科学, 2013, 34(7): 2766-2774. QIU Huan-guang, LIAO Shao-pan, JING Yue, et al. Regional differences and development tendency of livestock manure pollution in China[J]. Environmental Science, 2013, 34(7): 2766-2774. |
| [4] |
董占荣, 陈一定, 林咸永, 等. 杭州市郊规模化养殖场猪粪的重金属含量及其形态[J]. 浙江农业学报, 2008, 20(1): 35-39. DONG Zhan-rong, CHEN Yi-ding, LIN Xian-yong, et al. Investigation on the contents and fractionation of heavy metals in swine manures from intensive livestock farms in the suburb of Hangzhou[J]. Acta Agriculturae Zhejiangensis, 2008, 20(1): 35-39. DOI:10.3969/j.issn.1004-1524.2008.01.008 |
| [5] |
Zhou D M, Hao X Z, Wang Y J, et al. Copper and Zn uptake by radish and pakchoi as affected by application of livestock and poultry manures[J]. Chemosphere, 2005, 59(2): 167-175. DOI:10.1016/j.chemosphere.2004.11.008 |
| [6] |
Wong M H, Chan K M, Liu W K. Trace metal concentrations in tilapia fed with pig and chicken manure[J]. Conservation Recycling, 1984, 7(2/3/4): 351-360. |
| [7] |
Quan W, Zhen W, Awasthi M K, et al. Evaluation of medical stone amendment for the reduction of nitrogen loss and bioavailability of heavy metals during pig manure composting[J]. Bioresource Technology, 2016, 220: 297-304. DOI:10.1016/j.biortech.2016.08.081 |
| [8] |
Marcato C E, Pinelli E, Pouech P, et al. Particle size and metal distributions in anaerobically digested pig slurry[J]. Bioresource Technology, 2008, 99(7): 2340-2348. DOI:10.1016/j.biortech.2007.05.013 |
| [9] |
Brierley J A, Brierley C L. Present and future commercial applications of biohydrometallurgy[J]. Hydrometallurgy, 2001, 9(2/3): 81-89. |
| [10] |
周顺桂, 周立祥, 黄焕忠. 生物淋滤技术在去除污泥中重金属的应用[J]. 生态学报, 2002, 22(1): 125-133. ZHOU Shun-gui, ZHOU Li-xiang, WONG Woo-chung. Removal of heavy metals from sewage sludge by bioleaching[J]. Acta Ecologica Sinica, 2002, 22(1): 125-133. DOI:10.3321/j.issn:1000-0933.2002.01.017 |
| [11] |
Zeng J, Gou M, Tang Y Q, et al. Effective bioleaching of chromium in tannery sludge with an enriched sulfur-oxidizing bacterial community[J]. Bioresource Technology, 2016, 218: 859-866. DOI:10.1016/j.biortech.2016.07.051 |
| [12] |
杨洁, 汪群慧, 王琪, 等. 垃圾焚烧飞灰浓度对黑曲霉生长及重金属生物淋滤效果的影响[J]. 环境科学, 2008, 29(3): 825-830. YANG Jie, WANG Qun -hui, WANG Qi, et al. Influence of fly ash concentrations on the growth of Aspergillus niger and the bioleaching efficiency of heavy metals[J]. Environmental Science, 2008, 29(3): 825-830. DOI:10.3321/j.issn:0250-3301.2008.03.048 |
| [13] |
赵玲, 杨栋, 朱南文. 废旧干电池的生物法资源回收技术[J]. 有色冶金设计与研究, 2007, 28(2): 98-102. ZHAO Ling, YANG Dong, ZHU Nan-wen. Bioleaching process for recovery of spent batteries[J]. Nonferrous Metals Engineering & Research, 2007, 28(2): 98-102. DOI:10.3969/j.issn.1004-4345.2007.02.023 |
| [14] |
Yang Z, Zhang Z, Chai L, et al. Bioleaching remediation of heavy metal-contaminated soils using Burkholderia sp. Z-90[J]. Journal of Hazardous Materials, 2016, 301: 145-152. DOI:10.1016/j.jhazmat.2015.08.047 |
| [15] |
Seidei H, Wennrich R, Hoffmann P, et al. Effect of different types of elemental sulfur on bioleaching of heavy metals from contaminated sediments[J]. Chemosphere, 2006, 62(9): 1444-1453. DOI:10.1016/j.chemosphere.2005.06.003 |
| [16] |
Pathak A, Dastidar M G, Sreekrishnan T R. Bioleaching of heavy metals from sewage sludge:A review[J]. Journal of Environment Management, 2009, 90(8): 2343-2353. |
| [17] |
杨慧敏, 王凯军, 李明华. 生物沥浸法去除不同初始pH值猪粪中的重金属[J]. 环境科学与技术, 2010, 33(6): 154-159. YANG Hui-min, WANG Kai-jun, LI Ming-hua. Bioleaching of heavy metals from pig manure with different initial pH[J]. Environmental Science & Technology, 2010, 33(6): 154-159. |
| [18] |
杨慧敏, 李明华, 王凯军, 等. 生物沥浸法去除畜禽粪便中重金属的影响因素研究[J]. 生态与农村环境学报, 2010, 26(1): 73-77. YANG Hui-min, LI Ming-hua, WANG Kai-jun, et al. Factors affecting bioleaching of heavy metals from animal excrement[J]. Journal of Ecology and Rural Environment, 2010, 26(1): 73-77. DOI:10.3969/j.issn.1673-4831.2010.01.014 |
| [19] |
Liu F W, Zhou L X, Zhou J, et al. Improvement of sludge dewaterability and removal of sludge-borne metals by bioleaching at optimum pH[J]. Journal of Hazardous Materials, 2012, 221-222(4): 170-177. |
| [20] |
陈德.内循环反应器生物沥滤法去除制革污泥中铬的试验研究[D].南京: 南京林业大学, 2008. CHEN De. Experimental study on bioleaching of Cr from tannery sludge in an inner loop reactor[D]. Nanjing: Nanjing Forestry University, 2008. |
| [21] |
Fang D, Zhou L X. Enhanced Cr bioleaching efficiency from tannery sludge with coinoculation of Acidithiobacillus thiooxidans TS6 and Brettanomyces B65 in an air-lift reactor[J]. Chemosphere, 2007, 69(2): 303-310. DOI:10.1016/j.chemosphere.2007.03.059 |
| [22] |
Chen S Y, Lin J G. Bioleaching of heavy metals from livestock sludge by indigenous sulfur-oxidizing bacteria:Effects of sludge solids concentration[J]. Chemosphere, 2004, 54(3): 283-289. DOI:10.1016/j.chemosphere.2003.08.009 |
| [23] |
黄玉溢, 陈桂芬, 刘斌, 等. 畜禽粪便中重金属含量、形态及转化的研究进展[J]. 广西农业科学, 2010, 41(8): 807-809. HUANG Yu-yi, CHEN Gui-fen, LIU Bin, et al. Research process on contents, speciation and transformation of heavy metals in livestock and poultry manures[J]. Guangxi Agriculture Science, 2010, 41(8): 807-809. DOI:10.3969/j.issn.2095-1191.2010.08.019 |
| [24] |
Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals[J]. Analytical Chemistry, 1979, 51(7): 844-851. DOI:10.1021/ac50043a017 |
| [25] |
Zhang P, Yi Z, Zhang G, et al. Sewage sludge bioleaching by indigenous sulfur-oxidizing bacteria:Effects of ratio of substrate dosage to solid content[J]. Bioresource Technology, 2008, 100(3): 1394-1398. |
| [26] |
Chartier M, Couillard D. Biological processes:The effects of initial pH, percentage inoculum and nutrient enrichment on the solubilization of sediment bound metals[J]. Water Air Soil Pollution, 1997, 96(1/2/3/4): 249-267. |
| [27] |
Wong J W C, Xiang L, Chan L C. pH requirements for the bioleaching of heavy metals from anaerobically digested wastewater sludge[J]. Water Air Soil Pollution, 2002, 138(1/2/3/4): 25-35. |
| [28] |
Zhou J, Zhou L, Liu F, et al. Transformation of heavy metals and the formation of secondary iron minerals during pig manure bioleaching by the co-inoculation acidophilic thiobacillus[J]. Environmental Technology, 2012, 33(22/23/24): 2553-2360. |
| [29] |
杜丽琼, 刘东方, 杨丹, 等. 超声和无机酸浸提猪粪中的重金属[J]. 环境工程学报, 2018, 12(1): 272-277. DU Li-qiong, LIU Dong-fang, YANG Dan, et al. Extraction of heavy metal from pig manure using ultrasound and inorganic acid[J]. Chinese Journal of Environmental Engineering, 2018, 12(1): 272-277. |
| [30] |
Kumar R N, Nagendran R. Influence of initial pH on bioleaching of heavy metals from contaminated soil employing indigenous Acidithiobacillus thiooxidans[J]. Chemosphere, 2007, 66(9): 1775-1781. DOI:10.1016/j.chemosphere.2006.07.091 |
| [31] |
Wei X C, Liu D F, Li W J, et al. Biochar addition for accelerating bioleaching of heavy metals from swine manure and reserving the nutrients[J]. Science of the Total Environment, 2018, 631-632: 1553-1559. DOI:10.1016/j.scitotenv.2018.03.140 |
| [32] |
鲍士旦. 土壤农化分析[M]. 三版.北京: 中国农业出版社, 2000. BAO Shi -dan. Soil agricultural chemistry analysis[M]. 3th Edition. Beijing: China Agriculture Press, 2000. |
 2018, Vol. 37
2018, Vol. 37