2. 天津农学院农学与资源环境学院, 天津 300384;
3. 沈阳农业大学植物保护学院, 沈阳 110866
2. College of Agronomy and Resource Environment, Tianjin Agricultural University, Tianjin 300384, China;
3. Plant Protection College, Shenyang Agricultural University, Shenyang 110866, China
黄顶菊又称二齿黄菊,是一年生草本植物,菊科堆心菊族黄菊属,原产南美洲[1-2],是近十年来入侵我国华北地区的一种新型外来植物[3]。2001年在天津市和河北省被发现后,扩散迅速[4-5]。目前,外来入侵植物已经严重威胁入侵地生态系统功能、农业生产以及人类健康,造成巨大的经济损失和生态后果[6-8]。大量研究表明,气候变暖、土壤营养水平增加,均会促使外来入侵植物增强其竞争力[9-10]。王满莲等[11]对入侵植物紫茎泽兰生长特性的研究认为增加营养可以提高其入侵性。周建等[12]研究发现,施氮的增加会显著促进空心莲子草和莲子草的生长。
表型可塑性是指同一基因型由于环境条件的改变在表型上作出相应变化的能力,具有遗传基础,也能发生进化,是生物适应环境的一种方式[13]。研究发现,优越的可塑性有利于植物在不同环境中竞争,且入侵植物比本地植物的表型可塑性更强,在生长过程中更能充分利用资源,导致入侵成功[14-15]。表观遗传学是指基于DNA或组蛋白上的共价修饰而非基因序列改变导致的基因表达水平的变化,这种变化具有遗传性且遗传是可逆的[16]。植物利用基因组的表观修饰,改变相同基因型个体的基因表达式样,通过表型可塑性来响应环境条件的变化[17]。DNA甲基化是目前机制研究最为透彻的表观遗传过程,是最重要的表观遗传修饰方式之一[18-20]。田耀华等[21]研究发现,增施氮肥会使紫茎泽兰的竞争能力和表型可塑性增强。Angers等[22]研究发现,环境条件能够诱导DNA甲基化变异,且环境诱导的DNA甲基化和表观变异有持续性和可遗传性。
以往对氮素添加条件下黄顶菊变化的研究主要集中在其与本地或替代植物的种间竞争、生理生态变化等方面,并没有从表观遗传变异与表型可塑性变化响应角度去研究其入侵性,此外,由于黄顶菊的发生时期、生长环境以及区域分布与夏玉米基本吻合,是威胁我国玉米产量的潜在“杀手”[23-25],所以本文模拟玉米田的施氮梯度对黄顶菊进行处理,旨在明确黄顶菊在施氮处理下表观遗传变异与表型可塑性响应特征,为农田外来植物入侵的防控提供理论依据。
1 材料与方法 1.1 试验设计黄顶菊种子采自天津静海,为2015年收获的新种。试验于2016年6—8月在农业部环境保护科研监测所试验网室(39°15′ 804″ N,117°08′ 805″ E)内进行,采用1.5 m×0.8 m微区试验设计,4个微区组成一个试验区组,分别设置4个施氮处理:CK(0 kg·hm-2)、T1(175 kg·hm-2)、T2(275 kg·hm-2)、T3(375 kg·hm-2),每个处理设12次重复(单株),每个区组重复3次。播种前各小区基肥施用钾肥(氯化钾)175 kg·hm-2、磷肥(磷酸氢二铵)120 kg·hm-2,氮肥(尿素,各梯度施用50%作为基肥),黄顶菊于2016年6月1日播种,出苗后按照所保留的密度,均匀拔出多余的黄顶菊幼苗及其他杂草,在出苗后30 d追施剩余50%氮肥。
1.2 黄顶菊甲基化MSAP测定 1.2.1 黄顶菊叶片基因组DNA提取参照Wang等[26]、全志星等[27]方法。采用改良CTAB法提取黄顶菊叶片基因组DNA,用ND 2000核酸蛋白分析仪测定DNA浓度。
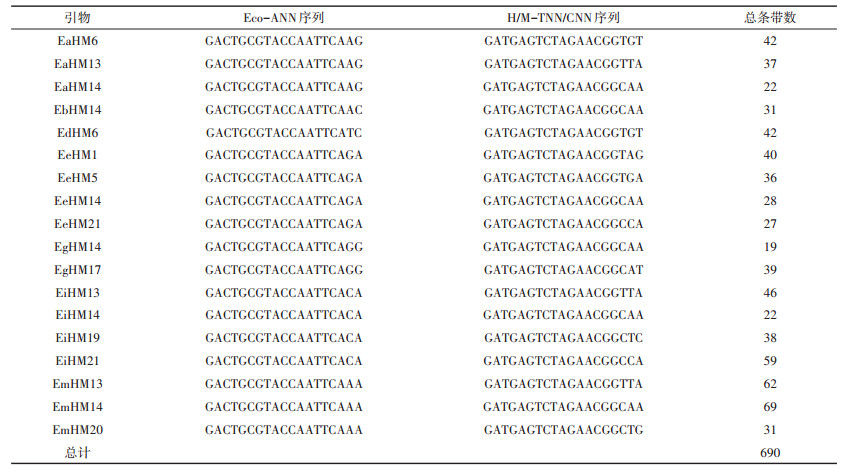
1.2.2 MSAP体系建立与优化参见全志星等[27]实验步骤。其中所用接头和引物序列见表 1。
|
|
表 1 本研究中接头和引物序列信息 Table 1 Sequence information of adaptor and primers used in this study |
于播种后90 d(2017年8月30日)进行植物生物量测定和取样。各处理随机选取5株,将其根、支持结构和叶分开进行生物量测定,在105 ℃杀青2 h后,在80 ℃烘72 h,电子天平(精度0.01 g)称量,计算如下参数:叶生物量比(Leaf mass ratio,LMR,叶质量/植株总质量)、根生物量比(Root mass ratio,RMR,根质量/植株总质量)、支持结构生物量比(Supporting organs biomass ratio,SBR,支持结构生物量/植株总质量,支持结构为植物的主茎与长度在3 cm以的分枝的茎的总和)、根冠比(Root mass/ Shoot mass Ratio,R/C,根生物量/地上部分生物量)。
1.3.2 生长指标测定株高采用直尺进行测量。茎粗采用游标卡尺进行测量。叶面积采用LI-3000C叶面积仪测量,叶面积指数=总叶面积/土地面积。统计花序数和分枝数(此处分枝指长度在3 cm以上,具有1对以上叶片的基部分枝和分株上的分枝)。
1.3.3 SPAD值测定采用SY-S02植物叶绿素测定仪测定。每个小区随机选取5株黄顶菊植株,每株选择中上部正常生长且叶位相同的两片功能叶,进行叶绿素含量测定。
1.3.4 光合生理指标测定利用LI-6400便携式光合仪测定。分析不同施氮处理对净光合速率(Pn)、气孔导度(Cond)、蒸腾速率(Tr)和水分利用效率(WUE =Pn/Tr)[28]的影响。
1.3.5 表型可塑性指数的计算表型可塑性指数即不同处理下某一变量的最大值减去其最小值再除以其最大值[29]。
1.4 数据统计与分析利用Quantity One软件标记出5%聚丙烯酰胺凝胶电泳图谱中100~800 bp区间扩展出的条带,转化成MSAP表型的数据0/1矩阵(其中有DNA条带记为1,无DNA条带记为0)。利用POP-Gene软件分析样品的多样性指数(na,ne,h,I)。
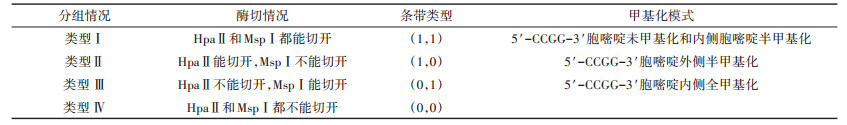
甲基化模式类型划分:HpaⅡ和MspⅠ能识别相同的酶切位点5’-CCGG-3’,利用两种同裂酶对5’- CCGG-3’位点胞嘧啶甲基化敏感程度的不同,切割同一个DNA样本会产生不同的甲基化模式,具体分类情况见表 2。
|
|
表 2 甲基化模式分类 Table 2 Methylation pattern classification |
使用Microsoft Excel 2010整理实验数据,利用Duncan法进行各指标的差异显著性检验(α=0.05),采用Pearson相关分析法分析表型可塑性与甲基化水平的相关性。
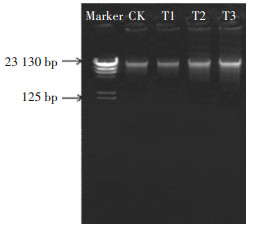
2 结果与分析 2.1 施氮处理下黄顶菊表观遗传变异分析 2.1.1 黄顶菊DNA提取及甲基化MSAP条带分析由于MSAP技术对基因组DNA质量要求很高,本试验提取的黄顶菊叶片DNA要确保OD260/280在1.7~ 1.9范围内,且用1%琼脂糖凝胶电泳检测时,如图 1所示,DNA条带必须呈清晰、无降解、无杂质状态,否则无法保证后续酶切、扩增和MSAP条带的稳定。
|
Marker:λ-Hind Ⅲ digest;CK、T1、T2、T3代表 4个施氮处理下的黄顶菊叶片基因组DNA Marker:λ-Hind Ⅲ digest; CK, T1, T2 and T3 represent the genomic DNA of Flaveria bidentis under four nitrogen treatments 图 1 黄顶菊基因组DNA提取 Figure 1 Extraction of the Flaveria bidentis genomic DNA |
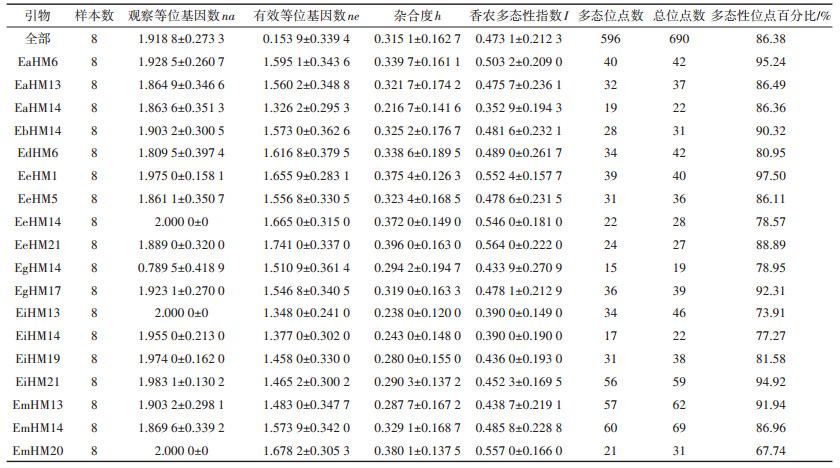
本试验在不同施氮处理下随机选取5株黄顶菊单株,共20个样本进行独立重复试验,通过筛选,从308对引物组合中选出18对扩增效果较好的引物组合进行MSAP试验分析。利用这18对扩增条带清晰的引物组合,共扩增出690条条带(本研究只统计长度在100~800 bp范围内的条带),部分引物的MSAP图谱如图 2所示。平均每对引物扩增出38.3条,引物序列信息和扩增条带数如表 3所示。其中,EmHM14引物组合扩增条带数最多为69条,EgHM14引物组合扩增条带数最少为19条。

|
图 2 部分黄顶菊单株MSAP检测结果 Figure 2 MSAP profile of Flaveria bidentis plants |
|
|
表 3 所选引物组合的序列信息及扩增条带数 Table 3 Sequence information of the selected primers and the amplified bands number |
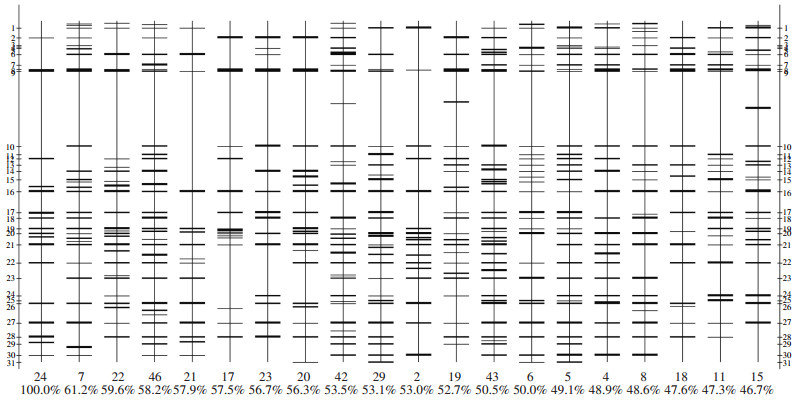
在本试验统计的条带大小范围内部分泳道的量化分析图如图 3所示,以第一条泳道作为参照,其余泳道扩增相同分子量的条带相似比,第7泳道与第1泳道扩增条带数相似度最高为61.2%,而第15条泳道与其相似度最低,为46.7%。
|
图 3 部分泳道量化分析图 Figure 3 Quantitative analysis diagram of part lane |
利用POPGene软件对样本遗传多样性指标进行分析,如表 4所示,18对引物观察等位基因数na平均值为1.918 8,有效等位基因数ne平均值为0.153 9,杂合度h平均值为0.315 1,香浓多态性指数I平均值为0.473 1。多样性指数越高则多态性位点百分比越高,由18对引物获得的690个位点中,有596个多态性位点,占总位点数的86.38%,表明本研究筛选获得的18对引物组合非常适用于黄顶菊表观遗传多样性研究。引物组合EeHM1的多态性位点百分比最高为97.50%,且该引物的观察等位基因数na、有效等位基因数ne、杂合度h以及香农多态性指数I均高于平均值,说明该引物对表观遗传多样性贡献率最大。引物组合EmHM20的多态性位点百分比最低为67.74%,多样性指数偏低,说明该引物对表观遗传多样性贡献率最小。
|
|
表 4 引物遗传多样性分析 Table 4 Genetic diversity analysis of primers |
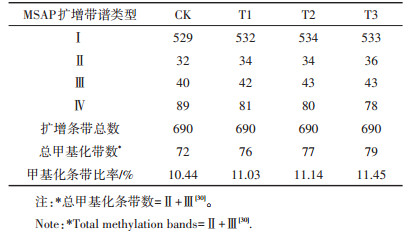
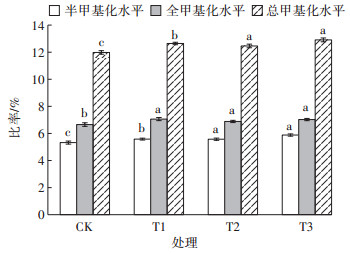
按照DNA甲基化模式类型分类,统计不同施氮处理下黄顶菊DNA甲基化水平变化情况,如表 5所示,各处理下扩增条带总数为690条,其中半甲基化(Ⅱ)和全甲基化(Ⅲ)条带数随施氮量的增加而增加,但是超甲基化(Ⅳ)条带数随施氮量的增加而减少。总甲基化条带数为72~79条,占比为10.44%~11.45%。由图 4可知,T2和T3施氮处理下各甲基化水平的变化趋势相似,差异不显著,但是半甲基化和总甲基化水平与CK和T1处理比较差异显著;全甲基化水平在T1、T2和T3处理下差异不显著,但是与CK处理差异显著。以上结果表明,施氮梯度会对黄顶菊甲基化状态产生影响。
|
半甲基化水平:Ⅱ(/Ⅰ+Ⅱ+Ⅲ)×100%;全甲基化水平:Ⅲ(/ Ⅰ+Ⅱ+Ⅲ)× 100%;总甲基化水平:(Ⅱ+Ⅲ)(/Ⅰ+Ⅱ+Ⅲ)×100%;其中Ⅰ、Ⅱ、Ⅲ分别代表Ⅰ、Ⅱ、Ⅲ类型的条带数量[30]。不同小写字母表示同一甲基化水平不同处理间差异显著 The level of hemomethylation:Ⅱ(/Ⅰ+Ⅱ+Ⅲ)× 100%;The level of total methylation:Ⅲ(/Ⅰ+Ⅱ+Ⅲ)× 100%;The overall level of methylation: (Ⅱ+Ⅲ)(/Ⅰ+Ⅱ+Ⅲ)×100%.Among them, Ⅰ, Ⅱ and Ⅲ represent the number of Ⅰ, Ⅱ and Ⅲ type bands, respectively.Different letters mean significant difference among different treatments under the same methylation 图 4 四种施氮处理下甲基化水平 Figure 4 The level of methylation under four nitrogen treatments |
|
|
表 5 各施氮处理下DNA甲基化水平变化情况 Table 5 The change of DNA methylation level under different nitrogen treatments |
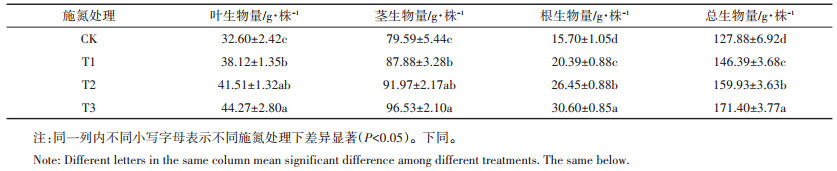
施氮处理明显增加了黄顶菊植株各部分的生物量。从表 6可以看出,黄顶菊的叶生物量、茎生物量、根生物量、总生物量均随着施氮量的增加而增大,在高氮(T3)处理下达到最大值。其中叶生物量和茎生物量在低氮(T1)和正常施氮(T2)处理下差异不显著,但是与无氮(CK)和高氮(T3)处理差异显著(P < 0.05);根生物量和总生物量在各施氮处理下差异显著。与无氮(CK)处理相比,低氮(T1)、正常施氮(T2)和高氮(T3)处理下:叶生物量分别增加了16.9%、27.3%和35.8%;茎生物量分别增加了10.4%、15.6%和21.3%;根生物量分别增加了29.9%、68.5%和94.9%;总生物量分别增加了14.5%、25.1%和34.0%。
|
|
表 6 不同施氮处理对黄顶菊生物量的影响 Table 6 Effects of different nitrogen treatments on biomass of Flaveria bidentis |
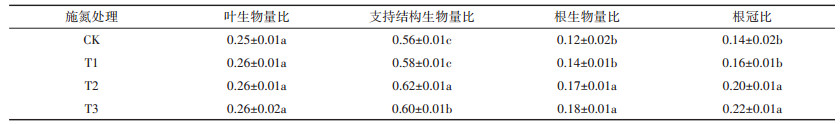
不同施氮处理下黄顶菊的生物量分配也有明显差异。如表 7所示,支持结构生物量比在正常施氮(T2)和高氮(T3)处理下差异不显著,但是在正常施氮(T2)和高氮(T3)处理下的支持结构比显著高于无氮(CK)和低氮(T1)处理下的支持结构比;根生物量比与根冠比在无氮(CK)和低氮(T1)处理下差异不显著,但是无氮(CK)和低氮(T1)处理下的根生物量比与根冠比显著低于正常施氮(T2)和高氮(T3)处理下的根生物量比与根冠比,这可能与此时植株把较多的生物量分配到根部有关。总之,黄顶菊的生物量随施氮梯度的增加而增加,施氮明显促进了黄顶菊的生长,说明农田中施氮量越高,越利于黄顶菊生长,所以黄顶菊的入侵风险越大。
|
|
表 7 不同施氮处理对黄顶菊生物量分配的影响 Table 7 Effects of different nitrogen treatments on biomass allocation of Flaveria bidentis |
施氮处理明显改变了黄顶菊的营养生长。黄顶菊的株高、茎粗、叶面积指数和分枝数在各施氮处理下差异明显,除分枝数外,其他指标均随施氮量的增加而增大,在T3施氮梯度下达到最大值;黄顶菊分枝数在T2施氮梯度下达到最大值。如图 5A、图 5B、图 5C、图 5D)所示,黄顶菊株高在各施氮梯度下差异显著(P < 0.05);黄顶菊茎粗在CK和T1施氮梯度下差异不显著,与T2和T3施氮梯度相比差异显著;黄顶菊叶面积指数在T1和T2施氮梯度下差异不显著,与CK和T3施氮梯度相比差异显著;黄顶菊分枝数在T2和T3施氮梯度下差异不显著,与CK和T1施氮梯度相比差异显著。由此可知,施氮可以促进黄顶菊的营养生长,施氮越多促进效果约明显,说明施氮量多的农田中更适合黄顶菊生长,黄顶菊的入侵风险也就越大。
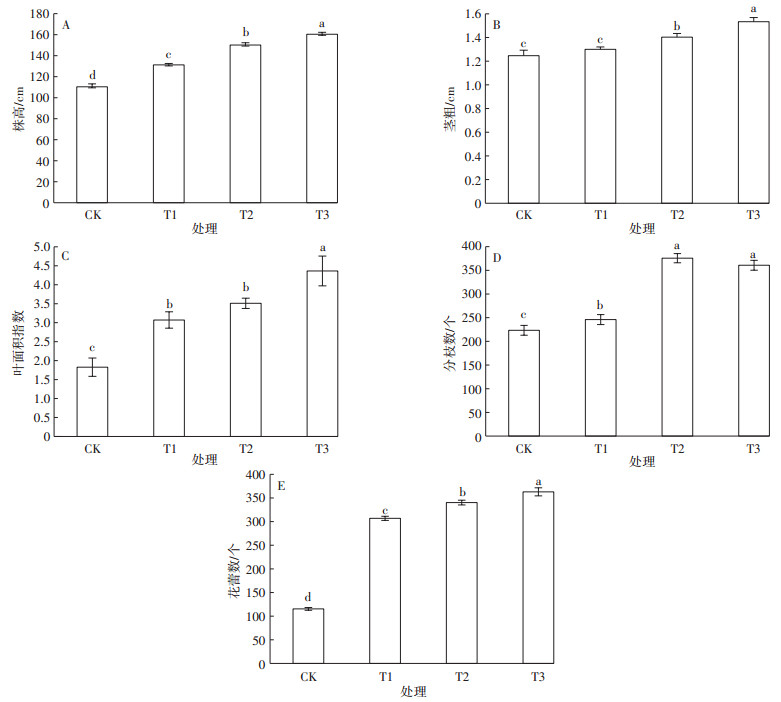
|
图 5 不同施氮处理对黄顶菊生长特征的影响 Figure 5 Effects of different nitrogen treatments on growth characteristics of Flaveria bidentis |
施氮处理也明显改变了黄顶菊的生殖生长,如图 5E所示,随施氮量的增加黄顶菊的花蕾数增加,且各施氮处理下差异显著(P < 0.05);与CK施氮梯度相比,T1、T2和T3施氮处理下花蕾数分别增加了116.2%、195.1%和214.7%。黄顶菊结实量大,一株黄顶菊可结12万粒种子,花蕾数的增加无疑增加了黄顶菊的种子数量,同时加大其入侵风险。所以施氮量的增加不仅促进黄顶菊的营养生长,更严重的是促进黄顶菊的生殖生长,增加结实量,增加入侵风险。
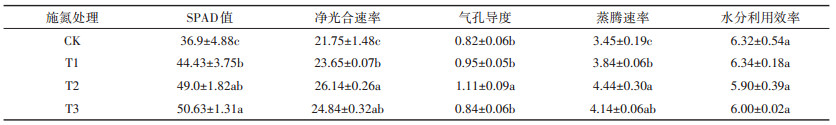
2.2.3 不同施氮处理对黄顶菊光合特性的影响如表 8所示,黄顶菊SPAD值随施氮梯度的增加而增大,在T3施氮梯度下达到最大值,T2处理下黄顶菊SPAD值与T1和T3处理下SPAD值差异不显著,但是与CK处理比较差异显著(P < 0.05);黄顶菊净光合速率随施氮梯度增加而增大,但在T3施氮梯度下出现下降趋势,且在T1和T3施氮梯度下差异不显著,与CK和T2施氮处理差异显著;黄顶菊蒸腾速率在各施氮处理下与黄顶菊净光合速率变化趋势相同;黄顶菊气孔导度虽然也随施氮量的增加而增加,但是只有T2施氮处理下气孔导度和CK、T1和T3处理下差异显著,CK、T1和T3处理下差异不显著;黄顶菊水分利用效率在不同施氮处理下差异不显著。
|
|
表 8 不同施氮处理对黄顶菊叶绿素含量和光合性状的影响 Table 8 Effects of different nitrogen treatments on chlorophyll content and photosynthetic characteristics of Flaveria bidentis |
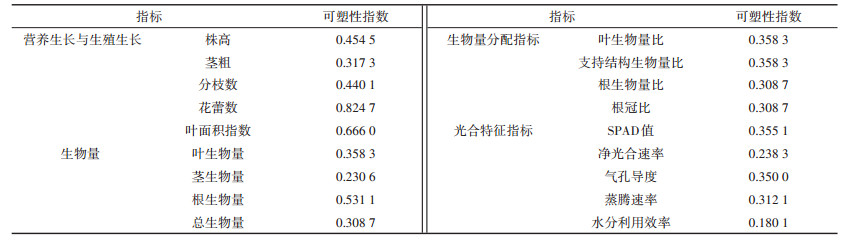
如表 9所示,本研究中,在不同施氮处理下,黄顶菊的营养生长和生殖生长指标的表型可塑性指数相对较高,其中花蕾数和叶面积指数的表型可塑性指数最高分别为0.824 7和0.666 0。另外,根生物量的表型可塑性指数也较高,为0.531 1;生物量分配指标和光合特征指标的表型可塑性指数相对较低。由此可以看出,黄顶菊是通过调节自身的营养生长和生殖生长等指标来适应施氮处理,通过增加根生物量来吸收土壤中的养分,从黄顶菊的各项指标的表型可塑性指数来看,黄顶菊的适应能力很强,可以很好地适应环境的变化。
|
|
表 9 黄顶菊的各项指标在不同施氮处理下的表型可塑性指数 Table 9 Phenotypic plasticity index of each index of Flaveria bidentis under different nitrogen treatments |
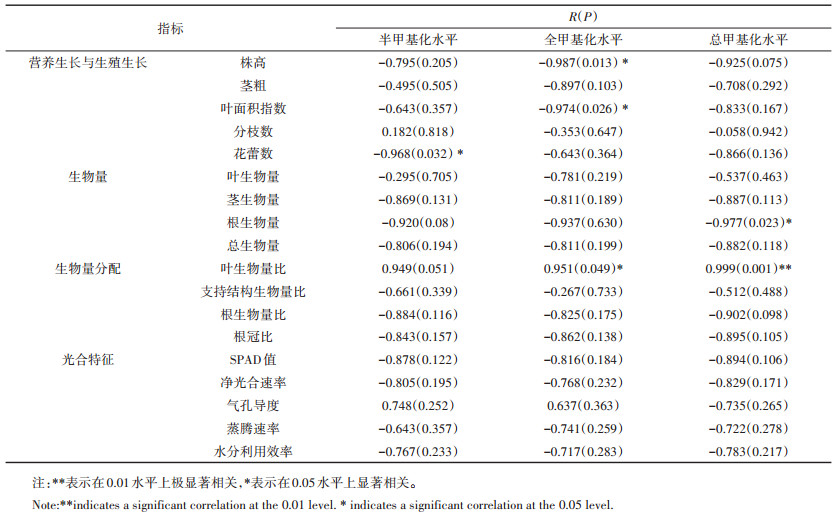
表观遗传变异可能是表型可塑性形成的重要分子基础,为研究不同氮素水平下黄顶菊DNA甲基化与表型可塑性的响应特征,本文进一步分析了各甲基化状态与不同生理指标表型可塑性指数之间的相关性(表 10)。结果表明,黄顶菊DNA半甲基化水平与花蕾数呈显著负相关,黄顶菊全甲基化水平与株高和叶面积指数呈显著负相关,黄顶菊总甲基化水平与根生物量呈显著负相关,与叶生物量比呈极显著正相关。这是由于植物可能通过在某些基因的内部或附近区域发生甲基化或去甲基化来抑制或激活这些基因的表达,从而参与植物生长发育的重要生命过程。随不同氮素水平的变化,黄顶菊可能主要通过调节5′ -CCGG-3′胞嘧啶外侧发生半甲基化或内侧发生全甲基化的水平,来开启花蕾数、根生物量、株高和叶面积指数相关基因的表达;而通过整体调节5′ -CC- GG-3′胞嘧啶内外侧发生半甲基化和全甲基化的总甲基化水平,开启根生物量相关基因的表达而关闭叶生物量比相关基因的表达。
|
|
表 10 黄顶菊各生理指标的表型可塑性指数与甲基化水平相关性 Table 10 Correlation analysis of phenotypic plasticity index and methylation level of each physiological index of Flaveria bidentis under different treatments |
外来生物入侵已成为威胁我国生态安全与生物安全的重要问题,我国每年由外来入侵物种造成的经济损失高达2000亿元[6, 31]。目前,有效预防和控制外来物种的危害已经成为学术界关注的重点[32]。在以往研究入侵植物与环境的相互作用以及物种的适应性进化中,多是强调遗传变异的作用,但事实上,植物面对环境条件的变化可以通过表型可塑性的改变来做出相应的变化从而适应环境,而基因组表观遗传变异是环境适应性和表型可塑性发生的机理。表型可塑性能使植物的生态幅拓宽,同时也增强了植物的耐受性,从而使植物可以在更复杂的环境下生存,使入侵种获得竞争优势[15, 33]。
氮素是生态系统中限制植物生长、生物量和光合作用的重要环境资源之一[34]。研究表明[35],氮素资源投入过剩会降低生态系统抵御外来植物入侵的能力,使生态系统功能面临破坏性威胁。Gilliam[36]的研究指出,当可利用的氮素含量升高时,入侵植物会加速入侵。黄顶菊是典型的C4植物,其C4结构及其代谢途径使它能够适应干旱、盐碱恶劣条件及强光条件,且具有很高的氮素利用能力[37-38]。王满莲等[39]研究发现,入侵植物紫茎泽兰和飞机草对氮素添加变化表现出很高的表型可塑性,随施氮量的增加,两种植物的根冠比、叶生物量比、叶面积比等均升高,说明土壤含氮量的增加利于两种植物的入侵。陆光亚等[40]研究发现,豚草的形态和生物量分配特征对氮素添加表现出很强的可塑性,且随着施氮量的增加,株高、总生物量、支持结构生物量比等显著增加,可知新区域中土壤含氮量增加更加方便豚草入侵。
表观遗传学研究显示,生物的适应性增强往往是表型变化而不是基因型的变化[41-43]。宋欣欣等[44]和Kou等[45]利用MSAP技术,研究了低氮处理对水稻DNA甲基化的影响,结果表明水稻在低氮和无氮处理后,DNA甲基化水平降低幅度较大,降低的模式以CNG甲基化水平的降低为主。池春玉等[46]研究结果表明,低氮处理的飞机草去甲基化比例高于高氮处理的飞机草,而甲基化增强的比例又低于高氮处理。本研究也显示T2施氮处理下获得甲基化类型Ⅰ的带数最多;甲基化类型Ⅱ的条带数随施氮量的增加而增加;类型Ⅲ的条带数在T2施氮梯度下达到最大值。T2和T3处理下甲基化的变化趋势相似,差异不显著;半甲基化和总甲基化在T2和T3处理下差异不显著但是与CK和T1处理差异显著,说明施氮梯度会对黄顶菊甲基化状态产生影响。
张耀鸿等[47]研究发现,外源氮输入促进了互花米草的生长、生物量积累;Harrington等[48]研究发现,入侵植物刺檗随着可利用氮素含量的升高,通过增加叶片氮含量和叶生物量来提高产量。与本文研究结果一致,本研究发现,黄顶菊的生长指标如叶生物量、茎生物量、根生物量、总生物量、根生物量比、根冠比、株高、茎粗、叶面积指数、分枝数和花蕾数等均随着施氮量的增加而增加;黄顶菊的光合特征指标SPAD值、净光合速率、气孔导度和蒸腾速率等均随着施氮量的增加而增加,这说明施氮会促进黄顶菊的生长。黄顶菊在受到不同施氮处理下,各生长指标的表型可塑性指数较高,说明黄顶菊具有较强的适应能力,通过调节形态和生物量分配来适应环境,这与皇甫超河等[49]研究结果一致。
总之通过本研究,首先可以确定黄顶菊的生长指标和光合特征指标均随着施氮量的增加而增大,施氮处理会促进黄顶菊生长,黄顶菊通过调节形态和生物量分配来适应施氮环境。其次,还可以确定黄顶菊DNA甲基化类型Ⅱ和类型Ⅲ均随着施氮量的增加而增大,说明施氮可以改变甲基化水平和模式。为进一步明确外来入侵植物如何通过表观遗传来适应环境提供证据。
4 结论施氮处理下,黄顶菊能够通过调节自身的营养和生殖生长及根生物量分配等表型可塑性指标的变化,来适应施氮水平的变化,这种变化可能是通过在相关基因内部或附近发生甲基化或者去甲基化来抑制或激活这些基因的表达来实现的。
| [1] |
刘全儒. 中国菊科植物一新归化种-黄菊属[J]. 植物分类学报, 2005, 43(2): 178-180. LIU Quan-ru. Flaveria Juss.(Compositae), a newly naturalized genus in China[J]. Journal of Plant Taxonomy, 2005, 43(2): 178-180. |
| [2] |
高贤明, 唐廷贵, 梁宇, 等. 外来植物黄顶菊的入侵警报及防控对策[J]. 生物多样性, 2004, 12(2): 274-279. GAO Xian-ming, TANG Ting-gui, LIANG Yu, et al. An alert regarding biological invasion by a new exotic plant, Flaveria bidentis, and strategies for its control[J]. Biodiversity, 2004, 12(2): 274-279. DOI:10.3321/j.issn:1005-0094.2004.02.008 |
| [3] |
张天瑞, 皇甫超河, 杨殿林, 等. 外来植物黄顶菊的入侵机制及生态调控技术研究进展[J]. 草业学报, 2011, 20(3): 258-278. ZHANG Tian-rui, HUANGFU Chao-he, YANG Dian-lin, et al. Invasion mechanism and ecological management of exotic plant, Flaveria bidentis[J]. Journal of Pratacultural Science, 2011, 20(3): 258-278. |
| [4] |
芦站根, 崔兴国, 蒋文静. 衡水湖黄顶菊入侵情况的初步调查研究[J]. 衡水学院学报, 2006, 8(1): 69-71. LU Zhan-gen, CUI Xing-guo, JIANG Wen-jing. The primary investigation and studies on the alien invasion of Flaveria bidentis Kuntze in Hengshui Lake[J]. Journal of Hengshui University, 2006, 8(1): 69-71. DOI:10.3969/j.issn.1673-2065.2006.01.026 |
| [5] |
郭成亮, 胡文多, 朱敏峰, 等. 有害杂草黄顶菊在河北衡水的入侵途径调查[J]. 动物检疫, 2007, 2(3): 187-188. GUO Cheng-liang, HU Wen-duo, ZHU Min-feng, et al. Investigation on the ways of invalidation of Flaveria bidentis[J]. Animal Quarantine, 2007, 2(3): 187-188. |
| [6] |
何影, 马淼. 入侵植物意大利苍耳种子萌发对环境因子的响应[J]. 生态学报, 2018, 38(4): 1226-1234. HE Ying, MA Miao. Response of seed germination of the inactive plant Xanthium italicum to environment factors[J]. Journal of Ecology, 2018, 38(4): 1226-1234. |
| [7] |
魏巍, 侯玉平, 张静, 等. 不同光照强度对入侵植物薇甘菊(Mikania micrantha)和飞机草(Chormolaena odorata)生长及生物量分配的影响[J]. 生态学报, 2017, 37(18): 6021-6028. WEI Wei, HOU Yu-ping, ZHANG Jing, et al. Effect of light intensity on growth and biomass allocation of invasive plants Mikania micrantha and Chormolaena odorata[J]. Journal of Ecology, 2017, 37(18): 6021-6028. |
| [8] |
蒋智林, 刘万学, 万方浩, 等. 紫茎泽兰入侵对土壤肥力特征的影响及其动态研究[J]. 农业环境科学学报, 2008, 27(1): 267-272. JIANG Zhi-lin, LIU Wan-xue, WAN Fang-hao, et al. Effects of Ageratina adenophora (Spreng.) invasion on soil nutrient properties and their seasonal dynamics[J]. Journal of Agro-Environment Science, 2008, 27(1): 267-272. DOI:10.3321/j.issn:1672-2043.2008.01.049 |
| [9] |
王琼, 唐娅, 王辉, 等. 入侵植物喜旱莲子草和本地种接骨草光合生理特征对增温响应的差异[J]. 生态学报, 2017, 37(3): 770-777. WANG Qiong, TANG Ya, WANG Hui, et al. Distinctive responses of photosynthetic characteristics to warming of invasive Alternanthera philoxerodies and native Sambucus chinensis[J]. Journal of Ecology, 2017, 37(3): 770-777. |
| [10] |
赵林, 孟玲, 李保平, 等. 施肥对苗期紫茎泽兰和黑麦草相对竞争力的影响[J]. 生态学杂志, 2007, 26(11): 1743-1747. ZHAO Lin, MENG Ling, LI Bao-ping, et al. Effects of fertilization on the relative competitive ability of Eupatorium adenophorum and Lolium perenne at their seedling stage[J]. Journal of Ecology, 2007, 26(11): 1743-1747. |
| [11] |
王满莲, 冯玉龙, 李新. 紫茎泽兰和飞机草的形态和光合特性对磷营养的响应[J]. 应用生态学报, 2006, 17(4): 602-606. WANG Man-lian, FENG Yu-long, LI Xin, et al. Effects of soil phosphorus level on morphological and photosynthetic characteristics of Ageratina adenophora and Chromolaena odorata[J]. Journal of Applied Ecology, 2006, 17(4): 602-606. DOI:10.3321/j.issn:1001-9332.2006.04.009 |
| [12] |
周建, 李红丽, 于飞海, 等. 施氮对空心莲子草(Alternanthera philoxeroides)和莲子草(Alternanthera sessilis)种间关系的影响[J]. 生态学报, 2015, 35(24): 8258-8267. ZHOU Jian, LI Hong-li, YU Fei-hai, et al. Effect of nitrogen fertilization on inter-specific competition between Alternanthera philoxeroides and Alternanthera sessilis[J]. Journal of Ecology, 2015, 35(24): 8258-8267. |
| [13] |
Scheiner S M. Genetics and evolution of phenotypic plasticity[J]. Annual Review of Ecology and Systematics, 1993, 24: 35-68. DOI:10.1146/annurev.es.24.110193.000343 |
| [14] |
郑欣颖, 薛立. 入侵植物三叶鬼针草与近缘本地种金盏银盘的可塑性研究进展[J]. 生态学杂志, 2018, 37(2): 580-587. ZHENG Xin-ying, XUE Li. Research progress about phenotypic plasticity of exotic invasive species Bidens pilosa and a congeneic native species B. biternate[J]. Chinese Journal of Ecology, 2018, 37(2): 580-587. |
| [15] |
Davidson A M. Do invasive species show higher phenotypic plasticity than native species and, if so, is it adaptive? A meta-analysis[J]. Ecology Letters, 2011, 14: 419-431. DOI:10.1111/ele.2011.14.issue-4 |
| [16] |
Bossdorf O, Auge H, Lafuma L, et al. Phenotypic and genetic differentiation between native and introduced plant populations[J]. Oecologia, 2005, 14(3): 1-11. |
| [17] |
王楠楠, 皇甫超河, 杨殿林, 等. 刈割对外来植物黄顶菊的生长、气体交换和荧光的影响[J]. 生态学报, 2012, 32(9): 2943-2952. WANG Nan-nan, HUANGFU Chao-he, YANG Dian-lin, et al. Effects of clipping on the growth, gas exchange and chlorophyll fluorescence of invasive plant, Flaveria bidentis[J]. Journal of Ecology, 2012, 32(9): 2943-2952. |
| [18] |
Richardson D M, Pysek P. Plant invasions:Merging the concepts of species invasiveness and community invisibility[J]. Phog Phys Geog, 2006, 30(2): 409-431. |
| [19] |
Schmitz R J, Schultz M D, et al. Pattems of population epigenomic diversity[J]. Nature, 2013, 495(7440): 193-198. DOI:10.1038/nature11968 |
| [20] |
Ruizgarcia L, Cervera M T, Martinezzapater J M, et al. DNA methylation increases throughout Arbidopsis development[J]. Planta, 2005, 222(2): 301-306. DOI:10.1007/s00425-005-1524-6 |
| [21] |
田耀华, 冯玉龙, 刘潮. 氮肥和种植密度对紫茎泽兰生长和竞争的影响[J]. 生态学杂志, 2009, 28(4): 577-588. TIAN Yao-hua, FENG Yu-long, LIU Chao, et al. Effect of nitrogen fertilizer and planting density on Ageratina adenophora growth and its competitive trains[J]. Ecology Journal, 2009, 28(4): 577-588. |
| [22] |
Angers B, Castonguay E, Massicotte R. Environmentally induced phenotypes and DNA methylation:How to deal with unpredictable conditions until the next generation and after[J]. Mol Ecol, 2010, 19(7): 1283-1295. DOI:10.1111/mec.2010.19.issue-7 |
| [23] |
Tyler A C, Lambrinos J G, Grosholz E D. Nitrogen inputs promote the spread of an invasive marsh grass[J]. Ecological Applications, 2007, 17(7): 1886-1898. DOI:10.1890/06-0822.1 |
| [24] |
Riper L V, Larson D, Larson J. Nitrogen-limitation and invasive sweet clover impacts vary between two great plains plant communities[J]. Biological Invasions, 2010. |
| [25] |
宋振, 纪巧凤, 张国良, 等. 黄顶菊入侵对土壤中主要功能细菌的影响[J]. 应用生态学报, 2016, 27(8): 2636-2644. SONG Zhen, JI Qiao-feng, ZHANG Guo-liang, et al. Effect of Flaveria bivalvia invasion on the diversity of functional bacteria in rhizosphere soil[J]. Journal of Applied Ecology, 2016, 27(8): 2636-2644. |
| [26] |
Wang B R, Li W G, Wang J B. Genetic diversity of Alternanthera philoxeroides in China[J]. Aquat Bot, 2005, 81(3): 277-283. DOI:10.1016/j.aquabot.2005.01.004 |
| [27] |
全志星, 田佳源, 王慧, 等. 不同入侵地区黄顶菊DNA表观遗传多样性变化特征[J]. 农业环境科学学报, 2017, 36(4): 625-634. QUAN Zhi-xing, TIAN Jia-yuan, WANG Hui, et al. Studies on epigenetic diversity variation characteristics of Flaveria bidentis genome DNA of four different geographical distributions[J]. Journal of AgroEnvironment Science, 2017, 36(4): 625-634. |
| [28] |
接玉玲, 杨洪强, 崔明刚, 等. 土壤含水量与苹果叶片水分利用效率的关系[J]. 应用生态学报, 2001, 12(3): 387-390. JIE Yu-ling, YANG Hong-qiang, CUI Ming-gang, et al. Relationship between soil water content and water use efficiency of apple leaves[J]. Chinese Journal of Applied Ecology, 2001, 12(3): 387-390. DOI:10.3321/j.issn:1001-9332.2001.03.016 |
| [29] |
Valladares F, Wright S J, Lasso E, et al. Plastic phenotypic response to light of 16 congeneric shrubs from a Panamanian rain forest[J]. Ecology, 2000, 81(7): 1925-1936. DOI:10.1890/0012-9658(2000)081[1925:PPRTLO]2.0.CO;2 |
| [30] |
Blouin M S, Thuillier V, Cooper B, et al. No evidence for large differences in genomic methylation between wild and hatchery steelhesd (Oncorhynchus mykiss)[J]. Canadian Journal of Fisheries and Aquatic Sciences, 2010, 67(2): 217-224. DOI:10.1139/F09-174 |
| [31] |
高志亮, 过燕琴, 邹建文. 外来植物水花生和苏门白酒草入侵对土壤碳氮过程的影响[J]. 农业环境科学学报, 2011, 30(4): 797-805. GAO Zhi -liang, GUO Yan-qin, ZOU Jian-wen. Effect of invasive plants(Conyze sumatrenss and Alternanthera philoxeroides) on soil carbon and nitrogen processes[J]. Journal of Agro-Environment Science, 2011, 30(4): 797-805. |
| [32] |
邰凤姣, 韩彩霞, 邵华, 等. 入侵植物意大利苍耳不同部位挥发油的化感作用及其化学成分的比较分析[J]. 生物学杂志, 2015, 32(2): 36-41. TAI Feng-jiao, HAN Cai-xia, SHAO Hua, et al. Comparison of the allelopathic effects of the volatile oils from different parts of Xanthium italicum Moretti[J]. Journal of Biology, 2015, 32(2): 36-41. DOI:10.3969/j.issn.2095-1736.2015.02.036 |
| [33] |
Hulme P E. Phenotypic plasticity and plant invasions:Is it all Jack?[J]. Functional Ecology, 2008, 22: 3-7. |
| [34] |
王楠楠.入侵植物黄顶菊对刈割、模拟天敌和施肥调控的生理生态响应[D].北京: 中国农科院农业部环境保护科研监测所, 2012: 33-36. WANG Nan-nan. Physio-ecological responses of invasive plant Flaveria bidentis to clipping, simulating herbivory and fertilizing management[D]. Beijing: Chinese Academy of Agricultural Sciences Agro-Environmental Protection Institute, Ministry of Agriculture, 2012: 33-36. http://cdmd.cnki.com.cn/article/cdmd-82101-1012415568.htm |
| [35] |
Tyler A C, Lambrinos J G, Grosholz E D. Nitrogen inputs promote the spread of an invasive marsh grass[J]. Ecological Applications, 2007, 17(7): 1886-1898. DOI:10.1890/06-0822.1 |
| [36] |
Gilliam F S. Response of the herbaceous layer of forest ecosystems to excess nitrogen deposition[J]. Journal of Ecology, 2006, 94(6): 1176-1191. DOI:10.1111/jec.2006.94.issue-6 |
| [37] |
任艳萍, 古松, 江莎, 等. 外来植物黄顶菊营养器官解剖特征及其生态适应性[J]. 生态学杂志, 2009, 28(7): 1239-1244. REN Yan-ping, GU Song, JIANG Shi, et al. Anatomical characteristics of vegetative organs and ecological adaptability of new alien species Flaveria bidentis[J]. Ecology Journal, 2009, 28(7): 1239-1244. |
| [38] |
Ross K A, Ehrenfeld J G, Patel M V. The effects of nitrogen addition on the growth of two exotic and two native forest understory plants[J]. Biological Invasions, 2011, 13(10): 2203-2216. DOI:10.1007/s10530-011-0034-7 |
| [39] |
王满莲, 冯玉龙. 紫茎泽兰和飞机草的形态、生物量分配和光合特性对氮营养的响应[J]. 植物生态学报, 2015, 29(5): 697-705. WANG Man-lian, FENG Yu-long. Effects of soil nitrogen levels on morphology, biomass allocation and photosynthesis in Ageratina adenophora and Chromoleana odorata[J]. Journal of Plant Ecology, 2015, 29(5): 697-705. |
| [40] |
陆光亚, 王晋萍, 桑卫国. 氮沉降对外来种豚草入侵能力与竞争能力的影响[J]. 东北林业大学学报, 2012, 40(6): 60-66. LU Guang-ya, WANG Jin-ping, SANG Wei-guo. Effects of nitrogen deposition on invasive and competitive abilities of an alien plant Ambrosia artemisiifolia[J]. Journal of Northeast Forestry University, 2012, 40(6): 60-66. DOI:10.3969/j.issn.1000-5382.2012.06.016 |
| [41] |
Zhang Y Y, Fischer M, Colot V, et al. Epigenetic variation creates potential for evolution of plant phenotypic plasticity[J]. New Phytologist, 2013, 197(1): 314-322. DOI:10.1111/nph.12010 |
| [42] |
Aubin-Horth N, Renn S C. Genomic reaction norms:Using integrative biology to understand molecular mechanisms of phenotypic plasticity[J]. Molecular Ecology, 2009, 18(18): 3763-3780. DOI:10.1111/mec.2009.18.issue-18 |
| [43] |
Weinig C, Brock M T, Dechaine J A, et al. Resolving the genetic basis of invasiveness and predicting invasions[J]. Genetica, 2007, 129(2): 205-216. DOI:10.1007/s10709-006-9015-7 |
| [44] |
宋欣欣, 刘宝.低氮水平下诱导的水稻DNA甲基化变异[D].长春: 东北师范大学, 2009. SONG Xin-xin, LIU Bao. Methylation alternations in rice induced by the nitrogen starvation[D]. Changchun: Northeast Normal University, 2009. http://cdmd.cnki.com.cn/article/cdmd-10200-2009177324.htm |
| [45] |
Kou H P, Li Y, Song X X, et al. Heritable alteration in DNA methylation induced by nitrogen-deficiency stress accompanies enhanced tolerance by progenies to the stress in rice(Oryza sativa L.)[J]. Plant Physiology, 2011, 168(14): 1685-1693. DOI:10.1016/j.jplph.2011.03.017 |
| [46] |
池春玉, 郭丹蒂, 丁国华, 等. 不同氮水平对原产地和入侵地飞机草(Chromolaena odorata L.)DNA甲基化的影响[J]. 核农学报, 2014, 28(9): 1591-1596. CHI Chun-yu, GUO Dan-di, DING Guo-hua, et al. Effect of different nitrogen levels on DNA methylation in Chromolaena odorata L. from native and invasive region[J]. Journal of Nuclear Agricultural Sciences, 2014, 28(9): 1591-1596. |
| [47] |
张耀鸿, 张富存, 李映雪, 等. 外源氮输入对互花米草生长及叶特征的影响[J]. 生态环境学报, 2010, 19(10): 2297-2301. ZHANG Yao-hong, ZHANG Fu-cun, LI Ying-xue, et al. Influence of exogenous N import on growth and leaf character of Spartina alterniflora[J]. Journal of Ecology and Environment, 2010, 19(10): 2297-2301. DOI:10.3969/j.issn.1674-5906.2010.10.006 |
| [48] |
Harrington R A, Fownes J H, Cassidy T M. Japanese barberry (Berberis thunbergii) in forest understory:Leaf and whole plant responses to nitrogen availability[J]. The American Midland Naturalist Journal, 2004, 151(2): 206-216. DOI:10.1674/0003-0031(2004)151[0206:JBBTIF]2.0.CO;2 |
| [49] |
皇甫超河, 王楠楠, 杨殿林, 等. 增施氮肥对黄顶菊与高丹草苗期竞争的影响[J]. 生态环境学报, 2010, 19(3): 672-678. HUANGFU Chao-he, WANG Nan-nan, YANG Dian-lin, et al. Effects of increased soil nitrogen on the competitive performance of Flaveria bidentis and Sorghum bicolor×Sorghum sudanense at seedling stage[J]. Ecology and Environmental Sciences, 2010, 19(3): 672-678. DOI:10.3969/j.issn.1674-5906.2010.03.031 |
 2018, Vol. 37
2018, Vol. 37