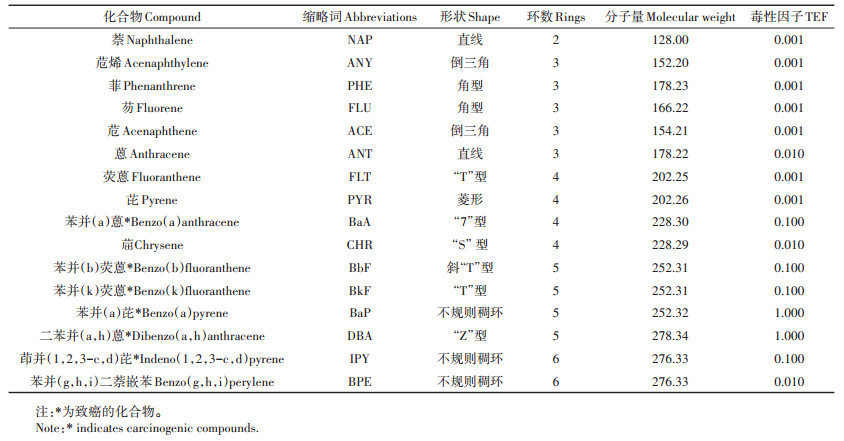
多环芳烃(Polycyclic aromatic hydrocarbons,PAHs)是具有致畸、致癌和致突变作用的一类典型持久性有机污染物[1-2]。它们广泛存在于大气、土壤及水体当中[3]。1998年欧美32个国家在欧洲环境会议上正式将其中危害较大的16种PAHs(表 1)列入优控名单中[4]。随着工农业的快速发展以及人们物质生活水平的迅速提高,煤和石油等在工农业生产、交通运输以及人民生活中被广泛应用,这使得越来越多的PAHs进入环境,对农作物生产安全和人类的生命健康产生极大的威胁[5-6]。PAHs污染是世界各国所面临的重大环境与公共健康问题之一,其对蔬菜的污染问题也越来越突出[7]。蔬菜是人们日常饮食中必不可少的食物之一。我国栽培的蔬菜有100多种,常见的有40~50种。近年来,蔬菜等农产品的质量安全问题越来越受到我国科研工作者的重视,部分科研基地被用于PAHs的试验研究。然而蔬菜体内PAHs的污染来源、风险与防治措施等还不为广大民众所熟悉,在化工厂、科研基地和机动车通道附近栽培蔬菜的案例并不少见。因此,对上述环境下栽培的蔬菜体内PAHs来源和风险的研究显得尤为重要。
目前,国内外关于水体、土壤、大气和植物中PAHs来源已有不同程度的研究[8-9]。有研究结果表明,植物体内PAHs的来源与介质的传播能力和植物自身的吸收能力有关[10-11]。不同生长环境下植物对PAHs吸收能力不同,因而其体内PAHs的含量和组分不同[4]。同分异构体比值法通过某些同分异构体组分含量比值大小判断蔬菜体内PAHs来源,这对找出蔬菜体内PAHs污染的根源具有积极的作用。前人对土壤和淤泥中PAHs风险评估的方法主要有生态效应低中值法、风险商值法、有机碳归一化法和苯并(a)芘毒性等效当量法(Toxicity equivalent of BaP,TEQBaP)及其复合法[12]。其中,生态效应低中值法和TEQBaP法分别表征了单一和总体的PAHs生态风险。研究结果表明,单一的生态风险评估方法存在不同程度的缺陷,而复合法优于单一的评估方法,更具有客观性。另外,健康风险评估模型法是对评价有害物质食入路径进行健康风险评估的最有效方法[13-14],通过模型计算分析蔬菜体内PAHs所存在的潜在生态与健康风险,对于合理评价污染区蔬菜体内PAHs污染对人群健康的危害有重要意义。本研究采用豇豆为试验材料,分析在不同污染特征环境下豇豆体内PAHs的来源,用生态效应低中值法和TEQBaP法及其复合法分析豇豆还田后的生态风险,同时运用健康风险模型评估食入豇豆后的健康风险。只有对蔬菜体内PAHs来源和风险进行准确评价,才能更好地发展相应的污染控制技术,及时调控污染来源,减少PAHs在蔬菜体内的积累,为蔬菜的安全生产提供理论指导。
1 材料与方法 1.1 供试材料供试材料为桂豇二号豇豆[Vigna unguiculata(Linn.)Walp]、16种PAHs混合标准液(由美国AccuStandard公司提供)、石英砂等。
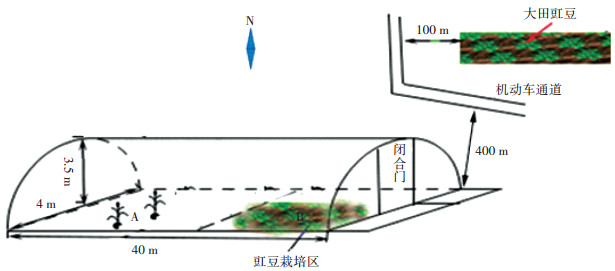
1.2 试验设计 1.2.1 栽培环境选取(1)塑料薄膜大棚(简称大棚)位于广西大学农学院基地内(22°85′ 49″ N,108°30′ 13″ E)。于2015—2017年期间用500 mL 600 μg·mL-1的16种PAHs混合标准液对棚内盆栽蔬菜及其土壤进行处理,PAHs累计用量为4.8 g。土壤采用混合的方式,蔬菜采用涂抹和喷雾的方式处理,同时严格控制外来气流的影响。2017年6月20日将直接用于PAHs处理的土壤和蔬菜枯枝败叶全部放置于图 1中A处(A与豇豆栽培点B相距约5 m),同时停止一切PAHs的添加处理试验,并揭开大棚上覆盖的薄膜。(2)露地大田(简称大田)位于广西大学基地内(22°85′64″N,108°29′99″ E)。大棚和大田附近无工业区,其与最近的住宅区距离均约为200 m,大棚距离机动车通道约为400 m,大田距离机动车通道约为100 m。栽培期平均气温约为30 ℃,雨水较充足,微风,偶有东南风3~4级。
|
图 1 栽培环境分布示意图 Figure 1 The sketch map of cultivation environment |
2017年6月20日将豇豆分别播种于大棚和大田内的泡沫箱(规格:50 cm×40 cm×30 cm),株距为15~20 cm。大棚和大田豇豆栽培的土壤和水源相同,其中土壤均来自大田,浇灌水均由广西绿城水务股份有限公司提供,其余栽培管理条件相同。于2017年8月4日采摘豇豆豆荚样品,将表面的尘土洗净并晾干表面水分后装入纸袋,存放于-20 ℃冰箱预冷,待干燥。
1.3 方法 1.3.1 PAHs提取、净化与检测将预冷后的豇豆样品经冷冻真空干燥至完全脱水变脆后研磨成粉末,采用四分法称取样品,最终每个样品组设3个重复。样品PAHs的提取与检测方法参照文献[15]。为了利于16种PAHs有效分离以及减少分析所用时间,本实验采用梯度洗脱方式,同时采用了外标法进行PAHs定量。
1.3.2 PAHs来源分析方法同分异构体比值法是识别PAHs来源的最简单和最常用的方法[17]。PAHs在迁移、传输过程中存在着分馏作用,而PAHs的同分异构体具有相似的分子结构和理化性质,在传输过程中不会发生分馏作用[18]。本研究选择ANT/(ANT + PHE)、FLT/(FLT + PYR)、BaA/(BaA+CHR)和IPY/(IPY+BPE)比值相结合的方法来判断豇豆体内PAHs的来源,其判断标准见表 2。
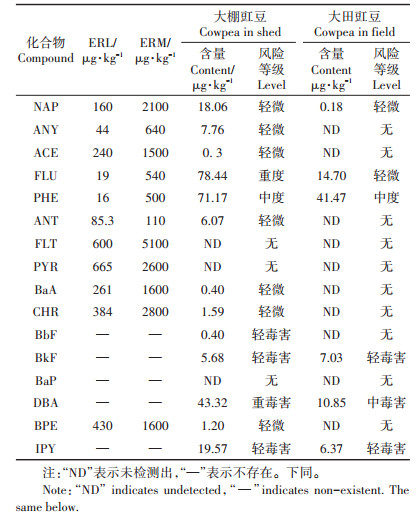
1.3.3 风险评估方法(1)效应区间低中值法:生态效应区间低中值法以生态效应低值(Effects range low,ERL)与生态效应中值(Effects range medium,ERM)作为标志水平进行评价[12, 19]。检测值为0,则不存在生态风险;检测值小于ERL,则污染物对生物毒害概率小于10%,极少产生负面生态影响(轻微);介于ERL与ERM之间,则污染物偶尔产生负面生态影响(中度);大于ERM,则污染物对生物毒害概率高于50%,经常产生负面生态影响(重度)。16种PAHs中的BbF、BkF、BaP、DBA和IPY不存在生态评价低值,规定只要检出就会对生物产生毒害作用[20]。
(2)TEQBaP法:BaP作为强化学致癌物质,常被视为PAHs类污染物的代表[19]。TEQBaP法是将污染物含量与毒性当量因子相乘,使16种PAHs转化为苯并(a)芘的等效毒性当量,其PAHs单体毒性当量越大,对生物的毒性越大[12]。计算公式如下:
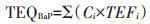
|
式中:Ci为污染物i的测定浓度;TEFi为污染物i的毒性当量因子(表 1)。
TEQBaP法以荷兰土壤标准目标参考值(33.0 μg· kg-1)进行评价。当TEQBaP < 33.0 μg·kg-1时,则不存在生态风险;TEQBaP≥33.0 μg·kg-1,则存在生态风险[12]。荷兰《土壤修复法案》规定修复后的土壤污染物(PAHs)含量必须低于修复限值标准(低于该标准值不对生态或人体产生毒害)[7]。1994年,荷兰引入污染土壤的人体健康风险评估和陆生生态风险评估方法,同时建立了目标值的标准值体系,此后该目标参考值被用作TEQBaP法的参考值[12, 21]。目前,TEQBaP法被广泛应用于土壤或淤泥中PAHs的生态风险判断,而蔬菜还田后属于土壤中的一部分,因而该方法可用于蔬菜还田后的生态风险评估。
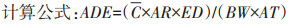
|
(1) |
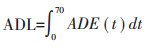
|
(2) |
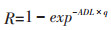
|
(3) |
式中:ADE(Average daily exposure)为日平均暴露量,μg·kg-1·d-1;C(Concentration)为PAHs的平均浓度,μg·kg-1;AR(Absorption rate)为吸收率;ED(Continuous exposure days)为持续暴露时间,0.5 h · d-1;BW(Balance weight)为平均体重,50 kg;AT(Average lifetime)为人群平均寿命,70 a。ADL(Average daily exposure for lifetime)为PAHs经食入路径的终生暴露量,μg·kg-1;R为人群健康风险度;q为化合物的致癌强度系数。
1.3.4 质量控制与数据分析方法质量保证与质量控制参照文献[10]。本方法通过空白加标(用等量的石英砂代替分析的样品,加入PAHs混合标样)和基质加标(PAHs混合标样加入实际空白样品)进行回收率测定分析,加标水平为1000 μg·kg-1,平行测定5次。空白试验中各目标化合物低于检出限;5次空白加标和基质加标16种PAHs的平均回收率为61.74%~100.00%和69.01%~149.26%。最后结果经过空白扣除。本实验设计进行的方法回收率试验为样品检测的准确性和可靠性提供了基本的保障。
数据处理与分析采用Excel 2013和SPSS 18.0。
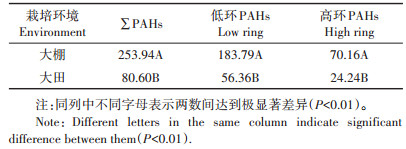
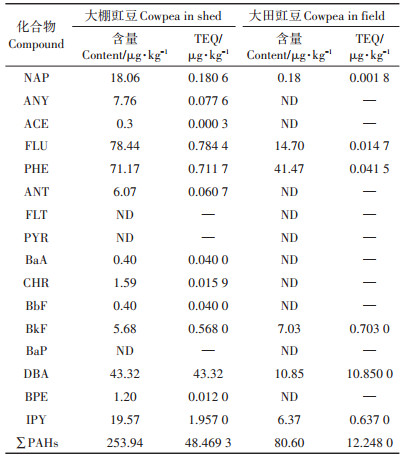
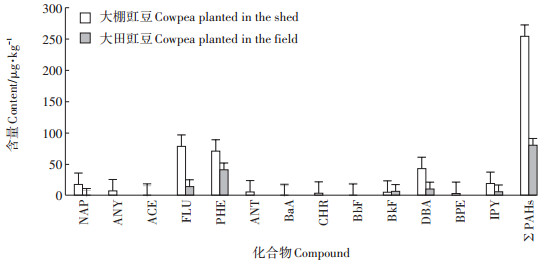
2 结果与分析 2.1 大棚与大田豇豆体内PAHs种类与含量本研究中,取3次重复试验结果均值再进行PAHs含量分布、来源和风险分析等相关计算。结果表明,16种PAHs各组分在50~5000 μg·L-1范围内线性关系良好,检出限范围为0.5~6.0 μg·kg-1。大棚豇豆体内检测到的PAHs种类和含量大于大田豇豆。大棚豇豆体内∑PAHs为253.94 μg·kg-1,大田豇豆体内∑ PAHs为80.60 μg · kg-1。大棚豇豆体内16种PAHs的含量范围为0~78.44 μg·kg-1,以2~4环的为主,其中3环占∑PAHs的64.47%;大田豇豆体内16种PAHs的含量范围为0~41.47 μg·kg-1,其中FLU和PHE占∑PAHs的69.69%。NAP、FLU和PHE无论在大棚豇豆体内还是在大田豇豆体内的含量都较高。大棚豇豆体内检测到的13种PAHs中,ANY、ACE、ANT、BaA、CHR、BbF和BPE的含量较低,而在大田豇豆体内未检测到。大田豇豆体内检测到的6种PAHs,除了BkF比大棚豇豆的略高外,其余的组分含量均低于大棚豇豆体内相应组分含量。
|
图 2 样品中PAHs种类与含量 Figure 2 Species and content distribution of PAHs in the samples |
为了便于统计分析,将2~4环归为低环,5~6环归为高环。分析结果表明(表 3),大棚豇豆体内∑PAHs含量高于大田豇豆体内的含量,且达到极显著差异;大棚和大田豇豆体内的PAHs都表现为低环的含量高于高环的含量;而低环和高环的PAHs含量都表现为大棚高于大田,且达到极显著差异(P < 0.01)。
|
|
表 3 栽培环境对不同类型PAHs吸收的影响(μg·kg-1) Table 3 Effects of cultivated environment on PAHs absorption in different type(μg·kg-1) |
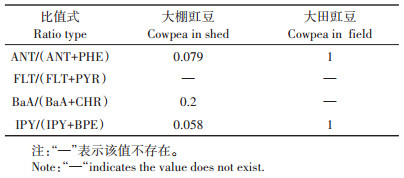
同分异构体比值公式中分母为0没有统计意义,因此比值式FLT/(FLT+PYR)不能用于大棚和大田豇豆PAHs来源的判断,比值式BaA/(BaA+CHR)不能用于大田豇豆PAHs来源的判断。根据该方法计算得出大棚豇豆PAHs来源为原油污染;大田豇豆PAHs来源为燃烧污染(表 4)。
|
|
表 4 豇豆体内PAHs的同分异构体比值 Table 4 Isomer ratio of PAHs in Vigna unguiculata(Linn.) Walp |
分析结果表明(表 5),大棚中豇豆体内存在NAP、ANY、ACE、ANT、BaA、CHR和BPE轻微污染风险,PHE的中度污染及FLU的重度污染风险,同时还受到BbF、BkF、DBA和IPY等PAHs的不同程度毒害作用。大田豇豆除了受NAP、FLU轻微污染,PHE中度污染和BkF、DBA、IPY较低的毒害作用外,未发现PAHs的重度污染现象。由于生态效应低中值法规定BbF、BkF、BaP、DBA和IPY只要检出就会构成潜在的毒害生态风险,但没有对其潜在风险予以分级,对评估结果影响较大。为此本研究建立了低中值法-TE-QBaP复合法对这5种物质进行毒害风险等级的划分,该复合法以5种单体的TEQBaP值比荷兰土壤标准目标参考值进行加权计算。结果得出大棚豇豆体内5种单体的相对生物毒害概率分别为0.12%、1.7%、0、131.27%、5.93%;大田豇豆分别为0、2.13%、0、32.88%、1.93%。因而大棚豇豆体内除了DBA存在重度毒害风险外,其余4种为轻微或无污染风险;大田豇豆体内除了DBA存在中度毒害及BkF、IPY存在轻微毒害外,其余2种不存在污染风险。可见,BkF、DBA和IPY不论在大棚豇豆还是大田豇豆体内都富集了一定的含量,且存在一定的生态风险。
|
|
表 5 PAHs生态效应低中值风险评估 Table 5 The result of low median risk assessment of PAHs ecological effects |
根据毒性当量计算公式得出(表 6),大棚豇豆体内TEQBaP为48.47 μg·kg-1>33.0 μg·kg-1(存在生态风险),大田豇豆体内的TEQBaP为12.25 μg·kg-1 < 33.0 μg·kg-1(不存在生态风险)。大棚和大田豇豆体内的DBA毒性当量分别为43.32 μg·kg-1和10.85 μg·kg-1,相应的TEQBaP毒性当量贡献率分别为89.38%和88.57%,可见DBA是豇豆体内PAHs污染最主要的风险物质。
|
|
表 6 16种PAHs的TEQBaP值 Table 6 The TEQBaP value of 16 PAHs |
根据美国环保署建立的介质中PAHs人群健康风险的计算模型(公式1~公式3),得出大棚豇豆健康风险度为2.07×10-6>1.0×10-6(美国环保署认为可接受的健康风险度);大田豇豆健康风险度为6.5×10-7 < 1.0×10-6。
3 讨论不同栽培环境植物体内PAHs的来源与生态风险因地因时而异。本研究对两种不同污染特征的栽培环境下豇豆体内PAHs的来源进行剖析,评估其潜在生态风险和健康风险。
3.1 豇豆体内PAHs来源分析环境中PAHs的来源可分为两大类:一是原油类(未经过燃烧),二是燃烧类。燃烧与非燃烧途径产生的PAHs组分不同。燃烧源不同产生的PAHs特征化合物含量不同。不同植物吸收PAHs的来源和途径有差异[23-24]。在开放的环境中,蔬菜体内PAHs来源很难通过周围PAHs的含量确定。因为蔬菜栽培土壤PAHs含量、雨水PAHs含量、大气PAHs含量、植物自身合成的PAHs量,及栽培期风向、光照长度和强度、气温和空气湿度等都会随时间的改变而改变,难以获得同一时刻测定值,且目前还没有研究方法能确定蔬菜分别从土壤、水体和大气中吸收PAHs的含量。而同分异构体比值法克服了上述的问题,通过蔬菜体内PAHs的特征化合物比值推知其体内PAHs的来源。通过同分异构体比值法能够确定豇豆体内PAHs的主要来源,但还有少量PAHs的来源不能通过该方法确定,这少部分PAHs来源的确定既耗时耗力,且产生的实际效果不大。已有的研究中通常仅用1~2种同分异构体比值式判断介质中PAHs的来源。本研究使用4种比值式对豇豆体内PAHs来源进行分析,结果均表明:大棚豇豆体内的PAHs主要来源于原油污染,大田豇豆体内的PAHs主要来源于燃烧污染。大棚豇豆栽培区除了2015—2017年期间人为使用的16种PAHs混合标准液处理棚内蔬菜和土壤外,豇豆栽培的土壤、水源等均未发现受到原油的污染。豇豆栽培期间风力较小,周边无工业污染区,PAHs从远处迁移的可能性很小(距离机动车通道400 m的大棚豇豆没有检测到燃烧源污染),因此得出大棚豇豆PAHs污染源为2015—2017年期间人为使用的16种PAHs混合标准液。大田豇豆栽培区附近100 m内有机动车通道,在栽培期有秸秆等农作物燃烧,而同分异构体比值也表明大田豇豆体内PAHs主要源于机动车燃油产生的尾气和生物质燃烧。机动车尾气中的PAHs可以随着扬尘进行短距离的迁移,一部分附着在豇豆的茎叶并通过气孔或者细胞间隙进入体内,一部分沉降到地面上被根系吸收[7]。PAHs进入植物体内可以通过主动吸收和被动吸收两种方式[24]。不同的吸收方式对其体内PAHs的来源有一定的影响。植物对PAHs的吸收与其正辛醇-水分配系数及植物自身的含脂肪量、含水量和蒸腾速率等有关[25-26]。因而不同种类的蔬菜其体内PAHs污染来源不同。
在16种优控的PAHs中,大田豇豆体内检测到6种,其余10种(ANY、ACE、ANT、FLT、PYR、BaA、CHR、BaP、BbF和BPE)未能检测到。在植物体内未能检测到的PAHs,是因为植物未吸收或未合成该物质,也可能是吸收或合成后立即分解,但是根据PAHs难降解的性质,吸收或合成后立即在植物体内分解不成立。由此得出ANY、ACE、ANT、FLT、PYR、BaA、CHR、BaP、BbF和BPE不是来源豇豆自身合成,只能通过外源吸收而来。ANY、ACE、ANT、BaA、CHR、BbF和BPE在大田豇豆中未检测到,但在大棚豇豆中可以检测到较低含量,可见,这7种PAHs进入豇豆体内较困难,需要有相应的载体或者外力的作用,一旦有载体或者外力的作用,则通道被打通,相应的PAHs才能快速进入体内。大棚豇豆体内NAP、FLU、PHE含量分别是大田豇豆体内的100、5倍和2倍,体现了不同污染环境豇豆对外源PAHs吸收的差异。豇豆体内的PAHs表现为以低环为主。低环的PAHs主要通过空气流动迁移至植物表面,当其浓度未达到饱和状态时通过主动运输进入豇豆体内,而当其浓度达到饱和后则通过被动运输进入豇豆体内[24]。豇豆生长期枝叶茂盛,与大气中PAHs接触面积大,且枝叶暴露于低环PAHs时间较长,有利于豇豆对低环PAHs的吸收。高环的PAHs,如BbF、BkF和IPY主要来源于根部吸收。植物吸收高环的PAHs一般受限于根系的发达程度,根系越发达,吸收的含量越高[11]。
3.2 豇豆体内PAHs生态风险与健康风险评估不同的生态风险评估方法,得到的结果有一定的差异。本文通过生态效应低中值法、TEQBaP法和中值法-TEQBaP复合法对不同栽培环境下的豇豆进行风险评估。结果表明,无论是单一PAHs的污染风险还是总的PAHs污染风险,大棚豇豆几乎都比大田豇豆高一个风险等级。说明在PAHs污染残留物附近(5 m以内)栽培蔬菜存在较高的风险;在距离机动车通道100 m以外,栽培期有1~2次的生物质燃烧源,一般未出现生态风险和健康风险。大棚豇豆与人为污染源的距离近,有利于PAHs的迁移与吸收进入体内。大棚豇豆体内检测到13种PAHs,部分PAHs存在一定的生态风险,其体内的DBA与荷兰土壤标准目标参考值相比,超标73.28%。大田豇豆体内仅检测到6种PAHs,且含量都较低。大田豇豆体内BkF、DBA、IPY的含量虽较低,但其毒性强,长期食用产生的毒性积累效应增加,其潜在风险不容忽视,因此应该警惕这些物质在豇豆体内的富集作用。对大棚和大田豇豆检测结果表明,DBA是最主要的风险物质,所以降低DBA的含量是降低豇豆风险的关键。生态效应低中值法和TEQBaP法的生态风险评估标准体系不同。前者侧重于PAHs单体的生态风险,能更好地分析单体的潜在生态风险,而TEQBaP法侧重于生物毒性表征PAHs总体的生态风险。两种评估方法的结合可以更好地说明介质中潜在的生态风险。根据生态效应低中值法、TEQBaP法和中值法-TEQBaP复合法的评估结果综合分析得出:大棚豇豆存在一定的生态风险,大田豇豆尚不存在PAHs的生态风险。
食入路径健康风险结果表明,大棚豇豆超过了可接受的健康风险度,大田豇豆则在可接受的范围内。对于同一栽培环境下的蔬菜,经过食入路径健康风险模型评估得到的风险结果不完全相同。因为不同的蔬菜体内酶种类和含量不同,其新陈代谢能力也不同。蔬菜蒸腾作用也会影响其体内的PAHs运输与迁移作用[27]。另外,不同的生长时期,蔬菜体内PAHs存储部位不同,PAHs的分解能力不同[26],这些都会影响到最终评估结果的准确性。另外,该模型的计算过程是在一种理想状态下进行的估算,其计算过程忽略了不同人体质差异、吸收和排泄能力差异和寿命长短的差别。不同的人食入量和喜好食入的部位不同,所以对于具体的个体,得到的健康风险值可能存在一定的差异。因而,某些蔬菜通过该方法评估认定为对群体有一定健康风险,但存在对个别人没有健康风险的可能。因此对于特殊个体,需重新调整评估方案,以便获得更符合实际的评判结果。
由不同栽培环境下豇豆体内PAHs来源与风险评估结果可知,选择无PAHs污染或者远离PAHs污染的区域栽培蔬菜可降低蔬菜体内PAHs对人体的危害风险。而对于已受到PAHs污染的蔬菜,应该采取通风、加强光照和冲洗的方式降低其体内PAHs的含量,必要时采用生物或化学的技术方法进行处理。
4 结论(1)不同污染源,豇豆体内特征化合物的种类和含量不同。大棚豇豆体内PAHs主要源于污染区残留的16种PAHs混合标准液,大田豇豆体内PAHs主要来源于机动车尾气和生物质燃烧。
(2)在受到PAHs直接污染的大棚内栽培蔬菜,即使栽培时为敞开模式,也会使蔬菜体内PAHs污染风险增加,因而不宜在其周边栽培供食用的蔬菜。
(3)PAHs的毒性因子越大其对人体及整个生态系统危害越大,因此应该严格控制DBA的摄入量。降低DBA的含量可有效降低豇豆的风险等级。
| [1] |
Qiao M, Wang C, Huang S, et al. Composition, sources, and potential toxicological significance of PAHs in the surface sediments of the Meiliang Bay, Taihu Lake, China[J]. Environment International, 2006, 32(1): 28-33. DOI:10.1016/j.envint.2005.04.005 |
| [2] |
Gerbeth A, Krausse S, Gemende B, et al. Search of microorganisms that degrade PAHs under alkaline conditions[J]. Engineering in Life Sciences, 2004, 4(4): 311-318. DOI:10.1002/(ISSN)1618-2863 |
| [3] |
Wilcke W, Amelung W, Martius C, et al. Biological sources of polycyclic aromatic hydrocarbons (PAHs) in the Amazonian rain forest[J]. Journal of Plant Nutrition and Soil Science, 2015, 163(1): 27-30. |
| [4] |
薛海全.典型农作物中多环芳烃和多氯联苯的分布、累积规律[D].济南: 山东大学, 2011. XUE Hai-quan. Accumulations and distributions of PAHs, PCBs in typical crops[D]. Jinan: Shandong University, 2011. http://cdmd.cnki.com.cn/article/cdmd-10422-1011222892.htm |
| [5] |
Vasilakos C H, Levi N, Maggos T, et al. Gas-particle concentration and characterization of sources of PAHs in the atmosphere of a suburban area in Athens, Greece[J]. Journal of Hazardous Materials, 2007, 140(1/2): 45-51. |
| [6] |
Thorsen W A, Cope W G, Shea D. Bioavailability of PAHs:Effects of soot carbon and PAH source[J]. Environmental Science & Technology, 2004, 38(7): 2029-2037. |
| [7] |
贺小敏, 李爱民, 吴昊, 等. 武汉市远城区农田土壤中多环芳烃的分布特征、来源和风险评价[J]. 环境化学, 2015, 34(11): 2139-2141. HE Xiao-min, LI Ai-min, WU Hao, et al. Study on distribution characteristic, source and risk assessment of OCPs, PAHs and PFCs in typical regions of Hubei, China[J]. Environmental Science, 2015, 34(11): 2139-2141. DOI:10.7524/j.issn.0254-6108.2015.11.2015041801 |
| [8] |
许晓伟, 黄岁樑. 地表水中多环芳烃迁移转化研究进展[J]. 环境科学与技术, 2011, 34(1): 26-33. XU Xiao-wei, HUANG Sui-liang. Transport-transformation of polycyclic aromatic hydrocarbons in surface waters[J]. Environmental Science & Technology, 2011, 34(1): 26-33. |
| [9] |
罗孝俊, 陈社军, 余梅, 等. 多环芳烃在珠江口表层水体中的分布与分配[J]. 环境科学, 2008, 29(9): 3-9. LUO Xiao-jun, CHEN She-jun, YU Mei, et al. Distribution and partition of polycyclic aromatic hydrocarbons in surface water from the Pearl River Estuary[J]. Environmental Science, 2008, 29(9): 3-9. |
| [10] |
龙明华, 龙彪, 梁勇生, 等. 南宁市蔬菜基地土壤多环芳烃含量及来源分析[J]. 中国蔬菜, 2017, 1(3): 52-57. LONG Ming-hua, LONG Biao, LIANG Yong-shng, et al. Contents and sources of polycyclic aromatic hydrocarbons in vegetable and soil of Nanning, China[J]. China Vegetables, 2017, 1(3): 52-57. |
| [11] |
高彦征, Collins C D.植物体内多环芳烃的传输作用[C]//第四届全国环境化学学术大会论文汇编, 2007: 664-665. GAO Yan -zheng, Collins C D. Transmission of polycyclic aromatic hydrocarbons in plants[C]//Compilation of Papers for the Fourth National Conference on Environmental Chemistry, 2007: 664-665. |
| [12] |
赵欧亚, 冯圣东, 石维, 等. 煤矿区农田土壤多环芳烃生态风险评估方法比较[J]. 安全与环境学报, 2015, 15(2): 352-358. ZHAO Ou-ya, FENG Sheng-dong, SHI Wei, et al. Comparison of ecological risk assessment methods for polycyclic aromatic hydrocarbons in farm soil of coal mining area[J]. Journal of Safety and Environment, 2015, 15(2): 352-358. |
| [13] |
施启文.石油化工区周边农作物对多环芳烃(PAHs)的累积及风险削减方法初探[D].武汉: 华中农业大学, 2011. SHI Qi-wen. Accumulation and brif exploration of risk reduction of polycyclic aromatic hydrocarbons (PAHs) in crop grown near petrochemical area[D]. Wuhan: Huazhong Agricultural University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10504-1011404794.htm |
| [14] |
张菊, 何振芳, 董杰, 等. 东平湖表层沉积物重金属的空间分布及污染评价[J]. 生态环境学报, 2016, 25(10): 1699-1706. ZHANG Ju, HE Zhen-fang, DONG Jie, et al. Spatial distribution and pollution assessment of heavy metals in the surface sediments of Dongping Lake[J]. Ecology and Environmental Sciences, 2016, 25(10): 1699-1706. |
| [15] |
龙明华, 巫桂芬, 梁勇生, 等. PAHs胁迫对菜心品质及其解毒系统的影响[J]. 南方农业学报, 2017, 48(6): 1036-1041. LONG Ming-hua, WU Gui-fen, LIANG Yong-sheng, et al. Influence of PAHs stress on Brassica Parachinensis bailey quality and its detoxification system[J]. Journal of Southern Agriculture, 2017, 48(6): 1036-1041. DOI:10.3969/j.issn.2095-1191.2017.06.16 |
| [16] |
U. S. EPA. Guidelines for exposure assessment[DB/OL].[2018-04-22]. https://www.epa.gov/sites/production/files/2014-11/documents/guidelines_exp_assessment.
|
| [17] |
Luo X J, Chen S J, Mai B X, et al. Distribution, source apportionment, and transport of PAHs in sediments from the Pearl River Delta and the Northern South China Sea[J]. Archives of Environmental Contamination & Toxicology, 2008, 55(1): 11-20. |
| [18] |
Long E R, Macdonal D D, Smith S L. Incidence of adverse biological effects within ranges of chemical concentrations in marine and estuarine sediments[J]. Environmental Management, 1995, 19(1): 81-97. DOI:10.1007/BF02472006 |
| [19] |
何隽杰, 陆光华, 丁剑楠, 等. 太湖北部表层沉积物中多环芳烃和多溴联苯醚及多氯联苯的分布和来源及生态风险评价[J]. 环境与健康杂志, 2013, 30(8): 699-702. HE Jun-jie, LU Guang -hua, DING Jian-nan, et al. Distribution, sources and risk assessment of PAHs, PBDEs and PCBs in surface sediments from northern Taihu Lake[J]. Journal of Environment & Health, 2013, 30(8): 699-702. |
| [20] |
Van Leeuwen C J, Bro-Rasmussen F, Feijtel T C, et al. Risk assessment and management of new and existing chemicals[J]. Environmental Toxicology and Pharmacology, 1996, 2(4): 243-299. DOI:10.1016/S1382-6689(96)00072-5 |
| [21] |
Verdonck F A, Janssen C R, Jaworska J, et al. Geo-referencing of probabilistic risk of new chemicals in rivers[J]. Water Science and Technology, 2003, 48(3): 39-46. DOI:10.2166/wst.2003.0156 |
| [22] |
董继元, 刘兴荣, 张本忠, 等. 大连市人群对多环芳烃的暴露及健康风险评价[J]. 安全与环境学报, 2015, 15(5): 330-334. DONG Ji-yuan, LIU Xing-rong, ZHANG Ben-zhong, et al. Polycyclic aromatic hydrocarbons exposure and health risk assessment for the population of Dalian[J]. Journal of Safety and Environment, 2015, 15(5): 330-334. |
| [23] |
王喆, 卢丽. 南宁市清水泉地下河水中多环芳烃分布特征[J]. 环境科学与技术, 2016, 39(4): 132-136. WANG Zhe, LU Li. Distribution characteristics of polycyclic aromatic hydrocarbons in water from Qingshuiquan underground river in Nanning[J]. Environmental Science & Technology, 2016, 39(4): 132-136. |
| [24] |
李云桂.典型有机污染物在植物角质层上的吸附行为与跨膜过程[D].杭州: 浙江大学, 2011. LI Yun-gui. Sorption behavior and penetration process of typical organic pollutants onto plant cuticles[D]. Hangzhou: Zhejiang University, 2011. http://cdmd.cnki.com.cn/Article/CDMD-10335-1013340091.htm |
| [25] |
孔祥胜, 苗迎. 南宁市郊空气和大气干湿沉降物中多环芳烃的污染特征[J]. 环境污染与防治, 2014, 36(8): 34-42. KONG Xiang-sheng, MIAO Ying. Pollution characteristic of PAHs in the atmospheric deposition and air of Nanning Suburb[J]. Environmental Pollution and Control, 2014, 36(8): 34-42. DOI:10.3969/j.issn.1001-3865.2014.08.006 |
| [26] |
Feilberg A, Nielsen T. Photodegradation of nitro-PAHs in viscous organic media used as models of organic aerosols[J]. Environmental Science & Technology, 2015, 35(1): 108-113. |
| [27] |
Esen F, Tasdemir Y, Vardar N. Atmospheric concentrations of PAHs, their possible sources and gas-to-particle partitioning at a residential site of Bursa, Turkey[J]. Atmospheric Research, 2008, 88(3): 243-255. |
 2018, Vol. 37
2018, Vol. 37