近年来,由于工业含镉(Cd)“三废”的大量排放以及污水灌溉等造成了大面积农田土壤不同程度的Cd污染[1-2]。据2014年《全国土壤污染状况调查公报》显示,Cd的污染点位超标率达7.0%,居无机污染物的榜首[3]。而2016年5月颁布的《土壤污染防治行动计划》要求:到2020年,我国污染地块安全利用率达到90%以上。因此对Cd污染区土壤的安全利用及生态修复已迫在眉睫。
目前,国内外众多学者围绕超富集植物的筛选及其对重金属的富集、转运等进行了大量的研究和探索[4-6]。现已发现的Cd超富集植物有遏蓝菜(Thlaspi caerulescens L.)[7]、龙葵(Solanum nigrum L.)[8]、印度芥菜(Brassica juncea L.)[9]、东南景天(Sedum alfredii H.)[10]等。龙葵地上部分Cd含量可达387 mg·kg-1[8];东南景天主要是Zn超富集植物,然而Cd、Zn的化学性质相似,因此也可吸收较高含量Cd[10]。尽管这些超富集植物可以吸收大量的Cd,可是由于生长缓慢,植株矮小,很难应用于污染土壤的工程修复。印度芥菜虽然生物量较大且地上部分Cd含量可达376 mg·kg-1[9],但其对气候较为敏感,具有很强的地域性[11],在我国难以大面积种植。我国芥菜品种资源丰富,生物量大、生长期短、适应性强,而且印度芥菜是芥菜的近缘植物。因此从我国现有的芥菜资源中筛选出耐性强、吸收率高的品种,对我国Cd污染土壤的植物修复具有重要现实意义。
物种敏感性分布(SSD)是基于一系列物种或相同物种的不同品种间对某一种污染物敏感性差异提出来的一种生态风险评价方法,可用于在一定的污染条件下,计算保护大多数生物物种安全的污染物浓度值。该方法假设不同物种或相同生物不同种类的毒性数据能被某概率分布函数所拟合,计算出重金属对受试物种所产生的胁迫程度,以确定风险最大的物种类别,并体现出物种的敏感性差异[12-13]。目前关于Cd胁迫下植物敏感性分布差异报道较少。因此,研究Cd胁迫对不同品种芥菜的敏感性分布,筛选出具有修复Cd污染土壤潜力的芥菜品种,具有重要的理论和实际价值。
本文以国内市场最为常见的21个芥菜品种为研究对象,对其在Cd胁迫下的剂量-效应关系进行拟合,在此基础上,计算不同品种芥菜对Cd的敏感性分布,并对筛选出的两个代表性芥菜品种体内抗氧化酶活性和Cd含量进行测定分析,以期科学地筛选出对Cd耐性强且吸收率较高的芥菜品种,并了解其抗氧化机制,为土壤Cd污染区植物修复提供理论与技术支撑。
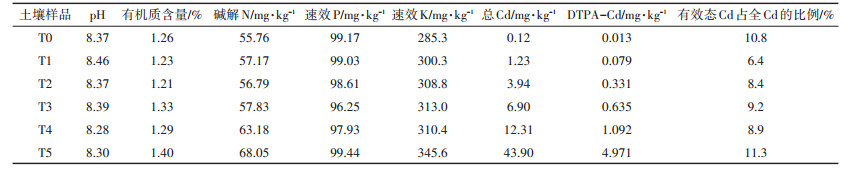
1 材料与方法 1.1 试验材料供试土壤采集于陕西省凤县某铅锌冶炼厂(33° 56′ N,106°32′ E)附近农田的0~20 cm耕层褐土,将采集的土壤自然风干后,去除石砾、残渣等杂物,过2 mm尼龙筛备用。为便于描述,按土壤Cd含量高低,分别将获得的土壤样品记作T0、T1、T2、T3、T4和T5。研究中,同时取少量土壤过0.15 mm和0.25 mm筛,用于土壤常规分析及Cd含量测定,测定方法见《土壤农化分析》[14],其理化性质见表 1。T0为无污染,T1~T5这5种土壤中Cd含量均超过《土壤环境质量标准》的限制,其中T1为轻度污染,T2为中度污染,T3、T4、T5为重度污染。
|
|
表 1 土壤基本理化性质 Table 1 Basic physicochemical properties of the tested soils |
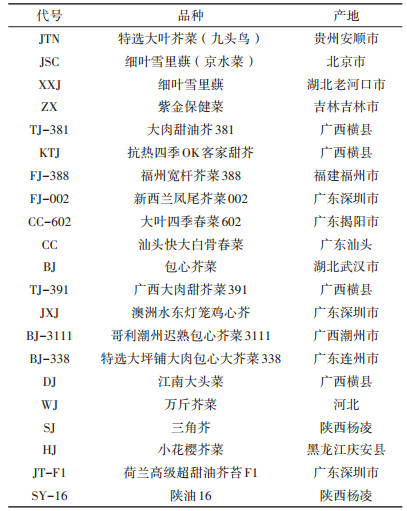
供试芥菜购自国内多个蔬菜种子公司(表 2),品种发芽率≥90%,纯度≥95%。
|
|
表 2 供试芥菜代号、品种及其产地 Table 2 The code, name and origin of test materials |
本试验于2017年5—7月在西北农林科技大学资源环境学院旱棚内进行。为保证各处理间养分含量相同且满足植物生长需要,对T0~T5的6种土壤施入尿素、磷酸氢钙和氯化钾,使各处理养分在同一水平(N 100 mg·kg-1、P 120 mg·kg-1、K 350 mg·kg-1)。取3 kg(以干质量计)事先处理好的土壤装入塑料花盆中(高25 cm、直径20 cm)。将上述芥菜品种种子用10% H2O2消毒15 min,然后用去离子水冲洗干净后,挑选籽粒饱满的芥菜种子播种,每盆播种20粒,待植株生长至3片真叶时,间苗至6株,种植期间将土壤含水量保持在田间持水量的70%,及时去除虫害和杂草。每个品种每个处理均重复3次。种植50 d后,选取3株植物,各选部位、长势、叶龄一致的有代表性的叶子,剪碎混匀测定分析抗氧化酶活性,最后每盆定苗3株,在种植第60 d收获。收获时先用自来水将完整的芥菜植株冲洗干净,再用EDTA-2Na浸泡植株根系30 min,以去除根系表面的可交换态Cd,最后经去离子水完全冲洗后用吸水纸擦干,并将芥菜分为根和地上部分装入信封。
1.3 指标测定用105 ℃烘干称重法进行芥菜生物量测定。芥菜植株的丙二醛(MTA)含量测定采用硫代巴比妥酸法,超氧化物歧化酶(SOD)活性测定采用氮蓝四唑法,过氧化氢酶(CAT)活性测定采用比色法,过氧化物酶(POD)活性测定采用愈创木酚法[15]。参照《土壤农化分析》将芥菜植株用HNO3-H2O2微波消解后,利用石墨炉原子吸收分光光度计(Hitachi Z-3000,日本)进行Cd含量测定。同时以国家标准物质(GSB 04-1721—2004,GBW 08502)进行分析质量控制,所有植物样品的Cd回收率均大于95%。按照下列公式计算芥菜植株中Cd的富集系数(BCF)和转运系数(TF)。
富集系数(BCF)=植株地上部Cd含量或根部Cd含量/土壤Cd含量
转运系数(TF)=植株地上部Cd含量/植株根部Cd含量
净化率=植株Cd积累量/土壤有效Cd总量×100%
1.4 数据处理及分析 1.4.1 剂量-效应曲线拟合采用逻辑斯蒂克分布模型(Log-logistic distribution)对不同品种芥菜Cd胁迫的剂量-效应曲线进行拟合,已有研究表明此模型能较好地拟合重金属及抗生素等对植物的剂量-效应关系[16]:

|
式中:y为各Cd处理水平芥菜干质量与T0处理的芥菜干质量的比值,%;y0、b为拟合参数;x为不同处理中Cd的浓度值,mg·kg-1;M为EC50的自然对数值。
当低浓度Cd对芥菜产生刺激效应时,采用低剂量效应拟合方程(Hormesis dose-effect)进行剂量-效应曲线拟合[17],方程如下:
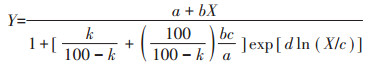
|
式中:Y是芥菜相对生物量,%;X是土壤中Cd的浓度,mg·kg-1;a、b、c、d是方程参数。k是与有效抑制浓度相关的变量,其范围为0~100,当k为50时,参数c定义为EC50。
1.4.2 芥菜对Cd胁迫的物种敏感性分布(SSD)在剂量-效应测定基础上,对不同品种芥菜Cd的半抑制毒性阈值浓度(EC50)进行对数变换后,利用概率函数模型(Burr-Ⅲ)进行不同品种芥菜Cd胁迫的物种敏感性分布曲线拟合[12]:
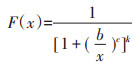
|
式中:x为土壤中Cd的浓度,mg·kg-1;b、c、k为函数的3个参数。该方法利用澳大利亚联邦科学和工业研究组织提供的计算软件Burrlioz来完成。
1.4.3 数据处理采用Excel 2016进行数据处理,Origin 2016软件进行绘图,应用SPSS 23.0统计分析软件对数据进行单因素方差分析和P < 0.05水平下的Duncan检验。
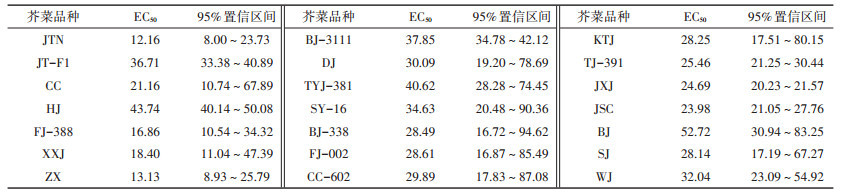
2 结果与讨论 2.1 不同品种芥菜对Cd胁迫的剂量-效应关系剂量-效应关系是指作用于个体或群体的外源化学物质的剂量与其引起的生物效应强度之间的相互关系。如图 1所示,在低浓度Cd(T1,1.23 mg·kg-1)时,除了JTN、JT-F1、CC、FJ-388以外,其余17种芥菜生长均表现出一定的毒性刺激(Hormesis)效应,与T0相比,生物量增加了2.0%~30.5%,并且植株叶子翠绿、茎秆粗壮。随着土壤中Cd浓度的升高,芥菜相对生物量均降低。当土壤Cd含量达到最大(T5,43.90 mg·kg-1)时,Cd对芥菜的生长抑制最为明显。姚诗音等[18]研究发现1 mg·kg-1 Cd处理可以促进青葙(Celosia argentea L.)的生长,其生物量较对照组显著增加且达到最大值。Sidhu等[19]也发现低浓度Cd处理能增加臭荠(Coronopus didymus L.)的生物量和根长。这可能是由于植物在低浓度Cd胁迫下应激产生保护作用,通过加速生理生化活动,产生大量的代谢产物,提高了植物体内的抗氧化酶活性,从而促进植物生长。通过剂量-效应关系曲线,计算出21种芥菜Cd的EC50及其95%置信区间(表 3)。由表 3可知,Cd对上述21种芥菜的EC50变化范围为12.16~52.72 mg·kg-1,相差3.34倍。JTN的EC50值为12.16 mg·kg-1,而BJ的EC50值为52.72 mg·kg-1。
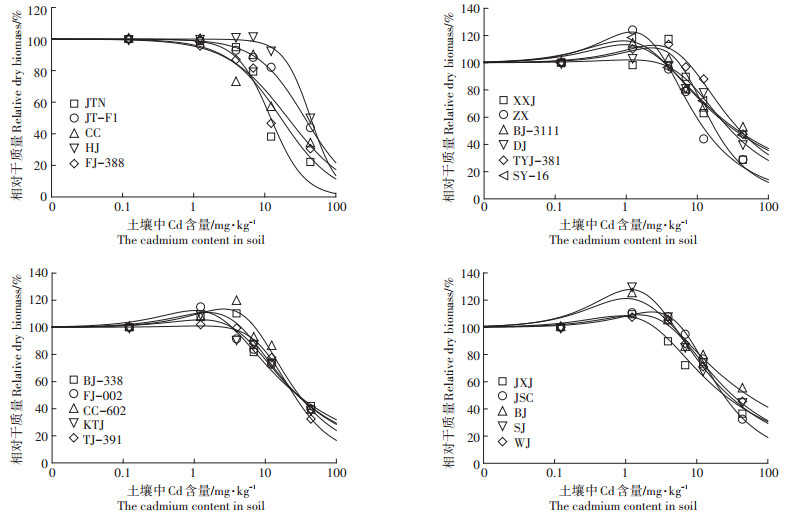
|
图 1 不同品种芥菜对Cd胁迫的剂量-效应关系曲线 Figure 1 Dose-effect curves of different mustard cultivars under Cd stress |
|
|
表 3 基于生物量的芥菜Cd半抑制毒性阈值浓度(EC50)及95%置信区间(mg·kg-1) Table 3 Toxicity thresholds of Cd to mustard cultivars based on biomass response and their 95% confidence intervals (mg·kg-1) |
物种敏感性分布(SSD)法摒弃了以往单一物种、单一污染物的评价模式,评价结果较准确,已有研究证明实验室与野外围隔试验所获得的毒理数据没有明显差异[20]。针对SSD曲线的构建,不同学者提出了不同的参数拟合方法。王小庆等[21]通过使用Burr-Ⅲ、Log-normal、Log-logistic、Weibull及Gamma 5种常用函数分别拟合酸性、中性、碱性及石灰性土壤中不同物种对铜胁迫的SSD曲线,发现Burr-Ⅲ拟合效果稳定且精确度较高。刘亚莉等[22]利用不同分布函数拟合敌敌畏对水生生物的SSD曲线时,同样发现Burr-Ⅲ拟合效果最好。
本实验对上述不同品种芥菜EC50进行对数变化后,利用Burr-Ⅲ概率函数模型对不同品种芥菜Cd胁迫的SSD曲线进行拟合(图 2)。不同品种芥菜对Cd胁迫的敏感性分布顺序为BJ>HJ>TJ-381>BJ-3111> JT - F1>SY - 16>WJ>DJ>CC - 602>FJ-002>BJ - 338> KTJ>SJ>TJ - 391>JXJ>JSC>CC>XXJ>FJ - 388>ZX>JTN,表明21种芥菜对Cd胁迫的敏感性分布具有明显差异。其中JTN对于Cd胁迫最敏感,而BJ表现出最强的耐性。Ding等[23]研究发现,SSD曲线能很好地描述12种根茎类蔬菜对铅的敏感性,并发现马铃薯在铅污染的红壤及潮土中耐性最强。雷丽萍等[24]同样利用SSD法在16种南方主栽烟草中,筛选出了适宜植烟区Cd污染种植的耐性烟草品种。
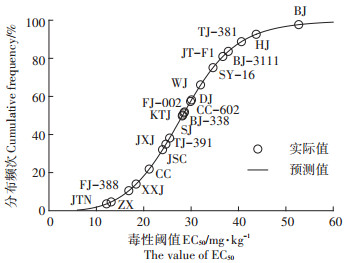
|
图 2 不同品种芥菜基于EC50的物种敏感性分布曲线 Figure 2 Cumulative frequencies of species sensitivity distributions(SSD)of the different mustard cultivars based on EC50 |
为了深入探讨不同敏感性品种在Cd胁迫下的抗氧化系统响应机制,本试验选取JTN、BJ这两种对Cd敏感性具有显著差异的芥菜品种,对其体内MDA含量和抗氧化酶活性进行测定。
通常情况下,植物细胞内活性氧(ROS)的产生与清除处于动态平衡,但当植物受到外界Cd胁迫时,这一平衡受到破坏,过量ROS会导致植物细胞膜系的功能和结构遭到破坏。MDA是膜脂过氧化的重要产物,其含量的高低是判断植物细胞膜受害程度、抵抗不良环境强弱的一个重要指标[25]。试验结果表明(图 3A),土壤中Cd含量较低时(T1),耐性品种BJ体内MDA含量较T0减少了38.3%,这可能与BJ在低浓度Cd胁迫下,表现出的毒性刺激效应有关。随着Cd含量的升高,两种芥菜MDA含量都显著升高(P < 0.05),但BJ的MDA含量显著低于JTN,表明Cd深刻影响着芥菜体内膜脂过氧化作用,且Cd对敏感性品种的影响要强于对耐性品种的影响。BJ和JTN体内MDA含量在T5时达到峰值,分别比T0增加了86.1%、407.0%,这与邵国胜等[26]和李冬琴等[27]研究结果一致。表明高浓度的Cd加剧芥菜体内膜脂过氧化,促进MDA积累,而且Cd胁迫对不同基因型芥菜体内MDA含量的影响存在显著差异,以敏感性品种受影响最大。
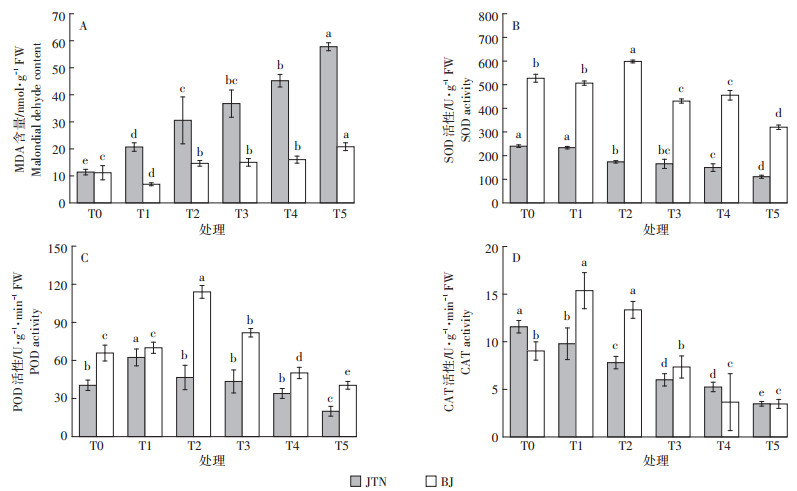
|
不同小写字母表示同一品种各处理水平间差异显著(P < 0.05,n=3) Different lowercase indicate significant differences in the same mustard cultivar among different treatments (P < 0.05, n=3) 图 3 Cd胁迫对两种芥菜MDA含量和抗氧化酶活性的影响 Figure 3 Effect of Cd stress on malondialdehyde content and antioxidant enzyme activities of two mustard cultivars |
植物体内的SOD、CAT和POD等抗氧化酶组成了一个有效的活性氧清除系统,能够有效清除活性氧自由基,减缓细胞膜系统的伤害,使植物适应逆境环境。SOD可将O2-分解为H2O2和O2,是清除活性氧的第一道防线。如图 3B所示,低浓度Cd胁迫下(T1),BJ体内SOD活性与T0相比差异不显著(P>0.05),随着Cd含量增加到T2时,SOD活性显著升高,达到峰值,随后表现出下降趋势,虽然T4较T3略有增高,但差异不显著(P>0.05)。BJ的SOD显著高于JTN,表明耐性品种由于自身的保护能力,具有较高的SOD活性,从而降低了体内活性氧自由基对细胞膜膜脂过氧化作用的伤害。这也佐证了前述的BJ体内MDA含量较JTN低这一结论。JTN体内SOD活性随着Cd浓度的增加显著下降(P < 0.05),在T5时最为严重,较T0低53.9%,表明Cd胁迫对敏感型品种已造成严重伤害,其自身对Cd胁迫的缓解作用有限。
POD和CAT在植物呼吸代谢和植物逆境胁迫中起着重要作用,可以将植物体内H2O2进行氧化分解,减缓自由基对植物的伤害[28]。在Cd胁迫下,两种芥菜POD活性均随Cd浓度增加呈先增后减的趋势(图 3C)。JTN与BJ分别在T1、T2下达到峰值,分别是T0的1.5、1.7倍。两种芥菜CAT活性呈不同的变化趋势(图 3D),BJ体内CAT活性表现出先增后降的趋势,在T1时达到峰值,相比T0增加了70.1%;JTN则表现下降的趋势,T5比T0下降了69.9%。史静等[29]对Cd胁迫下不同水稻品种抗氧化酶研究也得出类似的结论。据此可以认为,耐性品种体内较高的抗氧化酶,有效抵抗了Cd胁迫造成的过氧化胁迫,从而减轻了活性氧对细胞膜的伤害,减缓了膜脂过氧化反应。但植物耐受Cd的机制除抗氧化酶系统作用外,还受多种生理变化和遗传因子调控,所以还应对其进行进一步研究。
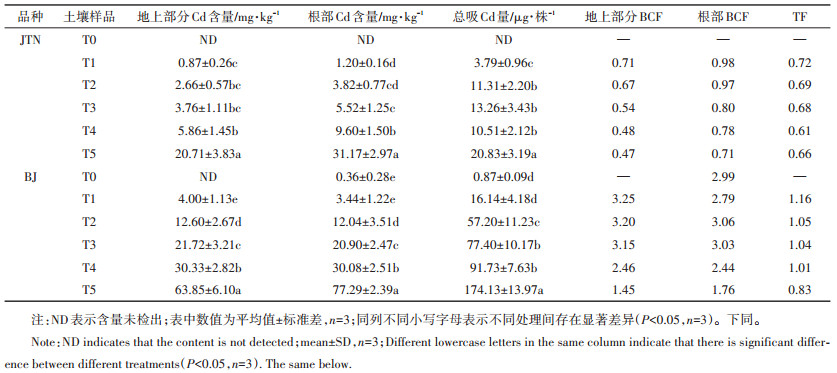
2.4 不同品种芥菜对Cd的吸收积累特征植物体内的Cd含量是筛选植物修复资源的重要指标之一。由表 4可知,在T0条件下,仅BJ的根部检测到Cd,其含量仅为0.36 mg·kg-1。随着土壤中Cd浓度的升高,两种芥菜根部和地上部Cd含量均显著升高,且耐性品种BJ地上部和根部均显著高于敏感性品种JTN。特别是在T5条件下,BJ地上部和根部Cd含量分别达到68.85 mg·kg-1和77.29 mg·kg-1,是JTN的3.1倍和2.5倍。这表明耐性品种BJ具有良好的Cd吸收能力。Liu等[30]对在Cd胁迫下的40种白菜进行研究发现,耐性白菜品种对Cd的吸收能力较弱,可以作为低积累安全品种种植。本研究结果与之不一致,这可能是由于植物对Cd吸收及耐受能力与植物品种的基因型有很大关系[31-32],即便是耐性植物对重金属的吸收积累能力也不同[33-34]。
|
|
表 4 Cd胁迫下两种芥菜的Cd含量、转运系数(TF)和富集系数(BCF)(均以干质量计算) Table 4 Cd content, bioconcentration factor and translocation factor of two mustard cultivars under Cd stress (calculated by dry weight) |
富集系数(BCF)和转运系数(TF)分别反映了植物各部位对土壤中重金属的富集能力和重金属从根部向地上部分的迁移能力。通过表 4分析可知,随着土壤Cd含量的增加,两种芥菜BCF基本呈下降趋势,但耐性品种BJ的BCF始终大于1,且明显大于敏感性品种,说明耐性品种BJ对Cd的富集能力较强。BJ地上部分和根部的BCF分别在T1、T2处理达到最大3.25和3.06,但其与Cd超富集植物龙葵[8]、印度芥菜[35]相比较小,这是因为本试验中采用的是自然污染土壤,其Cd有效态含量较低,仅为Cd全量的10%左右。敏感性品种JTN的TF在T1~T5处理下均小于1,这可能是由于敏感型品种根部对Cd的固定和区隔化,使得只有少部分Cd能通过木质部导管运输至地上部,从而减缓Cd对植物地上部分的胁迫。而耐性品种仅在最高Cd浓度(T5)下TF才小于1,这可能是因为高浓度胁迫已经超出了植物耐受能力,导致植物转运Cd的能力下降。但我国90%以上的Cd污染土壤为中轻度污染(Cd≤1.5 mg·kg-1)[3],BJ的耐受能力可以符合土壤修复需要。
Cd积累量反映了植物吸收储存Cd的能力,其大小与植株生物量和植株Cd含量有直接的关系。本试验中,在高浓度Cd处理下(T5),BJ的地上部Cd积累量达156.03 μg·株-1(表 5),已经超过Cd超富集植物龙葵(142 μg·株-1)[8]。净化率可作为重金属污染土壤植物修复效率的综合指标[35]。从表 5两种芥菜生长60 d后的盆栽试验土壤净化率可以看出,BJ地上部分及总净化率在T3时达到最大值,分别为11.0%和12.2%,高于苏德纯等[35]对印度芥菜、范洪黎等[36]对苋菜及唐皓等[37]对高积累水稻的相关研究。虽然本文筛选的耐性芥菜BJ并未达到Cd超富集植物的标准,但其生长周期短,具有较大生物量,自身对Cd具有较高耐性、积累量和净化率,说明耐性植物BJ在修复Cd污染土壤中具有一定的应用潜力。
|
|
表 5 Cd胁迫下两种芥菜对Cd的积累量及对污染土壤的净化能力(均以干质量计算) Table 5 Cd accumulation and purification rate by two mustard cultivars under Cd stress (calculated by dry weight) |
(1)21个芥菜品种对Cd胁迫的敏感性分布具有显著性差异,其中JNT对Cd胁迫最为敏感,BJ则表现出最强耐性。
(2)Cd处理下,BJ与JTN受到了氧化胁迫,耐性品种BJ体内抗氧化酶(SOD、CAT、POD)的协同作用高于敏感性品种JTN,从而减缓了Cd胁迫下活性自由基对其生物膜的伤害。
(3)随土壤Cd浓度的增大,不同品种芥菜根部和地上部Cd含量均呈增加趋势,耐性品种BJ富集系数大于1,地上积累量最大可达156.03 μg·株-1,Cd净化率最大为11.0%,说明耐性品种BJ对Cd有较好的吸收净化能力,用于修复Cd污染土壤具有一定潜力。
| [1] |
Wei B, Yang L. A review of heavy metal contaminations in urban soils, urban road dusts and agricultural soils from China[J]. Microchemical Journal, 2010, 94(2): 99-107. DOI:10.1016/j.microc.2009.09.014 |
| [2] |
李荣华, 冯静, 李晓龙, 等. 陕西某关闭冶炼厂土壤重金属污染评价与工程修复[J]. 农业机械学报, 2015, 46(10): 223-228. LI Rong-hua, FENG Jing, LI Xiao-long, et al. Heavy metals polluted soil environment assessment and engineering remediation practice in closed smelter in Shaanxi Province[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(10): 223-228. DOI:10.6041/j.issn.1000-1298.2015.10.029 |
| [3] |
中华人民共和国环境保护部, 中华人民共和国国土资源部.全国土壤污染状况调查公报[R].北京: 中华人民共和国环境保护部, 中华人民共和国国土资源部, 2014: 1-5. Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC. Report on the national general survey of soil contamination[R]. Beijing: Ministry of Environmental Protection of PRC, Ministry of Land and Resources of PRC, 2014: 1-5. |
| [4] |
周东美, 郝秀珍, 薛艳, 等. 污染土壤的修复技术研究进展[J]. 生态环境, 2004, 13(2): 234-242. ZHOU Dong-mei, HAO Xiu-zhen, XUE Yan, et al. Advances in remediation technologies of contaminated soils[J]. Ecology and Environment, 2004, 13(2): 234-242. DOI:10.3969/j.issn.1674-5906.2004.02.028 |
| [5] |
Gramlich A, Tandy S, Gauggel C, et al. Soil cadmium uptake by cocoa in Honduras[J]. Science of the Total Environment, 2018, 612: 370-378. DOI:10.1016/j.scitotenv.2017.08.145 |
| [6] |
Leung H M, Wu F Y, Cheung K C, et al. Synergistic effects of arbuscular mycorrhizal fungi and phosphate rock on heavy metal uptake and accumulation by an arsenic hyperaccumulator[J]. Journal of Hazardous Materials, 2010, 181(1/2/3): 497-507. |
| [7] |
Liu M, Yanai J, Jiang R, et al. Does cadmium play a physiological role in the hyperaccumulator Thlaspi caerulescens?[J]. Chemosphere, 2008, 71(7): 1276-1283. DOI:10.1016/j.chemosphere.2007.11.063 |
| [8] |
Sun Y, Zhou Q, Diao C. Effects of cadmium and arsenic on growth and metal accumulation of Cd-hyperaccumulator Solanum nigrum L.[J]. Bioresource Technology, 2008, 99(5): 1103-1110. DOI:10.1016/j.biortech.2007.02.035 |
| [9] |
Salt D E, Prince R C, Pickering I J, et al. Mechanisms of cadmium mobility and accumulation in Indian mustard[J]. Plant Physiology, 1995, 109(4): 1427-1433. DOI:10.1104/pp.109.4.1427 |
| [10] |
Tang L, Yao A, Yuan M, et al. Transcriptional up-regulation of genes involved in photosynthesis of the Zn/Cd hyperaccumulator Sedum alfredii in response to zinc and cadmium[J]. Chemosphere, 2016, 164: 190-200. DOI:10.1016/j.chemosphere.2016.08.026 |
| [11] |
Boomiraj K, Chakrabarti B, Aggarwal P K, et al. Assessing the vulnerability of Indian mustard to climate change[J]. Agriculture, Ecosystems & Environment, 2010, 138(3/4): 265-273. |
| [12] |
Xu F, Li Y, Wang Y, et al. Key issues for the development and application of the species sensitivity distribution (SSD) model for ecological risk assessment[J]. Ecological Indicators, 2015, 54(3): 227-237. |
| [13] |
Kwak J I, Moon J, Kim D, et al. Determination of the soil hazardous concentrations of bisphenol A using the species sensitivity approach[J]. Journal of Hazardous Materials, 2018, 344: 390-397. DOI:10.1016/j.jhazmat.2017.10.048 |
| [14] |
鲍士旦. 土壤农化分析[M]. 三版. 北京: 中国农业出版社, 2000. BAO Shi-dan. Soil and agricultural chemistry analysis[M]. 3rd Edition. Beijing: China Agriculture Press, 2000. |
| [15] |
高俊凤. 植物生理学实验指导[M]. 北京: 高等教育出版社, 2006. GAO Jun-feng. Experimental guidance for plant physiology[M]. Beijing: Higher Education Press, 2006. |
| [16] |
Haanstra L, Doelman P, Voshaar J. The use of sigmoidal dose response curves in soil ecotoxicological research[J]. Plant and Soil, 1985, 84(2): 293-297. DOI:10.1007/BF02143194 |
| [17] |
Schabenberger O, Tharp B E, Kells J J, et al. Statistical tests for hormesis and effective dosages in herbicide dose response[J]. Agronomy Journal, 1999, 91(4): 713-721. DOI:10.2134/agronj1999.914713x |
| [18] |
姚诗音, 刘杰, 王怡璇, 等. 青葙对镉的超富集特征及累积动态研究[J]. 农业环境科学学报, 2017, 36(8): 1470-1476. YAO Shi-yin, LIU Jie, WANG Yi-xuan, et al. Cd hyperaccumulation and accumulative kinetics of Celosia argentea Linn. for phytoremediation of Cd-contaminated soil[J]. Journal of Agro-Environment Science, 2017, 36(8): 1470-1476. |
| [19] |
Sidhu G P S, Singh H P, Batish D R, et al. Tolerance and hyperaccumulation of cadmium by a wild, unpalatable herb Coronopus didymus (L.) Sm. (Brassicaceae)[J]. Ecotoxicology and Environmental Safety, 2017, 135: 209-215. DOI:10.1016/j.ecoenv.2016.10.001 |
| [20] |
Hose G C, Van den Brink P J. Confirming the species-sensitivity distribution concept for endosulfan using laboratory, mesocosm, and field data[J]. Archives of Environmental Contamination and Toxicology, 2004, 47(4): 511-520. DOI:10.1007/s00244-003-3212-5 |
| [21] |
王小庆, 韦东普, 黄占斌, 等. 物种敏感性分布法在土壤中铜生态阈值建立中的应用研究[J]. 环境科学学报, 2013, 33(6): 1787-1794. WANG Xiao-qing, WEI Dong-pu, HUANG Zhan-bin, et al. Application of species sensitivity distribution in deriving of ecological thresholds for copper in soils[J]. Acta Scientiae Circumstantiae, 2013, 33(6): 1787-1794. |
| [22] |
刘亚莉, 谢玉为, 张效伟, 等. 应用物种敏感性分布评价敌敌畏对淡水生物的生态风险[J]. 生态毒理学报, 2016, 11(2): 531-538. LIU Ya-li, XIE Yu-wei, ZHANG Xiao-wei, et al. Assessing ecological risks of dichlorvos to freshwater organisms by species sensitivity distribution[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 531-538. |
| [23] |
Ding C, Ma Y, Li X, et al. Derivation of soil thresholds for lead applying species sensitivity distribution:A case study for root vegetables[J]. Journal of Hazardous Materials, 2016, 303: 21-27. DOI:10.1016/j.jhazmat.2015.10.027 |
| [24] |
雷丽萍, 刘彬, 陈世宝, 等. 不同烟草对Cd吸收的敏感性分布及烟草中Cd的结合形态[J]. 农业环境科学学报, 2015, 34(10): 1858-1864. LEI Li-ping, LIU Bin, CHEN Shi-bao, et al. Cd-phytotoxicity species sensitivity distributions and root Cd forms of different tobacco cultivars[J]. Journal of Agro-Environment Science, 2015, 34(10): 1858-1864. DOI:10.11654/jaes.2015.10.004 |
| [25] |
Li Y, Zhang S, Jiang W, et al. Cadmium accumulation, activities of antioxidant enzymes, and malondialdehyde (MDA) content in Pistia stratiotes L.[J]. Environmental Science and Pollution Research, 2013, 20(2): 1117-1123. DOI:10.1007/s11356-012-1054-2 |
| [26] |
邵国胜, Muhammad Jaffar Hassan, 章秀福, 等. 镉胁迫对不同水稻基因型植株生长和抗氧化酶系统的影响[J]. 中国水稻科学, 2004, 18(3): 57-62. SHAO Guo-sheng, Muhammad Jaffar Hassan, ZHANG Xiu-fu, et al. Effects of cadmium stress on plant growth and antioxidative enzyme system in different rice genotypes[J]. Chinese Journal of Rice Science, 2004, 18(3): 57-62. |
| [27] |
李冬琴, 陈桂葵, 郑海, 等. 镉对两品种玉豆生长和抗氧化酶的影响[J]. 农业环境科学学报, 2015, 34(2): 221-226. LI Dong-qin, CHEN Gui-kui, ZHENG Hai, et al. Effects of cadmium on growth and antioxidant enzyme activities of two kidney bean(Phaseolus vulgaris L.) cultivars[J]. Journal of Agro-Environment Science, 2015, 34(2): 221-226. |
| [28] |
Rahoui S, Ben C, Chaoui A, et al. Oxidative injury and antioxidant genes regulation in cadmium-exposed radicles of six contrasted Medicago truncatula genotypes[J]. Environmental Science and Pollution Research, 2014, 21(13): 8070-8083. DOI:10.1007/s11356-014-2718-x |
| [29] |
史静, 潘根兴, 夏运生, 等. 镉胁迫对两品种水稻生长及抗氧化酶系统的影响[J]. 生态环境学报, 2013, 22(5): 832-837. SHI Jing, PAN Gen-xing, XIA Yun-sheng, et al. Effects of Cd on different rice growth and antioxidant enzyme system[J]. Ecology and Environmental Sciences, 2013, 22(5): 832-837. DOI:10.3969/j.issn.1674-5906.2013.05.018 |
| [30] |
Liu W, Zhou Q, An J, et al. Variations in cadmium accumulation among Chinese cabbage cultivars and screening for Cd-safe cultivars[J]. Journal of Hazardous Materials, 2010, 173(1/2/3): 737-743. |
| [31] |
Zhou Q, Guo J, He C, et al. Comparative transcriptome analysis between low-and high-cadmium-accumulating genotypes of pakchoi (Brassica chinensis L.) in response to cadmium stress[J]. Environmental Science & Technology, 2016, 50(12): 6485-6494. |
| [32] |
Huang B, Xin J, Dai H, et al. Root morphological responses of three hot pepper cultivars to Cd exposure and their correlations with Cd accumulation[J]. Environ Sci Pollut Res Int, 2015, 22(2): 1151-1159. DOI:10.1007/s11356-014-3405-7 |
| [33] |
Jia W, Miao F, Lv S, et al. Identification for the capability of Cd-tolerance, accumulation and translocation of 96 sorghum genotypes[J]. Ecotoxicology and Environmental Safety, 2017, 145: 391-397. DOI:10.1016/j.ecoenv.2017.07.002 |
| [34] |
Grant C A, Clarke J M, Duguid S, et al. Selection and breeding of plant cultivars to minimize cadmium accumulation[J]. Science of the Total Environment, 2008, 390(2/3): 301-310. |
| [35] |
苏德纯, 黄焕忠. 油菜作为超累积植物修复镉污染土壤的潜力[J]. 中国环境科学, 2002, 22(1): 48-51. SU De-chun, HUANG Huan-zhong. The phytoremediation potential of oilseed rape(B. juncea) as a hyperaccumulator for cadmium contaminated soil[J]. China Environmental Science, 2002, 22(1): 48-51. DOI:10.3321/j.issn:1000-6923.2002.01.012 |
| [36] |
范洪黎, 周卫. 镉超富集苋菜品种(Amaranthus mangostanus L.)的筛选[J]. 中国农业科学, 2009, 42(4): 1316-1324. FAN Hong-li, ZHOU Wei. Screening of amaranth cultivars(Amaranthus mangostanus L.) for cadmium hyperaccumulation[J]. Scientia Agricultura Sinica, 2009, 42(4): 1316-1324. DOI:10.3864/j.issn.0578-1752.2009.04.023 |
| [37] |
唐皓, 李廷轩, 张锡洲, 等. 水稻镉高积累材料不同生育期镉积累变化特征研究[J]. 农业环境科学学报, 2015, 34(3): 471-477. TANG Hao, LI Ting-xuan, ZHANG Xi-zhou, et al. Cadmium accumulation in high cadmium-accumulating rice cultivars at different growth stages[J]. Journal of Agro-Environment Science, 2015, 34(3): 471-477. |
 2018, Vol. 37
2018, Vol. 37