2. 农业农村部稻米产品质量安全风险评估实验室, 杭州 310006
2. Laboratory of Quality & Safety Risk Assessment for Rice(Hangzhou), Ministry of Agriculture and Rural Affairs, Hangzhou 310006, China
化学农药和重金属是两类最为普遍的土壤环境污染物,在大多数地区往往同时存在[1]。其中,重金属镉是土壤中具有潜在危害的重要污染物,其污染程度越来越受到关注;农药污染中除草剂的污染尤为突出。丁草胺为氯代乙酰胺类除草剂,是目前我国用量最大的三大除草剂之一[2-3]。由于其具有用量大、水溶性高、土壤残留期长的特点,不仅影响后茬作物的生长,还不可避免地造成生态环境的污染,因此,环境中丁草胺残留已引起人们的广泛关注。有研究表明,微生物降解是消除环境中丁草胺的主要方式。目前,关于丁草胺的微生物降解的报道较多,多数研究集中在降解菌的筛选、鉴定、降解特性、降解酶以及丁草胺代谢途径的研究[4-5]。关于丁草胺降解菌株的蛋白质组学研究较少,重金属胁迫下的蛋白质组学研究更是鲜见报道[6]。
近年来,随着分子生物学技术的不断发展,研究微生物在重金属及农药胁迫生理的分子方面的报道越来越多。目前,研究发现重金属、盐胁迫、极端高温或低温、化学因子及紫外线等多种逆境因子均能影响蛋白质的正常合成,同时能够抑制(下调)或者促进(上调)以及诱导新蛋白质的合成与表达[7-10]。蛋白质组学能够从生物体或细胞的整体水平上研究蛋白质的表达和修饰状态,它比传统研究微生物胁迫生物体生理生化变化更能够深入阐明微生物降解污染物及对环境的适应机制,对于揭示微生物对恶劣环境适应能力的规律具有重要的意义。
本研究通过筛选获得一株能耐受镉并高效降解丁草胺的菌株,通过双向电泳技术,比较双向电泳图谱差异,并对差异蛋白质进行质谱鉴定及生物信息学分析,从而探讨降解菌在镉胁迫下蛋白表达的差异,以期从细菌的蛋白质组学水平上阐明镉胁迫下降解菌对丁草胺降解和对镉耐受的分子机理。
1 材料与方法 1.1 仪器设备及试剂分光光度仪(UV1800,美谱达仪器公司),纯水装置(摩尔公司),超声细胞破碎仪(浙江新芝),IPGhor等电聚焦仪(GE Healthcare),DALT-SIX SDS-PAGE电泳仪(GE Healthcare),Ettan-DALT-Six系统水浴循环仪,ImageScanner扫描仪(GE Healthcare),PDquest分析软件(Bio-Rad),4800 Plus MALDI TOF/TOFTM Analyzer(ABI)。
Immobiline TM DryStrip pH 3-10 NL,24 cm和IPG Buffer pH 3-10 NL购自GE公司;Tris-base、Urea、Thiourea、3 - [(3-胆酰胺丙基)-二乙胺] -丙磺酸(CHAPS)、二硫苏糖醇(DTT)、溴酚蓝、十二烷基磺酸钠(SDS)、碘乙酰胺(IAA)、丙烯酰胺、甲叉双丙烯酰胺、过硫酸铵(APS)、TEMED、2-D电泳样品提取缓冲液系列、甘氨酸(Gly)、低熔点琼脂糖、乙醇、冰醋酸、2-D Equilibration Buffer以及非干扰型蛋白质浓度测定试剂盒均购自生工生物工程(上海)股份有限公司;CHCA购自Sigma公司;乙腈和三氟乙酸购自Merck公司;Mass Standards Kit for the 4700 Proteomics Analyzer购自ABI公司。
1.2 供试菌株筛选及培养基配方 1.2.1 供试菌株筛选5 g农药厂底层淤泥加入到含100 mg·L-1丁草胺的MM培养基中,37 ℃、150 r·min-1振荡培养7 d。以1%的接种量转接到新鲜无机盐(MM)培养基中,连续转接3次(转接培养基中丁草胺的浓度逐渐增大)。取200 μL菌悬液逐级稀释并涂布在含200 mg·L-1丁草胺的MM平板上。待菌落长出后,挑选单菌落进行划线纯化。纯化获得的菌落依次转接到50 mL LB液体培养基中,培养到对数生长期时,转接到50 mL含100 mg·L-1丁草胺的MM培养基中,37 ℃、150 r·min-1振荡培养3 d,测定丁草胺降解率。在此基础上,筛选获得优势丁草胺降解菌,并通过菌株纯培养、提取总DNA、PCR扩增及扩增产物的序列测定,最终实现对筛选菌株的鉴定。
1.2.2 培养基配方LB培养基:蛋白胨10 g,酵母膏5 g,NaCl 10 g,加水定容到1 L,pH 7.0。固体加入1.5%的琼脂。分装灭菌后备用。
无机盐(MM)培养基:NH3NO3 1.0 g,K2HPO4 1.5g,KH2PO4 0.5 g,MgSO4 0.2 g,NaCl 1.0 g,加水定容到1 L,pH 7.0。分装灭菌后备用。
1.3 实验设计将前期分离到的优势菌株在LB培养基中活化24 h后,分别以2%的接种量接种到50 mL含10 mg· L-1镉的20 mg·L-1丁草胺的MM培养基及50 mL只含20 mg·L-1丁草胺的MM培养基(对照)中,37 ℃、150 r·min-1振荡培养7 d后,离心收集菌体。处理和对照分别设置3个重复。
1.4 蛋白样品的提取及定量采用经典的TCA/丙酮法进行样品中蛋白质的提取。样品制备方法:取菌体,加入适量蛋白裂解液;80~100 W超声破碎3 min;4 ℃,2000 r·min-1离心30 min,去除沉淀;加适量预冷TCA丙酮提取液(10% TCA丙酮溶液),适量的10 mol·L-1 DTT使其终浓度为50 mmol·L-1,冰浴下高速匀浆1 min,-20 ℃沉淀过夜;4 ℃,12 000 r·min-1离心30 min;去除上清,沉淀中加入适当预冷丙酮,轻轻混匀,4 ℃,12 000 r·min-1离心30 min,重复此步骤1~2次;将沉淀适当晾干(不要特别的干燥),之后沉淀中加入适量蛋白裂解液溶解蛋白。
采用生工生物的非干扰型蛋白质浓度测定试剂盒(SK3071)进行蛋白定量。
1.5 双向电泳及凝胶图像分析委托生工生物工程(上海)股份有限公司进行蛋白的双向电泳及凝胶图像分析。双向电泳第一相等电聚焦(IEF)选用pH 3-10 NL IPG预制干胶条,蛋白上样量是150 μg;第二相SDS - PAGE凝胶浓度为12.5%。电泳结束后,凝胶采用AgNO3染色法染色[11]。两个样品均设置3次生物学重复,以获得稳定清晰的电泳图谱。对脱色后凝胶进行扫描(分辨率≥300 dpi),并使用PDquest 8.0软件对图像进行分析。选取清晰、没有重叠的各个单一蛋白质点作为有效蛋白质点,并将表达量倍数变化>2或者 < 0.5的蛋白质点确定为差异蛋白质点。
1.6 质谱鉴定样品制备及质谱分析 1.6.1 胶内酶解及Ziptip脱盐从凝胶上小心切下存在差异的蛋白质点,进行脱色冻干,加入5 μL 2.5~10 ng·μL-1测序级Trypsin(Promega)溶液[酶与蛋白质量比为1:(20~100)],37 ℃反应过夜进行胶内酶解;再用Ziptip(millipore)进行脱盐。
1.6.2 MALDI-TOF-MS质谱分析脱盐后样品委托生工生物工程(上海)股份有限公司进行蛋白点MALDI-TOF-MS质谱鉴定。取酶解样品2 μL,加20%乙腈复溶;取1 μL样品,点于样品靶上,让溶剂自然干燥;取0.5 μL过饱和CHCA基质溶液(溶剂为50% ACN,0.1% TFA)点至对应靶位上并自然干燥;样品靶经氮气吹净后放入仪器进靶槽,进行质谱分析:激光源为355 nm波长的Nd:YAG激光器,加速电压为2 kV,采用正离子模式和自动获取数据的模式采集数据,PMF质量扫描范围为800~ 4000 Da,选择信噪比大于50的母离子进行二级质谱(MS/MS)分析,每个样品点上选择8个母离子,二级MS/MS激光激发2500次,碰撞能量2 kV,CID关闭。
1.7 蛋白数据库检索及生物信息学分析将获得的蛋白肽质量指纹图谱(PMF),输入到Mascot网站(http://www.matrixscience.com/)蛋白质数据库进行检索,搜索与PMF相匹配的蛋白质,并完成功能查询,从而实现差异蛋白质点的鉴定。检索参数设置如下:Database设置为NCBInr;Taxonomy设置为Bacteria;Enzyme设置为Trypsin;Fixed Modification设置为Carbamidomethyl(C);Variable modifications设置为Acetyl(Protein N-term),Deamidated(NQ),Dioxidation(W),Oxidation(M);Missed cleavages设置为Allow up to one;Peptide mass tolerance设置为±100 mg·L-1;Fragment Mass Tolerance设置为±0.2 Da;Mass values设置为Monoisotopic。MASCOT分析中P < 0.05时,认为蛋白鉴定结果可信。差异蛋白按照2-D电泳图谱上的差异点编号、蛋白编号、蛋白名称、所属物种、等电点、分子量、覆盖度、得分、肽段匹配数及比值等进行整理,并进行GO功能分析和COG功能分析,从中获得一些感兴趣的重要蛋白。
2 结果与分析 2.1 嗜温鞘氨醇杆菌的分离鉴定通过1.2.1中菌株的筛选获得多株能够耐受200 mg·L-1丁草胺菌株的纯培养,进一步通过丁草胺降解实验,最终获得一株丁草胺高效降解菌,编号为15#。通过将15#菌株进行纯培养、提取菌株总DNA、16S rDNA的PCR扩增及将扩增产物送到生工生物工程(上海)股份有限公司进行序列测定,测定结果(1437 bp)在NCBI网站(https://www.ncbi.nlm.nih.gov/)上进行BLAST比对,该菌株与革兰氏阴性杆菌——嗜温鞘氨醇杆菌属菌株(Sphingobacterium thalpophilum strain S8SF4)的同源性为99%,最终将筛选到的菌株15#鉴定为嗜温鞘氨醇杆菌属菌株(Sphingobacterium thalpophilum sp.),GeneBank登录号KJ452209。
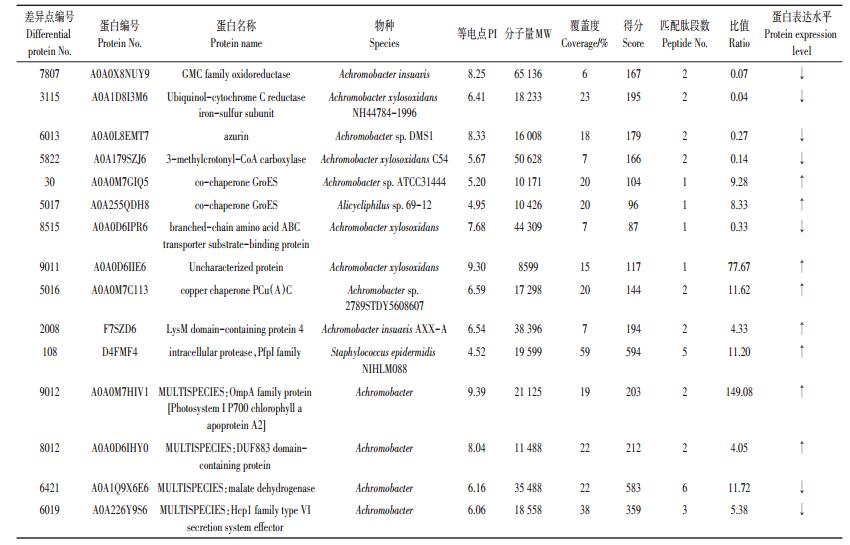
2.2 双向电泳图谱分析双向电泳后的凝胶图进行图像采集后,利用PDQuest 8.0图像分析软件对凝胶图像进行差异比对分析,每个处理的3块胶图分别来自于3个独立的生物学重复试验。只有那些重复性好(3块胶上均出现)、蛋白的丰度比即差异倍数>2或者 < 0.5,且经统计检验P-value < 0.05的显著性差异的蛋白点才可以认定为差异表达的蛋白点。通过只加丁草胺和丁草胺-镉复合处理组之间的差异比对分析,共鉴定到差异表达蛋白点93个(图 1),其中上调蛋白共49个,占差异蛋白总数的52.7%,下调蛋白44个,占差异蛋白总数的47.3%。
|
A(CK),只加20 mg·L-1丁草胺;B,20 mg·L-1丁草胺+10 mg·L-1 Cd A(CK),20 mg·L-1 butachlor;B,20 mg·L-1 butachlor +10 mg·L-1 Cd 图 1 镉胁迫下丁草胺降解菌总蛋白的双向电泳图谱 Figure 1 2-D electrophoresis of protein extracted from butachlor-degradation bacteria under cadmium stress |
分析2个处理2-D图谱共得到差异蛋白质点93个,分别将选出的23个重复性好且最为明显的差异蛋白质点从凝胶上取下,经胰蛋白酶胶内酶解消化后,利用MALDI-TOF-MS技术对其进行质谱检测,质谱检测得到的肽质量指纹图谱(PMF)数据和二级质谱图数据结合形成混合谱,再用Mascot(http://www.matrixscience.com/)软件对数据库进行搜索。结果显示,在23个重复性好且最为明显的差异蛋白质点中,成功鉴定出15个差异蛋白点,其中上调蛋白8个,占差异蛋白的53.3%,均为镉胁迫下蛋白表达量明显增加的蛋白,下调蛋白7个,占差异蛋白的46.7%,均为镉胁迫下蛋白表达量明显减少的蛋白,相关信息见表 1。对于鉴定到的蛋白,可以通过NCBI数据库和UniProt数据库(https://www.uniprot.org/)进一步查询,也可以通过BLAST(http://blast.ncbi.nlm.nih.gov/)比对得到同源或功能相似的蛋白,从而进行后续的生物信息学分析。
|
|
表 1 差异蛋白点的鉴定结果 Table 1 Identification of the differential protein points |
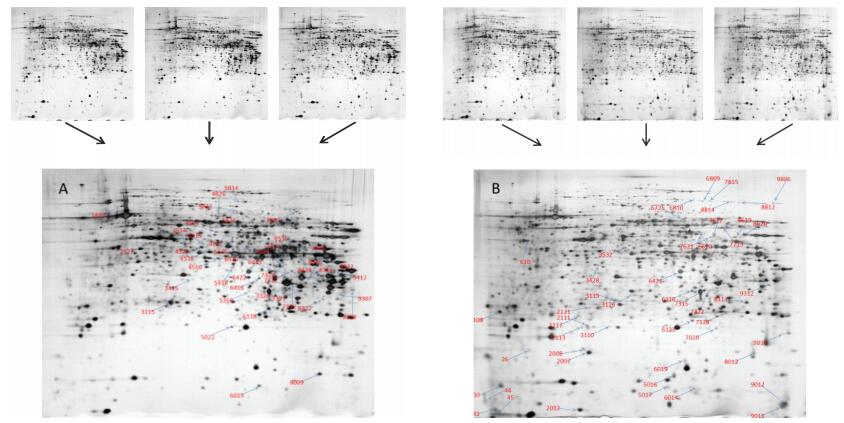
蛋白质相对分子质量(MW)和等电点(pI)含有生物学与病理学中生物标记物和信号分子的重要信息,所以在蛋白质组学研究中蛋白质相对分子质量(MW)和等电点(pI)分布引起广泛关注。成功鉴定的15个差异蛋白点,其等电点(PI)和分子量变化如图 2所示。等电点在3~4之间没有蛋白点的分布,等电点在6~7之间的蛋白数目最多(5个),占鉴定到的差异蛋白总量的33.3%;等电点在7~8之间的蛋白数目最少(1个),占总蛋白的6.7%;等电点在4~5与5~6区段的蛋白数目和9~10区段的蛋白数目一致,均为2个,占总蛋白的13.3%。差异蛋白分子量分布差别较大,差异蛋白主要集中在分子量范围为10 kDa~20 kDa之间的区间,该区间蛋白数量为8个,占鉴定到的差异蛋白总量的53.3%,其他分子量区间差异蛋白数量均很少,其中分子量在30 kDa~40 kDa之间差异蛋白数为2个,占总差异蛋白总数的13.3%,其他区段差异蛋白数均为1个,分别占总差异蛋白的6.7%。
|
图 2 差异蛋白等电点和分子量分布 Figure 2 Isoelectric point and molecular weight distribution of difference proteins |
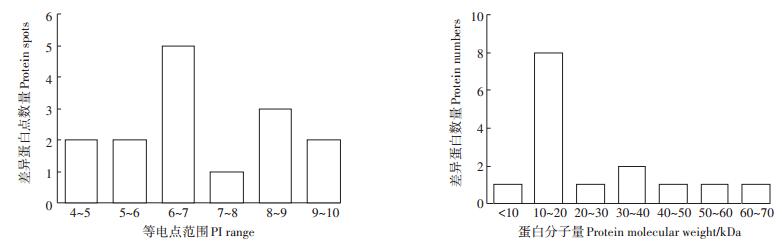
Gene Ontology(简称GO)已经成为生物信息领域中一个极为重要的方法和工具。本文针对鉴定出的所有蛋白进行了GO功能注释分析(图 3)。由图 3可以看出,这15个差异表达蛋白参与了4个生物学过程,分别为代谢过程(40%)、生物合成过程(33.3%)、跨膜转运(13.3%)和蛋白折叠等细胞过程(20%);细胞组分类别分析发现,这15个差异表达蛋白可以定位到细胞膜、细胞周质间隙、细胞质、细胞外膜等,其中能够定位到细胞和细胞膜的差异表达蛋白所占例分别为53.3%和40%,两者所占的比例之和为93.3%;分子功能类别共分为4个亚类,其中催化和结合亚类所占比例最高,均占差异表达蛋白的40%,转移活性和电子载体活动分别为13.3%和6.7%。
|
图 3 差异蛋白表达的GO分析(包括分子功能、细胞组成和生物过程) Figure 3 The GO enrichment analysis of differences expressed proteins(molecular function; cell component; biological process) |
为了更加深入地了解鉴定到的差异蛋白的生物学功能,我们还对所鉴定到的15个差异表达蛋白通过NCBI网站中的BLAST与COG数据库进行比对,得到相应的注释结果,从而进行蛋白相邻类的聚簇(Cluster of orthologous groups of proteins,简称COG)功能分类(图 4)。由图 4可见,15个差异蛋白按功能分为E、M、U、I、C、J、R、P、O和S共10组,分别为氨基酸转运和代谢、细胞壁/膜/生物起源、细胞内的贩运、分泌和囊泡运输、脂质转运和代谢、能量产生和转换、翻译、核糖体结构和生物遗传、通用功能预测、无机离子转运和代谢、翻译后修饰、蛋白转角和伴侣功能以及未知功能。其中,具有能量产生和转换功能的蛋白最多,占差异表达蛋白总量的20%;其次为脂质转运和代谢、通用功能预测、翻译后修饰、蛋白质转化和伴侣功能的蛋白,分别占差异表达蛋白总量的13.3%;这4类蛋白数量占有COG注释蛋白数量的60%。

|
图 4 差异蛋白点的COG注释图 Figure 4 COG annotation diagram of the differential protein points |
与传统的研究微生物胁迫的生理生化变化相比,蛋白质组学从生物体或者细胞的整体水平上研究蛋白质在胁迫情况下的表达和修饰状态,能够从更深层次揭示微生物对环境的适应机制,具有重要的理论意义。本文采用双向电泳这一经典技术研究了镉胁迫下丁草胺降解菌降解丁草胺的蛋白质组学研究。通过前期的筛选,我们获得了一株能够高效降解丁草胺的嗜温鞘氨醇杆菌菌株(Sphingobacterium thalpophilum sp.),该菌在丁草胺降解试验中表现优异(结果未在本文列出)。通过只加丁草胺处理和丁草胺-镉复合处理组之间的2D电泳图谱进行差异比对分析,我们共鉴定到差异表达蛋白点93个(图 1),其中上调蛋白共49个,均是在镉胁迫下通过诱导表达从而导致蛋白含量增加;93个差异蛋白点中,鉴定到的下调蛋白共44个,均在只加丁草胺处理的2D电泳胶图上较为明显,说明在镉的胁迫下这些蛋白的表达受到一定程度的抑制。为了进一步明确差异蛋白的性质,对差异蛋白进行了质谱分析。由表 2也可以看出,丁草胺单独处理及丁草胺-镉复合处理的样品经质谱鉴定到的差异蛋白表达水平有上调也有下调,其中8个蛋白在丁草胺-镉复合处理后的菌株中表现上调,7个蛋白在加镉处理后的菌株中表达量下降。但是鉴定到的这15个蛋白不论是表达量增加还是减少,在镉胁迫下依然能够显著表达,说明这些差异蛋白同时也是镉耐受蛋白。这与Silver[12]所报道的细菌中存在多种抗金属的基因,当受到外界重金属胁迫时,能够编码对金属产生耐性的蛋白的结论相吻合。
本文分别对鉴定到的15个差异蛋白分别进行了GO功能注释分析和COG功能分类。本文中鉴定到的位于细胞质中差异点编号为30和5017的co-chaperone GroES(蛋白编号为A0A0M7GIQ5和A0A255QDH8)以及差异点编号为5016的无机离子转运蛋白copper chaperone PCu(A)C蛋白分别属于分子伴侣蛋白的一种,在镉胁迫下其表达量明显上调(分别是只加丁草胺处理的蛋白表达量的9.28、8.33倍和11.62倍)。其中,两种co-chaperone GroES蛋白能够在Mg-ATP的作用下辅助位于质体的伴侣蛋白Cpn60与底物的结合并抑制ATP酶活性。Copper chaperone PCu(A)C蛋白经功能分析后发现,该蛋白主要参与无机离子的转运与代谢,因此,加镉处理菌株中该蛋白表达上调。有研究表明,分子伴侣蛋白往往具有多种功能,如胁迫保护防止交联聚沉,转运,调节转录和复制,组装细胞骨架,通常是在应激反应情况下产生的。近年来的研究表明在正常生长条件下,这类蛋白仍少量存在,对蛋白跨膜运输,结构折叠也有重要作用。当受到重金属胁迫时,该类蛋白表达量会增加,过量表达水平与胁迫程度呈正相关[13]。微生物在长期的进化过程中,形成了自己独特的信号转导系统以响应外界环境的胁迫,从而产生了一些响应胁迫的蛋白质。在鉴定到的所有上调蛋白中,相对于单独丁草胺处理,加镉处理后上调幅度最大的为光合系统Ⅰ叶绿体脱辅基蛋白PSⅠP700(差异点编号为9012,蛋白编号为A0A0M7HIV1,差异倍数为149.08),GO功能注释分析发现该蛋白为一种外膜蛋白,分子功能为氧化胁迫的信号肽,结合COG功能分类分析推测该蛋白在镉由细胞外向细胞内转运过程中起了关键作用,是菌株响应镉胁迫的敏感蛋白,与菌株抗镉密切相关。在鉴定到的上调蛋白中,还有一个在镉胁迫后蛋白表达量显著增加,且增加程度仅次于光合系统Ⅰ叶绿体脱辅基蛋白PSⅠP700的蛋白(蛋白编号为A0A0D6IIE6,差异点编号为9011),该蛋白为功能未知蛋白,在镉存在时其表达水平是单一丁草胺处理菌株中的77.67倍,推测镉的存在刺激了该蛋白的表达,说明该蛋白与菌株抗镉之间存在着某种密切联系,该蛋白同样作为镉胁迫的敏感蛋白,也是值得我们深入研究的蛋白之一。
差异点编号为8515的氨基酸转运蛋白(蛋白编号为A0A0D6IPR6)主要参与降解菌株对丁草胺的代谢,镉胁迫情况下该蛋白的表达水平为下调,说明降解菌株对丁草胺的代谢受到一定程度的抑制。该结论与王金花[14]的推测相一致。GMC氧化还原酶广泛存在于原核生物和真核生物中,主要作用是参与碳水化合物的代谢。差异点编号为7807的GMC氧化还原酶蛋白(蛋白编号为A0A0D6IPR6)在处理中也表现为下调,同样说明镉胁迫下钙蛋白的表达受到一定程度的抑制。
另外,在GO分析和COG分析中,我们还发现,所有参与代谢的蛋白中大多数蛋白在镉胁迫下均表现为下调表达,只有蛋白编号为D4FMF4的蛋白为嗜热家族(PfpI)蛋白(差一点编号为108)表现为上调,说明该蛋白能够在镉胁迫下抗镉的同时参与丁草胺的代谢。通过查阅文献,我们发现该类蛋白具有多种生物学功能,最典型的就是抗氧化应激功能,随着氧化应激的积累,该蛋白对氧化应激的敏感性随之增高,从而蛋白表达水平上调。关于其抗氧化的机制,相关研究表明有以下几种方式:自身构型改变、分子伴侣作用、通过保护线粒体功能抵抗氧化应激以及调控抗氧化应激相关基因等[15]。该蛋白以及其抗氧化机制也是一个非常值得深入研究的课题。
4 结论(1)筛选到一株镉胁迫下丁草胺高效降解菌株15#,经16S rDNA基因测序及序列比对分析,该菌株鉴定为革兰氏阴性杆菌——嗜温鞘氨醇杆菌(Sphingobacterium thalpophilum sp.),GeneBank登录号KJ452209。
(2)通过不同处理间的双向电泳图谱差异比对分析,共鉴定到差异表达蛋白点93个,其中上调蛋白49个,下调蛋白44个。在重复性好且差异最为明显的23个蛋白质点中,利用MALDI-TOF-MS技术成功鉴定出15个差异蛋白,其中8个为上调蛋白,7个为下调蛋白,且这些蛋白的等电点主要分布在6~7之间,分子量范围主要集中在10 kDa~20 kDa之间的区间。
(3)鉴定到的15个蛋白在镉处理下均能显著表达,说明这些差异蛋白同时也是镉耐受蛋白。这15个蛋白总共分为两大类,一类为参与丁草胺代谢的蛋白,另一类为响应镉胁迫敏感蛋白及在抗镉情况下参与丁草胺代谢的蛋白。
(4)分析发现,镉胁迫下上调幅度最大的两个敏感蛋白(蛋白编号分别为A0A0M7HIV1和A0A0D6IIE6)以及抗镉胁迫的同时参与丁草胺代谢的蛋白(蛋白编号为D4FMF4),均为今后延续性研究中需要重点研究的三个蛋白。
| [1] |
Su Y H, Zhu Y G, Lin A J, et al. Interaction between cadmium and atrazine during uptake by rice seedlings(Oryza sativa L.)[J]. Chemosphere, 2005, 60: 802-809. DOI:10.1016/j.chemosphere.2005.04.022 |
| [2] |
刘长令. 世界农药大全——除草剂卷[M]. 北京: 化学工业出版社, 2002: 259-260. LIU Chang-ling. World pesticide-herbicide roll[M]. Beijing: Chemical Industry Press, 2002: 259-260. |
| [3] |
Min H, Ye Y F, Cheng Z Y, et al. Effects of butachlor on microbial enzyme activities in paddy soil[J]. Journal of Environmental Sciences, 2002, 14: 413-417. |
| [4] |
Yang G, Lei J, Hui S, et al. Characterization of a novel butachlor biodegradation pathway and cloning of the debutoxylase(Dbo)gene responsible for debutoxylation of butachlor in Bacillus sp. hys-1[J]. Journal of Agricultural and Food Chemistry, 2015, 63(38): 8381-8390. DOI:10.1021/acs.jafc.5b03326 |
| [5] |
Chhavi A, Sonia S, Shivam Y, et al. A novel aldo-keto reductase (AKR17A1)of Anabaena sp. PCC 7120 degrades the rice field herbicide butachlor and confers tolerance to abiotic stresses in E. coli[J]. PloS One, 2015, 10(9): 1-15. |
| [6] |
Wang J H, Lu Y T, Chen Y Y. Comparative proteome analysis of butachlor-degrading bacteria[J]. Environmental Geology, 2008, 53(6): 1339-1344. DOI:10.1007/s00254-007-0742-6 |
| [7] |
Bernadette B N, Reinhard B. Induetion of stress proteins in the phototrophic bacterium Rhodobaeter sphaeroides[J]. FEMS Microbiology Letters, 1997, 153: 173-180. DOI:10.1111/j.1574-6968.1997.tb10479.x |
| [8] |
Paula M P, Tjakko A, Jeroen A W. Analysis of the heat-adaptive response of psychrotrophic Bacillus weihenstephanensis[J]. International Journal of Food Microbiology, 2002, 79: 17-26. DOI:10.1016/S0168-1605(02)00175-7 |
| [9] |
Cho Y S, Park S H, Kim C K, et al. Induction of stress shock proteins dnaK and groEL by phenoxyherbicide 2, 4-D in Burkholderia sp. YK-2 isolated from rice field[J]. Current Microbiology, 2000, 41: 33-38. DOI:10.1007/s002840010087 |
| [10] |
Hoper D, Bemhardt J, Hecker M. Salt stress adaptation of Bacillus subtilis:A physiological proteomics approach[J]. Proteomics, 2006, 6: 1550-1562. DOI:10.1002/(ISSN)1615-9861 |
| [11] |
Rabilloud T. Silver staining of 2D electrophoresis gels[J]. Quantitative Methods in Proteomics, 2012, 893: 61-73. DOI:10.1007/978-1-61779-885-6 |
| [12] |
Silver S. Bacterial resistances to toxic metal ions:A review[J]. Gene, 1996, 179: 9-19. DOI:10.1016/S0378-1119(96)00323-X |
| [13] |
Chhavi A, Sonia S, Shilpi S, et al. Comparative proteomics reveals association of early accumulated proteins in conferring butachlor tolerance in three N2-fixing Anabaena spp.[J]. Journal of Proteomics, 2014, 96: 271-290. DOI:10.1016/j.jprot.2013.11.015 |
| [14] |
王金花.丁草胺-镉复合污染对土壤微生物的分子生态毒理效应与生物修复研究[D].上海: 上海交通大学, 2007. WANG Jin-hua. Studies on molecular ecotoxicological effects of combined pollution between butachlor and cadmium on soil microbe and bioremediation[D]. Shanghai: Shanghai Jiao Tong University, 2007. http://cdmd.cnki.com.cn/Article/CDMD-10248-2007153744.htm |
| [15] |
王志勇, 汤玲珍, 高天文. DJ-1抗氧化应激功能研究进展[J]. 第二军医大学学报, 2012, 33(1): 88-91. WANG Zhi-yong, TANG Ling-zhen, GAO Tian-wen. Protective effect of DJ-1 against oxidative stress:An advance[J]. Academic Journal of Second Military Medical University, 2012, 33(1): 88-91. |
 2018, Vol. 37
2018, Vol. 37