2. 湖北省农业科技创新中心中药材研究分中心, 湖北 恩施 445000;
3. 南京农业大学资源与环境科学学院, 南京 210095;
4. 作物遗传与种质创新国家重点实验室, 南京 210095
2. Chinese Herbal Medicine Subcenter of Hubei Agricultural Science and Technology Innovation Centre, Enshi 445000, China;
3. College of Resources and Environmental Sciences, Nanjing Agricultural University, Nanjing 210095, China;
4. State Key Laboratory of Crop Genetics and Germplasm Enhancement, Nanjing 210095, China
砷(As)是一种有毒的类金属元素,其氧化物三氧化二砷(As2O3)俗称“砒霜”。过量摄入As或长期暴露在As污染的环境中可诱发皮肤、肾脏、膀胱等器官和组织的癌变[1],患癌几率大幅上升[2]。我国属于水稻种植大国,含As灌溉水的使用,导致我国南方一些水稻种植地区的As污染已经相当严重[3],而水稻根系的高效硅运输通道使其对As的吸收大大增加[4]。世界范围内,特别是水稻种植区,稻米已经成为食物链中As的主要来源[5-7],因此As污染水稻土的修复工作显得尤为重要。
目前,As污染土壤的修复主要采用物理法和化学法[8-9],物理化学方法相对简单,但成本较高,且容易造成二次污染[10],因而运用高效绿色的生物方法具有重要意义。无机砷中三价砷[As(Ⅲ)]的毒性最强,并且As(Ⅲ)在多数环境下相比于五价砷[As(Ⅴ)]更难以被吸附[11-12]。在一定条件下,微生物可以将As(Ⅲ)氧化为As(Ⅴ),从而降低As的移动性和毒性[13]。好氧条件下,莫于婷等[14]筛选的砷氧化菌As-I、As-Q能高效将1.3 mmol·L-1的As(Ⅲ)氧化为As(Ⅴ),其氧化率可达99%。厌氧条件下,Zhang等[15]分离的砷氧化菌Paracoccus sp. SY能够将1 mmol·L-1的As(Ⅲ)完全氧化,同时将As氧化与硝酸盐还原过程进行偶联,从中获得能量维持自身的生长。无论在好氧还是厌氧条件下,As污染水稻土中均存在大量砷氧化菌,在As污染水稻土的修复技术中,利用微生物的As(Ⅲ)氧化作用对As污染水稻土进行修复具有潜在的应用价值[15-16]。目前有关As污染水稻土的微生物修复的研究较多,但对其修复机理的研究还较少。
水稻土在淹水的过程中,厌氧环境使土壤中的As易被活化[7, 17]。在淹水条件下,水稻土孔隙水中的As(Ⅴ)含量理论上占总As的10%~30%,但研究人员发现水稻土淹水后孔隙水中的As(Ⅴ)含量远超过理论值,说明水稻土淹水后As的转化虽然以还原反应为主,但仍可能存在氧化过程[18]。本文以全国不同地区的As污染水稻土为研究对象,从中筛选砷氧化菌,并进行分离和鉴定,同时开展菌株对As(Ⅲ)的耐受性及其As氧化特性研究并模拟其在淹水条件下对As污染水稻土的修复作用,为As污染水稻土的微生物修复提供依据以及探索淹水条件下砷氧化菌修复As污染水稻土的可能机理。
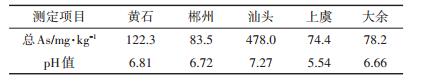
1 材料与方法 1.1 试验材料试验所用土壤为湖北黄石、湖南郴州、广东汕头等地的As污染水稻土,风干后过20目筛测定pH值,过100目筛测定总As含量,测定结果见表 1。
|
|
表 1 各地As污染水稻土的总As含量和pH值 Table 1 Total As and pH value of different As-contaminated paddy soil |
供试培养基:LB培养基、牛肉膏蛋白胨培养基、MSM培养基(Mineral salts medium)、CDM培养基(Chemically defined medium),可参照Zhang等[15]的方法配置。所有化学试剂均为分析纯,购自国药集团化学试剂有限公司。
供试仪器:紫外分光光度计UV2450;高效液相电感耦合等离子色谱NexIon300X;电子分析天平BSAD4S-CW;PCR扩增仪EDC-810;微量分光光度计NanoDrop 2000c。
1.2 菌株DWY-1的生理生化特性及分子鉴定砷氧化菌的筛选采用KMnO4检测法[19],选取具有代表性的砷氧化菌DWY-1作为后续研究的试验对象,接种到LB固体培养基,30 ℃培养48 h后进行生理生化检测,检测内容包括:革兰氏染色、V.P测定、吲哚的产生、硝酸盐还原反应、水解反应(脲素、七叶灵、山梨醇)和碳源利用情况(葡萄糖、精氨酸、甘露醇、麦芽糖、苹果酸、苯乙酸)。测定方法参照《常见细菌系统鉴定手册》 [20]。
以菌株DWY-1的总DNA作为模板,分别使用引物27F/1492R[21]和aoxBM1-2F/aoxBM3-2R[22]进行16S rDNA基因和砷氧化酶基因(aioA)的扩增。将纯化的目的片段送武汉奥科生物技术有限公司测序,测定的目的基因序列提交到NCBI数据库(http://www.ncbi.nlm.nih.gov/),获得相应的登录号。使用Nucleotide Blast的方法将目的基因与基因库中的序列进行比对,下载最相似菌株序列作为系统发育树的参考序列。采用MEGA 5.1软件中ClustalW的方法进行多序列比对,用邻接法(Neighbor-Joining Tree)进行系统发育分析,系统发育树各分支置信度由自举分析方法(Bootstrap)检验,重复1000次。
1.3 菌株DWY-1的As(Ⅲ)抗性及在不同浓度As(Ⅲ)中的生长情况配制CDM培养基(pH值7.0~7.4),亚砷酸钠的浓度梯度为:0、0.5、1、2、3 mmol·L-1和5 mmol·L-1,接种菌株后30 ℃、200 r·min-1摇床培养24 h,测定OD600nm值。
配制含0、0.5、1.0 mmol·L-1和1.5 mmol·L-1 As(Ⅲ)的CDM培养基,将菌株DWY-1接种到含不同浓度亚砷酸钠的CDM培养基中,30 ℃、200 r·min-1摇床培养48 h,测定OD600nm值。
1.4 菌株DWY-1的As(Ⅲ)氧化特性以NaHCO3为碳源(10 mmol·L-1)配制含0.5、1.0 mmol·L-1和1.5 mmol·L-1 As(Ⅲ)的MSM培养基(不添加KNO3)。接种菌株DWY-1到培养基中,每个浓度均设置不加菌处理作为对照,每个处理3个重复,从接种后开始,48 h内每隔6 h测定一次As形态。
以NaHCO3为碳源(10 mmol·L-1)配制含0.5、1.0 mmol·L-1和1.5 mmol·L-1 As(Ⅲ)的MSM培养基(添加1 mmol·L-1 KNO3),接种菌株DWY-1,通入N2/CO2(80: 20,V/V)的混合气体制造厌氧环境后开始,7 d内每隔1 d测定一次As形态。试验结束后测定培养基中硝态氮的浓度(NO3-的测定采用酚二磺酸紫外分光光度法,NO2-的测定采用N-[1-萘基]-乙二胺光度法)。
1.5 菌株DWY-1对As污染水稻土的修复作用选取黄石As污染水稻土为试验对象,称取50 g水稻土和50 mL的蒸馏水到100 mL的血清瓶,通入N2/CO2(80:20,V/V)的混合气体制造厌氧环境后放置在室温下进行厌氧培养3 d。将菌株DWY-1在厌氧的MSM培养基(含5 mmol·L-1 NO3-和10 mmol·L-1 NaHCO3)中培养到OD600nm=0.5左右,取10 mL菌液12 000 r·min-1离心5 min,弃上清液,用0.85%的NaCl溶液洗3遍,将菌体重悬到2 mL 0.85%的NaCl溶液中,投入到血清瓶(整个过程在微生物厌氧工作台操作),同时准备一组不加菌液(用2 mL 0.85%的NaCl溶液代替)的处理作为阴性对照,继续在室温下培养14 d,每个处理设置4个重复。培养结束后将血清瓶中的悬浮液倒掉,泥浆8000 r·min-1离心10 min,上清液过0.22 μm滤膜,立即取1 mL 1.5 mol·L-1的HNO3溶液加入到9 mL的滤液中保存As形态[15, 23];用0.6 mol·L-1的磷酸和0.1 mol·L-1的抗坏血酸混合液提取吸附在水稻土底泥中的As[15, 24],离心后上清液过0.22 μm滤膜,用相同方法保存滤液,上HPLC-ICP-MS测定As形态。
1.6 数据统计与分析采用Excel 2007和SPSS 20.0软件对数据进行统计分析,采用单因素(One-way ANOVA)和Duncan法进行方差分析和多重比较(α=0.05)。使用Origin 8.1软件作图,TRAP软件计算EC50。采用Primer 5.0和MEGA 5.1进行基因序列的整理和系统发育树的构建。
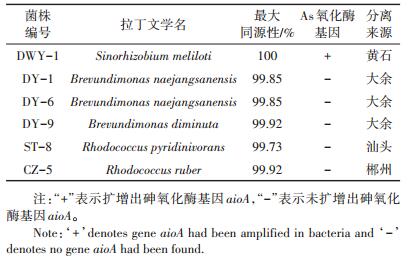
2 结果与分析 2.1 菌株DWY-1的分离、生理生化特性从全国各地的As污染水稻土中共计分离出6株具有As氧化功能的菌株(表 2),其中一株扩增出As氧化酶基因(aioA),命名为DWY-1。菌株DWY-1为中华根瘤菌属(Sinorhizobium sp.),DY-1、DY-6、DY- 9为短波单胞菌属(Brevundimonas sp.),ST-8、CZ-5为红球菌属(Rhodococcus sp.)。
|
|
表 2 菌种信息表 Table 2 Information of As (Ⅲ)oxidizing bacteria |
由表 3可知,菌株DWY-1的硝酸盐还原呈阳性,其他反应均呈阴性。能够利用葡萄糖、甘露醇、麦芽糖等作为碳源进行生长。综上可得DWY-1为革兰氏阴性菌,具有多种生长代谢途径。
|
|
表 3 菌株DWY-1的生理生化测定 Table 3 Physiological and biochemical characteristics of strain DWY-1 |
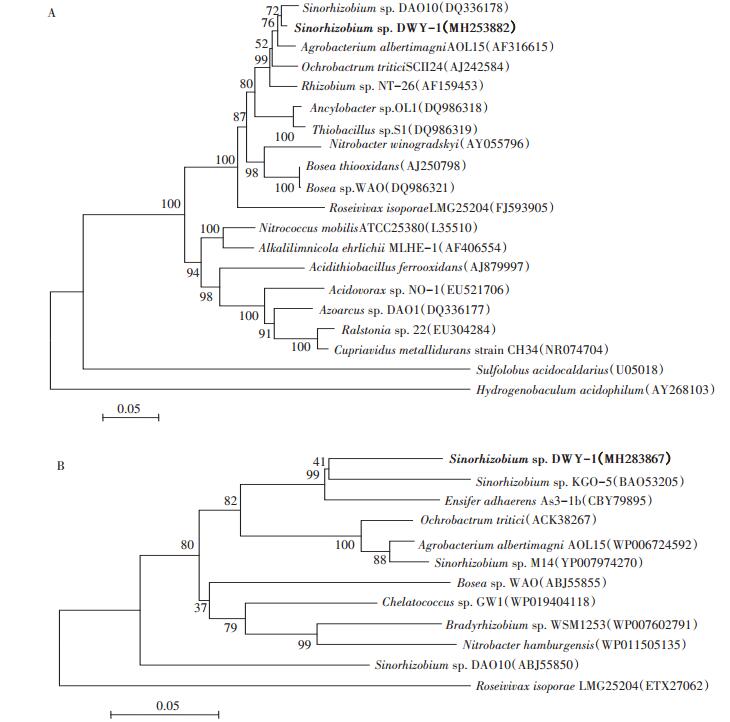
将目的基因16S rDNA以及aioA提交到NCBI,在Genbank中获得相应的序列登录号,分别为MH253882(16S rDNA)和MH283867(aioA)。将测序得到的16S rDNA基因在NCBI上通过BLAST检索与Genbank中的核酸序列进行比对,并下载同源性序列构建系统发育树进行分析(图 1A)。发现DWY-1与苜蓿中华根瘤菌(Sinorhizobium meliloti)及费氏中华根瘤菌(Sinorhizobium fredii)的相似性均为100%,基于菌株DWY-1的16S rDNA序列构建的系统发育树显示,其与Sinorhizobium sp.DAO10的亲缘关系最近。将菌株DWY-1的As氧化酶基因aioA翻译成氨基酸序列,在NCBI上进行比对并下载同源性较高的序列构建系统发育树(图 1B),发现其与Sinorhizobium sp. KGO-5亲缘关系最近,综上认定菌株DWY-1为中华根瘤菌属(Sinorhizobium sp.)。
|
自展值已在分支点显示,标尺代表 5%的变异度 Bootstrap values are shown at the branch points, and the bar equals 5% difference 图 1 基于16S rDNA序列(A)及砷氧化酶氨基酸序列(B)构建的系统发育树 Figure 1 Phylogenetic tree based on 16S rDNA sequences (A)and aioA amino acid sequences (B)of strain DWY-1 and related sequences which were retrieved from NCBI |
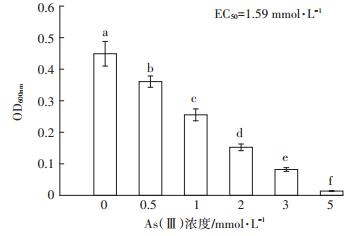
如图 2所示,菌株DWY-1培养24 h后,不加As处理的菌株生长状况最佳,OD600nm达到0.449,其次为0.5 mmol·L-1As(Ⅲ)处理,OD600nm为0.361,当As(Ⅲ)的浓度达到5 mmol·L-1时,菌株DWY-1的生长受到严重抑制,培养24 h后仍处于调整期,OD600nm仅为0.014。不同浓度的As处理间均存在显著性差异(P < 0.05)。利用TRAP软件模拟As(Ⅲ)对菌株DWY-1的半抑制浓度,得出EC50=1.59 mmol·L-1。
|
图 2 不同浓度As(Ⅲ)对菌株DWY-1生长的影响 Figure 2 Effects of different concentrations of As(Ⅲ)on growth of strain DWY-1 |
经过48 h的培养,DWY-1在不添加As(Ⅲ)的CDM培养基中生长的最好(图 3),OD600nm值达到2.02;其次为0.5 mmol·L-1 As(Ⅲ)处理,OD600nm=1.98,两者没有显著性差异。当As(Ⅲ)的浓度达到1.0 mmol· L-1时,对DWY-1的生长产生了明显的抑制作用,且随着As(Ⅲ)的浓度增高,调整期逐渐延长。培养48 h后1.0 mmol · L-1和1.5 mmol · L-1 As(Ⅲ)处理的OD600nm分别为1.68和1.24,与0 mmol·L-1和0.5 mmol· L-1As(Ⅲ)处理均存在显著性差异(P < 0.05)。
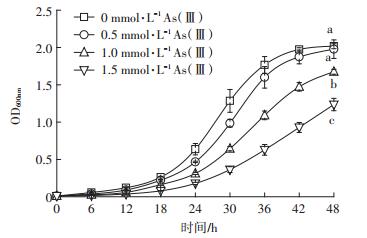
|
图 3 菌株DWY-1在不同浓度As(Ⅲ)中的生长曲线 Figure 3 Growth curves of strain DWY-1 in CDM medium containing different concentrations of As(Ⅲ) |
如图 4A所示,好氧条件下,DWY-1可以在24 h内将0.5 mmol·L-1的As(Ⅲ)完全氧化为As(Ⅴ),36 h内氧化1.0 mmol·L-1的As(Ⅲ),48 h内氧化1.5 mmol· L-1的As(Ⅲ)。厌氧条件下(图 4B),DWY-1可以在4 d内完全将0.5 mmol·L-1的As(Ⅲ)的氧化为As(Ⅴ), 6 d内氧化1.0 mmol· L-1的As(Ⅲ),7 d内氧化1.5 mmol·L-1的As(Ⅲ),无论在好氧条件下还是厌氧条件下,未加菌的对照组均未检测到As(Ⅴ)。厌氧培养结束后,0.5、1.0、1.5 mmol·L-1 As(Ⅲ)处理的培养基中剩余的NO3-浓度分别为0.793、0.597、0.387 mmol· L-1,NO3-的去除率分别为20.7%、40.3%以及59.7%,培养结束后未检测到NO2-(图 4C)。
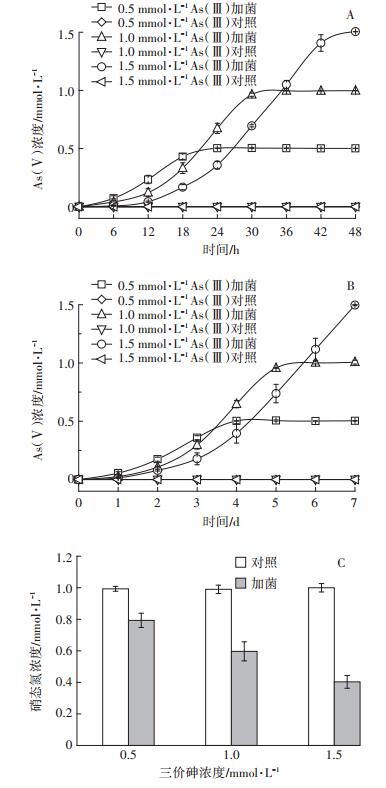
|
图 4 菌株DWY-1在好氧(A)和厌氧(B)条件下As氧化特性以及厌氧条件下硝态氮浓度变化(C) Figure 4 Oxidiation of As (Ⅲ)by strain DWY-1 under aerobic condition without NO3- (A)or anaerobic condition with 1 mmol· L-1 NO3- as the electron acceptor (B)and nitrate removel under anaerobic condition (C) |
从图 5可以看出,未添加菌株DWY-1的对照组(CK)培养两周后土壤孔隙水(图 5A)和土壤底泥(图 5B)中磷酸可提取态的As仍以As(Ⅲ)为主,分别为2.80 mg · L-1和45.54 mg · kg-1,占总As的75.7%和91.3%。而添加菌株DWY-1处理的土壤孔隙水和土壤底泥中磷酸可提取态的As以As(Ⅴ)为主,分别为1.73 mg · L-1和24.37 mg · kg-1,占总砷的69.6%和72.8%。添加菌株DWY-1的土壤孔隙水和土壤底泥中磷酸可提取态的As(Ⅲ)含量与CK相比分别降低73.0%和80.0%,总As含量分别降低32.6%和32.9%。
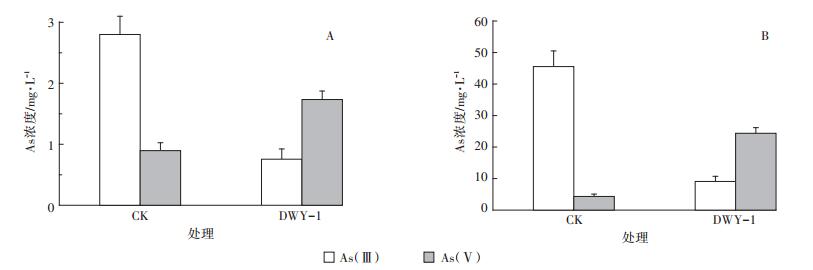
|
图 5 菌株DWY-1对土壤孔隙水(A)和底泥(B)As形态的影响 Figure 5 Effect of strain DWY-1 inoculation on As speciation in the soil solution (A)and the phosphoric acid-extractable fraction in a flooded soil slurry (B) |
在自然环境中,As(Ⅲ)可以被氧气等通过化学反应缓慢的氧化为As(Ⅴ),但是在微生物的作用下,As(Ⅲ)的氧化速率大幅提高[25]。As(Ⅴ)相比于As(Ⅲ)的移动性更小,毒性更低,因此微生物介导的As氧化被认为是As污染土壤修复的主要途径之一[16, 26]。环境中存在一些微生物能够抵抗高浓度的As,甚至可以从As(Ⅲ)氧化与As(Ⅴ)还原的过程中获得能量用于自身生长,这些微生物在大自然中普遍存在且在As的地球化学循环过程中发挥了重要作用[27-29]。本研究从As污染水稻土中分离出一株砷氧化菌DWY- 1,最高可抵抗5.0 mmol · L-1的As(Ⅲ)。对菌株DWY-1进行鉴定发现其属于中华根瘤菌属(Sinorhizobium sp.),与其亲缘关系最近的菌株Sinorhizobium sp.DAO10和Sinorhizobium sp. KGO-5均具有As氧化功能,且菌株DAO10也能将厌氧As氧化与硝酸盐还原过程进行偶联[28],但其对As污染水稻的修复作用尚未见报道。对菌株DWY-1的生理生化特性进行研究,发现菌株DWY-1为革兰氏阴性菌,能利用多种碳源进行生长,在好氧条件下和厌氧条件下均具有As(Ⅲ)氧化功能。
有研究表明,部分砷氧化菌可通过耦合As(Ⅲ)氧化与硝酸盐还原过程并从中获得能量用于自身生长[15, 28]。Chen等[30]通过对水稻施用不同的氮肥,发现氮肥的施用可以减少水稻对As的吸收,这很可能是依赖于硝酸盐还原进行As氧化的微生物造成的。在对菌株DWY-1的As氧化特性进行研究时发现其在好氧条件下和厌氧条件下均具有As氧化功能,并且厌氧条件下氧化As(Ⅲ)的同时伴随着硝酸盐还原。厌氧培养结束后,培养基中未检测到NO2-的存在,且NO3-的去除率与As(Ⅲ)的消耗量成正比,根据化学计量学分析,发现菌株DWY-1的As氧化与硝酸盐还原过程存在如下反应:5H3AsO3+2NO3- →5HAsO42-+N2+ 8H++H2O(实验得出消耗的As3+和NO3-比值为2.47± 0.05,与理论消耗比值2.5没有显著性差异),推测NO3-被还原为N2,在以往的研究中,类似的菌株已有报道[15, 28]。研究表明,好氧条件下,砷氧化酶AioA位于细胞的周质空间,As(Ⅲ)经甘油水蛋白或离子通道进入菌体细胞的周质空间后被氧化为As(Ⅴ),并释放两个电子,电子传递路径为As(Ⅲ)传递两个电子到大亚基AioA的钼蝶呤辅因子,接着经分子键传递给[3Fe-4S]簇,然后到小亚基AioB的[2Fe-2S]簇,再到细胞色素C蛋白AioC,最后到呼吸链的O2,完成整个好氧As氧化过程[31-32]。然而Rhine等[33]在厌氧砷氧化菌Sinorhizobium sp.DAO10中也扩增出As氧化酶基因(aioA),说明As氧化酶AioA可能同时负责好氧As氧化以及厌氧As氧化过程。本研究在兼性厌氧菌株DWY-1的基因组DNA中也扩增出As氧化酶基因(aioA),再次证实了这一观点。有研究报道,厌氧条件下,反硝化细菌中的硝酸还原酶(NAR)的电子供体为醌氢类,亚硝酸还原酶(NIR)的电子供体为细胞色素Cytbc1[34]。对于菌株DWY-1能够在厌氧条件下将As(Ⅲ)氧化与硝酸盐还原进行偶联,笔者提出以下猜想(图 6):As3+传递电子到大亚基AioA的钼蝶呤辅因子,然后经分子键传递到[3Fe-4S]簇,再到小亚基AioB的[2Fe-2S]簇,此时一部分电子传递给醌氢类(QxHy),再传递到硝酸还原酶(NAR),NAR将电子传递给NO3-并将其还原为NO2-;另外一部分电子先传递给细胞色素Cytbc1,然后再传递到亚硝酸还原酶(NIR),NO2-在NIR的作用下接受电子并被多次还原最后生成氮气(N2),从而完成As(Ⅲ)氧化协同硝酸盐还原的整个过程。
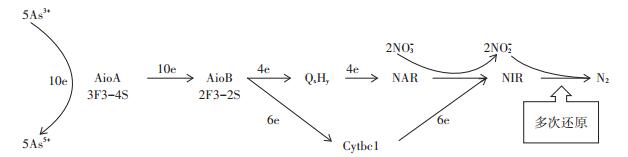
|
图 6 厌氧条件下As氧化与硝酸盐还原偶联的猜想 Figure 6 Supposed process of anaerobic As(Ⅲ)oxidation coupled to denitrification |
水稻土中As的氧化作用可以促进土壤溶液中的五价As与铁的氧化物或氢氧化物共沉淀,降低As的生物有效性和移动性[7, 35]。在模拟菌株DWY-1修复As污染水稻土的过程中,发现接种菌株DWY-1处理的土壤孔隙水和土壤底泥中磷酸可提取态的总As含量相比于对照分别降低32.6%和32.9%,As(Ⅴ)占总As的百分比分别从24.2%和8.7%提高到69.6%和72.8%。推测菌株DWY-1在淹水水稻土中将As(Ⅲ)氧化成As(Ⅴ),部分As(Ⅴ)与铁氧化物形成共沉淀,致使土壤孔隙水和土壤底泥中磷酸可提取态As的含量降低,这与李思妍等[36]的研究结果相符。根据As(Ⅲ)与硝态氮反应的方程式来看,As(Ⅲ)的氧化过程需要的硝态氮不多,且在水稻土中As是微量元素,而氮是大量元素,所以推测菌株DWY-1在氧化As(Ⅲ)的过程中,土壤会溶出一部分的硝态氮,促进了菌株DWY-1的厌氧As氧化与硝酸盐还原过程。
在研究的过程中,还发现5株未扩增出As氧化酶基因但具有As氧化功能的菌株,包括嗜吡啶红球菌(Rhodococcus pyridinivorans)、泡囊短波单胞菌(Brevundimonas naejangsanensis)和赤红球菌(Rhodococcus ruber)等,推测此类微生物在As污染水稻土中大量存在且在As的氧化还原过程中扮演着重要角色。适当改善As污染水稻土中有利于此类微生物生长的因素,如添加合适的碳源、调节土壤酸碱度、盐浓度以及添加适量的硝酸盐[37]或种植有利于此类微生物生长的植物都可能促进土壤中的As氧化过程,从而降低土壤中As的移动性和生物有效性。
4 结论(1)砷氧化菌DWY-1对As污染水稻土具有较强的修复作用,在淹水土壤中厌氧培养14 d后,添加菌株DWY-1处理的土壤孔隙水和底泥中磷酸可提取态的As(Ⅲ)含量与对照(不加菌)相比分别降低73.0%和80.0%,总As含量分别降低32.6%和32.9%,表明菌株DWY-1可作为修复As污染水稻土的潜在菌种资源。
(2)菌株DWY-1在好氧和厌氧条件下均具有As氧化功能,且在厌氧培养过程中,As3+和NO3-存在如下反应:5H3AsO3+2NO3-→5HAsO42-+N2+8H++H2O,说明砷氧化菌DWY-1可以耦合厌氧As氧化与硝酸盐还原并从中获得能量用于自身生长,此过程可作为修复As污染水稻土的途径之一。
| [1] |
Gamboaloira B, Cebrián M E, Francomarina F, et al. Arsenic metabolism and cancer risk:A meta-analysis[J]. Environmental Research, 2017, 156: 551-558. DOI:10.1016/j.envres.2017.04.016 |
| [2] |
Tseng W P, Chu H M, How S W, et al. Prevalence of skin cancer in an endemic area of chronic arsenicism in Taiwan[J]. Journal of the National Cancer Institute, 1968, 40(3): 453-463. |
| [3] |
Zhu Y G, Williams P N, Meharg A A. Exposure to inorganic arsenic from rice:A global health issue?[J]. Environmental Pollution, 2008, 154(2): 169-171. DOI:10.1016/j.envpol.2008.03.015 |
| [4] |
Su Y H, Mcgrath S P, Zhao F J. Rice is more efficient in arsenite uptake and translocation than wheat and barley[J]. Plant and Soil, 2010, 328(1/2): 27-34. |
| [5] |
Zhao F J, Ma J F, Meharg A A, et al. Arsenic uptake and metabolism in plants[J]. New Phytologist, 2009, 181(4): 777-794. DOI:10.1111/j.1469-8137.2008.02716.x |
| [6] |
Zhao F J, Mcgrath S P, Meharg A A. Arsenic as a food chain contaminant:Mechanisms of plant uptake and metabolism and mitigation strategies[J]. Annual Review of Plant Biology, 2010, 61(1): 535. DOI:10.1146/annurev-arplant-042809-112152 |
| [7] |
赵方杰. 水稻砷的吸收机理及阻控对策[J]. 植物生理学报, 2014, 50(5): 569-576. ZHAO Fang-jie. Mechanisms of arsenic uptake by rice and mitigation strategies[J]. Plant Physiology Journal, 2014, 50(5): 569-576. |
| [8] |
Zou Q, An W, Wu C, et al. Red mud-modified biochar reduces soil arsenic availability and changes bacterial composition[J]. Environmental Chemistry Letters, 2017, 60(15): 1-8. |
| [9] |
Cao M, Ye Y, Chen J, et al. Remediation of arsenic contaminated soil by coupling oxalate washing with subsequent ZVI/Air treatment[J]. Chemosphere, 2016, 144: 1313. DOI:10.1016/j.chemosphere.2015.09.105 |
| [10] |
侯李云, 曾希柏, 张杨珠. 客土改良技术及其在砷污染土壤修复中的应用展望[J]. 中国生态农业学报, 2015(1): 20-26. HOU Li-yun, ZENG Xi-bai, ZHANG Yang-zhu. Application and outlook of alien earth soil-improving technology in arsenic-contaminated soil remediation[J]. Chinese Journal of Eco-Agriculture, 2015(1): 20-26. |
| [11] |
And S D, Hering J G. Comparison of arsenic(Ⅴ)and arsenic(Ⅲ) sorption onto iron oxide minerals:Implications for arsenic mobility[J]. Environmental Science & Technology, 2003, 37(18): 4182. |
| [12] |
Wolthers M, Charlet L, Weijden CHVD, et al. Arsenic mobility in the ambient sulfidic environment:Sorption of arsenic(Ⅴ)and arsenic (Ⅲ)onto disordered mackinawite[J]. Geochimica Et Cosmochimica Acta, 2005, 69(14): 3483-3492. DOI:10.1016/j.gca.2005.03.003 |
| [13] |
Valenzuela C, Campos VL, Yañez J, et al. Isolation of arsenite-oxidizing bacteria from arsenic-enriched sediments from Camarones River, Northern Chile[J]. Bulletin of Environmental Contamination and Toxicology, 2009, 82(5): 593-596. DOI:10.1007/s00128-009-9659-y |
| [14] |
莫于婷, 宋卫锋, 孙国萍, 等. 土壤中砷氧化细菌的分离及其培养条件研究[J]. 广西轻工业, 2009, 25(02): 83-84, 88. MO Yu-ting, SONG Wei-feng, SUN Guo-ping, et al. Isolation and culture conditions of arsenic oxidizing bacteria in soil[J]. Guangxi Journal of Light Industry, 2009, 25(2): 83-84, 88. DOI:10.3969/j.issn.1003-2673.2009.02.046 |
| [15] |
Zhang J, Zhou W, Liu B, et al. Anaerobic arsenite oxidation by an autotrophic arsenite-oxidizing bacterium from an arsenic-contaminated paddy soil[J]. Environmental Science & Technology, 2015, 49(10): 5956-5964. |
| [16] |
王革娇, 黄银燕, 李洁. "吃"砒霜的细菌——解析微生物的砷代谢[J]. 微生物学报, 2011, 51(02): 154-160. WANG Ge-jiao, HUANG Yin-yan, LI Jie. Bacteria live on arsenicanalysis of microbial arsenic metabolism[J]. Acta Microbiologica Sinica, 2011, 51(2): 154-160. |
| [17] |
钟松雄, 尹光彩, 陈志良, 等. Eh、pH和铁对水稻土砷释放的影响机制[J]. 环境科学, 2017, 38(6): 2530-2537. ZHONG Song-xiong, YIN Guang-cai, CHEN Zhi-liang, et al. Influencing mechanism of Eh, pH and iron on the release of arsenic in paddy soil[J]. Environmental Science, 2017, 38(6): 2530-2537. |
| [18] |
Zhao F J, Harris E, Yan J, et al. Arsenic methylation in soils and its relationship with microbial arsM abundance and diversity, and as speciation in rice[J]. Environmental Science & Technology, 2013, 47(13): 7147-7154. |
| [19] |
Salmassi T M, Kasthuri V, Masataka S, et al. Oxidation of arsenite by Agrobacterium albertimagni, AOL15, sp. nov., isolated from Hot Creek, California[J]. Geomicrobiology Journal, 2002, 19(1): 53-66. DOI:10.1080/014904502317246165 |
| [20] |
东秀珠, 蔡妙英. 常见细菌系统鉴定手册[M]. 北京: 科学出版社, 2001. DONG Xiu-zhu, CAI Miao-ying. Manual of systematic determinativefamiliar bacteriology[M]. Beijing: Science Press, 2001. |
| [21] |
Osborne C A, Galic M, Sangwan P, et al. PCR-generated artefact from 16S rRNA gene-specific primers[J]. Fems Microbiology Letters, 2005, 248(2): 183. DOI:10.1016/j.femsle.2005.05.043 |
| [22] |
Quéméneur M, Heinrichsalmeron A, Muller D, et al. Diversity surveys and evolutionary relationships of aoxB genes in aerobic arsenite-oxidizing bacteria[J]. Applied and Environmental Microbiology, 2008, 74(14): 4567-4573. DOI:10.1128/AEM.02851-07 |
| [23] |
Yamaguchi N, Nakamura T, Dong D, et al. Arsenic release from flooded paddy soils is influenced by speciation, Eh, pH, and iron dissolution[J]. Chemosphere, 2011, 83(7): 925-932. DOI:10.1016/j.chemosphere.2011.02.044 |
| [24] |
Giral M, Zagury G J, Deschênes L, et al. Comparison of four extraction procedures to assess arsenate and arsenite species in contaminated soils[J]. Environmental Pollution, 2010, 158(5): 1890-1898. DOI:10.1016/j.envpol.2009.10.041 |
| [25] |
Cullen W R, Reimer K J. Arsenic speciation in the environment[J]. Chemical Reviews, 2010, 89(4): 713-764. |
| [26] |
苏世鸣, 曾希柏, 白玲玉, 等. 微生物对砷的作用机理及利用真菌修复砷污染土壤的可行性[J]. 应用生态学报, 2010, 21(12): 3266-3272. SU Shi-ming, ZENG Xi-bai, BAI Ling-yu, et al. Action mechanisms of microorganisms on arsenic and the feasibility of utilizing fungi in remediation of arsenic-contaminated soil[J]. Chinese Journal of Applied Ecology, 2010, 21(12): 3266-3272. |
| [27] |
Oremland R S, Kulp T R, Blum J S, et al. A microbial arsenic cycle in a salt-saturated, extreme environment[J]. Science, 2005, 308(5726): 1305. DOI:10.1126/science.1110832 |
| [28] |
Rhine E D, Phelps C D, Young L Y. Anaerobic arsenite oxidation by novel denitrifying isolates[J]. Environmental Microbiology, 2006, 8(5): 899-908. DOI:10.1111/emi.2006.8.issue-5 |
| [29] |
周武先.淹水条件下水稻土中砷氧化菌对砷形态的影响及机制研究[D].南京: 南京农业大学, 2016. ZHOU Wu -xian. Effects of anaerobic arsenite oxidizing bacteria on arsenic speciation in flooded paddy soils[D]. Nanjing: Nanjing Agricultural University, 2016. http://cdmd.cnki.com.cn/Article/CDMD-10307-1017261721.htm |
| [30] |
Chen X P, Zhu Y G, Hong M N, et al. Effects of different forms of nitrogen fertilizers on arsenic uptake by rice plants[J]. Environmental Toxicology & Chemistry, 2008, 27(4): 881-887. |
| [31] |
Silver S, Phung L T. Genes and enzymes involved in bacterial oxidation and reduction of inorganic arsenic[J]. Applied & Environmental Microbiology, 2005, 71(2): 599-608. |
| [32] |
Mukhopadhyay R, Rosen B P, Le T P, et al. Microbial arsenic:From geocycles to genes and enzymes[J]. Fems Microbiology Reviews, 2002, 26(3): 311-325. DOI:10.1111/j.1574-6976.2002.tb00617.x |
| [33] |
Rhine E D, Chadhain S M Ní, Zylstra G J, et al. The arsenite oxidase genes(aroAB)in novel chemoautotrophic arsenite oxidizers[J]. Biochemical & Biophysical Research Communications, 2007, 354(3): 662-667. |
| [34] |
Jetten M S M, Logemann S, Muyzer G, et al. Novel principles in the microbial conversion of nitrogen compounds[J]. Antonie Van Leeuwenhoek, 1997, 71(1/2): 75-93. DOI:10.1023/A:1000150219937 |
| [35] |
Jia Y, Huang H, Chen Z, et al. Arsenic uptake by rice is influenced by microbe-mediated arsenic redox changes in the rhizosphere[J]. Environmental Science & Technology, 2014, 48(2): 1001-1007. |
| [36] |
李思妍, 史高玲, 娄来清, 等. P、Fe及水分对土壤砷有效性和小麦砷吸收的影响[J]. 农业环境科学学报, 2018, 37(3): 415-422. LI Si-yan, SHI Gao-ling, LOU Lai-qing, et al. Effects of P, Fe and water supply on arsenic availability in soil and accumulation in wheat seedlings[J]. Journal of Agro-Environment Science, 2018, 37(3): 415-422. |
| [37] |
Zhang J, Zhao S, Xu Y, et al. Nitrate stimulates anaerobic microbial arsenite oxidation in paddy soils[J]. Environmental Science & Technology, 2017, 51(8): 4377. |
 2018, Vol. 37
2018, Vol. 37