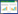文章信息
- 李勇超, 杨晓燕, 李艳苓, 耿兵
- LI Yong-chao, YANG Xiao-yan, LI Yan-ling, GENG Bing
- 微藻为营养源固定化硫酸盐还原菌对含铜废水动态去除试验研究
- Immobilized sulfate reducing bacteria beads using microalgae as nutrient source for effective biotreatment of copper-containing wastewater in an upflow anaerobic reactor
- 农业环境科学学报, 2018, 37(2): 332-339
- Journal of Agro-Environment Science, 2018, 37(2): 332-339
- http://dx.doi.org/10.11654/jaes.2017-1075
文章历史
- 收稿日期: 2017-08-08
- 录用日期: 2017-10-16
2. 中国农业科学院农业环境与可持续发展研究所, 农业清洁领域团队, 北京 100081
2. Agricultural Clear Watershed Group, Institute of Environment and Sustainable Development in Agriculture, Chinese Academy of Agricultural Sciences, Beijing 100081, China
随着铜矿的开发利用,酸性铜矿废水的产生量逐年增加。铜矿废水pH值较低,含有Cu、Cd、As等多种金属离子,且硫酸盐浓度较高,对矿区及附近的水体、土壤等造成严重的污染[1]。传统的处理方法主要是化学中和法,通过提高水体pH值,沉淀重金属,然而实际操作和维持运行的费用昂贵[2]。
利用硫酸盐还原菌(Sulfate-reducing bacteria,SRB)去除酸性矿山废水中的重金属受到环境工作者的广泛关注。SRB是唯一能够以SO42-作为最终电子受体进行无氧呼吸的微生物。SRB利用有机物作为电子供体,通过对有机物的分解代谢、电子传递、氧化等作用而获取生存所需的能量,同时将SO42-还原为S2-,而S2-可以与Cd2+和Cu2+等多种金属离子作用生成CdS和CuS沉淀从而将其除去[3]。有机物不仅是SRB的碳源,也是其能量来源,是SRB生长和代谢必需的物质[4-5]。但是酸性矿山废水中溶解性有机碳含量通常较低,不利于进行生物修复[6]。因此,需要向废水中投加有机物作为SRB生长的营养源。
目前学者认为乙醇[7]、乳酸[8]、葡萄糖[9]作为营养源成本较高。最近研究使用污水[10]、牲畜粪便[11]和蜜饯残渣[12]等有机废物作为外加有机物,但是它们很难被SRB全部利用,导致出水COD偏高,形成二次污染。同时金属离子会对SRB,尤其是游离的SRB产生一定的毒害作用[13],影响处理效果。总之,营养源及重金属离子的毒害作用成为抑制SRB去除重金属的主要因素。
微藻是自养型生物,以光能作为能源,可利用无机物质合成复杂的有机质,供自身需要,它是水体的初级生产者[14]。Oswald等[15]研究表明,高负荷氧化塘中的微藻经过发酵会产生硫化氢气体。而在其他水体和沉积物中微藻的分解同样导致了硫化物的释放,既微藻是硫酸盐还原过程中的营养源[16]。此外,Boshoff等[17]发现,Spirulina spp.(螺旋藻)可以作为SRB的营养源,每克螺旋藻对硫酸盐的还原能力在150 mg·d-1。另外,微藻能在光合作用的同时分泌细胞外聚合物,其主要成分是多聚糖(占胞外聚合物的40%~95%),与微藻本身相比这些物质更容易被SRB所利用[15, 18]。
基于此,本研究以微藻为SRB的营养源,并用特定材料将活性SRB与微藻包埋固定制备成小球,该微环境既有利于SRB对营养物质的利用,减少二次污染,又能降低重金属离子对SRB的毒害作用。然后在上流式厌氧反应器操作条件下进行含铜废水动态去除实验,为水体重金属污染SRB修复提供一定的借鉴。
1 材料与方法 1.1 硫酸盐还原菌的富集、分离与鉴定将取自延庆某牛场底泥按2%的接种量分装到含有Postgate′s C培养基[19]的厌氧瓶中,通36 min氮气,加塞放置在30 ℃的生化培养箱内黑暗培养,约7 d后,厌氧瓶内呈现极浓的黑色,并散发出臭鸡蛋气味,表明硫酸盐还原菌已经大量繁殖。然后重新按2%的接种量接入另一厌氧瓶中继续培养,如此反复操作5次。
利用Hungate滚管技术[20]完成SRB菌的分离。滚管前,先将各厌氧试管中4.5 mL Fe(NH4)2(SO4)2·6H2O的固体培养基在沸水浴中融化。用移液枪吸取0.5 mL菌液,注入第1支试管内,快速混匀后,再从第1支试管吸取0.5 mL菌液注入第2支试管,同时将第1支试管水平放置在冰浴中均匀滚动30 s。重复以上操作,将富集培养后的菌液稀释成10-1、10-2、10-3、10-4、10-5、10-6、10-7共7个梯度,30 ℃遮光培养,直到管内长出黑色菌落。从中挑取长势良好、浓黑色的单菌落,接种于液体培养基中,将变黑的菌液继续平板划线,挑取单菌落,作进一步的纯化。如此交替纯化直至平板菌落形态一致。
分别从2组平行实验中取对数生长期的新鲜SRB菌液,离心收集菌体,按试剂盒(北京普博欣生物)说明书提取菌株DNA,采用通用引物进行PCR扩增,16S rDNA序列的引物27F:5′-AGAGTTTGATCCTGGCTCAG-3′,1492R:5′-GGTTACCTTGTTACGACTT-3′。委托北京三博远志生物技术有限责任公司进行16S rDNA测序。
1.2 微藻的培育与水解发酵普通小球藻、斜生栅藻、羊角月牙藻、螺旋鱼腥藻从中国科学院武汉水生植物所购得,采用含有BG-11培养基[21]的营养液进行培养。
取出一定量的培养3 d后微藻溶液,多次离心分离,洗涤。将富集后的微藻放置500 mL厌氧瓶中,投加一定量的土壤上清液,通氮气20 min后,密封放入恒温培养箱进行发酵,测定溶液COD值和脂肪酸的含量。
1.3 以微藻为营养源固定化SRB微球的制备取1.342 g培养至对数期的微藻,灭活、离心后,与聚乙烯醇(PVA)投入到100 mL去离子水,加热至80 ℃,然后加入海藻酸钠、二氧化硅,形成凝胶溶液。待其冷却至30 ℃时,取一定体积的SRB菌液(1×108 cfu·mL-1),弃去上清液与凝胶溶液混合均匀。将凝胶菌藻溶液用胶头滴管滴入到含有2%~8%氯化钙的饱和硼酸溶液中,在室温下硬化24 h后取出,用7%生理盐水洗2~3次,冷藏备用。同时制备未投加微藻的固定化SRB微球作为对照实验。
设计一个五因素四水平正交实验,见表 1,以硫酸盐的去除率为主要指标,以微球的成球情况、质量传递、机械强度为辅助指标,对正交实验结果进行分析,确定固定化SRB微球的最佳制备条件。具体方法如下,机械强度测试:将固定化SRB小球放入100 mL注射器中,加一定的压力,观察小球的破损情况,其中小球外型完整记为机械强度极好,小球破裂数小于5个记为机械强度好,小球破裂数大于5个记为机械强度差。传质性能的测定:取数粒SRB固定化小球投入盛有200 mL自来水的锥形瓶中,滴加两滴亚甲蓝,定时观察亚甲蓝进入小球的情况,5 min内球心被染为蓝色传质性能记为极好,10 min内浸入球心传质性能记为好,20 min及以上传质性能记为差。硫酸根还原能力的测定:将固定化小球在500 mL锥形瓶底部铺匀,约2~3 cm厚,加满Na2SO4溶液,密封静置,测定SO42-去除率。
采用上流式厌氧生化反应器进行微藻为营养源固定化SRB微球处理含铜废水。上流式厌氧生化反应器为有机玻璃制成的圆柱,高420 mm,内径70 mm,径高比为1:6,净空体积约为750 mL,反应器设有直径为5 mm的进出水口。使用纯水配制SO42-浓度为1000 mg·L-1、Cu2+浓度为100 mg·L-1的模拟废水作为实验进水,调节初始pH为5.5,氮气除氧30 min。首先将微藻为营养源固定化SRB微球填充到整个反应器中,然后使用蠕动泵自下而上泵入含铜废水,以0.5 mL·min-1速度均匀通过反应器,水力停留时间为25 h,按照一定的时间间隔取样,测定出水中SO42-、Cu2+浓度以及COD值。两组反应器同时运行,各装置使用聚四氟乙烯管连接,见图 1。此外将未投加微藻的固定化SRB微球投入反应器,相同条件下运行,作为对照实验。

|
| 图 1 含铜废水动态去除实验装置图 Figure 1 The experimental setup diagram for wastewater treatment in the bench-scale continuous runs |
SO42-采用铬酸钡分光光度法测定,COD采用重铬酸钾法测定[22]。溶液pH值使用pH计(Mettler Toledo FE 20)测定,Cu2+使用ICP-OES仪(Leeman Labs Prodigy 7)测定。微藻发酵产物使用GC-MS(Shimadzu QP 2010)测定。
2 结果与讨论 2.1 分离硫酸盐还原菌株的形态及16S rDNA序列分析经过富集分离,得到一株硫酸盐还原菌,命名为GSRB,含铁固体培养基上呈凸起黑色,菌落直径1~3 mm,该菌株革兰氏染色呈阳性,无芽孢,菌株为弧形,做波浪式运动,大小为(0.4~0.5)μm×(2.0~2.3)μm。
菌株GSRB的16S rDNA序列分析所得到的碱基序列在GenBank上登录,登录号为MF521825。利用GenBank数据库进行同源序列搜索,并将细菌GSRB的16S rDNA序列与最接近的种系群体的16S rDNA序列进行对比,通过邻接法构建了它和同源性较高的6个菌株的系统发育树(图 2)。据此初步断定,GSRB为脱硫弧菌属(Desulfovibrio)的一个分支,它与Desulfovibrio sp. Strain KRS1的同源性达到83%,但系统发育树显示两者并不在种群的同一个分支。
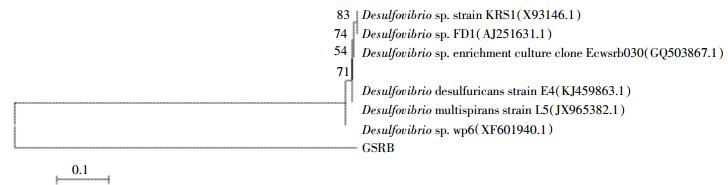
|
| 图 2 以16S rDNA为基础的菌株GSRB的系统发育树 Figure 2 Neighbor-joining phylogenetic tree based on 16S rDNA gene sequences |
图 3为微藻在发酵过程中每天溶液COD值的变化。可以看出,由于发酵前投加了一定量的土壤上清液,第1 d溶液COD值为1480~1620 mg·L-1,第2 d,除了普通小球藻,其他微藻溶液中的COD值开始增加。这表明在共存水解发酵菌的作用下发酵开始进行,随着反应的进行,虽然溶液COD值出现了波动,但总体来说,经过6 d发酵,发酵液COD值都有所增加。因为各微藻的成分不同,所以发酵容易程度和产物不尽相同,COD值也各不相同。尽管本研究没有对水解发酵细菌进行分离鉴定,但是实验现象表明了微藻的水解发酵确实存在。同时Zhang等[23]也指明,SRB与发酵细菌之间的协同作用可能是影响高效利用复杂有机质作为SRB碳源的关键。
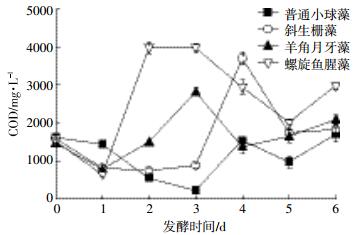
|
| 图 3 普通小球藻、斜生栅藻、羊角月牙藻、螺旋鱼腥藻发酵6 d后溶液COD值 Figure 3 COD value of solution after six days fermentation of microalgae(Chlorella vulgaris, Scenedesmus obliquus, Selenastrum capricornutum, Anabaena spiroides) |
表 2为发酵5 d后,各微藻溶液中的发酵产物。可以看出,普通小球藻的发酵产物67%为丙酸、丁酸等短链脂肪酸;斜生栅藻经过分解后88%为丙酸、丁酸、戊酸等;羊角月牙藻经过发酵,大部分分解产物为丁酸和碳酸;螺旋鱼腥藻76%以上分解产物为丙酸和戊酸。这说明各微藻在发酵菌的作用下易分解形成小分子脂肪酸。Cao等[24]考察了乙醇、挥发性脂肪酸、碳水化合物分别作为电子供体时,SRB生长情况及活性,结果表明小分子脂肪酸作为电子供体时,硫酸盐还原能力最强,其中以甲酸条件下,硫酸盐去除率最大,且最为经济。虽然本研究各微藻发酵产物几乎都不含甲酸和乙酸,但是丙酸、丁酸、戊酸同为小分子挥发性脂肪酸,所以最终选用发酵产物中挥发性脂肪酸比例最高的斜生栅藻作为SRB的包埋营养源。
以硫酸盐转化率为主要指标,以机械强度、传质性能、成球难易为辅助性指标,考察微藻为营养源固定化SRB小球体系最佳制备条件。表 3为正交实验结果与极差分析,其中k1、k2、k3和k4代表硫酸盐去除率的平均值,R代表该列的极差[25]。结果表明,实验2和15硫酸盐去除效果最好,硫酸盐去除率分别达93.4%和98.6%。各因素对硫酸盐去除率的影响由主到次排列为D>A>C>E>B(即二氧化硅用量>PVA用量>氯化钙用量>SRB包埋量>海藻酸钠用量)。可见,二氧化硅用量、PVA用量对硫酸盐去除能力的影响较大。通过对表 3中的k1、k2、k3和k4值进行比较,可知固定化SRB微球最优制备方案为A1B2C3D2E4,即PVA用量2%、海藻酸钠1%、CaCl2 6%、二氧化硅1%、SRB包埋量50 mL。
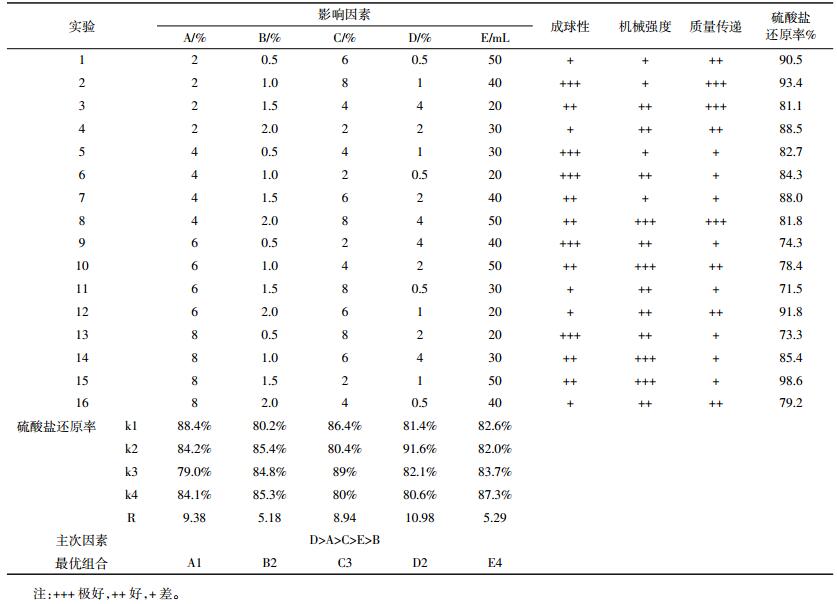
|
各因素水平对硫酸盐去除效应曲线见图 4。首先CaCl2中的Ca2+在包埋固定化过程中可与海藻酸根离子螯合形成不溶于水的海藻酸钙凝胶,从而将细胞固定,当CaCl2浓度较低时,会出现溶胀现象,不利于SO42-的还原,当CaCl2浓度过大又会影响小球的传质性,降低SRB菌的活性。其次是PVA的用量,当PVA的用量由2%到6%逐渐增加时,SO42-还原率不断降低,这是因为微球网络结构中交联点过多,结构致密,降低了微球的传质性能,从而影响到污染物的去除[26],当PVA含量达到8%时,SO42-还原率稍微增加,可能是PVA增加到一定程度,小球对SO42-的吸附作用增强。当二氧化硅含量为1%时,小球对SO42-还原率最高。SRB包埋量越大,SO42-的还原效果越好,但微生物包埋量不可过大,否则其在微球内部大量繁殖,可能导致细胞泄露,对水体造成二次污染[27]。海藻酸钠可改善使用PVA造成的成球困难和传质阻力大的不足,防止粘结,但它对SO42-的还原影响最小。
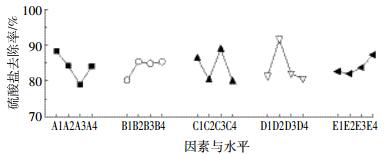
|
| 图 4 5种因素对硫酸盐去除率的影响趋势 Figure 4 Effect of five factors on sulfate reduction rate |
以斜生栅藻为营养源在最优制备条件下制备固定化SRB微球。图 5(a)和图 5(b)分别为新鲜制备的微藻为营养源固定化SRB微球和浸泡14 d后固定化微球的数码照片,图 5(c)为未投加微藻的SRB微球数码照片。可以看出,新鲜制备的微藻为营养源固定化SRB微球表面光滑,成球性好,无拖尾,粒径为2~3 mm,相对均匀。在水溶液中浸泡14 d后,微藻为营养源固定化SRB微球虽然出现了溶胀现象,但是整体来说微球没有发生破裂,机械强度较好,微生物细胞不会发生泄漏。然而空白微球因不含微藻,颜色较浅,呈规则球形。

|
| 图 5 新鲜制备的微藻为营养源固定化SRB微球(a)、水中浸泡14 d后的微藻为营养源固定化SRB微球(b)和新鲜制备的空白SRB微球(c)的数码照片 Figure 5 Digital photograph of fresh prepared immobilized SRB bead with microalgae as nutrient source(a), soaked in the water for 14 day(b), and immobilized SRB beads without microalgae as nutrient source(c) |
按照正交实验最优配比制备SRB微球,其中斜生栅藻的用量为1.432 g,硬化24 h,生理盐水洗涤3次后,装入上流式厌氧生化反应器内,监测出水COD值、SO42-、Cu2+离子浓度,结果见图 6、图 7、图 8。从图 6可以看出,第1 d,由于海藻酸钠微粒表面吸附作用导致对照实验和微藻为营养源固定化SRB微球填充反应器中出水硫酸盐浓度从1000 mg·L-1迅速降低至200 mg·L-1。随着含铜高硫酸盐废水连续进入反应器,对照组出水SO42-含量在第2 d迅速上升到751.96 mg·L-1,随后呈现出平稳增加的趋势,第45 d出水SO42-浓度为967.32 mg·L-1,接近进水SO42-浓度。对于微藻为营养源固定化SRB微球来说,经过第1 d吸附饱和后,第2 d出水中SO42-含量又重新升高,但是第5 d过后开始下降,第21 d最低至389.03 mg·L-1,后又缓慢上升,至第39 d出水SO42-含量同对照组相差不多。这主要是微藻为营养源固定化SRB微球中SRB经过5 d适应了环境,同时微藻易在共存发酵菌的作用下水解发酵,产生的小分子脂肪酸可被SRB菌作为营养源,将废水中SO42-经过代谢转换为S2-。经过20 d后大部分可降解微藻已被利用,再加上Cu2+不断累积造成对SRB菌的毒害,致使SRB菌的活性逐渐降低,还原能力下降,SO42-浓度开始逐渐上升,经过40 d左右的时间,上流式厌氧反应器中的固定化SRB微球彻底失效,出水SO42-浓度上升至对照水平。整体来说,在此运行条件下每克微藻作为营养源对SO42-的平均去除能力为182.17 mg·d-1。
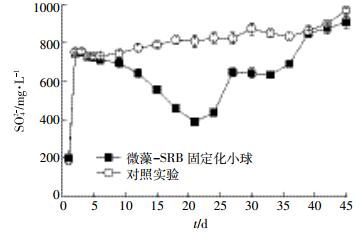
|
| 图 6 微藻为营养源固定化SRB微球连续化处理含铜废水SO42-变化 Figure 6 Sulfate content in the effluent from anaerobic reactor filled with immobilized SRB beads with microalgae as nutrient source |

|
| 图 7 微藻为营养源固定化SRB微球连续化处理含铜废水Cu2+变化 Figure 7 Copper ion content in the effluent from anaerobic reactor filled with immobilized SRB beads with microalgae as nutrient source |
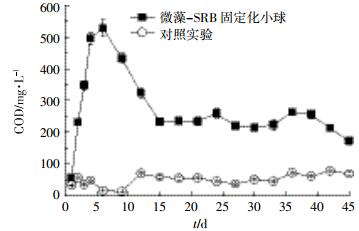
|
| 图 8 微藻为营养源固定化SRB微球连续化处理含铜废水出水COD值 Figure 8 COD value of the effluent from anaerobic reactor filled with immobilized SRB beads with microalgae as nutrient source |
从图 7可得,出水中Cu2+浓度变化趋势和SO42-并不同步,相对来说微球对Cu2+吸附作用更强,一方面是由于海藻酸钠微粒表面具有的羧基、羟基等化学基团与重金属离子发生络合作用[28];另一方面由于模拟废水中Cu2+浓度较SO42-低,海藻酸钠微粒表面与Cu2+螯合位点更多,从而反应前3 d对照组及固定化微球体系出水中Cu2+的含量均很低。反应5 d后吸附作用减弱,再加上营养物质匮乏,SRB活性很低,从而导致对照组出水Cu2+浓度迅速升高,18 d后Cu2+浓度为91.08 mg·L-1,33 d后接近进水中Cu2+含量。对于固定化SRB微球来说,前3 d反应器并没有明显的臭鸡蛋味和黑褐色沉淀,这说明Cu2+的去除以微球的吸附作用为主。此后,SRB活性被激发,硫酸盐还原作用明显,生成的大量S2-可与Cu2+形成CuS沉淀,污染物去除率达到98%以上,出水Cu2+含量维持在0.29~1.43 mg·L-1,达到《污水综合排放标准》(GB 8978—1996)对总铜的排放要求。反应36 d后,SRB的硫酸盐还原能力减弱,出水Cu2+浓度快速上升,反应第42 d出水Cu2+达到99.47 mg·L-1,系统完全失效。总之,在此运行条件下每克微藻对Cu2+的平均去除能力为45.28 mg·d-1。
图 8显示,固定化微球填充厌氧反应器运行1 d后出水的COD值为56 mg·L-1,从第2 d开始COD的值开始增加,这再次证明了共生的发酵细菌对微藻降解生成了有机物,但是前期SRB仍然处于停滞期,对营养物质的利用率小于微藻的降解速率。随着反应的进行,SRB适应了环境,硫酸盐还原能力大幅增强,对有机物的需求量增加,从而导致出水COD值在第6 d达到最大值,随后开始降低。第15 d以后,出水COD值为173~263 mg·L-1。此外,对照组SRB由于缺乏营养物质,出水COD值一直较低。Boshoff等[17]通过实验室规模的上流式厌氧反应器研究表明31%的Spirulina spp.(螺旋藻属)干固体可以作为SRB的碳源,当进水COD:SO42-为8:1时,最高的硫酸盐去除率达到90.3%,出水COD的值高达3000~5600 mg·L-1。虽然固定化SRB微球对硫酸盐的去除率不如文献[17]高,但是Boshoff等[17]在进水中投加了一定量的无机营养物可促进SRB的生长,其次,从其出水中较高的COD值可以看出此研究投加了大量的Spirulina spp.(螺旋藻属)干固体。尽管斜生栅藻水解后的脂肪酸并没有被SRB全部利用,但是它既保证了较高的硫酸盐还原力,而且出水COD值相对较低。综上,以微藻为营养源固定化SRB微球的形成,不仅可以减少含铜废水对SRB的毒害作用以得到满意的处理效果,而且可保证出水中含有较低的有机物,减少二次污染。
3 结论(1)从牛场底泥中筛选分离出一株硫酸盐还原菌菌株,经16S rDNA测序,发现该菌株为脱硫弧菌属(Desulfovibrio)的一个分支。
(2)普通小球藻、斜生栅藻、羊角月牙藻、螺旋鱼腥藻在发酵细菌作用下能够生成丙酸、丁酸、戊酸等小分子有机酸,可为SRB代谢提供碳源和能源,其中斜生栅藻发酵产物最佳,选为包埋微藻。
(3)以硫酸盐转化率为主要指标,正交实验表明微藻为营养源固定化SRB微球的最佳制备条件为PVA用量2%、海藻酸钠1%、CaCl2 6%、二氧化硅1%、SRB包埋量50 mL。在该条件下,固定化SRB微球成球性好、粒径(2~3 mm)相对均匀、水中浸泡14 d无破裂。
(4)将新鲜制备的固定化微球填充到上流式厌氧反应器,在进水SO42-浓度为1000 mg·L-1、Cu2+浓度为100 mg·L-1、pH为5.5、水力滞留时间为25 h的条件下,运行36 d之前出水Cu2+含量维持在0.29~1.43 mg·L-1,达到《污水综合排放标准》对总铜的要求;而且出水COD值较低,大幅降低了二次污染。
| [1] |
Cai L M, Xu Z C, Qi J Y, et al. Assessment of exposure to heavy metals and health risks among residents near Tonglushan mine in Hubei, China[J]. Chemosphere, 2015, 127: 127-135. DOI:10.1016/j.chemosphere.2015.01.027 |
| [2] |
Hlabel P, Maree J, Bruinsma D, et al. Barium carbonate process for sulphate and metal removal from mine water[J]. Mine Water and the Environment, 2007, 26(1): 14-22. DOI:10.1007/s10230-007-0145-7 |
| [3] |
McCauley C A, O'Sullivan A D, Milke M W, et al. Sulfate and metal removal in bioreactors treating acid mine drainage dominated with iron and aluminum[J]. Water Research, 2009, 43(4): 961-970. DOI:10.1016/j.watres.2008.11.029 |
| [4] |
Zagury G J, Kulnieks V I, Neculita C M. Characterization and reactivity assessment of organic substrates for sulphate-reducing bacteria in acid mine drainage treatment[J]. Chemosphere, 2006, 64(6): 944-954. DOI:10.1016/j.chemosphere.2006.01.001 |
| [5] |
Martins M, Faleiro M L, Barros R J, et al. Biological sulphate reduction using food industry wastes as carbon sources[J]. Biodegradation, 2009, 20(4): 559-567. DOI:10.1007/s10532-008-9245-8 |
| [6] |
Li Y C, Hu X X, Ren B R. Treatment of antimony mine drainage:Challenges and opportunities with special emphasis on mineral adsorption and sulfate reducing bacteria[J]. Water Science & Technology, 2016, 73(9): 2039-2051. |
| [7] |
Pagnanelli F, Cruz Viggi C, Cibati A, et al. Biotreatment of Cr(Ⅵ) contaminated waters by sulphate reducing bacteria fed with ethanol[J]. Journal of Hazardous Materials, 2012, 199/200(2): 186-192. |
| [8] |
Najib T, Solgi M, Farazmand A, et al. Optimization of sulfate removal by sulfate reducing bacteria using response surface methodology and heavy metal removal in a sulfidogenic UASB reactor[J]. Journal of Environmental Chemical Engineering, 2017, 5(4): 3256-3265. DOI:10.1016/j.jece.2017.06.016 |
| [9] |
Singh R, Kumar A, Kirrolia A, et al. Removal of sulphate, COD and Cr(Ⅵ) in simulated and real wastewater by sulphate reducing bacteria enrichment in small bioreactor and FTIR study[J]. Bioresource Technology, 2011, 102(2): 677-682. DOI:10.1016/j.biortech.2010.08.041 |
| [10] |
McCullough C D, Lund M A, May J M. Field-scale demonstration of the potential for sewage to remediate acidic mine waters[J]. Mine Water & the Environment, 2008, 27(1): 31-39. |
| [11] |
Zhang M L, Wang H X. Organic wastes as carbon sources to promote sulfate reducing bacterial activity for biological remediation of acid mine drainage[J]. Minerals Engineering, 2014, 69(69): 81-90. |
| [12] |
Das B K, Roy S, Dev S, et al. Improvement of the degradation of sulfate rich wastewater using sweetmeat waste(SMW) as nutrient supplement[J]. Journal of Hazardous Materials, 2015, 300: 796-807. DOI:10.1016/j.jhazmat.2015.08.013 |
| [13] |
Hao T W, Xiang P Y, Mackey H R, et al. A review of biological sulfate conversions in wastewater treatment[J]. Water Research, 2014, 65: 1-21. DOI:10.1016/j.watres.2014.06.043 |
| [14] |
刘林林, 黄旭雄, 危立坤, 等. 15株微藻对猪场养殖污水中氮磷的净化及其细胞营养分析[J]. 环境科学学报, 2014, 34(8): 1986-1994. LIU Lin-lin, HUANG Xu-xiong, WEI Li-kun, et al. Removal of nitrogen and phosphorus by 15 strains of microalgae and their nutritional values in piggery sewage[J]. Acta Scientiae Circumstantiae, 2014, 34(8): 1986-1994. |
| [15] |
Oswald W J, Golueke C G, Cooper R C, et al. Water reclamation, algal production and methane fermentation in waste ponds[J]. Advances in Water Pollution Research, 1964, 7(3): 119-157. |
| [16] |
Nedergaard R I, Risgaard-Peterson N, Finster K. The importance of sulfate reduction associated with Ulva lactuca thalli during decomposition:a mesocosm experiment[J]. Journal of Experimental Marine Biology & Ecology, 2002, 275(1): 15-29. |
| [17] |
Boshoff G, Duncan J, Rose P D. The use of micro-algal biomass as a carbon source for biological sulfate reducing systems[J]. Water Research, 2004, 38(11): 2659-2666. DOI:10.1016/j.watres.2004.03.031 |
| [18] |
Kalin M, Wheeler W N, Meinrath G. The removal of uranium from mining wastewater using algal microbial biomass[J]. Journal of Environmental Radioactivity, 2005, 78(2): 151-177. |
| [19] |
Postgate J R. The sulfate-reducing bacteria[M]. 2nd Edition. UK Cambridge: Cambridge University Press, 1984.
|
| [20] |
Hungate R E, Macy J. The roll-tube method for cultivation of strict anaerobes[J]. Bulletins from the Ecological Research Committee, 1973, 3(17): 123-126. |
| [21] |
沈丹丹. 富油及富淀粉微藻培养与奶牛场废水处理相结合的效果研究[D]. 广州: 暨南大学, 2013. SHEN Dan-dan. Integrated the biomass production of oleaginous and starch-rich microalgae and dairy wastewater treatment[D]. Guangzhou: Jinan University, 2013. http://cdmd.cnki.com.cn/Article/CDMD-10559-1013027649.htm |
| [22] |
国家环境保护总局. 水和废水监测分析方法[M]. 四版. 北京: 中国环境科学出版社, 2002, 211-212. State Environmental Protection Administration. Methods for monitoring and analysis of water and wastewater[M]. 4th Edition. Beijing: China Environmental Science Press, 2002, 211-212. |
| [23] |
Zhang M L, Wang H X, Han X M, et al. Preparation of metal-resistant immobilized sulfate reducing bacteria beads for acid mine drainage treatment[J]. Chemosphere, 2016, 154: 215-223. DOI:10.1016/j.chemosphere.2016.03.103 |
| [24] |
Cao J Y, Zhang G J, Mao Z S, et al. Influence of electron donors on the growth and activity of sulfate-reducing bacteria[J]. International Journal of Mineral Processing, 2012, 106-109: 58-64. DOI:10.1016/j.minpro.2012.02.005 |
| [25] |
张鸿郭, 李猛, 罗海玲, 等. 固定化硫酸盐还原菌除铅包埋条件优化研究[J]. 环境科学与技术, 2017, 40(2): 9-12. ZHANG Hong-guo, LI Meng, LUO Hai-ling, et al. Optimizing embedding conditions of immobilized sulfate reducing bacteria for lead removal[J]. Environmental Science & Technology, 2017, 40(2): 9-12. |
| [26] |
郑佩, 陈芳艳, 唐玉斌. 固定化菌藻微球的制备、表征及其对富营养化湖水的修复[J]. 环境工程学报, 2014, 8(5): 1999-2005. ZHANG Pei, CHEN Fang-yan, TANG Yu-bin. Preparation, characterization of immobilized bacteria-algae microspheres and bioremediation of eutrophic lake water[J]. Chinese Journal of Environmental Engineering, 2014, 8(5): 1999-2005. |
| [27] |
Ruiz-Marin A, Mendoza-Espinosal L G, Stephenson T. Growth and nutrient removal in free and immobilized green algae in batch and semi-continuous cultures treating real wastewater[J]. Bioresource Technology, 2010, 101(1): 58-64. DOI:10.1016/j.biortech.2009.02.076 |
| [28] |
Bayramoglu G, Arica M Y. Construction a hybrid biosorbent using Scenedesmus quadricauda and Ca-alginate for biosorption of Cu(Ⅱ), Zn(Ⅱ) and Ni(Ⅱ):Kinetics and equilibrium studies[J]. Bioresource Technology, 2009, 100(1): 186-193. DOI:10.1016/j.biortech.2008.05.050 |
 2018, Vol. 37
2018, Vol. 37