文章信息
- 李思妍, 史高玲, 娄来清, 蔡庆生
- LI Si-yan, SHI Gao-ling, LOU Lai-qing, CAI Qing-sheng
- P、Fe及水分对土壤砷有效性和小麦砷吸收的影响
- Effects of P, Fe and water supply on arsenic availability in soil and accumulation in wheat seedlings
- 农业环境科学学报, 2018, 37(3): 415-422
- Journal of Agro-Environment Science, 2018, 37(3): 415-422
- http://dx.doi.org/10.11654/jaes.2017-1251
文章历史
- 收稿日期: 2017-09-13
- 录用日期: 2017-11-15
2. 江苏省农业科学院粮食作物研究所, 南京 210014
2. Institute of Food Crops, Jiangsu Academy of Agricultural Sciences, Nanjing 210014, China
砷是自然界中广泛存在的一种有毒元素。中国是受砷污染最严重的国家之一,2014年《全国土壤污染状况调查公报》显示,土壤砷污染的点位超标率为2.7%。水体和土壤的砷污染现象在湖南、广东、广西、内蒙古等地均有报道[1-2]。土壤中的砷通过在农作物可食部位的积累而进入食物链,这是人体摄入砷的主要来源之一。研究结果表明,在砷污染区生长的水稻、小麦和蔬菜中砷的含量明显增加[3-4],长期摄入砷污染超标的食物,会增加人体健康风险。有效降低农作物对砷的积累是合理利用中轻度污染土地、降低砷对人体健康危害的有效途径之一。2016年国务院出台《土壤污染防治行动计划》,提出根据耕地污染状况和农产品超标情况,结合当地主要作物品种和种植习惯,制定实施受污染耕地安全利用方案。
植物对砷的吸收量主要取决于土壤溶液中砷的化学形态和生物有效性。降低土壤中砷的生物有效性是减少砷在农作物中积累的主要方式之一。外源砷进入土壤后,一小部分溶解在土壤溶液中,一部分吸附在土壤胶体上,大部分转化为难溶性砷化物[5]。砷在土壤中的结合形态可分为溶解在土壤溶液中的砷(水溶态砷)、吸附在土壤粘粒和其他金属难溶盐表面的砷(交换态砷)、形成难溶性的砷酸盐(难溶态砷)3类[6]。一般而言,水溶性和交换态砷生物有效性相对较高,易被根系吸收,为土壤活性砷,而第三种难溶态砷因其难溶性则不易被生物吸收[7]。因此,改变土壤中不同砷结合形态的比例可改变土壤中砷的生物有效性,从而影响植物对砷的吸收。
土壤中砷的生物有效性取决于土壤中砷的形态(无机或有机)、土壤pH、Eh(氧化还原电位)[8]以及其他金属离子和磷的含量[9]。研究表明,土壤中存在大量的铁对As(Ⅴ)具有很强的吸附和结合能力[10-12]。外源铁的施加可有效降低土壤中砷的生物有效性,降低水稻对砷的吸收[13]。土壤Eh较低时,土壤中砷和铁氧化物被还原,导致铁氧化物吸附的砷进入土壤溶液[14-16],铁的还原还导致砷从含铁矿物中解析出来[17]。而磷与砷的化学结构相似,可以竞争土壤中砷的结合位点,从而增加土壤中砷的生物有效性[18]。然而,由于植物对As(Ⅴ)的吸收是通过磷转运蛋白来完成,磷会竞争性抑制植物对砷的吸收[19]。因此,在不同土壤条件下,磷的施加会增加还是降低植物对砷的吸收还需个案研究。此外,不同形式的磷酸盐加入土壤后,由于不同阳离子的存在可能会对土壤的理化性质产生影响,从而也会影响土壤中砷的结合状态和砷的生物有效性。
综上所述,在不同氧化还原条件下,土壤中铁和磷的含量与砷的移动性有着密切的关系。本研究通过向土壤中添加3种形式的磷酸盐和FeCl3,并结合不同的水分处理分析这3种因素对土壤中砷的结合状态及植物对砷吸收的影响,为砷污染土壤的修复与利用提供参考。
1 材料与方法 1.1 供试土壤砷污染土壤采自广东省汕头市莲花山钨矿区周边的稻田,此地为亚热带季风气候,年平均气温21.1 ℃,平均降水量1444 mm[20]。采样点位于钨矿南部,距离钨矿约4 km,土壤类型为粘壤土。非污染土壤采自南京市南京农业大学实验基地,土壤类型为黄棕壤。耕作层土壤采集后经自然风干,过4 mm筛。过筛后将砷污染土壤、干净河沙和非污染土壤以4:2:4比例混合均匀,平衡待用。平衡后的混合土壤中砷的最终浓度为141.1 mg·kg-1,土壤氮、磷、钾的总量分别为1.24、1.41、11.2 g·kg-1,土壤pH值为7.01。
1.2 供试材料本实验所用的小麦为冬小麦(Triticum aestivum L.),品种为镇麦5号。
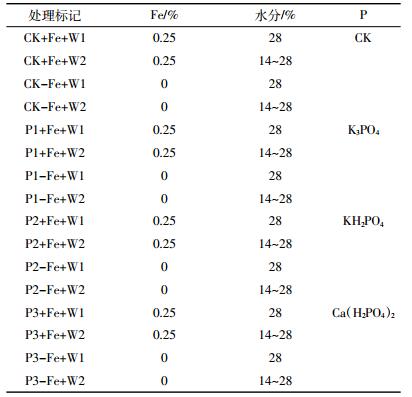
1.3 盆栽试验实验于温室内进行。每盆装入1 kg混合均匀的供试土壤,并预埋两个土壤溶液采集器,采用磷、铁及不同土壤水分含量复合处理。选用3种不同的磷酸盐[P1:K3PO4,P2:KH2PO4,P3:Ca(H2PO4)2]处理,其施加量为200 mg·kg-1 P2O5,以不加磷的组为对照;铁以FeCl3形式提供(浓度为0.25% Fe,W:W);磷和铁均以溶液的形式加入,即将不同的磷酸盐和FeCl3分别配制成溶液,将一定体积的溶液分别倒入盆托中,由下向上吸取,铁处理3 d后再加磷处理;磷和铁加入后,以称重的方式保持不同水分处理(W1:水分含量28%,W2:干湿交替处理,水分含量为14%~28%)。具体处理情况见表 1,每个处理设置5个重复。每隔15 d用土壤溶液采集器取一次土壤溶液,用于测定土壤溶液中的砷含量。取完第二次土壤溶液后,将露白的小麦种子均匀播种到上述盆钵中,播种7 d后间苗,每盆留8棵。播种15 d后再取一次土壤溶液。播种6周后将小麦从地上0.5 cm处剪下,洗净后放置在标记好的信封里,60 ℃烘至恒重,用于测定砷含量。植物收获后,将每盆全部土壤自然风干、去除根系、敲碎混匀后取少量用于测定土壤中各种结合态砷的含量及土壤pH值。
土壤过2 mm筛后,按土水比为1:2.5(W:V)的比例混合,室温下振荡0.5 h,用pH计测定土壤pH值。土壤总氮含量参考Avery和Bascomb[21]的方法检测。总砷、磷和钾的测定参考USEPA 3052中的方法[22],用ICP-OES(ICP-OES:Optima 2100DV,PerkinElmer,Waltham,MA)测定。土壤中不同结合态砷的提取参考Wenzel等[23]的方法。各溶液中砷含量用原子荧光光度计(HG-AFS,AFS-8230,北京吉天仪器有限公司)测定。将烘干的小麦样品磨碎后用HNO3-H2O2进行微波消煮,消煮完全后定容至10 mL,砷含量用原子荧光光度计测定。
1.5 数据处理所有数据运用SPSS 20.0和Microsoft Excel 2010进行统计分析。
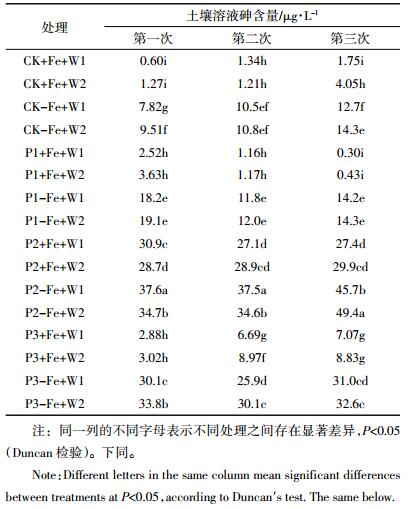
2 结果与分析 2.1 土壤溶液砷含量表 2为土壤溶液中砷含量。结果显示,在3次提取的土壤溶液中,各处理之间砷的含量存在显著差异。与不加铁的处理相比,加铁能显著降低土壤溶液中砷的含量;而不管在加铁还是不加铁的条件下,几种形态的磷均能显著增加土壤溶液中砷的含量,其中以KH2PO4和Ca(H2PO4)2的增加效果更为明显。对于不同水分处理来说,干湿交替(即W2处理)处理条件下,土壤溶液中砷的含量普遍高于饱和水处理(即W1处理)处理,部分处理达到显著水平。对于不同处理时间来讲,第三次取样时土壤溶液中砷的含量略高于前两次。
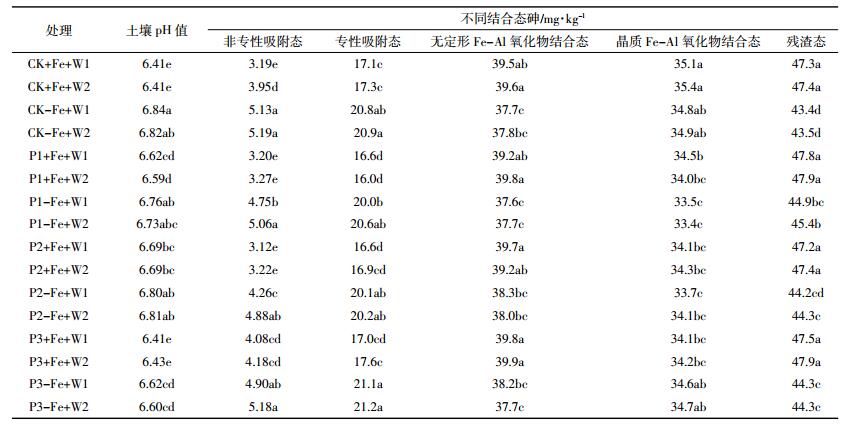
与不加铁的处理相比,外源添加铁显著降低了土壤的pH值(表 3)。而磷酸盐对土壤pH值的影响在加铁和不加铁的条件下有所不同。在不加铁的条件下,除Ca(H2PO4)2处理pH值降低外,其他两种磷酸盐处理对土壤pH没有显著影响;而在加铁的条件下,与不加磷的处理组相比,向土壤中添加K3PO4和KH2PO4则提高土壤pH值。在各种磷酸盐和铁处理条件下,不同水分处理对土壤pH值没有显著影响。
土壤各结合态砷的含量见表 3。非专性吸附态砷在土壤中所占比例最低,加铁处理后可显著降低土壤中非专性吸附态砷的含量;磷对非专性吸附态砷含量的影响没有铁明显,除个别处理外,磷处理时非专性吸附态砷含量与不加磷的对照相比没有显著差异。W2处理时土壤中非专性吸附态砷的含量普遍高于W1处理,部分处理达到显著水平。专性吸附态砷的含量与非专性吸附态砷含量的变化趋势相似,加铁处理可显著降低其含量。与非专性吸附态砷和专性吸附态砷含量趋势相反,加铁显著增加土壤中无定形Fe-Al氧化物结合态和残渣态砷的含量,磷和水分处理对土壤无定形Fe-Al氧化物结合态砷没有显著影响;不加铁的条件下,3种磷酸盐处理均显著增加土壤中残渣态砷的含量,不同水分处理对残渣态砷的含量没有显著影响。晶质Fe-Al氧化物结合态砷不受外源Fe和水分处理的影响,而不同磷酸盐处理则可以降低其含量。
土壤中不同结合态的砷含量存在显著差异,其中残渣态砷的含量最高,可以占到土壤总砷量的33%左右,其次是无定形Fe-Al氧化物结合态,约占土壤总砷量的27%;而非专性吸附态含量最低,仅占土壤总砷量的2%~3%,其次是专性吸附态,占土壤总砷量的12%左右。加铁处理可显著降低土壤非专性吸附态和专性吸附态砷所占的比例,而增加了其他3种结合态砷的比例。除个别处理外,磷和水分处理对土壤各提取态砷的比例没有显著影响(图 1)。
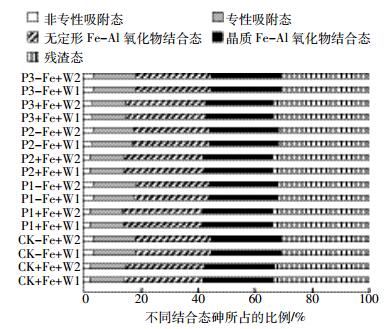
|
| 图 1 不同处理条件下土壤中不同结合态砷占土壤总砷的百分比 Figure 1 The proportion of arsenic phase in soil under different treatments |
生长6周后,小麦地上部生物量不受铁和水分处理的影响,不同形态的磷处理能降低小麦幼苗地上部的生物量(图 2A)。在加铁的条件下,KH2PO4和Ca(H2PO4)2处理显著降低小麦生物量。小麦幼苗地上部砷含量见图 2B。3种磷酸盐处理均可显著增加小麦幼苗中砷的含量,在加铁和不加铁的两种情况下,加磷后小麦地上部砷含量分别增加73%~99%和86%~99%,3种磷酸盐处理之间没有显著差异。而加铁则显著降低砷含量,与不加铁处理相比,加铁后小麦地上部砷含量降低8.2%~18%。除个别处理外,不同水分处理对砷含量没有显著影响。
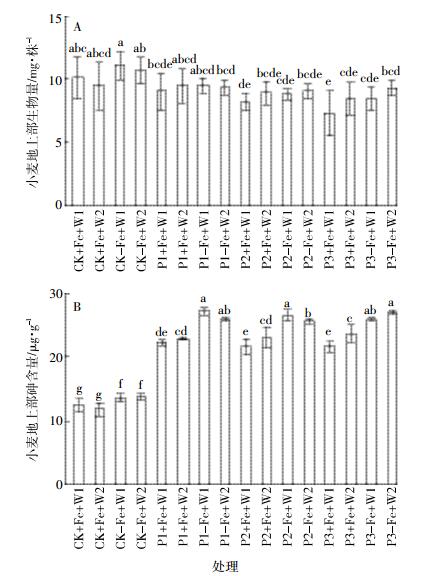
|
| 数据为平均值±SD(n=5),误差线上的不同字母代表在P < 0.05水平上存在显著性差异(Duncan检测) Data are means±SD(n=5). Bars with different letters are significantly different at P < 0.05 according to Duncan′s test 图 2 不同处理条件下小麦地上部分生物量(A)和砷含量(B) Figure 2 Dry weights(A) and As concentration(B) in shoots of wheat seedlings under different treatments |
土壤中各种结合态砷与小麦地上部砷含量和生物量的相关性见表 4。小麦地上部生物量与土壤中专性吸附态和晶质Fe-Al氧化物结合态砷呈显著正相关(P<0.05),与残渣态砷含量之间呈显著负相关(P<0.05),与无定形Fe-Al氧化物结合态砷含量的相关性达极显著水平(P<0.01)。地上部砷含量与土壤溶液砷含量、非专性吸附态和专性吸附态砷含量呈正相关,而与无定形Fe-Al氧化物结合态、晶质Fe-Al氧化物结合态和残渣态砷含量呈负相关,其中与专性吸附态砷含量和无定形Fe-Al氧化物结合态砷含量的相关性达显著水平(P<0.05),与土壤溶液砷含量和晶质Fe-Al氧化物结合态砷含量的相关性达极显著水平(P<0.01、P<0.001)。地上部砷含量和生物量之间存在极显著负相关(P<0.01)。
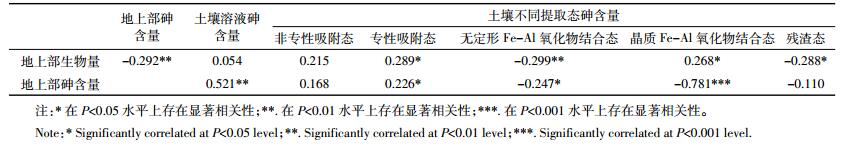
|
植物根系从土壤中吸收各种元素(包括必需元素和非必需元素),因此改变土壤中元素的溶解性和各种结合状态,可影响植物对元素的吸收。植物对砷的吸收量主要取决于土壤溶液中砷的化学形态和生物有效性[16]。改变土壤中砷的结合状态,可改变植物对砷的吸收。研究表明,铁和磷是影响土壤砷生物有效性的重要因素[24]。铁氧化物和氢氧化物在土壤中大量存在,对砷具有很强的吸附能力[11]。它们可以通过专性或非专性表面吸附或与砷形成难溶性沉淀物[12]来降低土壤中砷的生物有效性[25]。外源添加铁可有效降低土壤中砷的生物有效性,降低植物对砷的吸收[26]。本研究表明,外源施加FeCl3后,改变了土壤中砷的移动性,显著降低土壤溶液中砷的含量,从而降低了小麦地上部砷的含量(图 2)。外源FeCl3的施加也显著降低了土壤溶液中的砷含量,减少了土壤中非专性吸附态和专性吸附态砷的比例,增加了残渣态砷的比例。这可能与铁对土壤中砷的吸附有关,加铁后土壤中会形成更多的铁氧化合物,这些铁氧化物可与砷结合形成难溶性的沉淀物[16],从而导致土壤中残渣态砷的含量升高,而植物可吸收的非专性吸附态和专性吸附态砷的含量降低(表 3)。这与前人的研究结果类似,Yuan等[27]的研究结果发现,当FeHP施加量为10%时,土壤中NaHCO3提取态As的固化效率达69%。Kumpiene等[28]也报道,与不加铁的处理相比,施加Fe(0)使污染土壤溶液中As和Cr的含量分别降低99%和94%,而植物地上部含量分别减少84%和95%。铁进入土壤后,会形成无定形铁,无定形铁有巨大的比表面积和很强的表面化学活性,能强烈吸附砷酸盐和亚砷酸盐[29],铁的氧化,导致铁表面二价铁、三价铁及其氧化物膜的形成,这些物质在铁表面形成了许多砷的吸附位点,通过与砷形成内部双齿型球状复合物或通过表面沉淀作用覆盖于铁的表面,从而降低了土壤中砷的活性[29]。从形态上分析,铁固定土壤砷的机理主要是铁在土壤中转化为AO-Fe、C-Fe、Mn-Fe等能强吸附砷或与砷共沉淀的形态铁,与土壤中的各形态砷反应,将其转化为稳定性强的Rs-As[30],进而稳定、固定土壤中的砷。此外,由于外源FeCl3进入土壤后,会发生水解反应[FeCl3→Fe3++3Cl-;Fe3++3H2O→Fe(OH)3+3H+],产生大量的Cl-和H+,使土壤酸化[31-32]。随着pH值的降低,土壤胶体颗粒表面正电荷增加,因此砷的吸附量增加[26]。这也是其降低土壤砷移动性的一个主要原因。很多研究均表明,土壤中砷的形态受土壤pH影响[16],pH的增加与土壤中砷的移动性具有显著的正相关性[9]。
3.2 磷对土壤砷有效性和小麦砷吸收的影响由于磷与砷化学结构相似,具有类似的化学性质,磷可以竞争性地抑制植物对砷的吸收。但是另一方面,磷也可以将土壤颗粒吸附的砷释放出来,从而增加土壤中砷的生物有效性。谢正苗等[33]的研究结果表明,施用100 mg·kg-1磷后,土壤水溶性砷的含量超过不加磷的3倍。本实验结果显示,施加不同形态的磷酸盐后,土壤溶液中砷的浓度显著增加,其中以不加铁的Ca(H2PO4)2处理增加效果最明显,但对土壤不同提取态的砷影响效果不明显。磷的施加显著增加了小麦地上部砷的含量。因此,本研究结果表明土壤中外加磷后,磷对土壤中砷移动性增加而导致小麦对砷吸收增加的效果要明显大于磷与砷竞争根系通道的结果。但对于不同磷酸盐来说,虽然不同磷酸盐处理时土壤溶液中砷的浓度差异显著,但这并没有影响植物对砷的吸收,这可能与土壤溶液中的磷竞争性地抑制了植物根系对砷的吸收有关[34]。另外,植物根系对砷的吸收依赖于根系中磷转运蛋白的表达,当磷供应充足时,植物根系磷转运蛋白的表达减少,因此对砷的吸收也有影响。
3.3 不同水分含量对土壤砷有效性和小麦砷吸收的影响水分通过影响土壤的pH和Eh来影响土壤中砷的可利用性。有研究结果显示,淹水条件下,土壤中砷的溶解度[35]和生物有效性都大幅增加[15]。这是由于在厌氧条件下,土壤Eh较低[36],土壤中砷和铁氧化物被还原[14],导致铁氧化物吸附的砷进入土壤溶液,铁的还原还导致砷从含铁矿物中解析出来[17]。另外,厌氧条件下,土壤中发生的一系列还原反应还会导致土壤pH上升,这也促进了砷的解吸[16]。在本实验中饱和水处理时土壤溶液和土壤各提取态砷的含量略高于干湿交替处理,但没有显著差异,通过比较不同处理的土壤pH(表 3)发现W1、W2的不同处理并不能造成土壤pH的显著变化,从而解释了上述结论。
总之,植物对砷的吸收受多种因素的影响,除土壤中砷的可利用性外,植物根系对砷的亲和能力也会影响植物对砷的吸收。另外,其他因素,如土壤微生物、土壤营养状态及土壤有机质含量等均会影响植物对砷的吸收能力。
4 结论(1)外源FeCl3显著降低土壤中两种吸附态砷的含量,减少植物对砷的吸收。
(2)3种磷酸盐不同程度地增加了土壤溶液中砷的含量,而对土壤中非专性吸附态和专性吸附态砷的含量没有显著影响,小麦地上部对砷的积累量在3种磷酸盐处理之间也没有显著差异。
(3)除个别处理外,不同水分处理对土壤中砷的形态和植物的吸收没有显著差异。
| [1] |
Neidhardt H, Norra S, Tang X, et al. Impact of irrigation with high arsenic burdened groundwater on the soil-plant system:Results from a case study in the Inner Mongolia, China[J]. Environmental Pollution, 2012, 163(4): 8-13. |
| [2] |
Wei C Y, Ge Z F, Chu W S, et al. Speciation of antimony and arsenic in the soils and plants in an old antimony mine[J]. Environmental and Experimental Botany, 2015, 109: 31-39. DOI:10.1016/j.envexpbot.2014.08.002 |
| [3] |
Shi G L, Zhu S, Bai S N, et al. The transportation and accumulation of arsenic, cadmium, and phosphorus in 12 wheat cultivars and their relationships with each other[J]. Journal of Hazardous Material, 2015, 299: 94-102. DOI:10.1016/j.jhazmat.2015.06.009 |
| [4] |
Rehman Z U, Khan S, Qin K, et al. Quantification of inorganic arsenic exposure and cancer risk via consumption of vegetables in southern selected districts of Pakistan[J]. Science of Total Environment, 2016, 550: 321-329. DOI:10.1016/j.scitotenv.2016.01.094 |
| [5] |
刘文菊, 赵方杰. 植物砷吸收与代谢的研究进展[J]. 环境化学, 2011, 16(30): 56-62. LIU Wen-ju, ZHAO Fang-jie. A brief review of arsenic uptake and metabolism in plants[J]. Environmental Chemistry, 2011, 16(30): 56-62. |
| [6] |
李青青, 金大成, 罗启仕, 等. 场地土壤稳定化后有效态砷的浸出及影响因素[J]. 环境科学与技术, 2013, 36(12): 65-69. LI Qing-qing, JIN Da-cheng, LUO Qi-shi, et al. Leaching effect of available arsenic in site contaminated soil by stabilization[J]. Environmental Science & Technology, 2013, 36(12): 65-69. |
| [7] |
李月芬, 王冬艳, 汤洁, 等. 吉林西部土壤砷的形态分布及其与土壤性质的关系研究[J]. 农业环境科学学报, 2012, 30(31): 516-522. LI Yue-fen, WANG Dong-yan, TANG Jie, et al. Speciation of soil arsenic and its correlation with soil properties in western Jilin Province, China[J]. Journal of Agro-Environment Science, 2012, 30(31): 516-522. |
| [8] |
Liu C, Yu H Y, Liu C, et al. Arsenic availability in rice from a mining area:Is amorphous iron oxide-bound arsenic a source or sink?[J]. Environmental Pollution, 2015, 199: 95-101. DOI:10.1016/j.envpol.2015.01.025 |
| [9] |
Honma T, Ohba H, Kaneko-Kadokura A, et al. Optimal soil Eh, pH, and water management for simultaneously minimizing arsenic and cadmium concentrations in rice grains[J]. Environmental Science and Technology, 2016, 50(8): 4178-4185. DOI:10.1021/acs.est.5b05424 |
| [10] |
Parks G A, de Bruyn P L. The zero point of charge of oxides[J]. Journal of Physical Chemistry, 1962, 66(6): 967-973. DOI:10.1021/j100812a002 |
| [11] |
Fitz W J, Wenzel W W. Arsenic transformations in the soil-rhizosphere-plant system:Fundamentals and potential application to phytoremediation[J]. Journal of Biotechnology, 2002, 99(3): 259-278. DOI:10.1016/S0168-1656(02)00218-3 |
| [12] |
Komárek M, Vaněk A, Ettler V. Chemical stabilization of metals and arsenic in contaminated soils using oxides:A review[J]. Environmental Pollution, 2013, 172: 9-22. DOI:10.1016/j.envpol.2012.07.045 |
| [13] |
Yu H Y, Wang X, Li F, et al. Arsenic mobility and bioavailability in paddy soil under iron compound amendments at different growth stages of rice[J]. Environmental Pollution, 2017, 224: 136-147. DOI:10.1016/j.envpol.2017.01.072 |
| [14] |
Xu X Y, McGrath S P, Meharg A A, et al. Growing rice aerobically markedly decreases arsenic accumulation[J]. Environmental Science and Technology, 2008, 42(15): 5574-5579. DOI:10.1021/es800324u |
| [15] |
Stroud J L, Khan M A, Norton G J, et al. Assessing the labile arsenic pool in contaminated paddy soils by isotopic dilution techniques and simple extractions[J]. Environmental Science and Technology, 2011, 45(10): 4262-4269. DOI:10.1021/es104080s |
| [16] |
Yamaguchi N, Nakamura T, Dong D, et al. Arsenic release from flooded paddy soils is influenced by speciation, Eh, pH, and iron dissolution[J]. Chemosphere, 2011, 83(7): 925-932. DOI:10.1016/j.chemosphere.2011.02.044 |
| [17] |
Wang Y, Liu X H, Si Y B, et al. Release and transformation of arsenic from As-bearing iron minerals by Fe-reducing bacteria[J]. Chemosphere, 2016, 295: 29-38. |
| [18] |
Tao Y Q, Zhang S Z, Jian W, et al. Effects of oxalate and phosphate on the release of arsenic from contaminated soils and arsenic accumulation in wheat[J]. Chemosphere, 2006, 65(8): 1281-1287. DOI:10.1016/j.chemosphere.2006.04.039 |
| [19] |
Puckett E E, Serapiglia M J, DeLeon A M, et al. Differential expression of genes encoding phosphate transporters contributes to arsenic tolerance and accumulation in shrub willow(Salix spp.)[J]. Environmental and Experimental Botany, 2012, 75(1): 248-257. |
| [20] |
Liu C P, Luo C L, Gao Y, et al. Arsenic contamination and potential health risk implications at an abandoned tungsten mine, Southern China[J]. Environmental Pollution, 2010, 158(3): 820-826. DOI:10.1016/j.envpol.2009.09.029 |
| [21] |
Avery B W, Bascomb C L. Soil survey laboratory methods. Harpenden, soil survey technical monograph no. 6[D]. UK, Harpenden, Hertfordshire: Rothamsted Experimental Station, 1982.
|
| [22] |
USEPA. Microwave assisted acid digestion of siliceous and organically based matrices[R]. US Environmental Protection Agency, Office of Science and Technology, 1996.
|
| [23] |
Wenzel W W, Kirchbaumer N, Prohaska T, et al. Arsenic fractionation in soils using an improved sequential procedure[J]. Analytica Chimica, 2001, 436(2): 309-323. DOI:10.1016/S0003-2670(01)00924-2 |
| [24] |
Anderson M A, Malotky D T. The adsorption of protolyzable anions on hydrous oxides at the isoelectric pH[J]. Journal of Colloid and Interface Science, 1979, 72(3): 413-427. DOI:10.1016/0021-9797(79)90343-6 |
| [25] |
Kumpiene J, Lagerkvist A, Maurice C. Stabilization of As, Cr, Cu, Pb and Zn in soil using amendments:A review[J]. Waste Management, 2008, 28(1): 215-225. DOI:10.1016/j.wasman.2006.12.012 |
| [26] |
李婧菲. 外源铁对土壤-水稻系统中重金属和砷迁移的影响[D]. 长沙: 中南林业科技大学, 2013. LI Jing-fei. Effect of exogenous iron on translocation characteristics of heavy metals and arsenic in soil and paddy system[D]. Changsha: Central South University of Forestry and Technology, 2013. http://d.wanfangdata.com.cn/Thesis/Y2316949 |
| [27] |
Yuan Y, Cai L, Yang Z, et al. Simultaneous immobilization of lead, cadmium, and arsenic in combined contaminated soil with iron hydroxyl phosphate[J]. Journal of Soils and Sediments, 2017, 17(2): 432-439. DOI:10.1007/s11368-016-1540-0 |
| [28] |
Kumpiene J, Ore S, Renella G, et al. Assessment of zerovalent iron for stabilization of chromium, copper, and arsenic in soil[J]. Environmental Pollution, 2006, 144(1): 62-69. DOI:10.1016/j.envpol.2006.01.010 |
| [29] |
刘云璐, 李莲芳, 曾希柏, 等. 添加外源耐砷菌与零价铁对土壤砷有效性和形态的影响[J]. 农业环境科学学报, 2013, 32(11): 2175-2184. LIU Yun-lu, LI Lian-fang, ZENG Xi-bai, et al. Arsenic availability and speciation in soils treated with exogenous arsenic-resistant fungi and zero-valent iron[J]. Journal of Agro-Environment Science, 2013, 32(11): 2175-2184. DOI:10.11654/jaes.2013.11.011 |
| [30] |
胡立琼, 曾敏, 雷鸣, 等. 零价铁固定稻田土壤砷的持久性研究[J]. 水土保持学报, 2014, 28(2): 267-271. HU Li-qiong, ZENG Min, LEI Ming, et al. Persistence of immobilization effects on arsenic in paddy soil using zero-valent iron[J]. Journal of Soil and Water Conservation, 2014, 28(2): 267-271. |
| [31] |
Makino T, Takano H, Kamiya T, et al. Restoration of cadmium-contaminated paddy soils by washing with ferric chloride:Cd extraction mechanism and bench-scale verification[J]. Chemosphere, 2008, 70(6): 1035-1043. DOI:10.1016/j.chemosphere.2007.07.080 |
| [32] |
许端平, 李晓波, 王宇, 等. FeCl3-柠檬酸对土壤中Pb和Cd淋洗动力学特征[J]. 农业工程学报, 2016, 10(11): 6753-6760. XU Duan-ping, LI Xiao-bo, WANG Yu, et al. Washing kinetics characteristics of Pb and Cd from contaminated soil with FeCl3 -citric acid[J]. Transactions of the Chinese Society of Agricultural Engineering, 2016, 10(11): 6753-6760. |
| [33] |
谢正苗, 黄昌勇, 何振立. 土壤中砷的化学平衡[J]. 环境科学进展, 1998, 6(1): 22-37. XIE Zheng-miao, HUANG Chang-yong, HE Zhen-li. Chemical equilibria of arsenic in soils[J]. Advances in Environmental Science, 1998, 6(1): 22-37. |
| [34] |
Bolan N, Mahimairaja S, Kunhikrishnan A, et al. Phosphorus-arsenic interactions in variable-charge soils in relation to arsenic mobility and bioavailability[J]. Science of the Total Environment, 2013, 463/464(5): 1154-1162. |
| [35] |
Li R Y, Stroud J R, Ma J F, et al. Mitigation of arsenic accumulation in rice with water management and silicon fertilization[J]. Environmental Science and Technology, 2009, 43(10): 3778-3783. DOI:10.1021/es803643v |
| [36] |
Takahashi Y, Minamikawa R, Hattori K H, et al. Arsenic behavior in paddy fields during the cycle of flooded and non-flooded periods[J]. Environmental Science and Technology, 2004, 38(4): 1038-1044. DOI:10.1021/es034383n |
 2018, Vol. 37
2018, Vol. 37