文章信息
- 陈广世, 石炎, 薛聪, 邱宇平
- CHEN Guang-shi, SHI Yan, XUE Cong, QIU Yu-ping
- 应用探针分子研究骨炭和木炭吸附诺氟沙星的机理
- Use of probing molecules for exploring norfloxacin adsorption mechanisms on bone-derived and wood-derived biochars
- 农业环境科学学报, 2018, 37(3): 471-477
- Journal of Agro-Environment Science, 2018, 37(3): 471-477
- http://dx.doi.org/10.11654/jaes.2017-1299
文章历史
- 收稿日期: 2017-09-23
- 录用日期: 2018-01-15
生物炭是生物质在缺氧条件下热解产生的含碳物质[1]。不同前体来源的生物炭性质相差很大。例如:骨炭通常碳元素含量较低,无机矿物含量较大,孔径大而比表面积小[2-4];而木炭碳元素含量大,无机矿物含量低,孔径小而比表面积大[5-6];因此会导致二者对污染物的吸附差异显著。
近些年,氟喹诺酮类抗生素因其应用广泛、对水体污染严重而备受关注[7],诺氟沙星(NOR)是其典型的代表。Feng等[8]用木薯渣炭吸附NOR,发现随着热解温度的升高,吸附量增加,吸附机理为氢键和π-π作用;张涵瑜等[9]用芦苇基炭吸附溶液中的NOR,最大吸附量为0.006 7 mmol·g-1,其吸附机理主要是氢键作用。以上研究都基于植物源炭,而动物源炭对NOR的吸附研究还不多。
分子探针法适用于研究含有多官能团有机物的吸附。Mackay等[10]曾用探针法研究环丙沙星在土壤中的吸附过程,该分子同时含有羧基和哌嗪基,很难判断哪种基团在土壤吸附中发挥主导作用。因此,该研究引入两种探针化合物,其分子结构与目标物相似,但分别只含有羧基或哌嗪基。应用此方法,最终揭示了环丙沙星在土壤中的吸附主要依赖哌嗪基的阳离子交换作用。本研究将通过引入探针化合物氟甲喹(FLU)和1-苯基哌嗪(PHP),探索NOR在骨炭和木炭上的吸附差异,并进一步结合生物炭的理化性质,来讨论吸附机理。
1 材料与方法 1.1 生物炭与试剂将干燥的松木和清洗烘干过的猪骨分别置于马弗炉内,600 ℃缺氧热解5 h[11],热解后冷却至室温,研磨、过40目筛,制得骨炭(BB)和木炭(WB)。
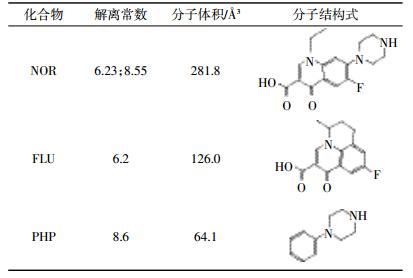
诺氟沙星(Norfloxacin,NOR)、氟甲喹(Flumequine,FLU)、1-苯基哌嗪(Phenylpiperazine,PHP)和羟基磷酸钙(Hydroxyapatite,HAP)均购自上海阿拉丁生化科技股份有限公司(纯度>98%),分子体积由ChemBio3D软件模拟分子最小能量态计算获得,化合物的性质见表 1。HCl、NaOH、CaCl2和NaN3均为分析纯。
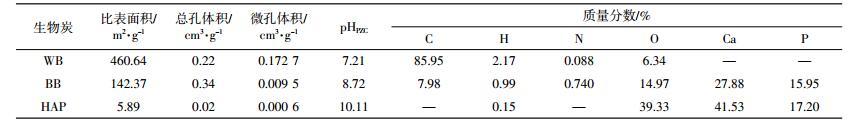
BB和WB两种生物炭的C、H、N、O含量采用元素分析仪(Thermo-Finnige Flash. EA 1112,意大利)测定;比表面积、总孔体积、微孔体积和平均孔径采用比表面积分析仪(Norcross,GA,美国)测定;表面官能团用傅里叶变换红外光谱仪(FT-IR Nicolet 5700 spectrophotometer,美国)测定;生物炭的矿物组分采用X射线粉末衍射仪(D8-Advance)分析;生物炭的P和Ca的含量用X-ray能谱仪(S-4800Ⅱ)分析;等电点的测试方法参照文献[12]。
1.3 吸附实验及影响因素 1.3.1 溶液pH值对吸附的影响实验背景液含0.02 mol·L-1 NaCl以维持体系离子强度,同时含0.20 g·L-1 NaN3,以抑制微生物生长。NOR溶液由NOR纯品溶于背景液配制而成,于25 mL安捷伦瓶中加入20 mL浓度为0.156 6 mmol·L-1的NOR溶液,进一步加入0.02 g的BB或WB,摇匀,并置于25 ℃恒温箱中黑暗条件下以150 r·min-1的频率振荡24 h,使其达到吸附平衡。期间用1 mol·L-1的HCl和NaOH溶液调节溶液pH值,控制溶液平衡pH=2~12,以研究pH值对吸附的影响。结束后取上清液过0.22 μm滤膜,用高效液相色谱仪(HPLC,Agilent 1200,美国)测定溶液中剩余的NOR浓度,测试方法参照文献[13]。
1.3.2 等温吸附实验称取0.02 g BB、WB、HAP分别加入至20 mL由背景液配制而成、初始浓度为0.031 3~0.156 6 mmol·L-1的NOR溶液中,分别用1 mol·L-1 HCl溶液和NaOH溶液调节pH,使溶液的平衡pH=5,于25 ℃恒温箱、无光条件下以150 r·min-1的频率振荡24 h,结束后取上清液过0.22 μm滤膜,测定溶液中剩余NOR的浓度。
分别用Langmuir模型和Freundlich模型对以上吸附过程进行拟合,两公式分别为:
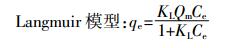 (1)
(1)  (2)
(2) 式中:Ce为平衡时溶液中溶质的浓度,mmol·L-1;Qm为最大吸附量,mmol·g-1;KL为Langmuir常数,L·mmol-1;KF为吸附容量参数,mmol(1-n)·Ln·g-1;N是Freundlich常数,表示吸附强度。
1.3.3 探针化合物实验分别用背景液配制0.150 0 mmol·L-1 NOR、0.150 0 mmol·L-1 PHP和0.100 0 mmol·L-1 FLU溶液1 L,在含有0.02 g BB或WB的25 mL安捷伦瓶中分别加入20 mL初始浓度为0.012 5~0.150 0 mmol·L-1的NOR、PHP或FLU,用1 mol·L-1 HCl溶液和NaOH溶液调节pH,使溶液的平衡pH=5,于25 ℃恒温箱、无光条件下以150 r·min-1的频率振荡24 h,结束后取上清液过0.22 μm滤膜,测定溶液中剩余溶质的浓度,PHP和FLU的测试方法参照文献[10]。
1.3.4 吸附动力学实验称取0.1 g BB、WB分别加入含有200 mL浓度为0.078 3 mmol·L-1 NOR溶液的锥形瓶中,调节溶液的pH=5,于25 ℃恒温箱、无光条件下以150 r·min-1的频率振荡1~480 min后取上清液过0.22 μm滤膜,测定溶液中剩余溶质的浓度。
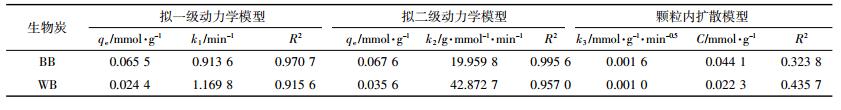
通过拟一级、拟二级动力学模型[14]和颗粒内扩散模型[15]来描述BB和WB对NOR的吸附过程,3种模型的表达式为:
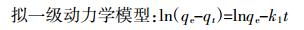 (3)
(3) 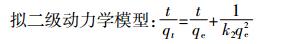 (4)
(4) 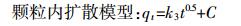 (5)
(5) 式中:qe和qt分别代表NOR平衡吸附量和t时刻的吸附量,mmol·g-1;t是吸附时间,min;k1、k2、k3分别代表各模型的速率常数,单位分别为min-1、g·mmol-1·min-1、mmol·g-1·min-0.5;C为常数。
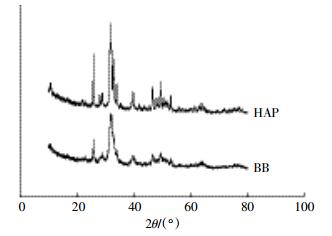
2 结果与讨论 2.1 生物炭理化性质及表征BB、WB和HAP的理化性质见表 2。由表 2中的数据可知原材料对生物炭的理化性质影响较大。WB中主要成分为C(85.95%),而BB中含量较多的元素为Ca和P,分别为27.88%和15.95%,C含量仅为7.98%。BB和HAP的X射线衍射谱图如图 1所示,可以发现,BB的无机矿物组分主要为HAP,这与先前研究的结果是一致的[16]。
|
| 图 1 BB和HAP的X射线衍射谱图 Figure 1 XRD patterns of BB and HAP |
比较BB和WB的比表面积和孔隙结构(表 2),可知BB的比表面积和微孔体积远小于WB,而总孔体积要大于WB,表明BB表面孔隙主要为中孔和大孔,而WB表面主要为微孔。BB的等电点较WB要大,说明BB较WB要偏碱性一些。值得注意的是,HAP的比表面积远小于WB和BB。
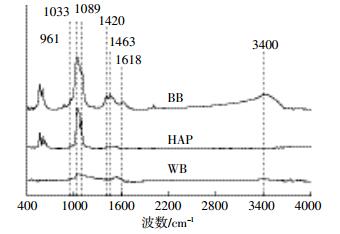
BB、WB和HAP 3种物质的红外光谱见图 2。可以看出,BB在4000~400 cm-1内光谱强度明显强于WB,表明BB表面含有的含氧官能团较多[17]。值得注意的是,WB在2000~1000 cm-1的峰强很弱,这说明WB表面的含氧官能团较少或芳香性较强[18]。1089、1033、961 cm-1属于磷酸基团的吸收峰[19];1420、1463 cm-1是C-O的吸收峰[20],3400 cm-1则是羟基官能团吸收峰[5]。BB表面含有较多的羟基官能团,也含有较多的磷酸基团,这与文献报道一致[2];WB在3400 cm-1处的峰强较弱,说明其表面羟基含量较低;HAP在1089、1033、961 cm-1处的峰强较强,且与BB的红外光谱相似,进一步表明BB的主要成分为HAP。
|
| 图 2 BB、WB和HAP的红外光谱图 Figure 2 The FTIR spectra of BB, WB and HAP |
NOR具有两个酸解离常数(pKa1=6.23,pKa2=8.55),随着溶液pH值改变,NOR自身形态也会发生改变;当溶液pH < 6.23时,NOR+占主要部分,而当pH>8.55时,NOR-占主要部分,6.23 < pH < 8.55时,NOR0和NOR±为主要部分[21]。这是因为NOR分子同时含有哌嗪基和羧基,其中哌嗪基可以结合溶液中的H+而使NOR分子带正电,而羧基则容易脱H去质子化而使NOR分子带负电[22]。
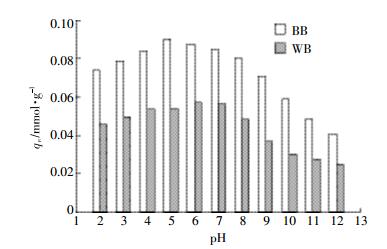
如图 3,在溶液pH=2~12的范围内,BB对NOR的吸附量要始终大于WB,BB最大吸附量出现在pH=5,而WB则在pH=6.0,在峰值的两端,二者吸附均呈下降趋势,这与Peng等[23]用竹炭吸附环丙沙星的结果类似。由表 2可知,BB的pHPZC=8.72,因此BB在pH>8.72时表面带负电荷,pH < 8.72时带正电荷。当溶液pH < 5.0或pH>8.72时,此时BB表面和NOR分子带同种电荷,由于静电排斥的作用,导致吸附量下降[22]。而当5.0 < pH < 8.72时,吸附量随溶液pH的下降而上升。可能是因为BB本身是碱性,pH降低时导致其中的一些碱性矿物被溶解,从而使更多的C暴露出来,增强了吸附能力。对WB而言,当pH>8.72或pH < 6.0时,WB表面和NOR分子带同种电荷,产生静电排斥,从而导致吸附量下降。当溶液pH接近7.0时,NOR分子在水溶液中的形态主要为净电荷为0的NOR0,此时其与WB之间的疏水作用最强。在pH=7.0~8.72范围内,随pH下降,NOR的疏水性增强,因而吸附增大。当pH从7.0降至6.0时,吸附趋势增加,这是因为在此pH变化范围内,NOR+分子含量增加。吸附质分子与吸附剂之间的π+-π作用力要强于π-π作用力,因此吸附量增大。
|
| 图 3 溶液pH值对NOR吸附作用的影响 Figure 3 Effect of solution pH on NOR adsorption |
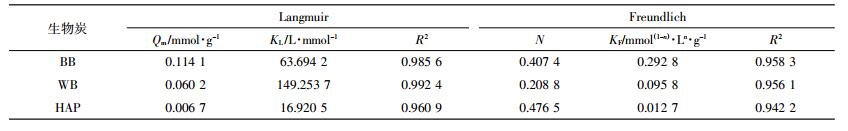
BB、WB和HAP的等温吸附线(图 4)采用常见的Langmuir和Freundlich模型来拟合,相关参数见表 3。可以看出Langmuir模型拟合的效果较Freundlich模型更优。BB对NOR的最大单层[24]吸附量(Qm)为0.114 1 mmol·g-1,与文献中报道的其他种类生物炭相比,具有较大优势(表 4),而WB和HAP的Qm分别为0.060 2 mmol·g-1和0.006 7 mmol·g-1。BB对NOR的吸附量高于WB,而HAP吸附量远低于BB和WB,说明HAP对NOR的吸附能力很弱。因此可以推测BB吸附NOR的过程中,无机组分几乎不发挥作用;这同时也表明,BB吸附量大于WB的原因并不能归结于无机矿物组分。而HAP吸附NOR弱的原因可能在于:HAP比表面积太小(5.89 m2·g-1),导致NOR与HAP上羟基无法充分接触形成氢键;另外据Srinivasan等[25]的研究,发现HAP的晶格是层状叠加结构,部分羟基被包裹在内部,也减少了与NOR分子的接触,从而使HAP未能有效吸附NOR。
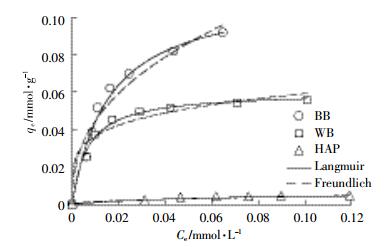
|
| 图 4 NOR吸附等温线 Figure 4 Adsorption isotherms of NOR on BB, WB and HAP |
|
为了探究不同生物炭(BB和WB)吸附NOR的机理,实验引入了两种探针化合物FLU和PHP(表 1)。两种探针化合物各含有一个与NOR分子类似的官能团结构。其中,FLU和NOR分子都含有一个氧代喹啉羧基结构,PHP和NOR分子都含有哌嗪基。NOR、FLU和PHP分子体积分别为281.8 Å3、126.0 Å3和64.1 Å3,可知NOR分子体积大于FLU和PHP。
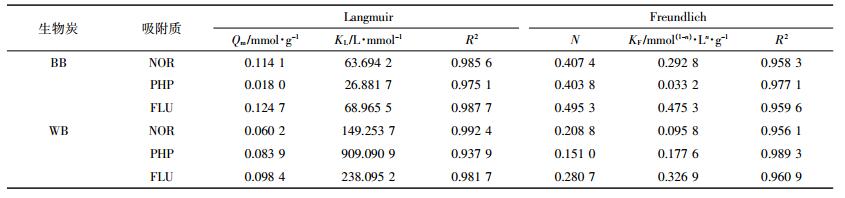
BB和WB对NOR、FLU和PHP的吸附等温线见图 5,拟合参数见表 5。FLU在BB上的吸附量大于NOR,而PHP在BB上的吸附量小于NOR。表明BB在吸附NOR过程中,NOR分子上的氧代喹啉羧基发挥了重要作用;相比而言,NOR上的哌嗪基对吸附过程的影响较小。此外,红外光谱揭示,BB表面含有大量羟基(图 2),可以和NOR分子上的氧代喹啉羧基形成氢键[8]。然而WB对FLU和PHP的摩尔吸附量均大于NOR的吸附量,说明NOR上的羧基和哌嗪基对吸附过程的影响较小。由图 2可知,WB表面含氧官能团较少,无法与NOR分子形成氢键作用。同时,WB碳化完全,芳香碳含量高。因此,WB吸附NOR可能是π-π作用推动[9]。而WB以微孔结构为主,体积较大的NOR受制于空间位阻效应,吸附要明显弱于FLU和PHP。
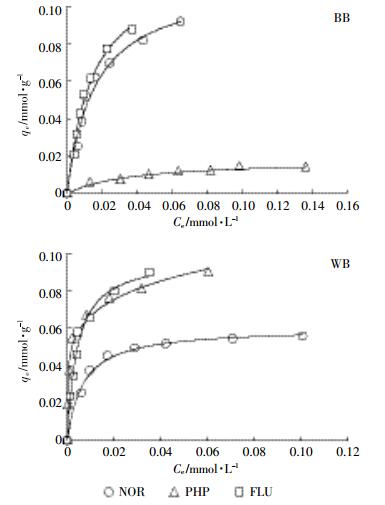
|
| 图 5 BB和WB对NOR、PHP和FLU的吸附等温线 Figure 5 Adoption isotherms of NOR, PHP and FLU onto BB and WB |
利用拟一级动力学、拟二级动力学和颗粒内扩散模型拟合动力学实验数据,动力学曲线见图 6,拟合参数见表 6。由表 6可知,拟二级动力学模型的拟合效果更好,表明生物炭对NOR吸附过程主要受生物炭表面吸附位点控制,与溶液中吸附质的浓度无关[29]。这一结论与其他研究生物炭对抗生素吸附动力学的结论是一致的[8]。
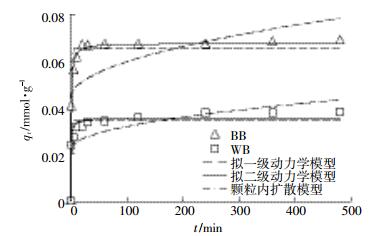
|
| 图 6 BB和WB吸附NOR的动力学曲线 Figure 6 Sorption kinetic of NOR onto BB and WB |
值得注意的是,BB和WB的拟二级动力学速率常数k2分别为19.959 8、42.872 7 g·mmol-1·min-1,BB的k2要远小于WB。表明在吸附过程中,BB要比WB先到达吸附平衡[9]。这一结果从另一个方面说明了WB在吸附NOR时所受到的空间位阻要大于BB,从而导致吸附达到平衡的时间延迟。
3 结论(1)溶液pH对生物炭吸附NOR的能力影响较大,BB和WB分别在pH=5.0和pH=6.0达到峰值。
(2)BB中主要组分为无机矿物HAP,但在吸附NOR的过程中几乎不起作用。
(3)FLU和PHP的分子探针实验表明,NOR分子上的氧代喹啉羧基可能是吸附的关键基团,而WB吸附NOR的主要机理为π-π作用。
(4)吸附动力学研究表明,两种生物炭对NOR吸附过程主要受生物炭表面吸附位点控制。NOR的空间位阻是导致其在WB上吸附达到平衡的时间要长于BB的重要原因。
| [1] |
Lehmann J, Rillig M C, Thies J, et al. Biochar effects on soil biota:A review[J]. Soil Biology and Biochemistry, 2011, 43(9): 1812-1836. DOI:10.1016/j.soilbio.2011.04.022 |
| [2] |
Medellin-Castillo N A, Leyva-Ramos R, Padilla-Ortega E, et al. Adsorption capacity of bone char for removing fluoride from water solution. Role of hydroxyapatite content, adsorption mechanism and competing anions[J]. Journal of Industrial and Engineering Chemistry, 2014, 20(6): 4014-4021. DOI:10.1016/j.jiec.2013.12.105 |
| [3] |
颜钰, 王子莹, 金洁, 等. 不同生物质来源和热解温度条件下制备的生物炭对菲的吸附行为[J]. 农业环境科学学报, 2014, 33(9): 1810-1816. YAN Yu, WANG Zi-ying, JIN Jie, et al. Phenanthrene adsorption on biochars produced from different biomass materials at two temperatures[J]. Journal of Agro-Environment Science, 2014, 33(9): 1810-1816. DOI:10.11654/jaes.2014.09.019 |
| [4] |
Shi K S, Qiu Y P, Li B, et al. Effectiveness and potential of straw-and wood-based biochars for adsorption of imidazolium-type ionic liquids[J]. Ecotoxicology and Environmental Safety, 2016, 130: 155-162. DOI:10.1016/j.ecoenv.2016.04.017 |
| [5] |
Keiluweit M, Nico P S, Johnson M G, et al. Dynamic molecular structure of plant biomass-derived black carbon(biochar)[J]. Environmental Science & Technology, 2010, 44(4): 1247-1253. |
| [6] |
Li H Y, Ye X X, Geng Z G, et al. The influence of biochar type on long-term stabilization for Cd and Cu in contaminated paddy soils[J]. Journal of Hazardous Materials, 2016, 304: 40-48. DOI:10.1016/j.jhazmat.2015.10.048 |
| [7] |
郭丽, 王淑平, 周志强, 等. 环丙沙星在深浅两层潮土层中吸附-解吸特性研究[J]. 农业环境科学学报, 2014, 33(12): 2359-2367. GUO Li, WANG Shu-ping, ZHOU Zhi-qiang, et al. Adsorption and desorption of ciprofloxacin by surface and subsurface soils of ustic cambosols in China[J]. Journal of Agro-Environment Science, 2014, 33(12): 2359-2367. DOI:10.11654/jaes.2014.12.012 |
| [8] |
Feng D, Yu H M, Deng H, et al. Adsorption characteristics of norfloxacin by biochar prepared by cassava dreg:Kinetics, isotherms, and thermodynamic analysis[J]. Bioresources, 2015, 10(4): 6751-6768. |
| [9] |
张涵瑜, 王兆炜, 高俊红, 等. 芦苇基和污泥基生物炭对水体中诺氟沙星的吸附性能[J]. 环境科学, 2016, 37(2): 689-696. ZHANG Han-yu, WANG Zhao-wei, GAO Jun-hong, et al. Adsorption characteristics of norfloxacin by biochars derived from reed straw and municipal sludge[J]. Environmental Science, 2016, 37(2): 689-696. |
| [10] |
Mackay A A, Seremet D E. Probe compounds to quantify cation exchange and complexation interactions of ciprofloxacin with soils[J]. Environmental Science & Technology, 2008, 42(22): 8270-8276. |
| [11] |
Li L, Qiu Y P, Huang J X, et al. Mechanisms and factors influencing adsorption of microcystin-LR on biochars[J]. Water, Air, & Soil Pollution, 2014, 225(12): 2220. |
| [12] |
Kikuchi Y, Qian Q, Machida M, et al. Effect of ZnO loading to activated carbon on Pb(Ⅱ) adsorption from aqueous solution[J]. Carbon, 2006, 44(2): 195-202. DOI:10.1016/j.carbon.2005.07.040 |
| [13] |
Chierentin L, Salgado H R N. Review of properties and analytical methods for the determination of norfloxacin[J]. Critical Reviews in Analytical Chemistry, 2016, 46(1): 22-39. DOI:10.1080/10408347.2014.941456 |
| [14] |
Ho Y S, McKay G. Sorption of dye from aqueous solution by peat[J]. Chemical Engineering Journal, 1998, 70(2): 115-124. DOI:10.1016/S0923-0467(98)00076-1 |
| [15] |
Weber W J, Morris J C. Kinetics of adsorption on carbon from solution[J]. Journal of the Sanitary Engineering Division, 1963, 89(2): 31-60. |
| [16] |
Novotny, Henriqueauccaise E, Rubenvelloso, et al. Characterization of phosphate structures in biochar from swine bones[J]. Pesquisa Agropecuária Brasileira, 2012, 47(5): 672-676. DOI:10.1590/S0100-204X2012000500006 |
| [17] |
Yi S Z, Gao B, Sun Y Y, et al. Removal of levofloxacin from aqueous solution using rice-husk and wood-chip biochars[J]. Chemosphere, 2016, 150: 694-701. DOI:10.1016/j.chemosphere.2015.12.112 |
| [18] |
Kizito S, Wu S, Kirui W K, et al. Evaluation of slow pyrolyzed wood and rice husks biochar for adsorption of ammonium nitrogen from piggery manure anaerobic digestate slurry[J]. Science of the Total Environment, 2015, 505: 102-112. DOI:10.1016/j.scitotenv.2014.09.096 |
| [19] |
Reyes-Gasga J, Martínez-Piñeiro E L, Rodríguez-álvarez G, et al. XRD and FTIR crystallinity indices in sound human tooth enamel and synthetic hydroxyapatite[J]. Materials Science and Engineering:C, 2013, 33(8): 4568-4574. DOI:10.1016/j.msec.2013.07.014 |
| [20] |
ŝlósarczykA, PaszkiewiczZ, PaluszkiewiczC. FTIR and XRD evaluation of carbonated hydroxyapatite powders synthesized by wet methods[J]. Journal of Molecular Structure, 2005, 744: 657-661. |
| [21] |
Wu M, Pan B, Zhang D, et al. The sorption of organic contaminants on biochars derived from sediments with high organic carbon content[J]. Chemosphere, 2013, 90(2): 782-788. DOI:10.1016/j.chemosphere.2012.09.075 |
| [22] |
Qin X P, Liu F, Wang G C, et al. Adsorption of levofloxacin onto goethite:Effects of pH, calcium and phosphate[J]. Colloids & Surfaces B:Biointerfaces, 2014, 116(14): 591-596. |
| [23] |
Peng X M, Hu F P, Lam F L, et al. Adsorption behavior and mechanisms of ciprofloxacin from aqueous solution by ordered mesoporous carbon and bamboo-based carbon[J]. Journal of Colloid and Interface Science, 2015, 460: 349-360. DOI:10.1016/j.jcis.2015.08.050 |
| [24] |
Shang J G, Kong X R, He L L, et al. Low-cost biochar derived from herbal residue:Characterization and application for ciprofloxacin adsorption[J]. International Journal of Environmental Science and Technology, 2016, 13(10): 2449-2458. DOI:10.1007/s13762-016-1075-3 |
| [25] |
Srinivasan M, Ferraris A C, White T. Cadmium and lead ion capture with three dimensionally ordered macroporous hydroxyapatite[J]. Environmental Science & Technology, 2006, 40(22): 7054-7059. |
| [26] |
张建强, 黄雯, 陈佼, 等. 羊粪生物炭对水体中诺氟沙星的吸附特性[J]. 环境科学学报, 2017, 37(9): 3398-3408. ZHANG Jian-qiang, HUANG Wen, CHEN Jiao, et al. Adsorption characteristics of norfloxacin in aqueous solution by sheep manure biochar[J]. Acta Scientiae Circumstantiae, 2017, 37(9): 3398-3408. |
| [27] |
闵敏, 谢云. 水稻秸秆生物炭对诺氟沙星的吸附性能研究[J]. 盐城工学院学报(自然科学版), 2015, 28(4): 6-10. MIN Min, XIE Yun. Study on adsorption properties of rice straw biochar on norfloxacin[J]. Journal of Yancheng Institute of Technology(Natural Science Edition), 2015, 28(4): 6-10. |
| [28] |
Wang B, Jiang Y S, Li F Y, et al. Preparation of biochar by simultaneous carbonization, magnetization and activation for norfloxacin removal in water[J]. Bioresource Technology, 2017, 233: 159-165. DOI:10.1016/j.biortech.2017.02.103 |
| [29] |
Liu Y. New insights into pseudo-second-order kinetic equation for adsorption[J]. Colloids and Surfaces A:Physicochemical and Engineering Aspects, 2008, 320(1): 275-278. |
 2018, Vol. 37
2018, Vol. 37