文章信息
- 张稳, 王亚利, 王米, 李银生, 薛飞群
- ZHANG Wen, WANG Ya-li, WANG Mi, LI Yin-sheng, XUE Fei-qun
- 土壤中沙咪珠利降解特性和生物学效应
- The degradation properties and biological effects of Ethanamizuril in soils
- 农业环境科学学报, 2018, 37(3): 478-484
- Journal of Agro-Environment Science, 2018, 37(3): 478-484
- http://dx.doi.org/10.11654/jaes.2017-1129
文章历史
- 收稿日期: 2017-08-18
- 录用日期: 2017-11-06
2. 中国农业科学院上海兽医研究所, 上海 200241
2. Shanghai Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Shanghai 200241, China
沙咪珠利(Ethanamizuril,EZL)是由中国农业科学院上海兽医研究所设计合成,具有新型化学结构的三嗪类化合物。该药与其他同类药物(地克珠利、妥曲珠利)无交叉耐药现象,并且无三致作用,安全性好、毒副作用低、抗球虫效果好,应用前景广阔[1]。本实验室前期研究[2]发现EZL属于慢消除药物,消除半衰期与给药剂量无明显关系,平均生物消除期为18.5 h。EZL在鸡粪便中的残留结果表明,临床给药10.00 mg·kg-1,给药7 d后粪便中EZL含量低于0.50 mg·kg-1。然而,兽药大量使用,在生产、销售、运输、使用和销毁过程中存在极大的环境暴露可能性;同时,兽药被动物摄取后大部分以原药或代谢物的形式,通过粪尿进入生态环境[3],进而影响土壤、水体,并可能通过食物链、食物网,最终影响人类健康[4]。
近年来,兽药污染问题不断加剧,对兽药进行环境风险评估的呼声越来越高。目前,国内申请注册新兽药需要提供环境影响资料,而这部分资料大多是查阅文献所得;而在国外,发达国家和地区,如欧盟、美国、日本等,均须在兽药的登记注册环节提供环境风险评估报告[5]。因此,新兽药EZL对土壤生态系统的研究为国内较早进行新兽药申报前的环境风险评估研究,可为其他新兽药的环境风险评估鉴定提供参考。
目前,国内对兽药环境行为的研究主要集中于抗生素[6-8],化学合成类兽药研究较少。兽药的主要环境行为包括其在土壤中的降解、吸附和迁移。研究兽药在土壤中的降解规律,对准确有效地评估其环境风险有重要意义。土壤微生物作为分解者,参与土壤中的碳氮循环,同时为土壤动物(如蚯蚓)提供营养。土壤微生物呼吸强度可反映土壤呼吸的能力,进而影响陆生动植物呼吸。蚯蚓是土壤环节动物的典型代表,营腐生生活,在生态系统中具有重要功能,已成为评价外来化合物对生态环境安全性的一种重要指示生物[9-10]。本文以EZL为研究对象,探讨其在3种土壤中的降解情况,以及对土壤中微生物呼吸的影响和对土壤动物蚯蚓的急性毒性,以期为该兽药的环境影响评价提供数据支持和理论依据。
1 材料与方法 1.1 试验材料供试土壤:分别选择上海灰潮土、南京黄棕壤、江西红壤,土壤均采自0~20 cm耕层,EZL本底值为0,经风干、研碎,过2 mm筛,备用。3种土壤的理化性质见表 1。
供试动物:赤子爱胜蚓(Eisenia foetida)购自上海桃源专业养殖场,驯养14 d。试验中选择2月龄以上、有明显环带、体重300~500 mg的健康成蚓。
试剂:EZL标准品(含量≥99.8%),批号130630,由中国农业科学院上海兽医研究所动物药学研究室制备;磷酸、甲酸、甲醇等试剂均为分析纯,购自国药集团化学试剂有限公司;色谱纯甲醇购自Merck公司。其他试剂均为分析纯。
仪器设备:高效液相色谱仪(HPLC)Waters 2695(美国Waters公司);紫外检测器Waters 2489(美国Waters公司);生化培养箱HPG-280H(哈尔滨东联技术电子开发有限公司);氮吹仪(美国Organomation Associates公司);Micro CL 17/21离心机(美国Thermo公司);多管漩涡混合仪MTV-100(杭州奥盛仪器有限公司);AE240双量程分析天平(梅特勒-托利多仪器(上海)有限公司);超纯水系统(上海瑞枫生物科技有限公司)。
1.2 试验方法 1.2.1 土壤降解试验分别称取20.00 g上述供试土壤于150 mL三角瓶中,将配制好的EZL储备液加到土壤中,添加浓度分别为2.00、10.00、50.00 mg·kg-1,混匀,挥发有机溶剂,调节土壤含水量为20%,用透气硅胶塞将瓶口塞紧,于(25±1)℃下进行暗培养。培养期间,为保持土壤湿度不变,采取称重差减法,每周用去离子水补充水分。每个处理设3个平行。定期取样进行残留测定,至药物降解达到90%以上时终止试验。
定期取样,称取1.00 g干土样品,加入提取液0.05%甲酸甲醇5 mL,混匀,超声30 min,然后在4000 r·min-1离心10 min,重复提取1次,合并2次上清液,60 ℃下氮气吹干。吹干后样品用1 mL 80%甲醇溶液复溶,过0.22 μm滤膜,待HPLC分析。
1.2.2 测定方法色谱条件:Diamonsil C18(4.6 mm×250 mm,5 μm)色谱柱;流动相为甲醇:0.2%磷酸=36:64;流速为1.0 mL·min-1;柱温为30 ℃;紫外检测器,检测波长为251 nm;进样量为20 μL。
方法的回收率:精确吸取浓度为20.00、100.00、500.00 mg·L-1的EZL溶液100 μL,分别加入1.00 g风干空白土壤中。然后按照1.2.1的方法进行前处理,测得EZL回收率在76.04%~110.01%之间。
1.2.3 土壤微生物呼吸强度试验试验分4个组:对照组、常量组(37.8 mg·kg-1,干重)、常量10倍组(378 mg·kg-1,干重)、常量100倍组(3780 mg·kg-1,干重)。
方法参考文献[11]:称取50.00 g干土于100 mL烧杯中,加药,混匀,通风24 h,调节土壤含水量为20%,将烧杯移入2 L可密闭的标本瓶中,同时在标本瓶内放置一个25 mL的小烧杯,盛有标准氢氧化钠溶液,用于吸收微生物呼吸所释放的CO2;然后用凡士林将标本瓶密闭,于(25±1)℃下进行暗培养,在实验开始后的1、2、4、7、11、15 d取出碱液进行酸滴定。吸取5 mL放入50 mL三角瓶中,加入2 mL BaCl2溶液,再加入2滴酚酞指示剂,用标准盐酸溶液滴定至红色消失,算出CO2释放量及影响率。
影响率计算公式如下(影响率为正数表示促进;反之,为抑制):

目前,将药物对土壤微生物的毒性划分成3个等级[12]。土壤中药物加量为常量,在15 d内对土壤微生物呼吸强度抑制达到50%作为高毒;土壤中药物加量为常量10倍,能达到上述抑制水平的划分为中毒;土壤中药物加量为常量100倍,能达到上述抑制水平的划分为低毒。
1.2.4 蚯蚓急性毒性试验使用欧盟推荐的标准蚯蚓急性毒性试验方法——人工土壤法(OECD207)。试验步骤为(1)配制人工土壤:土壤由69%石英砂、20%高岭土、10%泥炭土和1%碳酸钙组成,混匀,每一处理总重500 g。(2)清肠:取一个干净烧杯,在底部铺上一层滤纸,加少量水,以刚浸没滤纸为宜。挑选满足条件的蚯蚓,放在滤纸上,用保鲜膜封口,并用解剖针扎孔。将烧杯放入温度为(20±1)℃、湿度约75%、光照为1333 lx的人工气候箱中(光暗比为12 h:12 h)清肠24 h。(3)加药:药物用量以500 g土壤中的含量计算。EZL用甲醇溶解后加入人工土壤混匀,通风24 h以挥发有机溶剂,再移入试验容器中,含水量约为土壤重量1/4。(4)放入蚯蚓:将清肠的蚯蚓冲洗干净,并用滤纸吸干蚯蚓体表水分,每个容器放入10条蚯蚓。(5)培养:将其放入人工气候箱中培养。(6)观察:于培养后第7、14 d计数,记录死亡数及中毒症状。蚓体对针刺无反应判为死亡。培养后14 d结束试验。每一浓度设置3个重复,并设置一个对照组。
1.3 数据统计与计算采用Excel进行数据统计。利用Origin 8.0拟合降解动力学方程。利用药学数据处理软件计算LC50值和95%的置信区间。采用SPSS 13.0软件ANOVA方法对实验数据进行方差分析,P < 0.05表示差异显著;P < 0.01表示差异极显著。
用一级降解动力学方程dC/dt=-kC0[12]拟合降解曲线,根据相关系数确定一级动力学方程的结果可否采用。
式中C为某一时刻土壤中EZL的浓度,mg·kg-1;k为反应速率常数,d-1;t为降解时间,d。
以初始条件t=0,C=C0对上式积分,得C=C0e-kt,求出不同条件下的k值。
EZL在土壤中降解半衰期的计算公式为t1/2=ln2/k,根据k值可计算出土壤中不同浓度的EZL在不同温度下的半衰期t1/2(d),降解结果的划分参考文献[13]。
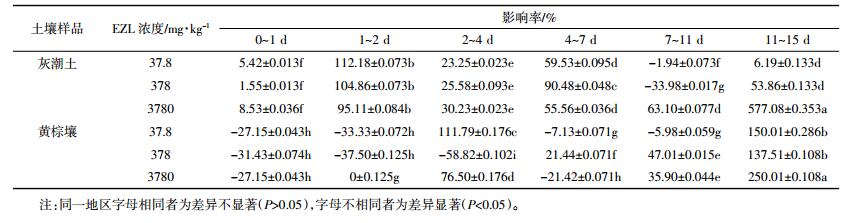
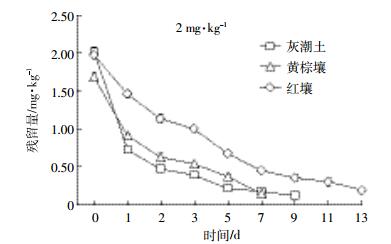
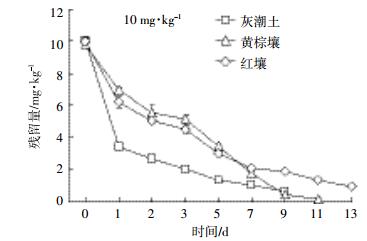
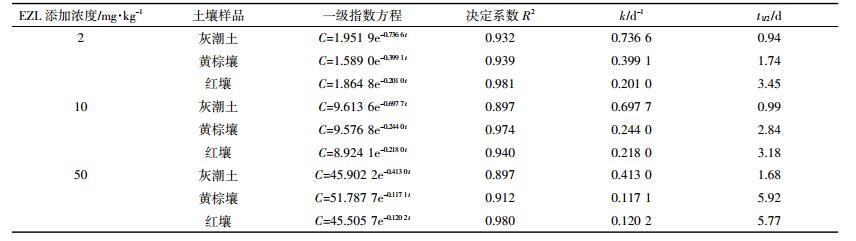
2 结果与分析 2.1 沙咪珠利在土壤中的降解总体来看,开始阶段,EZL在土壤中降解较快,随着时间延长其降解逐渐变缓(图 1、图 2、图 3)。这种现象在中低浓度组(2.00、10.00 mg·kg-1)比较明显。由表 2可知,拟合方程的相关系数在0.897~0.981之间,且根据降解曲线形状,发现一级动力学方程可以充分说明EZL在土壤中的降解动态。从图 1~图 3和表 2可以看出,EZL在3种土壤中稳定性较差,属于易降解药物。在中低浓度下,降解半衰期排序:灰潮土<黄棕壤<红壤;在高浓度(50.00 mg·kg-1)下为灰潮土<红壤<黄棕壤。在恒温避光条件下,添加2.00 mg·kg-1 EZL降解半衰期为0.94~3.45 d,添加10.00 mg·kg-1 EZL降解半衰期为0.99~3.18 d,添加50.00 mg·kg-1 EZL降解半衰期为1.68~5.92 d。在初始阶段,随着EZL浓度升高,EZL在土壤中的降解显著降低。以培养5 d的黄棕壤为例,在室温条件下,当添加的浓度由2.00 mg·kg-1增加到50.00 mg·kg-1时,EZL的降解率由68.05%降低到24.25%。另外,随着培养时间的增加,EZL在同一土壤中的降解速率降低,可能与土壤降解外来有机物的能力有限相关。
|
| 图 1 2 mg·kg-1 EZL在不同土壤中的降解动力学曲线 Figure 1 Degradation kinetics curve of 2 mg·kg-1 of Ethanamizuril at different soils |
|
| 图 2 10 mg·kg-1 EZL在不同土壤中的降解动力学曲线 Figure 2 Degradation kinetics curve of 10 mg·kg-1 of Ethanamizuril at different soils |
|
| 图 3 50 mg·kg-1 EZL在不同土壤中的降解动力学曲线 Figure 3 Degradation kinetics curve of 50 mg·kg-1 of Ethanamizuril at different soils |
|
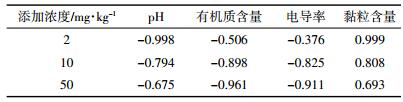
药物在土壤中的残留降解与土壤中的理化性质(如有机质、pH值、黏粒含量)有关。有机质含量越高,为微生物提供的养料越充足,更有利于微生物的降解作用。3种土壤中,灰潮土有机质含量最高,添加高、中、低任意浓度EZL,降解半衰期均最短。将不同土壤中的降解半衰期与土壤的理化性质进行相关分析,结果见表 3。由表 3可知,EZL与土壤的pH值、有机质含量、黏粒含量相关性均较好,决定系数为0.506~0.999。说明EZL在土壤中的降解受供试土壤理化性质的影响。但随着土壤中EZL的增加,降解半衰期与黏粒含量、pH值的相关性降低。
|
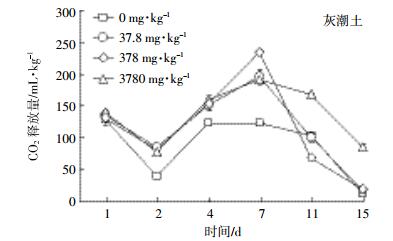
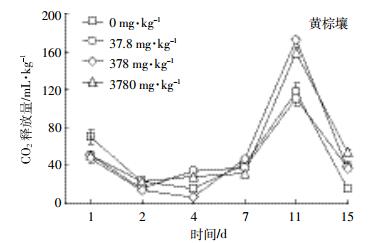
按实验设计的质量分数将EZL加入灰潮土和黄棕壤2种土壤后,土壤中微生物呼吸强度的测定结果见图 4和图 5。处理组微生物呼吸活动的变化有相似规律,曲线均为锯齿型,即微生物的呼吸活性受抑制与受促进交替存在;而对照组呼吸有一个“平台期”,为相对稳定期。本结果表明加入EZL会扰动土壤微生物的正常呼吸规律。
|
| 图 4 灰潮土中添加不同浓度EZL后CO2的释放量 Figure 4 CO2 emission of calcareous alluvial soil spiked with different concentration of Ethanamizuril |
|
| 图 5 黄棕壤中添加不同浓度EZL后CO2的释放量 Figure 5 CO2 emission of yellow-brown soil spiked with different concentration of Ethanamizuril |
不同浓度下EZL在不同时间段对土壤微生物呼吸作用的影响见表 4。药物对微生物的影响包括抑制和促进。处理组土壤呼吸强度低于对照土壤时表示抑制,相反表示促进。EZL在灰潮土中整体表现为促进作用;而在黄棕壤中,不同添加浓度抑制、促进作用具有阶段性。根据毒性划分标准,实验中常量10倍(378 mg·kg-1)EZL对黄棕壤微生物抑制率达到了50%,说明该兽药对黄棕壤微生物具有中等毒性;而对灰潮土微生物在3种浓度下,呼吸强度抑制率均未达到50%,说明该兽药对灰潮土微生物毒性不大。这可能与EZL在黄棕壤中的降解半衰期较短有关。
沙咪珠利对蚯蚓的急性毒性试验结果见图 6。采用文献[14]所用标准曲线法进行计算,以剂量对数为横坐标,死亡概率单位为纵坐标,得出回归方程,再求出LC50及95%的置信区间。
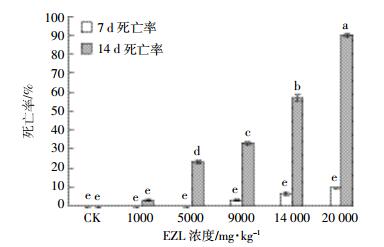
|
| 字母相同者为差异不显著(P>0.05),字母相同者为差异显著(P < 0.05) 图 6 EZL对蚯蚓死亡率的影响 Figure 6 Effects of Ethanamizuril on the mortality of earthworms |
EZL标准曲线y=2.95+2.12x,相关系数r=0.94,LC50=9 255.90 mg·kg-1,95%的置信区间为4 470.00~ 19 166.00 mg·kg-1,EZL的LC50远大于10.00 mg·kg-1,属于低毒级。
中毒症状表现为个体活动性下降,较为安静。在较高药物浓度(14 000.00、20 000.00 mg·kg-1)处理下,有小部分蚯蚓体表有黄色渗出液,环带和储精囊所在的节肿大,尤其环带肿大,严重者溃烂;身体萎缩,有断裂现象,有的断成多节,或节间沟深陷,整条蚯蚓成串珠状。7 d后,高低剂量组蚯蚓的死亡数无差异;14 d后,对照与1 000.00 mg·kg-1之间无差异,其余浓度组彼此差异显著(P < 0.05)。对照组蚯蚓正常。
3 讨论本实验室前期研究表明EZL临床推荐剂量为10.00 mg·kg-1,采用同位素示踪法测得粪尿中原药含量占7.02%。根据吴银宝等[15]的方法推算出EZL在干粪便中的理论值为37.80 mg·kg-1;并且对EZL进行急性毒性(斑马鱼、溞类等)研究发现EZL毒性作用不明显;同时,EZL易降解,不宜选择低浓度进行试验,故选用37.80 mg·kg-1为土壤微生物呼吸影响的浓度。查阅有关国内兽药降解行为的文献报道,同时考虑兽药残留的实际情况,选择2.00 mg·kg-1为土壤降解实验的浓度;同时,考虑到因药厂泄漏、药物运输或使用事故而可能出现的兽药污染的极端情况,选择10.00、50.00 mg·kg-1进行实验。
化学分子的土壤降解过程非常复杂,生物降解是兽药在环境中降解的重要途径,包括微生物降解、植物降解等,此外还受光照、温湿度等因素影响。在降解初期,随着EZL浓度升高,降解显著降低,这可能是因为过量的EZL在短时间内抑制微生物的活性,这与土霉素[8]在降解初期现象不同,后者主要与药物本身的化学结构、参与降解的微生物种类及数量、土壤性质等有关。具体原因需要进一步深入研究。
参考POPs国际公约[13],根据有机物在土壤中降解半衰期,可将有机物的土壤降解性划分成5个等级:< 1个月为易降解性;1~3个月为较易降解性;3~6个月为中等降解性;6~12个月为较难降解性;>12个月为难降解性。据此标准,EZL在3种土壤中的降解特性均属于易降解性,但不同土壤之间有所差异。药物在土壤中的降解是由它们本身的化学结构和外在环境(温度、湿度、土壤性质)综合决定的。EZL是一种弱酸性三嗪类抗球虫药物,在碱性土壤中易发生酸碱中和反应,从而破坏自身结构,红壤为酸性土壤,所以相对灰潮土而言在红壤中降解较慢。相比兽药在土壤中的降解特性,研究集中在抗生素类,农药中三嗪类降解研究较多,李素平等[16]研究了西玛津90%水分散粒剂在土壤中的残留降解动态,西玛津半衰期为19.3 d,属于易降解农药。王军等[17]探究了不同施肥土壤中莠去津的降解半衰期,约为20.16~33.12 d。贺敏等[18]测得55%硝磺·莠去津悬浮剂在土壤中的降解半衰期为0.97~1.07 d。可以看出三嗪类药物在多种形式、多种环境下,大部分属于易降解的物质,这种特性可能与这类药物的自身化学结构有关。
土壤微生物对土壤中残留的EZL以及其代谢物的敏感性、耐受性,存在地区差异。灰潮土相比黄棕壤,有机质更丰富,微生物的种群类别和数量较多,微生物作用比较明显。EZL进入土壤后,土壤微生物与药物相互作用,可能增强了土壤中微生物的活性,提高了土壤生物量;微生物的存在及其代谢活性的提高又能加快土壤中EZL的降解,使EZL在土壤中的滞留时间变短,持效性降低。药物主要通过两种方式影响土壤微生物:一是作为碳源增加微生物的活性,二是抑制微生物活动影响其活性[19]。在灰潮土中,EZL作为微生物碳源,整体表现为促进作用。但EZL的作用目标是针对一定的靶微生物,而不是对土壤中所有的微生物,如果土壤中的靶微生物少,而非靶微生物对药物又具有一定的耐受性,因此就可能出现给药组中土壤CO2的释放量增加的现象。王立群等[20]发现不动杆菌属、假单胞菌属、埃希菌属和芽孢杆菌属对β属内酰胺环类抗生素具有高效降解作用并有较强耐受能力。关于EZL影响土壤微生物的机理,需要进一步研究灰潮土和黄棕壤中细菌、真菌、放线菌种类和数量差异才能明确。
目前,兽药对蚯蚓的生态毒理研究还不健全,主要侧重抗生素和畜禽添加剂,而在抗球虫药物方面很少。李德金等[21]研究发现盐酸环丙沙星胁迫蚯蚓的LD50>5 000.00 mg·kg-1,存在一定毒性,但毒性较弱。董璐玺等[22]研究发现滤纸接触法实验中四环素和金霉素对蚯蚓的LC50>3.98×10-2 mg·cm-2,在远超过环境含量的受试剂量内未引起蚯蚓死亡,表明二者毒性较低。李银生等[23]用3种方法测得洛克沙胂、阿散酸的LC50均在g·kg-1土壤级,远大于10 mg·kg-1,属于低毒级。本研究中沙咪珠利的LC50接近10 g·kg-1,而在实际环境中兽药通过动物排泄物进入环境后,经环境稀释和降解,其毒性会进一步降低,因而对蚯蚓的毒性应该是较低的。然而,当蚯蚓长期暴露于含有一定浓度EZL的土壤中,体内酶活性是否降低,以及是否产生对EZL的富集作用,值得进一步研究。
4 结论(1)EZL在土壤中的降解动态符合一级动力学模型。降解速率随着添加浓度的增加和培养时间的延长而降低。虽降解半衰期不同,但都易降解,其降解特性与EZL本身化学结构有关。
(2)EZL对灰潮土和黄棕壤中的微生物呼吸强度影响不同。常量10倍EZL对黄棕壤中微生物呼吸作用的抑制率达到50%,说明该药对黄棕壤中的微生物具有中等毒性。
(3)人工土壤法测得EZL对蚯蚓的LC50为9 255.90 mg·kg-1,属于低毒药物。
| [1] |
肖文龙, 张可煜, 吴昊, 等. 高效液相色谱法(HPLC)测定饲料AC4的含量[J]. 饲料工业, 2014, 35(3): 54-57. XIAO Wen-long, ZHANG Ke-yu, WU Hao, et al. Analytical method for the determination of AC4 in feed by HPLC[J]. Feed Industry, 2014, 35(3): 54-57. |
| [2] |
林析. 沙咪珠利在肉鸡体内的药代动力学研究[C]//中国畜牧兽医学会兽医药理毒理学分会第十一届会员代表大会暨第十三次学术讨论会与中国毒理学会兽医毒理专业委员会第五次学术研讨会论文集. 长沙: 中国畜牧兽医学会兽医药理毒理学分会, 2015. LIN Xi. Study of pharmacokinetic of Ethanamizuril in broiler chichens[C]//The eleventh congress of veterinary pharmacology and toxicology branch of Chinese Society of Animal Husbandry and Veterinary Medicine. The thirteenth academic symposium and the fifth symposium on toxicology and toxicology of specialized committee of Chinese Toxicology Society. Changsha: Toxicology Branch of Chinese Society of Animal Husbandry and Veterinary Medicine, 2015. |
| [3] |
王娜, 单正军, 葛峰, 等. 兽药的环境污染现状及管理建议[J]. 环境监测管理与技术, 2010, 22(5): 14-18. WANG Na, SHAN Zheng-jun, GE Feng, et al. Environmental pollution situation and management suggestion of veterinary drugs[J]. The Administration and Technique of Environmental Monitoring, 2010, 22(5): 14-18. |
| [4] |
Raloff J. Pharm pollution:Excreted antibiotics can poison plants[J]. Science News, 2002, 161(26): 406-407. DOI:10.2307/4013500 |
| [5] |
王娜, 王昝畅, 郭欣妍, 等. 兽药抗生素环境风险控制管理政策探析[J]. 生态与农村环境学报, 2017, 33(7): 586-591. WANG Na, WANG Zan-chang, GUO Xin-yan, et al. Management policies for control of environmental risks of veterinary antibiotics[J]. Journal of Ecology and Rural Environment, 2017, 33(7): 586-591. DOI:10.11934/j.issn.1673-4831.2017.07.002 |
| [6] |
郭欣妍, 王娜, 许静, 等. 五种磺胺类抗生素在土壤中的吸附和淋溶特性[J]. 环境科学学报, 2013, 33(11): 3083-3091. GUO Xin-yan, WANG Na, XU Jing, et al. Adsorption and leaching behavior of sulfonamides in soils[J]. Acta Scientiae Circumstantiae, 2013, 33(11): 3083-3091. |
| [7] |
赵英姿, 徐振, 颜冬云, 等. 大环内酯类抗生素在土壤中的迁移转化与毒性效应分析[J]. 土壤, 2014, 46(1): 23-28. ZHAO Ying-zi, XU Zhen, YAN Dong-yun, et al. Analysis of migration, transformation and toxic effects of macrolides antibiotics in soils[J]. Soils, 2014, 46(1): 23-28. |
| [8] |
孙春晓, 宋文华, 高敏苓, 等. 土霉素在土壤中降解特性研究[J]. 农业环境科学学报, 2012, 31(6): 1141-1146. SUN Chun-xiao, SONG Wen-hua, GAO Min-ling, et al. Degradation properties of oxytetracycline in soil[J]. Journal of Agro-Environment Science, 2012, 31(6): 1141-1146. |
| [9] |
邱江平. 蚯蚓与环境保护[J]. 贵州科学, 2000, 18(1): 116-133. QIU Jiang-ping. Earthworms and environmental protection[J]. Guizhou Science, 2000, 18(1): 116-133. |
| [10] |
林长清, 梁锦基, 陈胤瑜, 等. 广州蚯蚓锌、铜、铁、钙营养评分的研究[J]. 广东医药学院学报, 1994, 10(1): 17-19. LIN Chang-qing, LIANG Jin-ji, CHEN Yin-yu, et al. Investigation of nutritional score of Zn, Cu, Fe, Ca in earthworm[J]. Journal of Guangdong Pharmaceulical, 1994, 10(1): 17-19. |
| [11] |
李晓亮, 秦智伟, 侯利园, 等. 土壤环境因素对残留农药降解的影响[J]. 东北农业大学学报, 2009, 40(4): 132-135. LI Xiao-liang, QIN Zhi-wei, HOU Li-yuan, et al. Influence of environmental factors on degradation of residual pesticide in soil[J]. Journal of Northeast Agricultural University, 2009, 40(4): 132-135. |
| [12] |
吴明, 蔡建国, 姚锦余, 等. 氯噻啉对土壤微生物呼吸的影响[J]. 农药, 2010, 49(3): 179-180. WU Ming, CAI Jian-guo, YAO Jin-yu, et al. Effects of pesticide imidaclothiz on soil microbes respiration[J]. Agrochemicals, 2010, 49(3): 179-180. |
| [13] |
Wilson J D. Biodegradation of organic chemicals[J]. Environ Sci Technol, 1985, 19(2): 106-111. DOI:10.1021/es00132a602 |
| [14] |
江泉观. 基础毒理学[M]. 北京: 化学工业出版社, 1991. JIANG Quan-guan. Basic toxicology[M]. Beijing: Chemical Industry Press, 1991. |
| [15] |
吴银宝, 廖新俤, 彭小珍, 等. 蛋鸡粪便排放量估算与污染风险评价系统及其建立方法: 中国, 201310452445. 9[P]. 2014-02-05. WU Yin-bao, LIAO Xin-di, PENG Xiao-zhen, et al. Emission estimation and pollution risk assessment system for laying hens and its establishment method: China, 201310452445. 9[P]. 2014-02-05. |
| [16] |
李素平, 肖怡, 刘雄伦, 等. 西玛津在甘蔗及土壤中的残留消解动态[J]. 精细化工中间体, 2011, 41(4): 66-69. LI Su-ping, XIAO Yi, LIU Xiong-lun, et al. Dissipation of simazine residue in sugarcane and soil[J]. Fine Chemical Intermediates, 2011, 41(4): 66-69. |
| [17] |
王军, 朱鲁生, 谢慧, 等. POPs污染物莠去津在长期定位施肥土壤中的残留动态[J]. 环境科学, 2007, 28(12): 2821-2826. WANG Jun, ZHU Lu-sheng, XIE Hui, et al. Degradation dynamics of POPs atrazine in soils under long-term located fertilization conditions[J]. Environmental Science, 2007, 28(12): 2821-2826. DOI:10.3321/j.issn:0250-3301.2007.12.027 |
| [18] |
贺敏, 贾春虹, 余平中, 等. 55%硝磺莠去津悬浮剂在玉米和土壤中的残留动态[J]. 农药, 2014, 53(8): 590-593. HE Min, JIA Chun-hong, YU Ping-zhong, et al. Residue dynamics of mesotrione·atrazine 55% SC in corn and soil[J]. Agrochemicals, 2014, 53(8): 590-593. |
| [19] |
Hossain A K M, Alexander M. Enhanzing soybean rhizosphere colonization by Rhizobium japonicum[J]. Appl Environ Microbiol, 1984, 48: 468-472. |
| [20] |
王立群, 孙文, 章广德, 等. 典型抗生素废水净化菌株的分离筛选及其效果研究[J]. 中国农业大学学报, 2008, 13(4): 97-101. WANG Li-qun, SUN Wen, ZHANG Guang-de, et al. Isolation and screening of bacterial strains during treatment of a typical antibiotic wastewater and study of their effect[J]. Journal of China Agricultural University, 2008, 13(4): 97-101. |
| [21] |
李德金, 郭锦, 李华英, 等. 环丙沙星对蚯蚓的急性和慢性毒性试验[J]. 毒理学杂志, 2015, 29(5): 365-368. LI De-jin, GUO Jin, LI Hua-ying, et al. Ciprofloxacin on earthworm acute and chronic toxicity test[J]. Journal of Toxicology, 2015, 29(5): 365-368. |
| [22] |
董璐玺, 谢秀杰, 周启星. 两种兽药添加剂对蚯蚓的DNA损伤及其联合效应[J]. 环境科学学报, 2011, 31(12): 2798-2803. DONG Lu-xi, XIE Xiu-jie, ZHOU Qi-xing, et al. The DNA damage and joint effects of two typical veterinary drugs on the earthworm Eisenia foetida[J]. Acta Scientiae Circumstantiae, 2011, 31(12): 2798-2803. |
| [23] |
李银生, 曾振灵, 陈杖榴, 等. 2种含砷兽药对蚯蚓的急性毒性试验[J]. 中国兽医学报, 2005, 25(4): 425-426, 445. LI Yin-sheng, ZENG Zhen-ling, CHEN Zhang-liu, et al. Acute toxicity test of two veterinary pharmaceuticals containing arsenic to earthworms[J]. Chinese Journal of Veterinary Science, 2005, 25(4): 425-426, 445. |
 2018, Vol. 37
2018, Vol. 37