文章信息
- 赵冰清, 郭东罡, 白中科
- ZHAO Bing-qing, GUO Dong-gang, BAI Zhong-ke
- 黄土区露天煤矿排土场刺槐×油松复垦模式17~22年间群落生长动态
- Community growth dynamics of Robinia pseudoacacia×Pinus tabuliformis reclamation pattern from the 17th to 22nd year in an open-pit coal mine waste dump in Loess area
- 农业环境科学学报, 2018, 37(3): 485-494
- Journal of Agro-Environment Science, 2018, 37(3): 485-494
- http://dx.doi.org/10.11654/jaes.2017-1097
文章历史
- 收稿日期: 2017-08-12
- 录用日期: 2017-11-15
2. 山西大学环境与资源学院, 太原 030006;
3. 国土资源部土地整治重点实验室, 北京 100035
2. School of Environment and Resources, Shanxi University, Taiyuan 030006, China;
3. Key Laboratory of Land Consolidation and Rehabilitation, Ministry of Land and Resources, Beijing 100035, China
大型露天煤矿开采造成了严重的生态破坏和环境污染,加之我国的露天煤矿大多地处干旱、半干旱的草原区、荒漠区和丘陵区等生态脆弱地区,采矿剧烈扰动更加剧了这些区域的生物多样性丧失、水土流失和土地荒漠化等问题。实践证明,植被恢复是矿区损毁土地进行生态修复的有效途径[1]。然而,在矿区气候干旱、土壤极度贫瘠的极端生境下进行植被恢复是一个复杂而漫长的过程[2-3]。依据人为设计和自我设计等理论建植的人工植物群落,在自然演替过程中,其群落特征如何变化,是否达到自然植被的稳定状态,或者是否达到预期的生态修复效果,这些信息对科学评估和优化复垦措施或复垦模式具有重要价值。
群落动态对解释物种共存和生物多样性维持机制至关重要[4],一直是生态学研究的热点[5]。许多研究表明,森林处于动态变化过程,其物种组成和结构会发生定向改变[6-7]。由于森林动态周期较长,众多学者开始关注森林群落的长期重复研究[4, 8]。近20多年来,一系列森林动态监测样地的建立和发展,为森林生态系统动态过程的研究提供了诸多有价值的信息[9],已成为研究森林动态的核心手段。我国许多学者对温带针阔混交林[10]、暖温带落叶阔叶林[11]、亚热带常绿阔叶林[12]、热带季雨林[13]等群落动态进行了研究。
矿区排土场是生态环境受到严重破坏的区域,在这种极度退化的生态系统建植的人工植被是人工干预和长时间自然演替共同作用的结果,植被组成与群落构建具有特殊性。人工植被的生长变化及恢复状况能够表征土地复垦的程度与质量,是土地复垦质量评价的重要因素之一[14]。因此,人工植被动态监测对矿区土地复垦具有重要意义。近年来,针对矿区复垦土地人工植被动态的研究陆续也有报道,内容涉及植被覆盖度时空演变[15]、物种组成与物种多样性变化[16]、种群结构与空间格局变化[17-18]、生物量演变[19]、更新动态[20]、群落演替[2]等,采用的生态调查监测方法和手段主要包括样方调查法、永久性动态样地监测法、遥感以及“3S”耦合的多因子分析等[21]。总体来看,目前的研究受时空尺度的限制,存在监测时间不连续、空间尺度单一等问题,基于长时间序列野外定位跟踪监测的研究还很缺乏。
本文以安太堡露天煤矿排土场复垦土地0.8 hm2“刺槐(Robinia pseudoacacia)×油松(Pinus tabuliformis)”复垦模式动态监测样地为研究平台,通过对比分析样地2010年和2015年两次调查的植物个体生长数据,试图回答以下问题:(1)在过去5年间,该群落的物种组成及数量特征是如何变化的?(2)各树种的种群大小变化趋势是怎样的?以期为该区生态修复过程中的复垦模式优化及生物多样性保护和管理提供科学依据。
1 材料与方法 1.1 研究区概况研究区位于山西省朔州市平鲁区境内的安太堡露天煤矿。该区属于典型的温带半干旱大陆性季风气候。平均气温4.8~7.8 ℃,年降水量在450 mm左右,全年降水量的65%集中于6—8月,年蒸发量约为2160 mm。地带性土壤为栗钙土与栗褐土的过渡带。根据中国植被区划,本区属于温带草原区域晋北山地森林草原区。
安太堡露天煤矿于1985年建矿,至今已形成南排土场、西排土场、西排土场扩大区和内排土场4个排土场,其中南排土场、西排土场和西排土场扩大区属于外排土场。南排土场面积180.50 hm2,最终标高1465 m,容量1.16亿m3,排土高度150 m,排弃时间为1985—1989年,1993年开始植被重建。南排土场是该矿复垦较早的区域之一,期间除了前3年进行浇水,前5年进行病虫害控制外,至今未采取人工浇水与施肥等管理措施[18]。经过20余年的复垦,南排土场已形成乔-灌-草多层次、多类型的植物结构布局,基本覆盖了排土场所有的裸露地表,复垦效应显著。乔木主要有刺槐、油松、榆树(Ulmus pumila)等;灌木主要有沙棘(Hippophae rhamnoides)、柠条(Caragana korshinskii)和沙枣(Elaeagnus angustifolia)等;草本植物主要有鹅观草(Roegneria kamoji)、大籽蒿(Artemisia sieversiana)、剪股颖(Agrostis matsumurae)等[22]。西排土场排弃时间为1985—1992年,1994年开始复垦。西排土场扩大区排弃时间为1993—1996年,2001年开始复垦。目前,研究区已全部实现内排。内排土场1989年开始排弃,1997年开始复垦。
2010年7月,参照CTFS(The Center for Tropical Forest Science)技术规范,在安太堡露天煤矿南排土场,选取复垦时间为1993年、复垦模式为刺槐×油松的植被恢复区,建立了一个0.8 hm2(80 m×100 m)的动态监测样地。样地最高海拔1449 m,最低海拔1425 m,平均海拔1437 m。坡度介于14.8°~26.2°,平均坡度18.9°。复垦初期各树种的栽植方式为三行刺槐(均为高0.3 m的1年生幼苗)间种一行油松(均为高1 m的5年生幼苗),行间距1 m,刺槐株距1.5 m,油松株距5 m。1993年,样地内立木总的种植密度为6381株·hm-2,刺槐和油松的种植密度分别为5976株·hm-2和405株·hm-2。2010年,除了复垦初期种植的刺槐和油松以外,还出现了入侵种榆树。样地内立木总密度为1913株·hm-2,其中刺槐和油松的密度分别为1278株·hm-2和210株·hm-2,榆树胸径(Diameter at Breast Height,DBH)1 cm以上的密度为425株·hm-2。
1.2 样地调查方法用全站仪将样地划分为80个10 m×10 m的样方,每个样方又细分为4个5 m×5 m的小样方,作为具体的调查单元[23]。2010年,对样地内DBH≥1 cm的所有木本植物进行每木检尺,并挂牌标记,同时鉴定物种名称,记录胸径、高度、坐标、生长状况等。在每个5 m×5 m小样方的左下角设置1个1 m×1 m的草本样方,样地内共设置草本样方320个,记录草本层植物的种类(样方中高度<30 cm的乔木和灌木幼苗归入草本)、多度(采用Drude的七级制多度标准[24])、种盖度、平均高度等。2015年的复查方法同2010年,对于新增的DBH≥1 cm的个体补充挂牌,记为5年间的增补个体。
1.3 数据分析本文以2010年和2015年两次调查中DBH≥1 cm的个体为研究对象,分析了群落物种组成、数量特征、平均胸径、径级结构变化以及种群大小变化趋势。本文的增补个体是指在第二次调查时,样地中新出现的DBH≥1 cm的更新个体;死亡个体是指在第二次调查时找到发现已死亡的个体或未找到的个体。
物种死亡率(M)、增补率(R)和种群大小变化率(λ)计算方法如下[25]:
M=(lnN0 -lnSt)/t
R=(lnNt -lnSt)/t
λ=(lnNt -lnN0)/t
式中:N0为某一种群在第一次调查时的个体数;Nt为该种群在第二次调查时的个体数;St为该种群在第二次调查时存活个体数;t为两次调查的间隔时间。
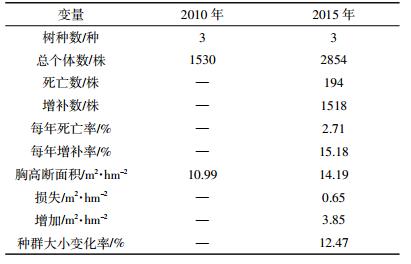
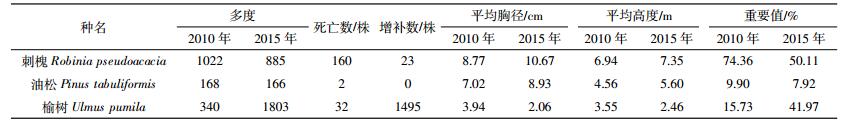
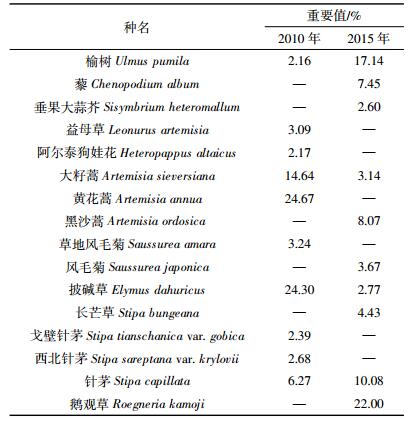
2 结果与分析 2.1 物种组成变化2010年,样地内记录到DBH≥1 cm的树种共3种(表 1);2015年,样地中DBH≥1 cm的树种仍为3种。5年间,群落的树种组成较为稳定,没有因死亡而消失的树种,也没有新增的树种。根据两次调查数据得到样地内不同树种的重要值(表 2),各树种的重要值排序没有发生变化,群落的优势种仍为刺槐。5年间,刺槐和油松的重要值均在下降,其中以刺槐的重要值降低幅度最大,由74.36%降低到50.11%。榆树的重要值增长较快,由15.73%增加到41.97%。2010年,记录到草本层植物16科30属44种,以菊科和禾本科植物为主;2015年,记录到草本层植物17科27属35种,主要为菊科和禾本科植物。5年间,草本层植物在优势成分上由黄花蒿(Artemisia annua)、披碱草(Elymus dahuricus)和大籽蒿变为鹅观草、榆树和针茅(Stipa capillata)(表 3)。
|
样地树木密度由2010年的1913株·hm-2增加到2015年的3568株·hm-2。2010—2015年间,群落内死亡个体共194株,每年死亡率为2.71%(表 1)。3个树种均发生了死亡现象,其中死亡量最大的是刺槐,死亡个体数为160株,占群落死亡总数的82.47%。榆树的死亡量较少,共32株。油松的死亡量最少,仅有2株。不同树种每年死亡率为刺槐(3.41%)>榆树(1.98%)>油松(0.24%)。
2010年记录的3个物种中,2个树种发生了增补现象,增补个体数共1518株,每年增补率为15.18%。榆树的增补个体数最多,高达1495株,占群落增补个体总数的98.48%。其次为刺槐,增补了23株。油松没有调查到增补个体。不同树种每年增补率为榆树(35.34%)>刺槐(0.53%)。
胸高断面积由2010年的10.99 m2·hm-2增加到2015年的14.19 m2·hm-2,净增加3.20 m2·hm-2。两次调查中,因死亡而减少的胸高断面积为0.65 m2·hm-2,新增的胸高断面积为3.85 m2·hm-2。两次调查期间,因树木死亡减少的胸高断面积中,优势树种刺槐减少最多,达0.48 m2·hm-2,占总损失量的74.01%。油松和榆树因死亡减少的胸高断面积分别占总损失量的0.13%和25.86%。5年间,因树木生长而增加的胸高断面积达到3.48 m2·hm-2,其中刺槐由于生长而带来的胸高断面积增加量(2.62 m2·hm-2)占总量的75.29%;油松和榆树由于生长分别增加0.54 m2·hm-2和0.32 m2·hm-2。增补个体进级而增加的胸高断面积仅为0.37 m2·hm-2,其中榆树的增量最大,达0.36 m2·hm-2,占总量的97.30%;油松的增量最小,不足总量的1%。总体来看,5年间,刺槐、油松和榆树的胸高断面积均为净增加,并且增加量表现为刺槐>油松>榆树。
2.3 平均胸径变化5年间,因树木个体死亡、增补以及树木本身胸径的增长,各树种的平均胸径发生了较大变化(表 2)。刺槐和油松的平均胸径增加,榆树的平均胸径减少,增加或减少值均在1~2 cm。尽管刺槐有大量大径级个体死亡,但由于新进级的个体较少,其平均胸径增长量仍然较大。油松死亡个体很少,没有新增个体出现,且个体生长量较大,平均胸径有所增加。榆树因有大量的新进级小个体,导致平均胸径减少。根据复垦初期种植的个体在两次调查时均仍存活的个体可知,22年间刺槐和油松的胸径生长速率分别为0.31 cm·a-1和0.39 cm·a-1。
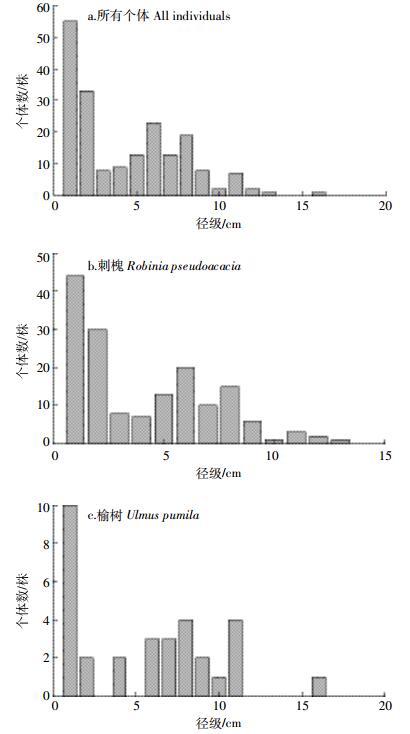
2.4 径级结构变化两次调查中,群落总体的径级结构发生了显著变化(χ2=533.565,P<0.01)(图 1)。2010年,DBH<5 cm的个体数占29.80%,5 cm≤DBH<15 cm的占68.10%,在9~10 cm处出现第二个峰值;2015年,DBH<5 cm的个体数占64.26%,5 cm≤DBH<15 cm的占31.74%,随着树木胸径的生长,第二峰值出现在11~12 cm处。刺槐和油松的径级结构在两次调查中有明显变化(刺槐:χ2=71.851,P<0.01;油松:χ2=8.814,P<0.01)。对比两次调查数据可以发现,刺槐DBH≤10 cm的个体数量有所减少,但DBH>10 cm的较大径级个体数在增加,可见DBH≤10 cm的个体死亡量大于增补量,而DBH>10 cm的个体死亡量较低,由于胸径生长而进级,个体数有所增加。油松的径级分布与刺槐类似,DBH≥10 cm的个体数明显增多。榆树的径级分布呈“L”型,DBH<3 cm的个体数量大幅增加。

|
| 图 1 2010年与2015年径级结构比较 Figure 1 Comparison of size classes between 2010 and 2015 |
所有死亡个体的径级分布类似于2010年所有存活个体的径级分布(图 2)。DBH<3 cm的死亡个体占总死亡数的45.36%,且在径级6 cm处出现第二个死亡高峰。进一步分析各树种死亡个体的径级分布可以看出,不同树种死亡个体的径级分布有所差异。刺槐死亡个体的径级分布与样地所有死亡个体的径级分布类似。油松只有2株个体死亡,占样地总死亡个体数的1.03%。总体来看,小径级个体死亡较多,大径级个体死亡相对较少。
|
| 图 2 2010—2015年死亡个体径级结构 Figure 2 Size classes of dead individuals during 2010—2015 |
增补个体数与死亡个体数的差值,反映了种群大小的变化;增补率与死亡率的差值,反映了种群大小的变化率。两次调查期间,刺槐和油松的死亡个体数均超过其增补个体数,死亡率均超过增补率,表明这两个种群大小都在下降,但降幅并不大,种群大小变化率分别为-2.88%和-0.24%。榆树的增补个体数远大于死亡个体数,增补率(35.34%)也相应高于死亡率(1.98%),种群大小变化率高达33.37%,超过5%,说明榆树种群在快速扩增。
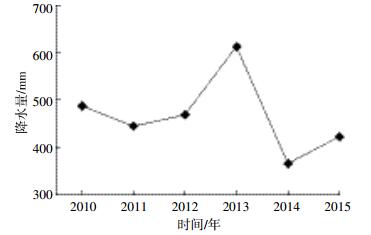
3 讨论 3.1 物种组成变化5年来,该群落没有因死亡而消失的树种,也没有新增的树种。群落物种组成变化与群落所处的演替状态、周围的物种库、受干扰情况以及研究的时间间隔等有关[26]。经过22年的群落演替,样地近年来没有发生较大的人为干扰以及极端的自然气候影响,且研究的时间间隔较短,因而群落的树种组成较为稳定。与2010年调查数据相比,2015年群落的优势种没有发生变化。刺槐因个体大量死亡导致重要值下降,榆树由于生长较快出现大量进级个体,且死亡个体数较少(32株),重要值增幅较大。5年间,草本层植物由44种减少到35种,可能与该地区的降水量有关(图 3)。降水条件较差的年份将导致草本层植物物种丰富度极大减少,而且在以后的年份中即使降水量增加,其丰富度恢复也较慢[27]。在降水条件相对较好的2010年(487.5 mm),草本层植物为44种;经过2014年(365.7 mm)和2015年(422.3 mm)两年降水低峰期,草本层植物仅为35种,与上述研究结果一致。从群落演替的角度来看,在优势成分上,研究区草本层植物呈现出由1年生或1~2年生向多年生、旱中生向中生演替的趋势。
|
| 图 3 平鲁区2010—2015年降水量变化 Figure 3 Precipitation data of Pinglu over the study period (2010—2015) |
2010—2015年间,样地内DBH≥1 cm的个体平均死亡242.5株·hm-2·a-1,远高于古田山常绿阔叶林样地2002—2007年间平均死亡55.4株·hm-2·a-1[12]、长白山阔叶红松林样地2004—2009年间平均死亡32.2株·hm-2·a-1[10]、长白山次生杨桦林样地2005—2010年间平均死亡84株·hm-2·a-1[28]、宝天曼落叶阔叶林样地2009—2014年间平均死亡149.4株·hm-2·a-1[11]。原因可能是与上述自然森林群落相比,复垦地重建的人工植物群落结构相对简单,且群落演替的时间相对较短(22年),样地内树种的径级还较小(最大DBH为24.05 cm),树种之间竞争较为激烈,群落尚不稳定。此外,样地内大量个体死亡可能与本地区所处的气候带有关。该区属典型的温带半干旱大陆性季风气候,降水量稀少。2010—2015年间,平鲁区最高年降水量为612.6 mm,最低仅为365.7 mm,年均降水量466.9 mm,年蒸发量超过降水量的4倍,水分成为该区植被恢复的限制因子[29]。5年间,3个树种均发生了死亡现象,其中刺槐的死亡个体数最多,可能与其复垦初期较高的种植密度有关。刺槐幼苗长大后,其2010年多度也较大。调查中发现样地内20.53%的刺槐出现了枯梢,主要原因是刺槐对水分的利用能力很强,其适应干旱的方式是降低其生长速率和高度,当发生严重干旱时,甚至牺牲部分构件(枯梢)[30]。总体来看,样地内2010年多度较大的树种,5年间其个体死亡量相应也较多,这与张池等[31]的研究结果一致。
物种更新涉及种子扩散、种子萌发、幼苗生长等过程,这些过程都可能对物种增补产生影响。前人的研究显示,同种个体密度较高或距离母树较近的地方,幼苗因密度制约其存活率会降低[32-33]。增补个体出现的地方,说明该处没有母树附近的种源限制和不利于生长的环境因子[12]。榆树的增补数最多,占增补个体总数的98.48%,其种源可能来自样地附近复垦模式为刺槐×榆树×臭椿(Ailanthus altissima)的平台[18]。由于榆树种子一次性结实量大,质量小,且果实具翅,适应于复垦地多风环境中传播扩散繁殖。2010年样地内出现大量的榆树幼苗,且榆树幼苗的存活率(71.15%)远高于刺槐幼苗(30.22%)[20],这些幼苗在5年间生长进级为DBH≥1 cm的增补个体。通过个体数目的大幅度增加,榆树迅速扩大其种群规模。样地内大量榆树的入侵和定居,一定程度上也说明复垦地的生境条件得到了改善。刺槐的增补数仅有23株,一方面可能是由于水分条件较差、林下光照不足;另一方面可能是由于刺槐的枯落物和根际土中存在自毒作用,抑制了其种子萌发和幼苗生长,导致林分自然更新出现障碍[34]。油松没有增补个体,表明油松的更新能力较差。张希彪等[35]的研究显示,油松的种子雨产量随树龄的增加而增加,树龄40年左右的油松种子雨产量和质量达到高峰。本研究中,油松的树龄相对较小,可能还没有到大量结实期,种子较低的自然发芽率(2.38%)也可能是导致其更新限制的一个重要原因[35]。此外,在群落演替的早期阶段,刺槐因生长速度较快,迅速占领林冠层。油松为阳生性树种,其生长速度相对较慢,更新幼苗在光资源竞争中处于劣势。林下大量的榆树等阔叶树种幼龄个体,还侵占了油松幼苗的潜在生态位,从而对油松的更新产生影响。
2010—2015年间,样地内DBH≥1 cm的个体年均死亡率和年均增补率分别为2.71%和15.18%,增补率大于死亡率,与已有的其他森林类型的固定样地调查结果类似。如BCI样地在1982—1995年间年均死亡率和增补率分别为2.64%和2.87%,马来西亚Pasoh样地在1986—1996年间分别为1.46%和1.65%[25],古田山样地2002—2007年间分别为2.02%和6.65%[12]。复垦地树种的年均死亡率与其他样地接近,但增补率却明显高出很多。不同树种的年均死亡率和年均增补率差异较大,如刺槐较高的年均死亡率(3.41%)和较低的年均增补率(0.53%)可能是由于样地内的资源不能满足其生态需求,大量个体的死亡是造成其年均死亡率较高的直接原因。
两次调查期间,群落总的胸高断面积净增加3.20 m2·hm-2,相对于5年间树木生长的胸高断面积(3.48 m2·hm-2),由死亡而减少的胸高断面积相对较少(0.65 m2·hm-2)。因此,总的胸高断面积增加。因树木死亡减少的胸高断面积中,刺槐减少最多,主要原因是其个体死亡量较大。5年间,刺槐的胸高断面积损失最多,其新增的胸高断面积也最多。油松的死亡量很小,且无增补个体,其胸高断面积的增长主要是由胸径生长引起的。榆树虽然数量多,但小径级个体占了很大比重,胸高断面积增长量并不大。
3.3 平均胸径变化5年间,刺槐和油松的平均胸径均增加是因为树木本身生长较多,且新进级的个体少。榆树的平均胸径减少主要是因生长较少,且出现大量新进级的小个体所致。不同树种胸径生长速率的差异主要与其自身的生长特性有关。陕西黄土高原油松胸径在15~40年时生长较快,45年后生长速率减慢进入稳定生长期[36]。本研究中,油松正处于胸径快速生长期,年均生长速率与上述研究结果基本一致,接近0.4 cm。黄土高原刺槐胸径生长的快速期在8年以前,10~12年时基本达到顶峰,此后胸径生长趋于缓慢。树龄小于12年时,刺槐的胸径生长速率为0.53 cm·a-1;树龄为12~18年时,胸径生长速率只有0.32 cm·a-1 [37]。胡振琪等[38]通过对煤矸石山刺槐林生长规律的研究发现,刺槐胸径的速生期出现在2~4年(年生长量0.6~1.0 cm),4年以后便明显下降。作为复垦地的先锋树种,刺槐经过前期的快速生长,复垦22年后已进入胸径缓慢生长阶段。
3.4 径级结构变化树木的死亡常与树木的大小有关。不同径级的树木,其个体死亡情况不同,DBH<3 cm的小径级个体死亡量较大。从死亡个体和2010年个体径级结构来看,个体数量较多的径级,其个体死亡数量也较多。小径级个体处于林下层,密度较大,个体间竞争较为激烈,对外界环境的压力也较为敏感。此外,大径级个体倒伏时也会对小径级个体造成伤害甚至致死。因此,小径级个体死亡数量较多。大径级个体生长稳定,并且个体数量相对较少,抵抗环境压力的能力较强,个体死亡数量较少。中径级个体对资源限制的敏感程度小于小径级个体,但在资源竞争方面又不如大径级个体,其死亡数量处于中间水平。以往的研究也支持了这一结论[39-40]。
刺槐死亡个体的径级结构与2010年的径级结构相类似。小径级个体死亡较多,因其个体数量本身就大。此外,刺槐属喜光树种,小径级个体为了争夺光资源,可能采取先高生长后径生长的策略,但在竞争过程中,很难竞争过大径级个体,对环境压力更加敏感。刺槐大径级个体死亡量也较多,且增补个体很少,说明刺槐已进入衰退状态。5年间,油松只有2株死亡个体,仅占样地总死亡量的1.03%,可见作为乡土树种,油松更加适应复垦地的环境。
3.5 种群大小变化Condit等[25]的研究发现,未受干扰的Pasoh样地中,2%的种群变化率超过5%;遭受严重干旱的BCI样地则高达10%。汪殷华等[12]通过对古田山样地2002—2007年间的更新动态研究显示,23.26%的种群变化率在5%以上。葛结林等[41]通过对比神农架样地9年间的群落动态特征发现,2001—2006年间3.6%的种群变化率超过5%,而遭受冰冻雪灾后,这一比率高达19%。增补率与死亡率的差值大于5%的种群属于快速变动的种群,将导致该物种在15年内个体数量加倍或减半[25]。本研究中,优势种刺槐的种群大小变化率为-2.88%,种群在缓慢减小。重要值排名第三位的油松,种群大小变化率为-0.24%,基本维持原有规模。重要值排名第二位的榆树,其种群大小变化率高达33.37%,显示种群更新速率较快,属于快速变动的种群。若继续保持5%以上的种群变化速率,样地中榆树的个体数量在未来15年内将发生大规模的变化,这将可能导致群落的物种组成和结构发生根本性变化。
总体来看,由于大量大径级个体死亡,且增补个体很少,刺槐正逐渐退出优势种的行列。在早期演替阶段,刺槐由于生长速度快,能够快速增加复垦地的植被覆盖度。同时,刺槐具有根瘤,能够固氮,可以有效增加土壤氮素,提高土壤肥力。作为先锋树种,刺槐对于后续植被恢复以及复垦地生态条件的改善具有重要作用。但刺槐属于高耗水树种,在半干旱地区会过渡消耗土壤中的贮水,最终使其生长受到抑制。而乡土树种(如低耗水、耐旱的油松)是在当地自然条件下生长的植被,能够较好地适应当地的气候条件。因此,通过种植先锋植物,待复垦地的生态环境得到改善后,可适当引入乡土植被。榆树虽然为乡土树种,耐旱、生长较快,但其结实有明显的大小年之分,且在生长过程中具有强烈的自疏习性,导致其在各个阶段特别是幼树阶段具有较高的死亡率[42]。此外,榆树的分布与降水量有着密切的正相关关系[42]。目前,榆树虽然有大量的增补个体,但其在自然降水稀少的半干旱地区能否成林,还有待持续跟踪研究。
矿区损毁土地的生态修复是一个漫长的过程,不仅包括短期的形态修复,还包括中、长期的功能修复。本文只是基于样地两次调查数据,初步分析了复垦地人工植被5年间的群落生长动态,要想科学评估不同演替阶段的植被恢复效应,还需要开展进一步的长期定位监测。
4 结论(1)2010—2015年间,群落的树种组成较为稳定,优势种仍为刺槐,但其重要值大幅下降,榆树的重要值增长较快。草本层植物由44种减少到35种,在优势成分上呈现出由1年生或1~2年生向多年生、旱中生向中生演替的趋势。
(2)样地内DBH≥1 cm的独立个体数由1530株增至2854株,死亡194株,年死亡率为2.71%;新增1518株,年增补率为15.18%。死亡量最多的树种是刺槐(160株),榆树的增补个体数最多(1495株)。群落总的胸高断面积有所增加。
(3)刺槐和油松的平均胸径增加,榆树的平均胸径减少,增加或减少值均在1~2 cm。
(4)小径级个体的死亡量较大,DBH<3 cm的死亡个体占总死亡量的45.36%。不同树种的死亡个体径级分布基本类似于2010年该树种的径级分布。
(5)刺槐和油松两个种群呈小幅度负增长,榆树种群大小变化率超过5%,属于快速增长的种群。
| [1] |
Haigh M J, Gentcheva-Kostadinova S. Ecological erosion control on coal-spoil banks:An evaluation[J]. Ecological Engineering, 2002, 18(3): 371-377. DOI:10.1016/S0925-8574(01)00087-8 |
| [2] |
郝蓉, 白中科, 赵景逵, 等. 黄土区大型露天煤矿废弃地植被恢复过程中的植被动态[J]. 生态学报, 2003, 23(8): 1470-1476. HAO Rong, BAI Zhong-ke, ZHAO Jing-kui, et al. Vegetation dynamics during plant rehabilition in degraded mined land of large opencast coal mine within loess area[J]. Acta Ecologica Sinica, 2003, 23(8): 1470-1476. |
| [3] |
Huang L, Zhang P, Hu Y G, et al. Vegetation and soil restoration in refuse dumps from open pit coal mines[J]. Ecological Engineering, 2016, 94(9): 638-646. |
| [4] |
Legendre P, Mi X, Ren H, et al. Partitioning beta diversity in a subtropi cal broad-leaved forest of China[J]. Ecology, 2009, 90(3): 663-674. DOI:10.1890/07-1880.1 |
| [5] |
Rees M, Condit R, Crawley M, et al. Long-term studies of vegetation dynamics[J]. Science, 2001, 293(5530): 650-655. DOI:10.1126/science.1062586 |
| [6] |
Laurance W F, Oliveira A A, Laurance S G, et al. Pervasive alteration of tree communities in undisturbed Amazonian forests[J]. Nature, 2004, 428(6979): 171-175. DOI:10.1038/nature02383 |
| [7] |
Feeley K J, Davies S J, Perez R, et al. Directional changes in the species composition of a tropical forest[J]. Ecology, 2011, 92(4): 871-882. DOI:10.1890/10-0724.1 |
| [8] |
Umeki K, Kikuzawa K. Long-term growth dynamics of natural forests in Hokkaido, Northern Japan[J]. Journal of Vegetation Science, 1999, 10(6): 815-824. DOI:10.2307/3237306 |
| [9] |
Hubbell S P, Foster R B. Short-term dynamics of a neotropical forest:Why ecological research matters to tropical conservation and management[J]. Oikos, 1992, 63(1): 48-61. DOI:10.2307/3545515 |
| [10] |
王利伟, 李步杭, 叶吉, 等. 长白山阔叶红松林树木短期死亡动态[J]. 生物多样性, 2011, 19(2): 260-270. WANG Li-wei, LI Bu-hang, YE Ji, et al. Dynamics of short-term tree mortality in broad-leaved Korean pine(Pinus koraiensis) mixed forest in the Changbai Mountains[J]. Biodiversity Science, 2011, 19(2): 260-270. |
| [11] |
刘晓静, 任思远, 李鹿鑫, 等. 宝天曼国家级自然保护区落叶阔叶林密度制约效应对树木存活的影响[J]. 生物多样性, 2016, 24(6): 639-648. LIU Xiao-jing, REN Si-yuan, LI Lu-xin, et al. Detecting density dependence on tree survival in a deciduous broadleaved forest in Baotianman National Nature Reserve[J]. Biodiversity Science, 2016, 24(6): 639-648. DOI:10.17520/biods.2015134 |
| [12] |
汪殷华, 米湘成, 陈声文, 等. 古田山常绿阔叶林主要树种2002-2007年间更新动态[J]. 生物多样性, 2011, 19(2): 178-189. WANG Yin-hua, MI Xiang-cheng, CHEN Sheng-wen, et al. Regeneration dynamics of major tree species during 2002-2007 in a subtropical evergreen broad-leaved forest in Gutianshan National Nature Reserve in East China[J]. Biodiversity Science, 2011, 19(2): 178-189. |
| [13] |
胡跃华, 曹敏, 林露湘. 西双版纳热带季节雨林的树种组成和群落结构动态[J]. 生态学报, 2010, 30(4): 949-957. HU Yue-hua, CAO Min, LIN Lu-xiang. Dynamics of tree species composition and community structure of a tropical seasonal rain forest in Xishuangbanna, Southwest China[J]. Acta Ecologica Sinica, 2010, 30(4): 949-957. |
| [14] |
寇晓蓉, 白中科, 杜振州, 等. 黄土区大型露天煤矿企业土地复垦质量控制研究[J]. 农业环境科学学报, 2017, 36(5): 957-965. KOU Xiao-rong, BAI Zhong-ke, DU Zhen-zhou, et al. Land reclamation quality completion standards for large opencast coal mine enterprises in Loess areas[J]. Journal of Agro-Environment Science, 2017, 36(5): 957-965. DOI:10.11654/jaes.2017-0368 |
| [15] |
Liu X Y, Zhou W, Bai Z K. Vegetation coverage change and stability in large open-pit coal mine dumps in China during 1990-2015[J]. Ecological Engineering, 2016, 95(10): 447-451. |
| [16] |
Zhang Y, Yang J Y, Wu H L, et al. Dynamic changes in soil and vegetation during varying ecological-recovery conditions of abandoned mines in Beijing[J]. Ecological Engineering, 2014, 73(12): 676-683. |
| [17] |
Zhao Z Q, Bai Z K, Zhang Z, et al. Population structure and spatial distributions patterns of 17 years old plantation in a reclaimed spoil of Pingshuo opencast mine, China[J]. Ecological Engineering, 2012, 44(3): 147-151. |
| [18] |
Zhao Z Q, Wang L H, Bai Z K, et al. Development of population structure and spatial distribution patterns of a restored forest during 17-year succession(1993-2010) in Pingshuo opencast mine spoil, China[J]. Environmental Monitoring and Assessment, 2015, 187(7): 1-13. |
| [19] |
王金满, 郭凌俐, 白中科, 等. 黄土区露天煤矿排土场复垦后土壤与植被的演变规律[J]. 农业工程学报, 2013, 29(21): 223-232. WANG Jin-man, GUO Ling-li, BAI Zhong-ke, et al. Succession law of reclaimed soil and vegetation on opencast coal mine dump of loess area[J]. Transactions of the Chinese Society of Agricultural Engineering, 2013, 29(21): 223-232. DOI:10.3969/j.issn.1002-6819.2013.21.028 |
| [20] |
张青, 毕润成, 吴兆飞, 等. 安太堡露天煤矿植被恢复区物种天然更新时空动态[J]. 生态学杂志, 2016, 35(12): 3223-3232. ZHANG Qing, BI Run-cheng, WU Zhao-fei, et al. Temporal-spatial dynamics of natural regeneration of species in ecological reclamation of Antaibao opencast coal mine[J]. Chinese Journal of Ecology, 2016, 35(12): 3223-3232. |
| [21] |
黄元仿, 张世文, 张立平, 等. 露天煤矿土地复垦生物多样性保护与恢复研究进展[J]. 农业机械学报, 2015, 46(8): 72-82. HUANG Yuan-fang, ZHANG Shi-wen, ZHANG Li-ping, et al. Research progress on conservation and restoration of biodiversity in land reclamation of opencast coal mine[J]. Transactions of the Chinese Society for Agricultural Machinery, 2015, 46(8): 72-82. DOI:10.6041/j.issn.1000-1298.2015.08.012 |
| [22] |
岳建英, 郭春燕, 李晋川, 等. 安太堡露天煤矿复垦区野生植物定居分析[J]. 干旱区研究, 2016, 33(2): 399-409. YUE Jian-ying, GUO Chun-yan, LI Jin-chuan, et al. Colonized wild plants in the reclamation area of the Antaibao opencast coal mine[J]. Arid Zone Research, 2016, 33(2): 399-409. |
| [23] |
Condit R. Research in large, long-term tropical forest plots[J]. Trends in Ecology and Evolution, 1995, 10(1): 18-22. DOI:10.1016/S0169-5347(00)88955-7 |
| [24] |
黄建辉. 植物群落调查方法概要[J]. 生物学通报, 1992(5): 45-46. HUANG Jian-hui. Summary of plant community survey methods[J]. Bulletin of Biology, 1992(5): 45-46. |
| [25] |
Condit R, Ashton P S, Manokaran N, et al. Dynamics of the forest communities at Pasoh and Barro Colorado:Comparing two 50-ha plots[J]. Philosophical Transactions of the Royal Society of London, 1999, 354(1391): 1739-1748. DOI:10.1098/rstb.1999.0517 |
| [26] |
Condit R, Hubbell S P, Foster R B. Short-term dynamics of a neotropical forest:Change within limits[J]. Bioscience, 1992, 42(11): 822-828. DOI:10.2307/1312081 |
| [27] |
常学礼, 赵爱芬, 李胜功. 科尔沁沙地固定沙丘植被物种多样性对降水变化的响应[J]. 植物生态学报, 2000, 24(2): 147-151. CHANG Xue-li, ZHAO Ai-fen, LI Sheng-gong. Responses of species diversity to precipitation change on fixed-dunes of the Naiman Banner region[J]. Acta Phytoecologica Sinica, 2000, 24(2): 147-151. |
| [28] |
张昭臣, 郝占庆, 叶吉, 等. 长白山次生杨桦林树木短期死亡动态[J]. 应用生态学报, 2013, 24(2): 303-310. ZHANG Zhao-chen, HAO Zhan-qing, YE Ji, et al. Short-term death dynamics of trees in natural secondary poplar-birch forest in Changbai Mountains of Northeast China[J]. Chinese Journal of Applied Ecology, 2013, 24(2): 303-310. |
| [29] |
王改玲, 白中科. 安太堡露天煤矿排土场植被恢复的主要限制因子及对策[J]. 水土保持研究, 2002, 9(1): 38-40. WANG Gai-ling, BAI Zhong-ke. Main limiting factors for revegetation and measures of dumping site in Antaibao opencast mine[J]. Research of Soil and Water Conservation, 2002, 9(1): 38-40. |
| [30] |
刘江华. 黄土高原刺槐人工林生长特征及其天然化程度评价[D]. 杨凌: 中国科学院研究生院, 2008. LIU Jiang-hua. Study on growth traits of Robinia pseudoacacia plantation and its naturalization process on Loess Plateau[D]. Yangling: Graduate School of Chinese Academy of Sciences, 2008. |
| [31] |
张池, 黄忠良, 史军辉, 等. 鼎湖山季风常绿阔叶林木本植物个体死亡动态[J]. 生态学报, 2006, 26(8): 2457-2462. ZHANG Chi, HUANG Zhong-liang, SHI Jun-hui, et al. Dynamics and causes of woody plant death in the monsoon evergreen broad-leaved forest in Dinghushan Nature Reserve[J]. Acta Ecologica Sinica, 2006, 26(8): 2457-2462. |
| [32] |
Janzen D H. Herbivores and the number of tree species in tropical forests[J]. American Naturalist, 1970, 104(940): 501-528. DOI:10.1086/282687 |
| [33] |
Connell J H. On the role of natural enemies in preventing competitive exclusion in some marine animals and in rain forest trees[M]//den Bore P J, Gradwell G R. Dynamics of Population. Chicago: The University of Chicago Press, 1971: 298-310.
|
| [34] |
王辉. 刺槐自毒作用及与主要伴生树种化感作用研究[D]. 保定: 河北农业大学, 2009. WANG Hui. Study of Robinia pseudoacacia autointoxication and interspecific allelopathy between Robinia pseudoacacia and its associated tree species[D]. Baoding: Hebei Agricultural University, 2009. http://industry.wanfangdata.com.cn/dl/Detail/Thesis?id=Thesis_D144556 |
| [35] |
张希彪, 王瑞娟, 上官周平. 黄土高原子午岭油松林的种子雨和土壤种子库动态[J]. 生态学报, 2009, 29(4): 1877-1884. ZHANG Xi-biao, WANG Rui-juan, SHANGGUAN Zhou-ping. Dynamics of seed rain and soil seed bank in Pinus tabulaeformis Carr. forests in eroded hilly loess regions of the Loess Plateau in China[J]. Acta Ecologica Sinica, 2009, 29(4): 1877-1884. |
| [36] |
焦醒, 刘广全. 陕西黄土高原油松生长状况及其影响因子分析[J]. 西北植物学报, 2009, 29(5): 1026-1032. JIAO Xing, LIU Guang-quan. Growth and its influencing factors of Pinus tabulaeformis in the Loess Plateau of Shaanxi Province[J]. Acta Botanica Boreali-Occidentalia Sinica, 2009, 29(5): 1026-1032. |
| [37] |
张建军, 徐佳佳, 李慧敏. 水土保持林生长过程及碳密度的动态变化[J]. 中国水土保持科学, 2012, 10(1): 70-76. ZHANG Jian-jun, XU Jia-jia, LI Hui-min. Growth process of soil and water conservation forest and dynamic change of its carbon intensity[J]. Science of Soil and Water Conservation, 2012, 10(1): 70-76. |
| [38] |
胡振琪, 张光灿, 毕银丽, 等. 煤矸石山刺槐林分生产力及生态效应的研究[J]. 生态学报, 2002, 22(5): 621-628. HU Zhen-qi, ZHANG Guang-can, BI Yin-li, et al. Stand productivity and ecological effects of black locust in a coal waste pile[J]. Acta Ecologica Sinica, 2002, 22(5): 621-628. |
| [39] |
Smith K T, Shortle W C. Radial growth of hardwoods following the 1998 ice storm in New Hampshire and Maine[J]. Canadian Journal of Forest Research, 2003, 33(2): 325-329. DOI:10.1139/x02-185 |
| [40] |
Hopkin A, Williams T, Sajan R, et al. Ice storm damage to eastern Ontario forests:1998-2001[J]. Forestry Chronicle, 2003, 79(1): 47-53. DOI:10.5558/tfc79047-1 |
| [41] |
葛结林, 熊高明, 邓龙强, 等. 湖北神农架山地米心水青冈-多脉青冈混交林的群落动态[J]. 生物多样性, 2012, 20(6): 643-653. GE Jie-lin, XIONG Gao-ming, DENG Long-qiang, et al. Community dynamics of a montane Fagusengleriana-Cyclobalanopsis multiervis mixed forest in Shennongjia, Hubei, China[J]. Biodiversity Science, 2012, 20(6): 643-653. |
| [42] |
牛海亮. 浑善达克沙地榆树疏林榆树种群特征分析[D]. 呼和浩特: 内蒙古大学, 2008. NIU Hai-liang. Analysis of population characteristics of Ulmus pumila sparse forest in Hunshandake sandy land[D]. Huhehaote: Inner Mongolia University, 2008. http://d.wanfangdata.com.cn/Thesis/Y1376515 |
 2018, Vol. 37
2018, Vol. 37