文章信息
- 庞燕华, 陈莉娜, 张晟, 涂保华, 张文艺, 黄兆琴, 胡林潮
- PANG Yan-hua, CHEN Li-na, ZHANG Sheng, TU Bao-hua, ZHANG Wen-yi, HUANG Zhao-qin, HU Lin-chao
- 热处理后水稻土溶解性有机质光谱特征的变化
- Changes in the spectral characteristics of dissolved organic matter from paddy soil after heating
- 农业环境科学学报, 2018, 37(3): 505-514
- Journal of Agro-Environment Science, 2018, 37(3): 505-514
- http://dx.doi.org/10.11654/jaes.2017-1026
文章历史
- 收稿日期: 2017-07-24
- 录用日期: 2017-12-19
2. 常州市环境科学研究院, 江苏 常州 213022;
3. 江苏城市职业学院城市科学系, 南京 210036
2. Changzhou Academy of Environmental Science, Changzhou 213022, China;
3. College of Environmental and Ecologic, Jiangsu Open University, Nanjing 210036, China
溶解性有机物(DOM)是指自然环境中能通过孔径为0.45 μm滤膜的一类具有不同结构及分子量大小的有机物的连续体或混合体[1]。DOM在土壤有机质中含量一般不超过1%,主要来自动植物残体分解、根系分泌物、土壤微生物生物量及腐殖质等,由低分子量的游离氨基酸、碳水化合物、有机酸以及大分子量的酶、氨基糖、腐殖质等组成[2],它经地表径流、淋溶等途径进入水体并成为水体的一部分,是土壤中的重要组分,在土壤的很多化学和生物进程中起重要作用[3]。
土壤受火(或热处理)事件较常见,一般分为人为原因(比如秸秆焚烧、污染土壤热处理工艺等)和自然原因(森林大火、草原野火等)两类。火烧可以使土壤理化性质发生明显的变化[4],同时对土壤有机质的含量和组成产生极大的影响,其变化与火烧强度、持续时间等诸多因素有关[5]。国内外对热处理影响土壤的研究多停留在理化性质,而热处理对土壤DOM的组成、结构等诸方面的影响及其带来的环境影响尚不清楚。
国内外已有不少学者利用紫外-可见光谱(UV-VIS)和三维荧光光谱(3DEEM)相结合研究水体、沉积物和土壤中DOM的光学特性、组成结构和来源[6-8],但只有Vergnoux等[9]将其运用于受热之后土壤DOM光学特性的研究中,并且发现了热处理后土壤DOM的三维荧光图发生蓝移现象。由于DOM中含大量能产生荧光现象的基团,因此可以应用3DEEM分析土壤DOM的化学和物理性质[10]。过去通常是利用核磁共振、红外光谱等手段对DOM进行分析,目前,随着仪器分析技术的发展,越来越广泛地采用光谱技术对DOM进行表征。与前者相比,3DEEM灵敏度高,不破坏样品结构,需要样品量更少,分析DOM效果更显著[11]。紫外光谱通常被用来表征自然有机质,芳香结构可以通过UV-VIS光谱的分析确定,其具有方便、易操作并可随时监测等优势,紫外吸收的曲线特征、不同浓度的吸收值以及特定波长的吸收值之间的比值等对有机质的来源和组成结构分析等也具有一定的价值[12]。
本文利用UV-VIS光谱、3DEEM和红外光谱技术分析热处理对土壤DOM的影响,并基于光谱特征变化,探讨热处理作用对土壤DOM结构和组分的影响,初步分析热处理后土壤DOM变化带来的环境风险,同时为热影响下土壤中污染物的环境风险评估提供依据。
1 材料与方法 1.1 样品采集与处理2016年7月上旬,分别在长江中下游流域江苏省南通市(31°50′48″N,121°41′50″E)和常州市(31°40′35″N,119°58′42″E)按蛇形采样法随机采集0~15 cm表层水稻土壤,剔除草根及其他杂物,风干后过2 mm筛于4 ℃避光保存备用,分别记为水稻土A和B。
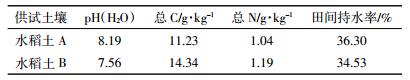
分别将两种土壤样品平均分成10份。其中一份为对照样品(CK),不作加热处理。其他样品放入带盖的25 mL陶瓷坩埚中,接着将坩埚放入马弗炉,在不同温度(200、250、300 ℃)和不同时间(2、4、6 h)下进行加热。样品在马弗炉达到目标温度后再加入,最后在干燥器中冷却至室温。处理后的土壤样品分别进行DOM提取及相关光谱表征。供试土样的基本理化性质见表 1。土壤pH采用电位法测定(土水质量比为1:2.5);土壤总有机碳含量采用重铬酸钾-硫酸外加热法测定;土壤总N采用凯氏定氮法测定;田间持水率采用环刀法测定。
取5 g处理后的土壤样品,加入超纯水50 mL(电阻率为18.2 MΩ·cm-1),水土比10:1,20 ℃下在黑暗处200 r·min-1振荡5 h后离心分离30 min(4000 r·min-1),取上层清液过0.45 μm滤膜,过滤后的液体即为DOM浸提液。其中DOM中的总有机碳(DOC)和总氮(DN)的测定采用TOC5000型总有机碳分析仪(Shimadzu,日本);紫外光谱采用UV1800紫外-可见分光光度计(Shimadzu,日本),扫描波长200~400 nm,扫描间隔1 nm;荧光光谱分析利用Cary Eclipse型荧光分光光度计(美国安捷伦)测定,测量波长范围:激发波长(λex)220~400 nm,增量5 nm;发射波长(λem)280~550 nm,增量2 nm;狭缝宽度5 nm,PMT电压800 V,扫描速度1200 nm·min-1,样品在1 cm石英荧光比色皿中测量。DOM红外光谱采用KBr压片法测定,将1 mg冻干的DOM及其组分样品与400 mg干燥的KBr磨细混匀,在10 t·cm-2下压成薄片并维持2 min,用FTIR光谱仪(Nicolet iS50,美国)测定并记录其光谱扫描波数范围(500~4000 cm-1),扫描精度为4 cm-1。
1.3 数据处理采用Origin8.5获得3DEEM等高线图、紫外光谱图和红外光谱图,试验数据采用Excel 2010软件进行分析。采用单因子方差分析(One-Way ANOVA)对不同温度下土壤DOM的总有机碳(DOC)和总氮(DN)含量进行显著性差异检验。
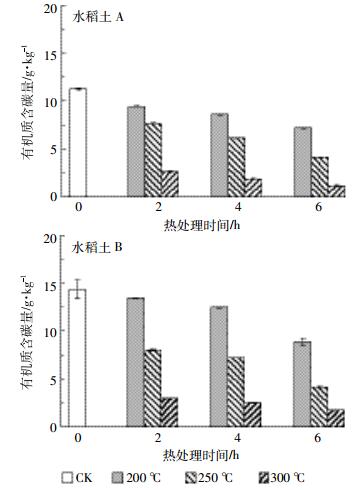
2 结果与讨论 2.1 加热处理对土壤有机碳含量的影响从图 1可以看出,两种土壤在不同温度处理下的有机碳含量变化趋势较为一致,有机碳含量均随温度的升高和加热时间的增加而逐渐减少。200 ℃时较CK时下降幅度不大,而300 ℃时有机碳含量大幅减少,其中水稻土A较CK减少了76.6%~90.0%,水稻土B减少了79.5%~88.0%,说明300 ℃时土壤中有机碳含量已很少。此外,不同土壤加热后有机碳的稳定性表现出较大差异。
|
| 图 1 热处理前后土壤有机碳含量的变化 Figure 1 Changes of organic carbon content of different heat treatment |
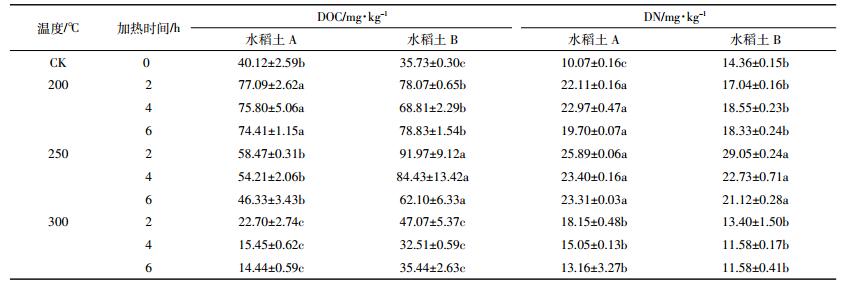
热处理前后两种土壤的DOC和DN含量变化如表 2,随着温度的升高,两种土壤DOC和DN均呈现出先增加后减少的趋势,且DOC在200 ℃或250 ℃时最高,为未加热时的1.92~2.22倍,300 ℃时DOC的含量较250 ℃存在显著差异(P < 0.05),说明不同加热温度下,土壤有机碳发生了不同程度的降解和转化。此结果与Fernandez[13]等研究发现一致,其中220 ℃加热土壤会使70%~80%的纤维素和半纤维素、50%的木质素、10%~25%的脂类物质完全分解。这些碳水化合物的水合、降解产生结构简单的脂肪族物质,使得200 ℃时DOC含量较CK显著增加(P < 0.05)。Prokushkin等[14]研究也发现了加热森林土壤和凋落物对其中有机质的影响,结果发现200 ℃时凋落物和土壤中DOC分别增加了4倍和3倍。土壤DOM中DN的含量也与加热强度相关,200 ℃加热后DOM中DN的升高可能使土壤团聚体破坏,300 ℃时DN大幅下降是因为含有机氮物质的氧化[13]。两种土壤DOM的DOC和DN在各个温度段和时间段下降幅度各异,表明不同土壤DOM由于其成分不同,热稳定性亦不同。200 ℃和250 ℃时DOC含量的增加可能是来源于土壤其他有机质的转化,加热后土壤有机碳的含量一直呈下降趋势。
土壤DOM紫外可见光谱见图 2,吸收光谱特征和水体DOM类似,土壤DOM吸收光谱中无明显特征峰,整体上样品吸光度随波长增加呈指数型减少,在波长达到400 nm后吸收逐渐趋于零。光谱主要呈现出两个吸收带,第一个位于波长200~240 nm处,第二个位于240~270 nm波长处[15-18]。加热后DOM低波段的波形发生了显著变化,第一个波段吸光度变得更高,这是因为含羧基化合物的存在[9]。
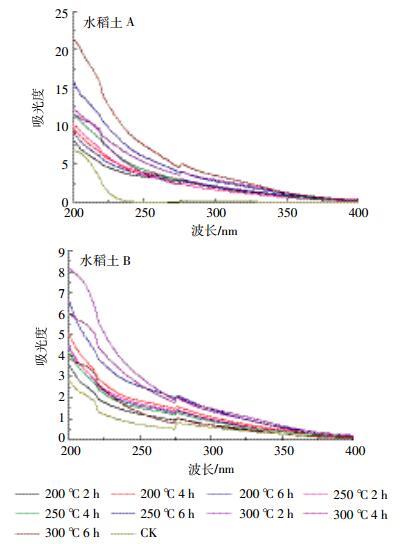
|
| 图 2 不同加热温度下水稻土A和B溶解性有机质的紫外可见光谱 Figure 2 UV-VlS absorption spectra of DOM in paddy soil A and B at different heating temperature |
250 nm和365 nm紫外吸光度比值E2/E3与DOM的分子量有很大的相关性,一般情况下,随着E2/E3的减小,分子量相对增大[9]。两种土壤DOM的E2/E3值变化如图 3所示,加热后E2/E3的值增加,其中水稻土B随着加热温度增加而增大。这表明加热后土壤DOM会表现出更低的分子量。同一温度下,随着加热时间的增加,E2/E3有时出现下降的现象,这可能是因为部分易降解的小分子量物质加热降解为无机组分。
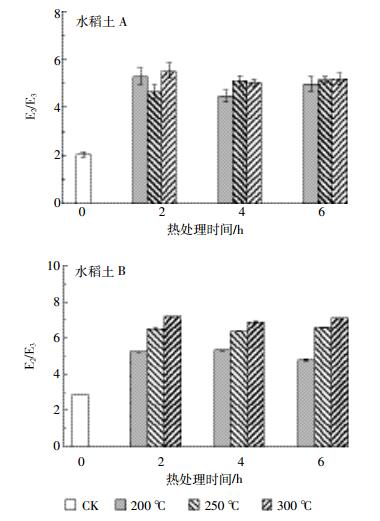
|
| 图 3 不同加热温度下水稻土A和B溶解性有机质的E2/E3的变化 Figure 3 E2/E3 of DOM in paddy soil A and B at different heating temperature |
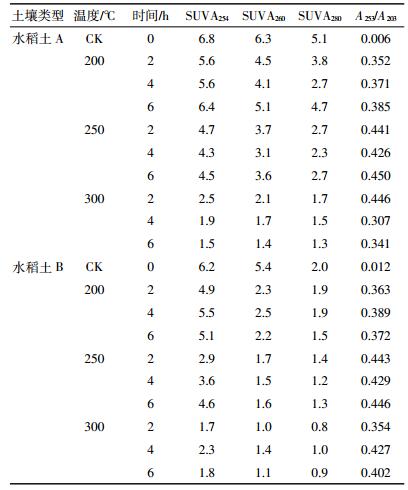
SUVA254、SUVA260、SUVA280分别是单位溶解性有机碳浓度下波长254、260、280 nm处的吸收系数,SUVA254和SUVA280的大小可以反映芳香性的大小,其值越小,芳香性越小[9],SUVA260可以表征DOM疏水性组分含量,其值越大,疏水性越强[7]。如表 3所示,加热后SUVA254、SUVA280和SUVA260明显低于原样,并且随着温度的升高逐渐减小,说明加热后温度越高,DOM芳香性越低,疏水性越弱。溶解性有机物在253 nm与203 nm吸光度的比值(A253/A203)可以反映出芳香环的取代程度及取代基的种类[19]。未加热前两种土壤的A253/A203均很低,说明DOM组分芳香环取代基以脂肪链为主,加热后A253/A203升高,说明加热后脂肪类物质大量分解,这与前面200 ℃加热后脂肪类物质分解的论述相符[13]。
|
图 4给出了未加热水稻土A和B的DOM的三维荧光扫描结果。从图 4中可知,水稻土A和B主要出现了4个荧光峰。λEx/Em=325/420 nm附近出现的荧光峰属于可见区类富里酸荧光峰(Visible fulvic-like)的C峰,水稻土A三维荧光图中λEx/Em=240/430 nm附近和水稻土B中λEx/Em=240/410 nm附近出现的荧光峰属于紫外区类富里酸荧光峰(UV fulvic-like)A峰,水稻土A三维荧光图中λEx/Em=220/310 nm处和水稻土B中λEx/Em=220/300 nm处的组分是类酪氨酸荧光峰B峰,而水稻土A和B中λEx/Em=225/340 nm处的组分是类色氨酸荧光T峰[11, 20]。形成酪氨酸和色氨酸荧光峰可能是由于生物降解,这部分微生物活性较高,各种有机质成分之间转换较为频繁,有利于提高土壤肥力[21];形成富里酸和腐植酸荧光峰的特征与土壤自身的腐殖质发育程度有关。两种水稻土DOM荧光峰的强度都是类腐殖质荧光峰A峰和C峰,远远大于类色氨酸荧光峰T峰和类酪氨酸荧光峰B峰,类腐殖质荧光峰A峰的强度又大于类腐殖质荧光峰C峰。本研究主要针对类腐殖质荧光峰A峰和C峰进行探讨分析。
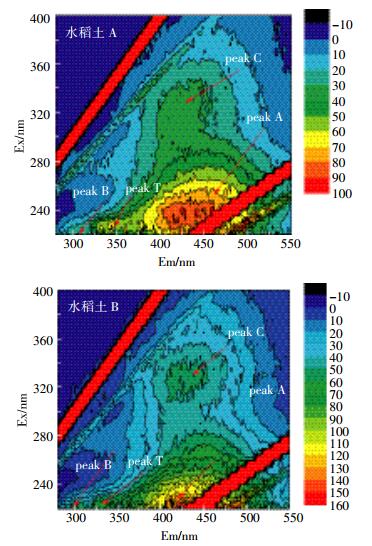
|
| 图 4 未加热水稻土A和B的溶解性有机质的三维荧光图 Figure 4 3D fluorescence EEM diagram of DOM in unheated paddy soil A and B |
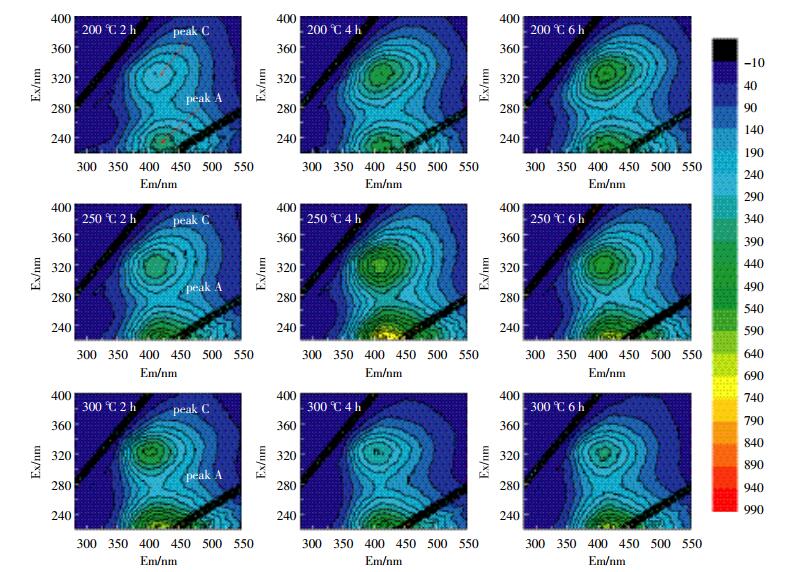
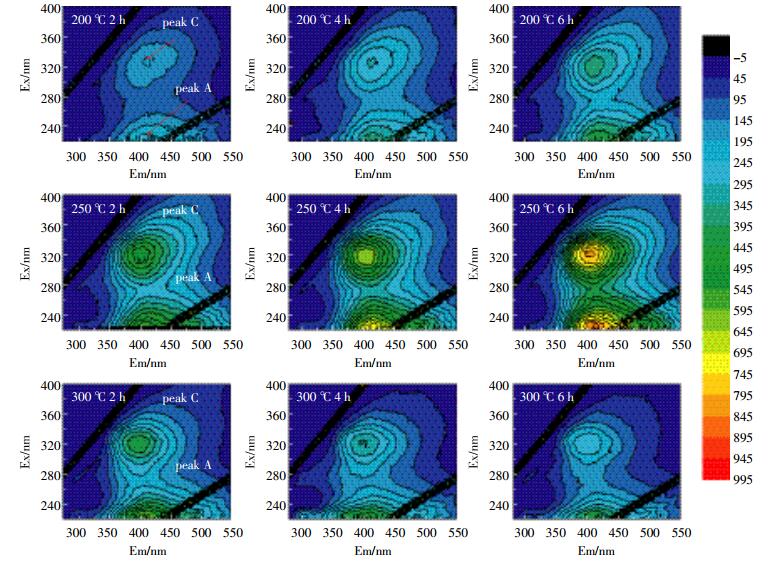
图 5、图 6为两种水稻土200、250、300 ℃的3个加热时间段的三维荧光图。表 4给出了加热前后土壤样品各组分荧光峰的荧光值和各组荧光峰的位置。从各组荧光峰的位置明显发现,两种水稻土的A峰和C峰,均发生了蓝移现象,反映了DOM各组分在加热过程中发生了化学变化,芳香烃结构被破坏,大分子转化为小分子[22-24]。Vergnoux等[9]研究森林火对DOM的三维荧光光谱影响时也发现了蓝移现象。
|
| 图 5 水稻土A溶解性有机质的200 ℃、250 ℃和300 ℃加热三维荧光图 Figure 5 3D fluorescence EEM diagrams of DOM in paddy soil A heated at 200 ℃, 250 ℃ and 300 ℃ |
|
| 图 6 水稻土B溶解性有机质的200 ℃、250 ℃和300 ℃加热三维荧光图 Figure 6 3D fluorescence EEM diagrams of DOM in paddy soil B heated at 200 ℃, 250 ℃ and 300 ℃ |
两个荧光峰的强度总体上随着加热时间的增加而增加,C峰强度增加是因为部分具有荧光效应的基团加热降解而进入溶液中,或大分子类腐殖质具有刚性和共平面性的结构在降解过程中增加,减少溶剂或其他溶质分子的相互作用和外转移能量的损失,从而增强荧光信号[23]。荧光峰A主要是由一些低分子量高荧光效率腐殖物质引起的,而荧光峰C峰则来自相对稳定的高分子量腐殖组分[20]。大分子量组分比小分子量组分更容易受热降解,DOM中具有较低分子量组分具有较强的荧光效应,荧光峰A强度的增加可能是大分子转化为小分子的原因。A峰强度300 ℃前随着加热时间和温度不断增强,主要是由于大分子类腐殖质组分被降解为低分子量组分[23-24],300 ℃时A峰强度有所下降,表明300 ℃时小分子组分会被继续降解。C峰强度300 ℃时下降,表明此温度时大分子转化和降解。荧光峰强度的增加也印证了前文DOM的增加来源于有机质分解的论述[25]。
类富里酸在紫外区与可见区中荧光峰值的比值r(A/C)是一个与有机质结构和成熟度相关的指标,r(A/C)值可用来反映腐殖组分发育程度[25]。加热后水稻土的r(A/C)较未加热时降低(表 4),表明加热后土壤DOM的芳香性降低;300 ℃时r(A/C)会略有上升,且随着加热时间的增加而逐渐增加,可能是因为此时非/弱芳香类物质逐步被消耗而导致富含芳香环结构的腐殖质比例逐渐上升,腐殖程度略有提高[26]。
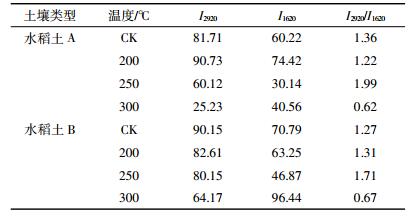
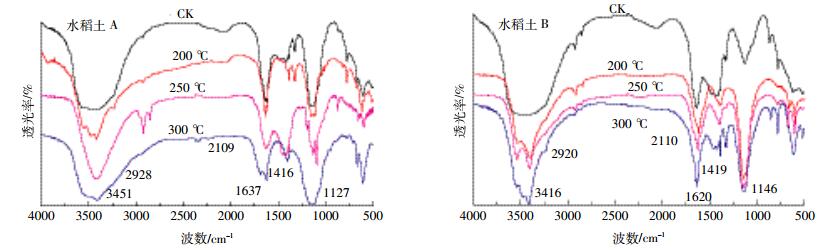
2.5 加热对土壤DOM红外光谱特征的影响图 7为两种水稻土热处理前后DOM的红外光谱,尽管加热前后存在着相同的官能基团,但是某些峰的强度已发生较大改变,说明某些基团的含量发生变化。两种水稻土加热200 ℃和250 ℃后,2920 cm-1和1420 cm-1附近的峰强增强而300 ℃时明显减弱,表明200 ℃和250 ℃加热时脂肪族类物质增加而300 ℃加热时明显减少,与前面220 ℃下水合、降解产生脂肪族物质的现象一致;1620 cm-1附近吸收峰为醛、酮中的C=O伸缩振动或芳香基上的C=C伸缩振动,加热后1620 cm-1峰强随温度增加明显增强,表明含更多的C=O、C=C官能团,羧酸类物质增多。C=C与C-H的相对强度之比与芳香化合物的含量密切相关。2920 cm-1与1620 cm-1吸收强度之比代表C=O/C-H [27],250°时C最大,300 ℃时最小(表 5),表明250 ℃ DOM结构脂肪碳含量增多,芳香碳含量相对减少;300 ℃时则反之。300 ℃时包括脂肪族和氨基酸的非芳香类物质减少导致芳香性相对增加,印证了上文提出的富含芳香环结构的腐殖质比例逐渐上升的论述。
|
| 图 7 不同热处理温度下水稻土A和B溶解性有机质的红外光谱图 Figure 7 FT-TR spectra of DOM extracted from paddy soil A and B at different temperatures |
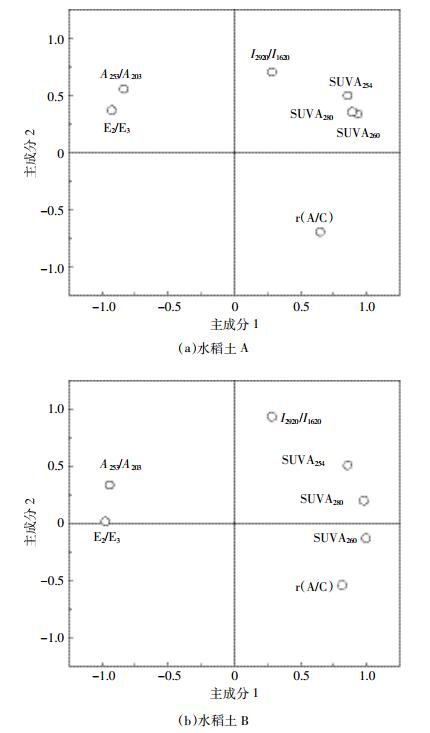
由于指标过多,统计数据得到的结果在一定程度上有重叠,综合以上分析结果,对r(A/C)、E2/E3、SUVA254、SUVA260、SUVA280、A253/A203、I2920/I1620评价指标进行主成分分析。由图 8可知,两种土壤主成分分析均产生2个主成分,水稻土A中主成分1(PCA1)累积方差贡献率为63.64%,与r(A/C)、SUVA254、SUVA260、SUVA280有很强的正相关性,与E2/E3、A253/A203有很强的负相关性。主成分2(PCA2)累积方差贡献率为27.13%,与I2920/I1620有很强的正相关性,与r(A/C)有很强的负相关性。两者累积方差贡献率为90.77%;水稻土B中则分别为74.86%、22.70%和97.56%,与PCA1有强相关性的指标与水稻土A一样,PCA2只与r(A/C)有很强的负相关性。说明r(A/C)、SUVA260、I2920/I1620这3个分别代表荧光、紫外和红外光谱的参数能够一致反映受热后土壤DOM的性质特征。其中,SUVA260与PCA1的相关性最好,说明SUVA260是最能反映土壤DOM性质的关键光谱参数。
|
| 图 8 主成分分析各组分载荷图 Figure 8 Principal components analysis factor loadings of all components |
(1)加热处理会改变土壤中DOM含量及组成,不同土壤的热稳定性亦不同。不同加热强度对土壤DOM造成的影响也不同,温度达到200 ℃和250 ℃时,有机碳含量显著提高;300 ℃时有机碳含量减少。DOM的增加来源于加热后有机质的分解和迁移。
(2)紫外光谱显示加热后土壤DOM的SUVA254减小,A253/A203升高,表明加热后土壤DOM分子量降低,脂肪类物质大量分解。加热后三维荧光图中类富里酸在可见区和紫外区的荧光峰都发生蓝移现象,荧光强度增加,r(A/C)降低,表明加热后DOM分子量和芳香性变小,DOM增加来源于加热后有机质的分解和迁移。土壤DOM红外光谱图显示加热后羧酸类物质增加,脂肪族物质200 ℃时显著增加,300 ℃时开始减少,这与紫外光谱的结果一致。
(3)土壤加热后,特别是200 ℃和250 ℃时,有机碳含量显著提高,土壤有机碳库的活动性增强,分子量减小,芳香性降低,富含羧基等强络合能力活性官能团,预示着其可能会增加相关污染物的环境风险。
| [1] |
Kalbita K. Controls on the dynamics of dissolved organic matter in soils:A review[J]. Soil Sci, 2000, 165(4): 277-304. DOI:10.1097/00010694-200004000-00001 |
| [2] |
王美丽, 李军, 朱兆洲, 等. 土壤溶解性有机质的研究进展[J]. 矿物岩石地球化学通报, 2010, 29(3): 304-310. WANG Mei-li, LI Jun, ZHU Zhao-zhou, et al. Advances in research on dissolved organic matter in soils[J]. Bulletin of Mineralogy, Petrology and Geochemistry, 2010, 29(3): 304-310. |
| [3] |
Chantigny M H. Dissolved and water-extractable organic matter in soils:A review on the influence of land use and management practices[J]. Geoderma, 2003, 113(3/4): 357-380. |
| [4] |
张喜, 朱军, 崔迎春, 等. 火烧对黔中喀斯特山地马尾松林土壤理化性质的影响[J]. 生态学报, 2011, 31(19): 5809-5817. ZHANG Xi, ZHU Jun, CUI Ying-chun, et al. Influence of fire on a Pinus massoniana soil in a karst mountain area at the center of Guizhou Province, China[J]. Acta Ecologica Sinica, 2011, 31(19): 5809-5817. |
| [5] |
耿玉清, 周荣伍, 李涛, 等. 北京西山地区林火对土壤性质的影响[J]. 中国水土保持科学, 2007, 5(5): 66-70. GENG Yu-qing, ZHOU Rong-wu, LI Tao, et al. Influences of forest fire on soil properties in Xishan area of Beijing[J]. Science of Soil and Water Conservation, 2007, 5(5): 66-70. |
| [6] |
Bi R, Lu Q, Yu W, et al. Electron transfer capacity of soil dissolved organic matter and its potential impact on soil respiration[J]. Journal of Soils and Sediments, 2013, 13(9): 1553-1560. DOI:10.1007/s11368-013-0748-5 |
| [7] |
吴东明, 刘景坤, 李勤奋, 等. 热带地区3类不同来源水溶性有机质的光谱特征[J]. 腐植酸, 2015(5): 11-18. WU Dong-ming, LIU Jing-kun, LI Qin-fen, et al. Spectral characteristics of dissolved organic matters from three different kinds of sources in torrid zone[J]. Humic Acid, 2015(5): 11-18. |
| [8] |
常单娜, 曹卫东, 包兴国, 等. 西北灌漠土长期不同施肥改变土壤可溶性有机质的化学及光谱学特性[J]. 光谱学与光谱分析, 2016, 36(1): 220-225. CHANG Dan-na, CAO Wei-dong, BAO Xing-guo, et al. Long-term different fertilizations changed the chemical and spectrum characteristics of DOM of the irrigation-desert soil in North-western China[J]. Spectroscopy and Spectral Analysis, 2016, 36(1): 220-225. |
| [9] |
Vergnoux A, Rocco R D, Domeizel M, et al. Effects of forest fires on water extractable organic matter and humic substances from Mediterranean soils:UV-vis and fluorescence spectroscopy approaches[J]. Geoderma, 2011, 160(3): 434-443. |
| [10] |
Milori D M B P, Galeti H V A, Martinneto L, et al. Organic matter study of whole soil samples using laser-induced fluorescence spectroscopy[J]. Soil Science Society of America Journal, 2006, 70(1): 57-63. DOI:10.2136/sssaj2004.0270 |
| [11] |
傅平青, 刘丛强, 尹祚莹, 等. 腐植酸三维荧光光谱特性研究[J]. 地球化学, 2004, 33(3): 301-308. FU Ping-qing, LIU Cong-qiang, YIN Zuo-ying, et al. Characterization of humic acid by three-dimensional excitation emission matrix fluorescence spectroscopy[J]. Geochimica, 2004, 33(3): 301-308. |
| [12] |
胡琼丹. 太湖沉积物中DOM的分子量组成和光谱学特征[D]. 成都: 四川师范大学, 2014. HU Qiong-dan. Composition and spectroscopy characteristics of molecular weight fraction of dissolved organic matters in the sediment from Taihu Lake, China[D]. Chengdu: Sichuan Normal University, 2014. http://cdmd.cnki.com.cn/Article/CDMD-10636-1014332213.htm |
| [13] |
Fernandez I, Cabaneiro A, Carballas T. Thermal resistance to high temperatures of different organic fractions from soils under pine forests[J]. Geoderma, 2001, 104(3): 281-298. |
| [14] |
Prokushkin A S, Tokareva I V. The influence of heating on organic matter of forest litters and soils under experimental conditions[J]. Eurasian Soil Science, 2007, 40(6): 628-635. DOI:10.1134/S106422930706004X |
| [15] |
Belin C, Quellec C, Lamotte M, et al. Characterization by fluorescence of the dissolved organic matter in natural water. Application to fractions obtained by tangential ultrafiltration and XAD resin isolation[J]. Environmental Technology, 1993, 14(12): 1131-1144. DOI:10.1080/09593339309385391 |
| [16] |
Fuentes M, González-Gaitano G, García-Mina J M. The usefulness of UV-visible and fluorescence spectroscopies to study the chemical nature of humic substances from soils and composts[J]. Organic Geochemistry, 2006, 37(12): 1949-1959. DOI:10.1016/j.orggeochem.2006.07.024 |
| [17] |
Kang K H, Shin H S, Park H. Characterization of humic substances present in landfill leachates with different landfill ages and its implications[J]. Water Research, 2002, 36(16): 4023. DOI:10.1016/S0043-1354(02)00114-8 |
| [18] |
Senesi N, Miano T M, Provenzano M R, et al. Spectroscopic and compositional comparative characterization of I. H. S. S. reference and standard fulvic and humic acids of various origin[J]. Science of the Total Environment, 1989, 81(1): 143-156. |
| [19] |
范春辉, 张颖超, 王家宏. pH值对秸秆腐殖化溶解性有机质紫外光谱和荧光光谱的影响[J]. 光谱学与光谱分析, 2015(7): 1933-1937. FAN Chun-hui, ZHANG Ying-chao, WANG Jia-hong. Effect of pH on the ultraviolet spectra and fluorescence characteristics of dissolved organic matter in the process of straw humification[J]. Spectroscopy and Spectral Analysis, 2015(7): 1933-1937. |
| [20] |
高洁, 江韬, 李璐璐, 等. 三峡库区消落带土壤中溶解性有机质(DOM)吸收及荧光光谱特征[J]. 环境科学, 2015(1): 151-162. GAO Jie, JIANG Tao, LI Lu-lu, et al. Ultraviolet-visible(UV-Vis) and fluorescence spectral characteristics of dissolved organic matter(DOM) in soils of water-level fluctuation zones of the Three Gorges Geservoir Region[J]. Environmental Science, 2015(1): 151-162. |
| [21] |
訾园园, 孔范龙, 郗敏, 等. 胶州湾滨海湿地土壤溶解性有机质的三维荧光特性[J]. 应用生态学报, 2016, 27(12): 3871-3881. ZI Yuan-yuan, KONG Fan-long, XI Min, et al. Three dimensional fluorescent characteristics of soil dissolved organic matter(DOM) in Jiaozhou Bay coastal wetlands, China[J]. Chinese Journal of Applied Ecology, 2016, 27(12): 3871-3881. |
| [22] |
Bridgeman J, Bieroza M, Baker A. The application of fluorescence spectroscopy to organic matter characterisation in drinking water treatment[J]. Reviews in Environmental Science and Bio/Technology, 2011, 10(3): 277-290. DOI:10.1007/s11157-011-9243-x |
| [23] |
傅平青, 吴丰昌, 刘丛强, 等. 太阳辐射对溶解有机质荧光光谱特征的影响[J]. 光谱学与光谱分析, 2006, 26(3): 471-474. FU Ping-qing, WU Feng-chang, LIU Cong-qiang, et al. Effect of sunlight irradiation on fluorescence properties of dissolved organic matter[J]. Spectroscopy and Spectral Analysis, 2006, 26(3): 471-474. |
| [24] |
Huguet A, Vacher L, Relexans S, et al. Properties of fluorescent dissolved organic matter in the Gironde Estuary[J]. Organic Geochemistry, 2009, 40(6): 706-719. DOI:10.1016/j.orggeochem.2009.03.002 |
| [25] |
李必才, 杨敏, 何连生, 等. 不同密度沉水植物腐解过程中水体DOM变化特征[J]. 环境工程学报, 2013, 7(5): 1754-1760. LI Bi-cai, YANG Min, HE Lian-sheng, et al. Characteristics of water DOM change in process of decomposition of submerged plant in different densities[J]. Chinese Journal of Environmental Engineering, 2013, 7(5): 1754-1760. |
| [26] |
杨承虎, 刘洋之, 朱亚先, 等. 铜绿微囊藻胞内DOM光降解及其对芘结合能力的影响[J]. 中国环境科学, 2016, 36(6): 1850-1858. YANG Cheng-hu, LIU Yang-zhi, ZHU Ya-xian, et al. Photodegradation of intracellular DOM from Microcystis aeruginosa and its effect on the binding of pyrene[J]. China Environmental Science, 2016, 36(6): 1850-1858. |
| [27] |
Bu X L, Wang L M, Ma W B, et al. Spectroscopic characterization of hot-water extractable organic matter from soils under four different vegetation types along an elevation gradient in the Wuyi Mountains[J]. Geoderma, 2010, 159(1): 139-146. |
 2018, Vol. 37
2018, Vol. 37