文章信息
- 刘璐, 刘萱, 王华, 赵慧敏, 于春艳, 冷金慧, 耿聪, 李章良
- LIU Lu, LIU Xuan, WANG Hua, ZHAO Hui-min, YU Chun-yan, LENG Jin-hui, GENG Cong, LI Zhang-liang
- 水环境因子对磺胺类抗性基因Sul1含量的影响
- Influence of water quality on sulfonamide resistance gene Sul1
- 农业环境科学学报, 2018, 37(3): 515-519
- Journal of Agro-Environment Science, 2018, 37(3): 515-519
- http://dx.doi.org/10.11654/jaes.2017-1236
文章历史
- 收稿日期: 2017-09-11
- 录用日期: 2017-11-15
2. 大连理工大学环境学院, 辽宁 大连 116024;
3. 莆田学院环境与生物工程学院, 福建省新型污染物生态毒理效应与控制重点实验室, 生态环境及其信息图谱福建省高等学校重点实验室, 福建 莆田 351100;
4. 国家海洋环境监测中心, 辽宁 大连 116023
2. School of Environment, Dalian University of Technology, Dalian 116024, China;
3. Fujian Provincial Key Laboratory of Ecology-toxicological Effects & Control for Emerging Contaminants, Key Laboratory of Ecological Environment and Information Atlas, Fujian Provincial University, College of Environmental and Biological Engineering, Putian University, Putian 351100, China;
4. National Marine Environmental Monitoring Center, Dalian 116023, China
磺胺类抗生素是一类具有广谱抗菌活性的人畜共用抗菌剂,被广泛用于医疗、畜牧和水产养殖等领域[1]。动物对磺胺类抗生素的排泄率为67%~90%[2],大量的磺胺类抗生素最终会进入地表水环境中[3]。水环境中的抗生素增加了水中微生物存活的选择性压力,使可携带抗生素抗性基因(Antibiotic resistant genes,ARGs)的耐药微生物成为水环境中的优势种。因而,磺胺类抗生素引发的磺胺类抗性基因污染受到人们的关注。目前,磺胺类抗性基因(Sul1、Sul2和Sul3)已在河流、河口及水产养殖区附近等水环境中检出[4-8]。其中,Sul1是在水环境中含量较高、分布相对广泛的磺胺类抗性基因[9-10]。
天然水环境的水质状况可能会影响抗生素抗性基因的水平转移,进而影响抗生素抗性基因的扩散。Bergeron等[11]对美国路易斯安那州东南部湿地中ARGs的分布特征进行研究发现,盐度对ARGs含量具有显著影响。张俊等[12]研究结果表明,pH变化对四环素ARGs的含量具有显著影响。另外,水中营养元素水平可能对ARGs的分布和传播有直接或间接的影响[13-14]。本研究选取Sul1为目的基因,采用绝对定量PCR技术,考察了5种水环境因子(pH、盐度、腐植酸、总氨氮和活性磷酸盐)对Sul1含量的影响,以期为水环境中磺胺类抗生素抗性基因的生态环境风险评估提供科学参考。
1 材料与方法 1.1 Sul1型模拟实验菌的构建从水环境样品中提取基因组DNA,扩增出长度为476 bp的Sul1基因,经1.5% 1×TAE琼脂糖凝胶电泳鉴定后纯化后,连接至pMD18-T克隆载体[宝日医生物技术(北京)有限公司],转入E. coli DH5α感受态细胞中,再通过蓝白斑筛选挑取含目的基因的阳性菌落,37 ℃恒温振荡培养过夜。采用质粒提取试剂盒[宝日医生物技术(北京)有限公司]在所得菌液中提取包含Sul1基因的pMD18-T/Sul1质粒,所得菌液命名为Sul1型模拟实验菌,将质粒送于生工生物工程(上海)股份有限公司测序。
1.2 Sul1荧光定量PCR方法的建立及标准曲线的绘制经Nanodrop核酸定量仪测定质粒的浓度及纯度,将标准质粒用超纯水稀释成1010~102 copies·μL-1的9个浓度,选取107、106、105、104、103和102这6个浓度作为模板,以0.3 μmol·L-1的Sul1F和Sul1R为特异引物,并加入10 μL的SYBR Premix Dimer Eraser(2×)、0.4 μL的ROX Reference DyeⅡ(50×)和6.4 μL的无菌水,反应体系20 μL。荧光定量PCR反应条件:95 ℃预变性5 min;95 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,进行35个循环;72 ℃延伸7 min。每个反应进行3次重复,并设置空白对照。以SYBR-Green Ⅰ荧光染料法,应用Step-one定量PCR仪(ABI,美国)绘制Sul1的标准曲线。绘制出的Sul1标准曲线为Y=-3.50lgX+39.03,熔解曲线具有特异性,决定系数R2为0.984,相对效率达96%。荧光定量PCR中所用试剂均购于宝日医生物技术(北京)有限公司。
1.3 环境因子对Sul1含量的影响在100 mL锥形瓶中加入10 mL LB肉汤培养基,加入0.01 mL Sul1型模拟实验菌,Sul1的初始浓度为1.10×105 copies·mL-1。所有实验均设置3组平行,同时设置空白对照。pH对Sul1含量的影响试验:通过150 g·L-1 NaOH或(1+5)HCl溶液调节LB肉汤培养基pH的初始值分别为3、4、5、6、7、8、9、10和11;盐度对Sul1含量的影响试验:通过NaCl溶液(200 g·L-1)将空白培养基盐度20逐渐增加至25、30、35、40和45;设置LB肉汤培养基的总氨氮(NH3-N)、活性磷酸盐(PO4-P)、腐植酸(HA)的初始浓度分别为0、0.05、0.1、0.2、0.5、1 mg·L-1。所有实验组均经37 ℃恒温振荡培养24 h后,取1.5 mL菌液,采用MiniBEST Bacteria Genomic DNA试剂盒[宝日医生物技术(北京)有限公司]提取各实验组的菌液基因组DNA,经过1.5%的1×TAE琼脂糖凝胶电泳(220 V,15 min,美国伯乐公司),纯度的测定采用微量核酸定量仪(赛默飞科技有限公司,美国)。Sul1含量的单因素方差分析(One-way ANOVA)应用SPSS 17.0软件计算,其中P < 0.05为差异显著,P < 0.01为差异极显著;并使用Origin 8.60进行绘图。
2 结果与讨论 2.1 pH和盐度对磺胺类抗性基因Sul1含量的影响图 1为pH初始值分别为3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0和11.0时对Sul1含量的影响。当Sul1的初始浓度为1.10×105 copies·mL-1、pH值为3~11时,Sul1基因含量的变化范围为4.66×104~1.14×108 copies·mL-1。当pH值为11时,Sul1的平均含量仅为4.66×104 copies·mL-1;而pH值为6时,Sul1的平均含量达到1.14×108 copies·mL-1,其含量极显著高于酸性(pH 3~5)和碱性(pH 9~11)条件(P < 0.01)。由此可见,中性pH适于抗性大肠杆菌的生长,间接促进了Sul1的含量增加,而酸性和碱性pH条件对Sul1的含量均呈现显著的抑制作用。
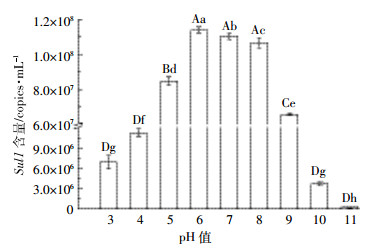
|
| 不同小写字母表示存在显著性差异(P < 0.05),不同大写字母表示存在极显著性差异(P < 0.01)。下同 Means with different lowercase letters indicate significant differences at P < 0.05 level; Means with different capital letters indicate extremely significant differences at P < 0.01 level. The same below 图 1 pH对磺胺类抗性基因Sul1含量的影响 Figure 1 Impact of pH on the content of sulfonamide resistance gene Sul1 |
pH是重要的水质指标,其过高或过低,都会直接影响水环境中抗性细菌菌落数量,进而影响到ARGs的存在和传播。本实验结果显示pH值为6时,Sul1的平均含量达到1.14×108 copies·mL-1,显著高于其他pH条件(P < 0.01),表明ARGs在环境中增殖和传播的最适pH值在6左右。
图 2为盐度对磺胺类抗性基因Sul1含量的影响,结果表明盐度对Sul1的含量有着极显著的影响(P<0.01)。盐度从20上升到45,Sul1含量的变化范围从1.04×108 copies·mL-1下降到8.34×105 copies·mL-1,这意味着盐度增加对Sul1的含量有明显的抑制作用。这可能是在高盐度条件下,细菌为了保持自身生命活动,避免盐度对其内部的生物化学反应造成干扰,细菌细胞膜阻止了绝大部分的外界物质进入,进而影响了Sul1的含量。
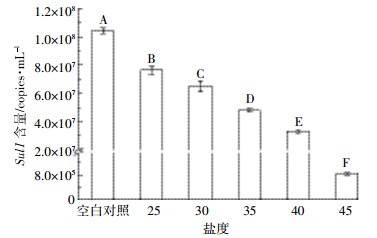
|
| 图 2 盐度对磺胺类抗性基因Sul1含量的影响 Figure 2 Impact of salinity on the content of sulfonamide resistance gene Sul1 |
盐度是影响细菌与外部环境发生物质与能量交换的一个重要因素,其高低决定了细菌渗透压的变化,从而直接影响细菌的活性。本研究中盐度从20提高到45,Sul1的含量显著下降了近3个数量级。Bergeron等[11]对美国路易斯安那州东南部湿地中ARGs的分布特征进行研究,结果显示盐度为6的采样点区域的ARGs分布和含量显著高于盐度为12的采样点区域,这个结果与本实验一致,证实了水环境中盐度可能对ARGs的分布和传播造成影响。
2.2 腐植酸对磺胺类抗性基因Sul1含量的影响图 3为不同浓度的HA对Sul1含量的影响。当无HA时,24 h后,Sul1含量上升到1.04×108 copies·mL-1。HA浓度为0.05 mg·L-1时,Sul1含量下降至1.00×108 copies·mL-1,差异不显著(P=0.130)。而当HA浓度高于0.05 mg·L-1时,随其浓度的升高,Sul1含量极显著降低(P<0.01),表明高浓度的HA(大于0.05 mg·L-1)对Sul1含量呈现显著的抑制作用(P<0.01),这可能是由于HA附着在E.coli-Sul1细胞膜表面,影响了细胞从培养基中吸收必要的营养物质,间接影响了Sul1的增殖和传播。

|
| 图 3 腐植酸(HA)对磺胺类抗性基因Sul1含量的影响 Figure 3 Impact of humic acid(HA) on the content of sulfonamide resistance gene Sul1 |
HA是天然水环境中广泛存在的重要吸光物质,是水体中色度构成和溶解性有机质(Dissolved organic matter,DOM)的主要成分[15]。HA含有大量的环状(苯环、稠苯环等)结构和多种官能团(羧基、酚羟基、酮基、胺基等),易与水环境中的抗生素或金属离子形成络合物或螯合物[16]。近年来,Chen等[17]研究表明,水溶液中DOM的存在,使四环素与其形成络合物,降低了四环素对E. coli的生物有效性,进而减弱了ARGs的筛选压力。本研究结果进一步证实,即使抗生素不存在时,高浓度的HA可能直接影响磺胺类抗性基因Sul1在水环境中的传播。
2.3 总氨氮和活性磷酸盐对磺胺类抗性基因Sul1含量的影响图 4为NH3-N对磺胺类抗性基因Sul1含量的影响。由图 4可见,低浓度的NH3-N对Sul1的含量呈促进作用,而高浓度呈抑制作用。当无NH3-N存在时,培养24 h后,Sul1基因含量达到7.30×107 copies·mL-1;随着NH3-N浓度提高到0.05 mg·L-1,Sul1含量增长到9.97×107 copies·mL-1;NH3-N浓度为0.05~0.2 mg·L-1时,对Sul1含量表现出促进作用(P < 0.05);NH3-N浓度为0.5 mg·L-1时,对Sul1含量具有抑制作用;当NH3-N浓度提高到1 mg·L-1,Sul1含量降低到5.87×107 copies·mL-1。可见NH3-N浓度高于0.5 mg·L-1时,对Sul1含量具有显著的抑制作用(P < 0.05)。
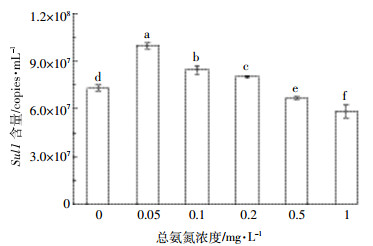
|
| 图 4 总氨氮(NH3-N)对磺胺类抗性基因Sul1含量的影响 Figure 4 Impact of ammonia nitrogen(NH3-N) on the content of sulfonamide resistance gene Sul1 |
图 5为PO4-P对磺胺类抗性基因Sul1含量的影响。图 5表明,当无PO4-P时,Sul1含量为7.30×107 copies·mL-1。当PO4-P浓度为0.05 mg·L-1时,Sul1含量达到1.19×108 copies·mL-1,高出对照实验组1个数量级,揭示低浓度的PO4-P对Sul1含量呈显著的促进作用(P < 0.05);但当PO4-P浓度为0.5 mg·L-1时,Sul1含量为7.56×107 copies·mL-1,与对照组相比差异不显著(P=0.403);而PO4-P浓度为1 mg·L-1时,Sul1含量仅为5.15×107 copies·mL-1,被显著抑制(P < 0.05)。
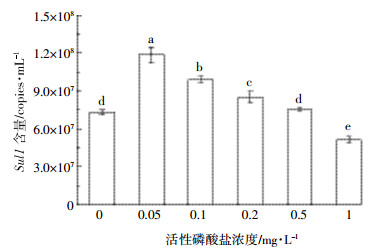
|
| 图 5 活性磷酸盐(PO4-P)对磺胺类抗性基因Sul1含量的影响 Figure 5 Impact of available phosphate(PO4-P) on the content of sulfonamide resistance gene Sul1 |
氮和磷都是水环境中的营养元素,本研究考察了总氨氮和活性磷酸盐对Sul1含量的影响,研究结果显示低浓度的氮、磷对目的基因的含量变化呈促进作用,而高浓度则呈现显著的抑制作用。Guo等[18]研究结果表明,与缺乏氮或磷条件相比,当氮、磷和葡萄糖同时存在时,细菌ARGs接合转移的转化效率提高近2倍,而与仅存葡萄糖相比,转化效率提高近100倍,实验结果进一步证明氮、磷的存在对ARGs在环境中的迁移和转化有显著的影响。
3 结论水环境因子对水中磺胺类抗性基因Sul1的存在及分布可能产生极其重要的影响,pH 3~5、pH 9~10、高盐度(25~45)、高HA浓度和高氮磷浓度对Sul1含量均呈显著的抑制作用,低浓度氮磷对Sul1含量起促进作用。
| [1] |
汪涛, 杨再福, 陈勇航, 等. 地表水中磺胺类抗生素的生态风险评价[J]. 生态环境学报, 2016, 25(9): 1508-1514. WANG Tao, YANG Zai-fu, CHEN Yong-hang, et al. Ecological risk assessment for sulfonamides in surface waters[J]. Ecology and Environmental Sciences, 2016, 25(9): 1508-1514. |
| [2] |
Kim Y, Jung J, Kim M, et al. Prioritizing veterinary pharmaceuticals for aquatic environment in Korea[J]. Environmental Toxicology & Pharmacology, 2008, 26(2): 167-176. |
| [3] |
冀秀玲, 刘芳, 沈群辉, 等. 养殖场废水中磺胺类和四环素抗生素及其抗性基因的定量检测[J]. 生态环境学报, 2011, 20(5): 927-933. JI Xiu-ling, LIU Fang, SHEN Qun-hui, et al. Quantitative detection of sulfonamides and tetracycline antibiotics and resistance genes in sewage farms[J]. Ecology and Environmental Sciences, 2011, 20(5): 927-933. |
| [4] |
杨颖. 北江水环境中抗生素抗性基因污染分析[D]. 广州: 中山大学, 2010. YANG Ying. Characterizing the pollution by the representative antibiotic resistance genes(ARGs) in the Beijiang River, South China[D]. Guangzhou:SunYat-sen University, 2010. |
| [5] |
梁惜梅, 聂湘平, 施震. 珠江口典型水产养殖区抗生素抗性基因污染的初步研究[J]. 环境科学, 2013, 34(10): 4073-4080. LIANG Xi-mei, NIE Xiang-ping, SHI Zhen. Preliminary studies on the occurrence of antibiotic resistance genes in typical aquaculture area of the Pearl River Estuary[J]. Environmental Science, 2013, 34(10): 4073-4080. |
| [6] |
张瑞泉, 应光国, 丁永祯, 等. 广东西枝江-东江流域抗生素抗性基因污染特征研究[J]. 农业环境科学学报, 2013, 32(12): 2471-2479. ZHANG Rui-quan, YING Guang-guo, DING Yong-zhen, et al. Pollution characteristics of antibiotic resistance genes in Xizhijiang-Dongjiang River basin, Guangdong Province, China[J]. Journal of Agro-Environment Science, 2013, 32(12): 2471-2479. DOI:10.11654/jaes.2013.12.021 |
| [7] |
王娜. 环境中磺胺类抗生素及其抗性基因的污染特征及风险研究[D]. 南京: 南京大学, 2014. WANG Na. Pollution characteristics and risk of sulfonamides antibiotics and their resistance genes in the environment[D]. Nanjing:Nanjing University, 2014. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2949358 |
| [8] |
李壹, 曲凌云, 朱鹏飞, 等. 山东地区海水养殖区常见抗生素耐药菌及耐药基因分布特征[J]. 海洋环境科学, 2016, 35(1): 55-62. LI Yi, QU Ling-yun, ZHU Peng-fei, et al. Distribution characteristics of antibiotic resistance bacteria and related resistance genes in mariculture area of Shandong[J]. Marine Environmental Science, 2016, 35(1): 55-62. |
| [9] |
Luo Y, Mao D Q, Rysz M, et al. Trends in antibiotic resistance genes occurrence in the Haihe River, China[J]. Environmental Science & Technology, 2010, 44(19): 7220-7225. |
| [10] |
Lu Z H, Na G S, Gao H, et al. Fate of sulfonamide resistance genes in estuary environment and effect of anthropogenic activities[J]. Science of the Total Environment, 2015, 527/528: 429-438. DOI:10.1016/j.scitotenv.2015.04.101 |
| [11] |
Bergeron S, Brown R, Homer J, et al. Presence of antibiotic resistance genes in different salinity gradients of freshwater to saltwater marshes in southeast Louisiana, USA[J]. International Biodeterioration & Bio-degradation, 2016, 113: 80-87. |
| [12] |
张俊, 罗方园, 熊浩徽, 等. 环境因素对土壤中几种典型四环素抗性基因形成的影响[J]. 环境科学, 2014, 35(11): 4267-4274. ZHANG Jun, LUO Fang-yuan, XIONG Hao-hui, et al. Effect of environmental factors on the formation of several typical tetracycline resistance genes in soil[J]. Environmental Science, 2014, 35(11): 4267-4274. |
| [13] |
Zhao Z L, Wang J, Han Y, et al. Nutrients, heavy metals and microbial communities co-driven distribution of antibiotic resistance genes in adjacent environment of mariculture[J]. Environmental Pollution, 2016, 220: 909-918. |
| [14] |
Zhu Y G, Zhao Y, Li B, et al. Continental-scale pollution of estuaries with antibiotic resistance genes[J]. Nature Microbiology, 2017, 2. DOI:10.1038/nmicrobiol.2016.270 |
| [15] |
于春艳. 腐植酸的分离及其组分对水中2, 4-D光降解作用[D]. 大连: 大连理工大学, 2009. YU Chun-yan. Separation of humic acids and effects of their fractions on the photodegradation of 2, 4-D in aqueous environment[D]. Dalian:Dalian University of Technology, 2009. http://cdmd.cnki.com.cn/Article/CDMD-10141-2010021879.htm |
| [16] |
欧晓霞. 腐植酸及其不同级分和铁的络合物对阿特拉津光降解的影响[D]. 大连: 大连理工大学, 2008. OU Xiao-xia. The effects of complexes of iron with humic acids and fractions on the photodegradation of atrazine[D]. Dalian:Dalian University of Technology, 2008. http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y1419422 |
| [17] |
Chen Z Y, Zhang Y J, Gao Y Z, et al. Influence of dissolved organic matter on tetracycline bioavailability to an antibiotic-resistant bacterium[J]. Environmental Science & Technology, 2015, 49(18): 10903-10910. |
| [18] |
Guo M T, Yuan Q B, Yang J. Distinguishing effects of ultraviolet exposure and chlorination on the horizontal transfer of antibiotic resistance genes in municipal wastewater[J]. Environmental Science & Technology, 2015, 49(9): 5771-5778. |
 2018, Vol. 37
2018, Vol. 37




