文章信息
- 谢月, 梁红, 宋立全, 王清波, 付东风, 高大文
- XIE Yue, LIANG Hong, SONG Li-quan, WANG Qing-bo, FU Dong-feng, GAO Da-wen
- 东北沼泽湿地土壤中氨氧化微生物活性和丰度研究
- Activity and abundance of ammonia-oxidizing bacteria and ammonia-oxidizing archaea of marsh wetland soil in Northeast of China
- 农业环境科学学报, 2018, 37(3): 546-551
- Journal of Agro-Environment Science, 2018, 37(3): 546-551
- http://dx.doi.org/10.11654/jaes.2017-0992
文章历史
- 收稿日期: 2017-07-15
- 录用日期: 2017-10-30
2. 东北林业大学林学院, 哈尔滨 150040;
3. 黑龙江三江国家自然保护区管理局, 黑龙江 抚远 156500
2. Forestry College of Northeast Forestry University, Harbin 150040, China;
3. Heilongjiang Sanjiang National Nature Reserve Administration, Fuyuan 156500, China
氨氧化微生物包括氨氧化细菌(Ammonia-oxidizing bacteria,AOB)和氨氧化古菌(Ammonia-oxidizing archaea,AOA),二者共同参与在好氧条件下将NH4+氧化为NO2-的过程,是氮循环的关键限速步骤[1]。人们曾一度认为氨氧化过程是由AOB独立完成[2],直到AOA基因组序列中发现存在参与氨氧化过程的关键功能基因-氨单加氧酶A基因(amoA)[3]以及第一株AOA Nitrosopumilus maritimus SCM1的成功分离和纯培养[4],才逐渐完善了我们对氮循环的理解[5]。同功微生物的出现使得探索在不同生境中AOA与AOB对氮循环的相对贡献成为研究热点。有研究认为氨氧化微生物的相对贡献取决于AOA与AOB功能基因amoA的相对丰度,通过衡量不同生境中amoA的拷贝数的多少来判断AOA/AOB在氮循环过程中占据主导地位的强弱[5-7]。后来人们逐渐认识到基因的丰度并不能完全反映其功能,于是将丰度与活性结合起来考虑,发现在土壤生态系统中虽然AOA在数量上较AOB更占优势,但硝化活性的变化却与AOB的amoA拷贝数成正比,并且在同位素实验中也证实了CO2的同化是由AOB完成的,意味着丰度并不高的AOB才是行使氨氧化功能的主要推动者[8]。探索丰度与活性之间的相互关系对明晰AOA和AOB所发挥的生态学功能具有重要的研究意义。
湿地被认为是“地球之肾”,拥有丰富的资源、独特的生态结构和功能,在生物氮循环过程中发挥着重要的作用[9]。三江国家级自然保护区(简称三江湿地)地处黑龙江省抚远县境内,位于我国最大的沼泽分布区--三江平原,是东北温带湿地中极具代表性的酸性土壤的沼泽湿地。扎龙国家级自然保护区(简称扎龙湿地)地处黑龙江省齐齐哈尔市,该地区部分洼地为弱碱性淡水沼泽区。两湿地均被列入《国际重要湿地名录》。两湿地对于研究东北沼泽湿地土壤具有良好的代表性,但国内外学者对于三江湿地、扎龙湿地的研究大多集中在对土壤养分以及微生物活性特征方面的研究上[10-12],对于其中氨氧化微生物的活性以及丰度的研究少之又少。
本文以三江湿地和扎龙湿地的表层土壤为研究对象。在ISO 15685-2012的土壤快速检测氨氧化方法的基础上,利用特异性抑制剂进一步区分AOA、AOB的潜在氨氧化活性(Potential ammonia oxidation activity,PAO)。在PAO测定以及功能基因amoA绝对定量分析的基础上,探究湿地土壤中PAO、丰度、环境因子之间的关系以及植被差异对PAO和丰度的影响,旨在为湿地生态系统中的氨氧化微生物研究提供一定的理论基础。
1 材料与方法 1.1 研究区域概况三江湿地取样地点的地理坐标为48.149 607°~48.156 843°N,134.605 912°~134.608 272°E,位于三江平原的东北边缘,具有三江平原内陆淡水沼泽湿地的典型特征。气候属于湿润大陆性季风气候,年平均降水量约600 mm,年平均气温2.2 ℃[13]。土壤类型主要有草甸土和沼泽土。取样地的植物优势种群为毛苔草、小叶章。毛苔草植被生长在常年积水区,小叶章生长在季节性集水区。采样区域土壤表层有较深厚的半泥炭化的草根层,其次为腐殖质层,腐殖质含量较高[14]。
扎龙湿地取样地理坐标47.175 952°~47.176 382°N,124.229 723°~124.230 377°E,采样地植被的优势种群为小叶章。
1.2 土壤样品的采集对三江湿地于2016年进行了连续4个月的取样(7月25日、8月25日、9月25日、10月24日),采集表层土壤(0~20 cm)。扎龙湿地于2016年采集了生长季(7月25日)和非生长季(10月22日)表层土壤(0~20 cm)2次。采样时首先去除表层2 cm的表层土壤,然后在取样地内采用S形随机选取10个样点,记录每个样点的坐标,之后的采样也依据此坐标,将采集的新鲜土样放于无菌袋中,低温保存,迅速带回实验室。将采集的平行样等量分为两份,一份保存于4 ℃冰箱中,用于理化性质以及PAO的测定,另一部分放于-80 ℃冰箱中,用于提取DNA。
1.3 土壤样品的理化指标分析NO3-、NH4+含量测定:取5 g新鲜土壤样品,用25 mL的1 mol·L-1的KCl溶液浸提,对浸提液使用流动分析仪(Skalar San++)检测。
pH值的测定:将5 g新鲜土壤样品加入12.5 mL去离子水(水土比为2.5:1),采用pH计检测pH值。采用烘干测重法测定土壤含水率。所有样品设置3个重复,具体理化指标见表 1。
PAO是指土壤或沉积物中参与氨氧化作用的微生物在饱和基质浓度下氧化氨氮的最大能力,与原位的PAO不一定是等同的[15]。PAO在一定程度上反映土壤中氨氧化微生物的生态功能及其硝化活性的强弱。
根据ISO 15685,利用氯酸盐抑制亚硝酸盐氧化菌(Nitrite-oxidizing bacteria,NOB),快速检测土壤中氨氧化微生物的PAO[16]。称取25 g新鲜土壤样品,添加100 mL的1 mmol·L-1磷酸盐缓冲液(K2HPO4 0.2 mol·L-1;KH2PO4 0.2 mol·L-1;pH 7.2)、1.5 mmol·L-1的(NH4)2SO4、10 mmol·L-1的NaClO3来抑制亚硝酸盐氧化,(25±2) ℃,175 r·min-1,避光培养。从开始培养后每隔1 h取一次样(1、2、3、4、5、6 h),每次取样设置3个重复。每次取1 mL土壤混合液置于50 mL离心管中,添加2 mL 4 mol·L-1 KCl溶液来终止氨氧化过程。3000 ×g离心2 min,取上清液加入盐酸N-(1-萘基)-乙二胺显色剂,在波长543 nm下用分光光度法测定NO2-的含量。对培养时间和NO2-的含量作图,在培养的前6 h NO2-的含量能呈线性增加,斜率即可作为PAO,AOA和AOB共同作用下的PAO,记做PAO(AOA+AOB)。结合Zhou等[17]和Zheng等[18]的实验方法,另一组实验在此基础上添加1 g·L-1的氨苄青霉素(Amp)来抑制AOB活性,只有AOA单独发挥作用记做PAO(AOA),以此区分AOA和AOB的相对贡献。
1.5 土壤DNA的提取称取0.5 g土壤样品,利用TENP(50 mmol·L-1 Tris,20 mmol·L-1 EDTA,100 mmol·L-1 NaCl,0.01 g·mL-1 PVPP,定容至500 mL,pH=10)缓冲液涡旋振荡,12 000 r·min-1室温离心5 min,离心弃上清,反复4次直到缓冲液冲洗过后颜色变淡,使用PBS缓冲液(1 mol·L-1 Tris-HCl,0.5 mol·L-1 EDTA,5 mol·L-1 NaCl)冲洗一次以去除腐植酸。将预处理后的土壤样品经过FastDNA® SPIN Kit for Soil试剂盒提取总DNA,最后采用80 μL DES洗脱。DNA的纯度和浓度采用nanodrop8000检测,提取的土壤DNA储存在-20 ℃冰箱中。
1.6 功能基因amoA的定量利用AOB的特异性引物amoA1F/amoA2R和AOA的特异性引物Arch-amoA F/Arch-amoA R进行PCR扩增,PCR产物经过SanPrep柱式DNA胶回收试剂盒纯化后连接在PUCm-T载体上,导入大肠杆菌DH-5α感受态细胞中,蓝白筛挑取阳性克隆制作标准质粒。AOA和AOB中amoA的丰度采用SYBR Green Ⅰ方法测定。反应体系为20 μL包括2×SGExcel FastSYBR Mixture 10 μL,正反引物各0.4 μL,模板DNA 0.8 μL,RNase-Free ddH2O补足至20 μL。每个样品做3个平行并设置阴性对照。扩增仪为ABI 7500 Real-Time PCR System,AOA扩增程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,30个循环。AOB扩增程序为94 ℃预变性5 min;94 ℃变性30 s,53 ℃退火30 s,72 ℃延伸30 s,30个循环。AOB标准质粒稀释6个浓度1.36×1010~1.36×105 copies·μL-1(相邻浓度相差10倍),AOA标准质粒稀释8个浓度1.27×1010~1.27×103 copies·μL-1(相邻浓度相差10倍)产生标准曲线r2分别为0.980 6、0.995 8,扩增效率分别为93%、100%。在4个温度步骤之后,设置溶解曲线从60~95 ℃,分析用于检测产物的特异性,单一峰均出现在目的产物Tm值附近,产物特异性良好。
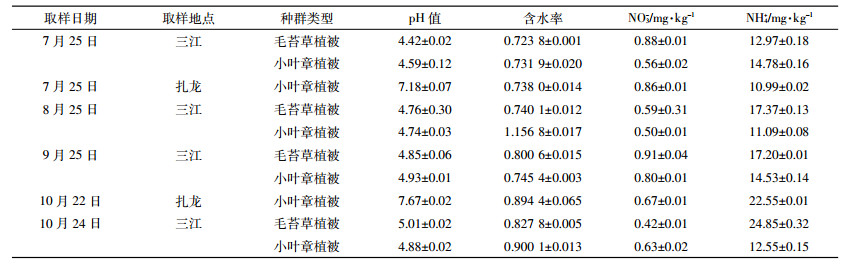
2 结果与讨论 2.1 不同pH值的湿地土壤中氨氧化微生物的活性与丰度 2.1.1 两种pH条件下氨氧化微生物的活性根系分泌物中含有的丰富营养物质不仅能为植物根际微生物的生长和繁殖提供养分,也会影响土壤微生物的种类和数量[19]。在表层植被均为小叶章的情况下,中性的扎龙湿地土壤和酸性的三江湿地土壤生长季与非生长季的PAO见图 1。
|
| 图 1 两种不同类型湿地土壤中氨氧化微生物的活性 Figure 1 The PAO of two different types of wetland soil |
在扎龙湿地中性的土壤中生长季的PAO(AOA+AOB)高于非生长季,而三江湿地酸性的土壤中非生长季的PAO(AOA+AOB)高于生长季。对比分析两地区的环境因子,可能与非生长季三江湿地土壤的pH上升有关。在两湿地土壤中AOA和AOB共同作用下的PAO均高于AOA单独作用下。在10月末三江湿地中未检测到PAO(AOA)。在生长季三江湿地土壤PAO(AOA+AOB)和PAO(AOA)较扎龙湿地土壤的低。对环境因子(pH、NO3-、NH4+、含水率)与PAO进行Pearson相关性分析,发现只有pH能显著影响PAO(AOA)(r=0.99,P < 0.01)。
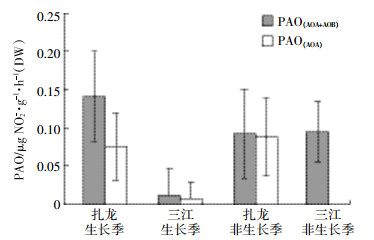
2.1.2 两种pH条件下的氨氧化微生物的丰度从图 2可以看出,生长季三江湿地土壤中AOB的丰度明显高于AOA丰度。而非生长季三江湿地、扎龙湿地AOA丰度与AOB丰度相差不大。两湿地非生长季AOA/AOB丰度之比较生长季有所上升。扎龙地区非生长季氨氧化微生物的丰度较生长季有所下降,但AOA/AOB有所上升(从0.9到1.18)。三江湿地AOA/AOB从生长季0.08上升到非生长季1.24。通过对理化指标、AOA和AOB的丰度和活性进行Pearson相关性分析,得出AOA的丰度与PAO(AOA+AOB)呈现显著正相关(r=0.96,P < 0.05),结论与Zheng等[18]报道相同。但AOA的丰度却与PAO(AOA)不存在相关性(P>0.05)。虽然在不同环境中AOA和AOB的amoA数量可能相差悬殊[1, 18, 20],但这并不意味着功能基因的数量多就一定能够在氨氧化过程中表达基因,进而发挥关键性作用。AOA的丰度与PAO(AOA)不存在相关性,推测原因是1 g·L-1的Amp抑制了部分AOA活性。Santoro等[21]在研究加州中部海域水体时也发现,硝化速率并未直接与AOA/AOB的丰度呈现相关关系。土壤中NO3-浓度也是影响AOA丰度的重要原因(r=0.954,P < 0.05)。
|
| 图 2 两种不同类型湿地土壤中氨氧化微生物的丰度 Figure 2 The abundance of AOB and AOA from two different types of wetland soil |
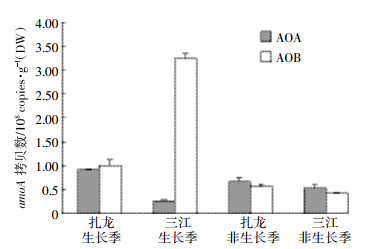
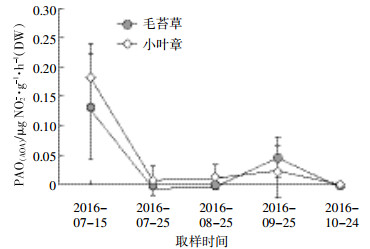
对比三江湿地土壤中以毛苔草与小叶章为主要植被的土壤中PAO(AOA+AOB)(图 3),由生长季向非生长季过渡的时间内总体PAO(AOA+AOB)呈现先降低后升高再降低的趋势。在7月末之前毛苔草土壤的PAO(AOA+AOB)要高于小叶章土壤,在此之后则相反,可能是受连日降雨影响[22],7月末样地积水位明显上升,导致7月末两种植被下表层土壤中氨氧化微生物活性大幅降低。对比图 3、图 4,其中7月15日样品中的活性值均高于之后4次所测得的值,可能也与样地的涨水以及7月末气温降低等因素有关。涨水持续至9月初,取样地中毛苔草一直生长在淹水环境,而小叶章生长在远离淹水区的地带,在8月末时可能由于小叶章已适应了浸水的环境,而毛苔草由于涨水被完全浸没其中,使得小叶章PAO(AOA+AOB)开始上升,甚至高于毛苔草。
|
| 图 3 三江湿地毛苔草与小叶章植被下土壤PAO(AOA+AOB) Figure 3 The PAO(AOA+AOB) of Calamagrostis angustifolia and Carex lasiocarpa in Sanjiang wetland |
|
| 图 4 三江湿地毛苔草与小叶章植被下土壤PAO(AOA) Figure 4 The PAO(AOA) of Calamagrostis angustifolia and Carex lasiocarpa in Sanjiang wetland |
结合5次采样,对抑制AOB前后活性进行配对样本t检验,发现在毛苔草土壤中,抑制AOB后PAO有显著降低(P < 0.05)。表明毛苔草土壤中AOB在氨氧化过程中发挥重要作用。但是小叶章湿地土壤中抑制AOB前后的PAO值没有显著差异。
在湿地中,硝化作用主要与沉积物[21]、植物根系所形成的微氧环境以及周围环境[23]有关。植物根系能释放出低分子量的化合物作为碳源供给微生物生长,同时也可能与微生物产生竞争作用,竞争氨、尿素、硝酸盐、氨基酸等[24]。研究表明,湿地植被能影响氨氧化微生物的活性[25],而与土样的理化指标无关[26]。但在本实验中植被的差异对PAO(AOA+AOB)和PAO(AOA)并无显著影响,表明植被的差异并不会影响到潜在氨氧化活性。
对环境因子(pH、NO3-、NH4+、含水率)与PAO进行相关性分析,pH显著影响PAO(AOA+AOB)(r=-0.703,P < 0.05)以及PAO(AOA)(r=-0.865,P < 0.01)。
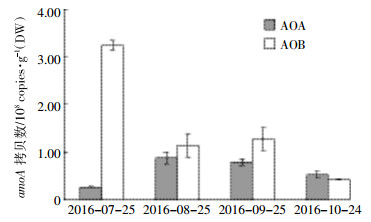
2.2.2 不同植被土壤中氨氧化微生物的丰度如图 5所示,三江小叶章湿地土壤中AOA的丰度呈现先增加后减少趋势,在8月末出现最大值。AOB丰度呈逐渐降低的趋势,在10月末之前AOB丰度均高于AOA。
|
| 图 5 三江小叶章植被土壤中氨氧化微生物丰度 Figure 5 The abundance of AOB and AOA of Carex lasiocarpa in Sanjiang wetland |
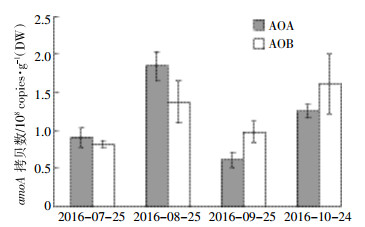
如图 6所示,在毛苔草植被土壤下AOA的丰度呈现先增加后减少再增加的趋势,在8月末出现最大值。在生长季(7月、8月)AOA的丰度均高于AOB,而非生长季则相反。
|
| 图 6 三江毛苔草植被土壤中氨氧化微生物丰度 Figure 6 The abundance of AOB and AOA of Calamagrostis angustifolial in Sanjiang wetland |
有文献表明在酸性环境中AOA的丰度要高于AOB[27],而在本文中大多数情况下AOB的丰度稍高。但不同植被下AOA和AOB的丰度没有显著差异,未发现影响氨氧化微生物丰度的环境因子。有研究表明在高NH4+浓度情况下AOB较AOA在氨氧化过程中更占主导位置[28],毛苔草植被的土壤NH4+浓度高于小叶章植被,这也可能是在毛苔草植被土壤中AOB发挥重要作用的原因,但NH4+浓度与AOB的丰度之间并无显著的相关关系。
3 结论(1) pH值极显著地影响AOA的PAO(r=0.99,P < 0.01)。AOA的丰度与PAO(AOA+AOB)呈现显著正相关(r=0.96,P < 0.05),而与PAO(AOA)不存在相关性。
(2) 在毛苔草湿地土壤中,抑制AOB后PAO显著降低(P < 0.05),毛苔草湿地土壤中AOB在氨氧化过程中发挥重要作用。
(3) 不同植被土壤中氨氧化微生物的PAO(AOA+AOB)、PAO(AOA)以及AOA与AOB丰度值并无显著差异。
| [1] |
Zhang J, Zhou X, Chen L, et al. Comparison of the abundance and community structure of ammonia oxidizing prokaryotes in rice rhizosphere under three different irrigation cultivation modes[J]. World Journal of Microbiology and Biotechnology, 2016, 32(5): 85. DOI:10.1007/s11274-016-2042-3 |
| [2] |
Prosser J I. Autotrophic nitrification in bacteria[J]. Adv Microb Physiol, 1990(30): 125-181. |
| [3] |
Venter J C, Remington K, Heidelberg J F, et al. Environmental genome shotgun sequencing of the Sargasso Sea[J]. Science, 2004, 304: 66-74. DOI:10.1126/science.1093857 |
| [4] |
Könneke M, Bernhard A E, de la Torre J R, et al. Isolation of an autotrophic ammonia-oxidizing marine archaeon[J]. Nature, 2005, 437(7058): 543-546. DOI:10.1038/nature03911 |
| [5] |
Zhang Y, Chen L J, Dai T J, et al. The influence of salinity on the abundance, transcriptional activity, and diversity of AOA and AOB in an estuarine sediment:A microcosm study[J]. Applied Microbiology and Biotechnology, 2015, 99(22): 9825-9833. DOI:10.1007/s00253-015-6804-x |
| [6] |
Sun W, Xia C Y, Xu M Y, et al. Distribution and abundance of archaeal and bacterial ammonia oxidizers in the sediments of the Dongjiang River, a drinking water supply for Hong Kong[J]. Microbes and Environments, 2013, 28(4): 457-465. DOI:10.1264/jsme2.ME13066 |
| [7] |
Wang J, Kan J, Zhang X, et al. Archaea dominate the ammonia-oxidizing community in deep-sea sediments of the Eastern Indian Ocean:From the Equator to the Bay of Bengal[J]. Frontiers in Microbiology, 2017, 8: 415. |
| [8] |
Jia Z J, Conrad R. Bacteria rather than Archaea dominate microbial ammonia oxidation in an agricultural soil[J]. Environmental Microbiology, 2009, 11(7): 1658-1671. DOI:10.1111/emi.2009.11.issue-7 |
| [9] |
Gruber N, Galloway J N. An earth-system perspective of the global nitrogen cycle[J]. Nature, 2008, 451(7176): 293-296. DOI:10.1038/nature06592 |
| [10] |
马玲, 丁新华, 顾伟, 等. 扎龙季节性湿草甸土壤养分和土壤微生物特性[J]. 应用生态学报, 2011, 22(7): 1717-1724. MA Ling, DING Xin-hua, GU Wei, et al. Spatial distribution patterns of soil nutrients and microbes in seasonal wet meadow in Zhalong wetland[J]. Chinese Journal of Applied Ecology, 2011, 22(7): 1717-1724. |
| [11] |
杨桂生, 宋长春, 万忠梅, 等. 三江平原小叶章湿地土壤微生物活性特征研究[J]. 环境科学学报, 2010, 30(8): 1715-1721. YANG Gui-sheng, SONG Chang-chun, WAN Zhong-mei, et al. Microbial activity in soils of Calamagrostis angustifolia wetlands in the Sanjiang Plain[J]. Acta Scientiae Circumstantiae, 2010, 30(8): 1715-1721. |
| [12] |
白雪, 马克明, 杨柳, 等. 三江平原湿地保护区内外的生态功能差异[J]. 生态学报, 2008, 28(2): 620-626. BAI Xue, MA Ke-ming, YANG Liu, et al. Ecological function differences inside and outside the wetland nature reserves in Sanjiang Plain[J]. Acta Ecologica Sinica, 2008, 28(2): 620-626. |
| [13] |
郑树峰, 张柏, 王宗明, 等. 三江平原抚远县景观格局变化研究[J]. 湿地科学, 2008, 6(1): 13-18. ZHENG Shu-feng, ZHANG Bai, WANG Zong-ming, et al. Landscape pattern change of Fuyuan County in the Sanjiang Plain[J]. Wetland Science, 2008, 6(1): 13-18. |
| [14] |
李露, 陈春宏, 高大文. 七星河湿地氨氧化古菌多样性和丰度及其与环境因子的相关性分析[J]. 环境科学学报, 2015, 35(4): 1097-1105. LI Lu, CHEN Chun-hong, GAO Da-wen. Diversity and abundance of ammonia-oxidizing archaea and its correlation with environmental factors in Qixing River Wetland[J]. Acta Scientiae Circumstantiae, 2015, 35(4): 1097-1105. |
| [15] |
O'Sullivan C A, Wakelin S A, Fillery I R P, et al. Factors affecting ammonia-oxidising microorganisms and potential nitrification rates in southern Australian agricultural soils[J]. Soil Research, 2013, 51(3): 240-252. DOI:10.1071/SR13039 |
| [16] |
International Organization for Standardization(ISO). ISO 15685-2012 Soil quality. Determination of potential nitrification and inhibit of nitrification:Rapid test by ammonium oxidation[S]. Geneva:ISO, 2012.
|
| [17] |
Zhou X H, Li Y M, Zhang J P, et al. Diversity, abundance and community structure of ammonia-oxidizing archaea and bacteria in riparian sediment of Zhenjiang ancient canal[J]. Ecological Engineering, 2016, 90: 447-458. DOI:10.1016/j.ecoleng.2016.01.068 |
| [18] |
Zheng Y L, Hou L J, Newell S, et al. Community dynamics and activity of ammonia-oxidizing prokaryotes in intertidal sediments of the Yangtze Estuary[J]. Applied and Environmental Microbiology, 2013, 80(1): 408-419. |
| [19] |
李勇, 黄小芳, 丁万隆. 根系分泌物及其对植物根际土壤微生态环境的影响[J]. 华北农学报, 2008, 23(增刊): 182-186. LI Yong, HUANG Xiao-fang, DING Wan-long. Root exudates and their effects on plant rhizosphere soil micro-ecology environment[J]. Acta Agriculturae Boreali-Sinica, 2008, 23(Suppl): 182-186. |
| [20] |
Baolan H, Shuai L, Wei W, et al. pH-dominated niche segregation of ammonia-oxidising microorganisms in Chinese agricultural soils[J]. FEMS Microbiol Ecol, 2014, 90(1): 290-299. DOI:10.1111/fem.2014.90.issue-1 |
| [21] |
Santoro A E, Casciotti K L, Francis C A. Activity, abundance and diversity of nitrifying archaea and bacteria in the central California Current[J]. Environmental Microbiology, 2010, 12(7): 1989-2006. DOI:10.1111/j.1462-2920.2010.02205.x |
| [22] |
Pett-Ridge J, Petersen D G, Nuccio E, et al. Influence of oxic/anoxic fluctuations on ammonia oxidizers and nitrification potential in a wet tropical soil[J]. FEMS Microbiol Ecol, 2013, 85(1): 179-194. DOI:10.1111/femsec.2013.85.issue-1 |
| [23] |
Philippot L, Hallin S, Börjesson G, et al. Biochemical cycling in the rhizosphere having an impact on global change[J]. Plant Soil, 2009, 321(1): 61-81. |
| [24] |
Philippot L, Raaijmakers J M, Lemanceau P, et al. Going back to the roots:The microbial ecology of the rhizosphere[J]. Nature Reviews Microbiology, 2013, 11(11): 789-799. DOI:10.1038/nrmicro3109 |
| [25] |
Wang H T, Su J Q, Zheng T L, et al. Insights into the role of plant on ammonia-oxidizing bacteria and archaea in the mangrove ecosystem[J]. J Soils Sediment, 2015, 15(5): 1212-1223. DOI:10.1007/s11368-015-1074-x |
| [26] |
Wedin D A, Tilman D. Species effects on nitrogen cycling:A test with perennial grasses[J]. Oecologia, 1990, 84(4): 433-441. DOI:10.1007/BF00328157 |
| [27] |
Chen X, Zhang L M, Shen J P, et al. Abundance and community structure of ammonia-oxidizing archaea and bacteria in an acid paddy soil[J]. Biology and Fertility of Soils, 2011, 47(3): 323-331. DOI:10.1007/s00374-011-0542-8 |
| [28] |
Andert J, Wessén E, Börjesson G, et al. Temporal changes in abundance and composition of ammonia-oxidizing bacterial and archaeal communities in a drained peat soil in relation to N2O emissions[J]. J Soil Sediment, 2011, 11(8): 1399-1407. DOI:10.1007/s11368-011-0413-9 |
 2018, Vol. 37
2018, Vol. 37