文章信息
- 宋婷婷, 赖欣, 王知文, 方明, 杨殿林, 居学海, 李洁, 张贵龙
- SONG Ting-ting, LAI Xin, WANG Zhi-wen, FANG Ming, YANG Dian-lin, JU Xue-hai, LI Jie, ZHANG Gui-long
- 不同原料生物炭对铵态氮的吸附性能研究
- Adsorption of ammonium nitrogen by biochars produced from different biomasses
- 农业环境科学学报, 2018, 37(3): 576-584
- Journal of Agro-Environment Science, 2018, 37(3): 576-584
- http://dx.doi.org/10.11654/jaes.2017-1122
文章历史
- 收稿日期: 2017-08-17
- 录用日期: 2017-10-30
2. 农业部环境保护科研监测所, 天津 300191;
3. 东北农业大学资源与环境学院, 哈尔滨 150030;
4. 农业部农业生态与资源保护总站, 北京 100125
2. Agro-Environmental Protection Institute, Ministry of Agriculture, Tianjin 300191, China;
3. College of Resources and Environment, Northeast Agricultural University, Harbin 150030, China;
4. Rural Energy & Environment Agency, Ministry of Agriculture, Beijing 100125, China
生物炭(Biochar)是由作物秸秆、木屑等生物质材料,经高温热解而产生的一类富碳的固态物质,是黑炭范畴的一种,一般呈碱性[1],具有比表面积大、孔隙度高[2-3]和离子交换量大[4]等特性,对水体、土壤无机离子[5]及有机污染物等具有一定的吸附能力。研究表明,玉米穗轴制备的生物炭能够有效吸附溶液铵态氮(NH4+-N),最大吸附量达22.6 mg·g-1[6]。Kizito等[7]研究发现,稻壳生物炭和木屑生物炭对猪场粪便发酵液中NH4+-N具有较大的吸附作用,最大吸附量分别为39.80、44.60 mg·g-1。关于生物炭对NH4+-N的吸附机制,有研究认为,生物炭表面含氧官能团和pH值是影响其NH4+-N吸附量的主要因素,新制备的生物炭对NH4+-N具有较低的吸附能力,经过一段时间氧化或通过氧化剂处理能够显著增加吸附能力[8]。低pH值(3.6~7)的生物炭对NH4+-N的吸附能力较低,当pH值增加到7时,吸附量增加2~3倍[9],李卓瑞等[10]研究证实竹炭通过阳离子交换作用吸附铵离子。王章鸿等[11]对橡木生物炭的研究表明,比表面积、表面碱性官能团和表面氧化物与氨态氮吸附有关。生物炭的制备原料分布广泛,其性能因制备原料不同而异。Kizito等[12]通过固定床柱试验表明硬木屑生物炭对污水NH4+-N的吸附能力较玉米穗轴生物炭和混合木屑生物炭大,且吸附量随NH4+-N浓度升高而增加。常温下(25 ℃)秸秆生物炭对铵离子的吸附能力约为竹炭的4倍,主要是秸秆炭表面孔隙的平均孔径大于竹炭,对四面体结构的铵根离子吸附的空间位阻较小,导致其对铵离子的吸附容量较大[13]。生物炭的制备原料决定其孔隙度、表面官能团分布、灰分元素及pH值等性质,而对NH4+-N的吸附多与其自身性质有关,因此,不同原料生物炭对NH4+-N的吸附能力不尽相同,对比研究不同原料生物炭对NH4+-N吸附作用,筛选高性能NH4+-N吸附材料,对于削减水体NH4+-N负荷和阻控土壤NH4+-N流失具有积极意义。
本研究以花生壳、玉米秆、杨木屑及竹屑为原料分别制取生物炭,利用电镜扫描(SEM)和傅立叶红外光谱(FTIR)分析技术,结合生物炭对铵态氮(NH4+-N)的固液相批量吸附试验,观察四种原料生物炭对NH4+-N的吸附特征,解析生物炭对NH4+-N吸附过程及行为,对比研究不同原料生物炭对NH4+-N的吸附能力,为筛选制备高效NH4+-N吸附炭基材料提供理论依据。
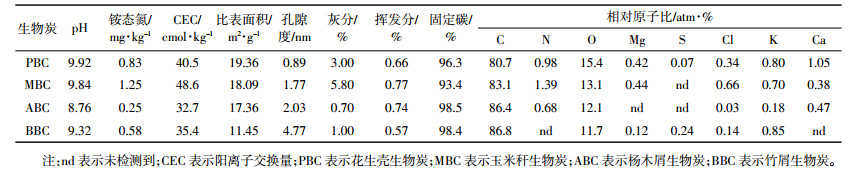
1 材料与方法 1.1 试验材料 1.1.1 生物炭的制备本试验以玉米秆、花生壳、杨木屑、竹屑四种生物质为原料。收集玉米秆、花生壳、杨木屑及竹屑风干、粉碎、研磨过20目筛,在500 ℃下制取生物炭。具体的操作过程:启动温度为60 ℃,以8 ℃·min-1幅度升温至500 ℃,保持120 min,然后保持通N2状态冷却至室温,冷却后,将生物炭研磨过100目筛,干燥保存备用,不同材料制备生物炭的基本组分等分析如表 1所示。
常温状态下将硫酸铵[(NH4)2SO4]溶解于去离子水中,配制1000 mg·L-1的母液,然后将母液稀释为所需的不同浓度。
1.2 测定方法pH测定参考GB/T 12496.7-1999;阳离子交换量采用火焰分光光度计进行测定;生物炭的比表面积、孔径采用比表面积分析仪测定;灰分含量测定采用缓慢灰化法,参照GB/T 17664-1999;挥发分的测定参照GB/T 2001-1991;固定碳的计算方法为固定碳(%)=100-灰分-挥发分;采用X射线光电子能谱(XPS)测定生物炭相对原子含量(%)。
傅里叶变化红外光谱分析(FITR):用傅里叶变换红外光谱仪(Nicolet 380,Nicolet Corp,美国)测定生物炭的红外光谱,采用KBr压片制样,扫描波数范围为400~4500 cm-1。
扫面电镜图(SEM):采用TM-1000型扫描电镜(HIECH Corp,中国台湾),冷场发射式,观察生物炭样品的大小、形状和表面特征。
溶液铵态氮(NH4+-N)浓度采用全自动连续流动分析仪(AA3,Bran+Luebbe Corp,德国)测定。
1.3 试验设计 1.3.1 吸附最适pH值确定试验称取0.2 g制备好的四种不同生物炭分别放入100 mL的塑料瓶中,用HCl/NaOH调节50 mL的50 mg·L-1 NH4+-N溶液pH分别为2.00、3.00、4.00、5.00、6.00、7.00、8.00、9.00、10.00、11.00、12.00,混合后的溶液在25 ℃、200 r·min-1的恒温振荡器中振荡24 h,静置,过滤,流动分析仪测定溶液中NH4+-N浓度,每个处理重复4次。根据公式(1)计算出单位质量生物炭对NH4+-N的吸附量:
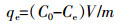 (1)
(1) 式中:qe为单位质量生物炭对NH4+-N的吸附量,mg·g-1;C0为溶液中NH4+-N的起始浓度,mg·L-1;Ce为吸附平衡时液相中NH4+-N的浓度,mg·L-1;V为吸附平衡溶液的体积,L;m为生物炭的加入量,g。
1.3.2 生物炭等电位点的测定向100 mL的塑料瓶中加入50 mL NaCl(0.1 mol·L-1)溶液,用HCl/NaOH调节pH值在2~12之间,用N2吹脱3~5 min以去掉溶解在溶液中的CO2,此时的pH记作pH0,将0.2 g四种不同生物炭分别加入瓶中,振荡24 h,测定上清液pH值,记作pHf,分别以(pH0-pHf)为纵坐标,pH0为横坐标,其中pH0-pHf=0即为等电点,记作pHpzc。
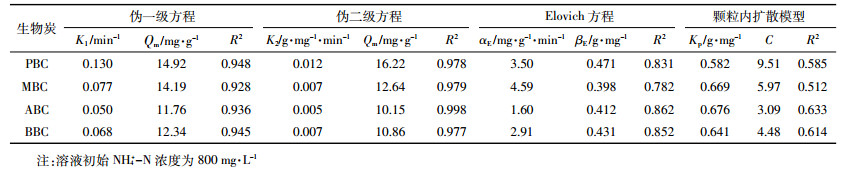
1.3.3 动力学吸附测定取50 mL 800 mg·L-1的NH4+-N溶液,分别加入玉米秸秆、花生壳、杨木屑、竹屑四种生物炭0.2 g,恒温振荡,吸附试验的条件为温度(25±0.5) ℃,pH值7.00。分别于5、10、20、30、40、50、60、90、120、180 min取出样品,过滤后测定滤液中NH4+-N浓度,每个处理重复4次。分别利用准一级动力学方程、准二级动力学方程、Elovich方程和离子扩散方程对实验数据进行拟合,分析生物炭吸附NH4+-N的时间与吸附量之间的关系,推断吸附反应机制:
 (2)
(2) 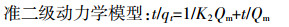 (3)
(3) 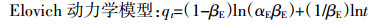 (4)
(4) 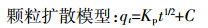 (5)
(5) 式中:qt为t时刻生物炭吸附NH4+-N的吸附量,mg·g-1;Qm为吸附状态达到平衡时生物炭吸附NH4+-N的吸附量,mg·g-1;K1、K2和Kp分别是准一级吸附、准二级吸附和颗粒内扩散速率常数;αE为初始吸附速率常数;βE为解吸附速率常数。
1.3.4 吸附等温线测定称取四种生物炭各0.2 g于不同的100 mL塑料瓶中,分别加入20、40、60、80、100、200、400、600、800、1000 mg·L-1不同浓度的(NH4)2SO4溶液50 mL,用HCl/NaOH调节溶液pH=7.00±0.3,每个处理4次重复,混合后的溶液在25 ℃、200 r·min-1的恒温振荡器中振荡24 h,静置,过滤,流动分析仪测定溶液中NH4+-N的溶度。按公式(1)计算出单位质量生物炭对NH4+-N的吸附量,根据计算出的结果,分别用Langmuir模型[14, 16]和Freundlich模型[15]对数据进行拟合。
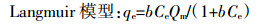 (6)
(6) 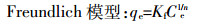 (7)
(7) 式中:qe为单位质量生物炭对NH4+-N的吸附量,mg·g-1;Ce为吸附平衡时液相中NH4+-N的浓度,mg·L-1;b为吸附平衡常数,L·g-1;Kf、n为吸附过程的经验系数;Qm为达到平衡时生物炭吸附NH4+-N的吸附量,mg·g-1。
1.4 数据处理与分析数据处理以及表格的绘制采用Microsoft Excel 2010,图表的制作采用Origin 9.1和OMNIC。
2 结果与分析 2.1 吸附前后扫描电镜图采用扫描电镜对四种生物炭吸附NH4+-N前、后的微观结构进行表征(图 1)。吸附NH4+-N前,四种生物炭表面均存在明显的孔隙结构,表面粗糙、凹凸不平,其中,杨木屑生物炭(图 1c)表面的孔隙大且密集,花生壳生物炭(图 1a)次之,再次是玉米秸秆生物炭(图 1b),最后是竹屑生物炭(图 1d)且其表面近乎没有孔隙,这种明显的差异可能与原料本身性质有关。吸附后生物炭表面附着颗粒或粉末物质,孔隙被填充,表面变得较为平坦,由图可更加直观地看出生物炭吸附NH4+-N后的状态。

|
| 图 1 不同原料生物炭对NH4+-N吸附前后扫描电镜图(×2000倍) Figure 1 SEM(×2000 times) before and after NH4+-N adsorption of different raw materials |
由图 2可知,四种原料生物炭吸附NH4+-N前后出峰的位置大致相同,表明它们所含有的官能团类似。3800~3156 cm-1范围吸收峰主要由分子间氢键缔合的-OH伸缩振动引起的[17],四种生物炭均在该范围内出现了吸收峰,且吸附后峰值减小,出峰位置发生了蓝移,峰形变窄,表明生物炭表面的羟基(-OH)均参与了对NH4+-N的吸附。1628 cm-1左右的吸收峰为芳香环羰基(-C=O)的伸缩振动[17],四种生物炭吸附后波峰明显变窄,说明生物炭表面-C=O参与了吸附。波数为1383 cm-1左右出现的吸收峰为醇或酚中(-C-O)的伸缩振动,吸附后,四种生物炭吸收峰强度都变弱,波峰变窄,说明该基团也参与了对NH4+-N的吸附。
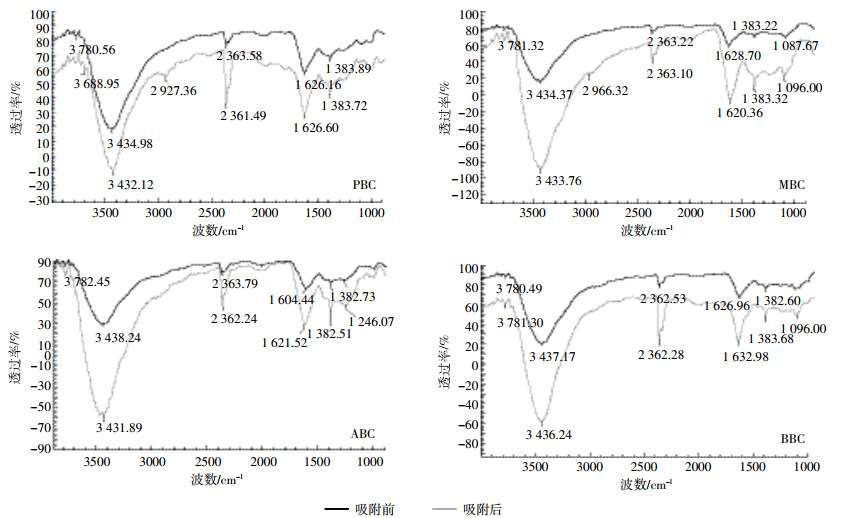
|
| 图 2 不同原料生物炭对NH4+-N吸附前后的FT-IR谱图 Figure 2 FT-IR spectra of NH4+-N before and after adsorption of biochar on different raw materials |
PBC和MBC在2927、2966 cm-1处出现吸收峰,此处是由脂肪烃或者环烷烃中的甲基(-CH3)和亚甲基(-CH2)伸缩振动产生[17],而ABC和BBC在此处基本看不到峰,说明PBC和MBC中的甲基和亚甲基同时参与了吸附过程。1300~1000 cm-1为醇类羟基(-OH)的弯曲振动和醚类(-O-)的伸缩振动[17],图中仅BBC吸附后波峰发生了偏移,说明BBC表面的醇羟基或者醚类等活性基团参与了吸附,而PBC、MBC和ABC表面的醇羟基或者醚类基没有参与NH4+-N吸附过程。
2.3 pH值对不同原料生物炭吸附效果的影响随溶液pH值逐渐升高,PBC、MBC、ABC和BBC四种原料生物炭对NH4+-N的吸附量呈逐渐增加趋势(图 3)。当溶液pH <4时,四种生物炭对NH4+-N的吸附量随pH上升大幅度增加,当溶液在pH4~8时,四种生物炭对NH4+-N的吸附量变化趋于平缓,不再显著增加。当pH>8时,生物炭对NH4+-N的吸附量又呈现快速增加趋势。由四种生物炭零电荷点测定曲线可知,四种生物炭的pHpzc范围在5.50~6.50,即该pH范围内生物炭表面正负电荷近乎相等,超过该范围,说明生物炭表面呈负电,有利于吸附溶液中NH4+-N等阳离子(图 4)。

|
| 图 3 不同原料生物炭在初始pH值梯度下对NH4+-N的吸附 Figure 3 Adsorption of NH4+-N of biochar from different raw materials at different pH gradients |

|
| 图 4 不同原料生物炭的零电荷点测定曲线 Figure 4 Point of zero surface charge of biochar from different raw materials |
由图 5可知,四种原料生物炭在溶液初始浓度为800 mg·L-1的体系中,在20 min内吸附量快速增加,当超过20 min后,生物炭对NH4+-N的吸附量随着时间增加缓慢,当时间延长至50 min左右,生物炭对NH4+-N的吸附达到了最大饱和吸附,再随着时间的增加,吸附量并没有显著变化。用伪一级动力学方程、伪二级动力学方程、Elovich方程和颗粒内扩散模型对吸附数据进行拟合(表 2),伪二级动力学方程拟合系数R2为0.978(PBC)、0.979(MBC)、0.998(ABC)、0.977(BBC),显著高于其他三个方程,并且Qm值与实际所测得值较为接近,因此伪二级动力学方程能够更好地描述生物炭对NH4+-N的动力学吸附过程。生物炭对NH4+-N的吸附可分为快速反应和慢速反应,根据伪二级动力学参数K2值进行判断,四种生物炭对NH4+-N的吸附主要是由快速反应所控制。
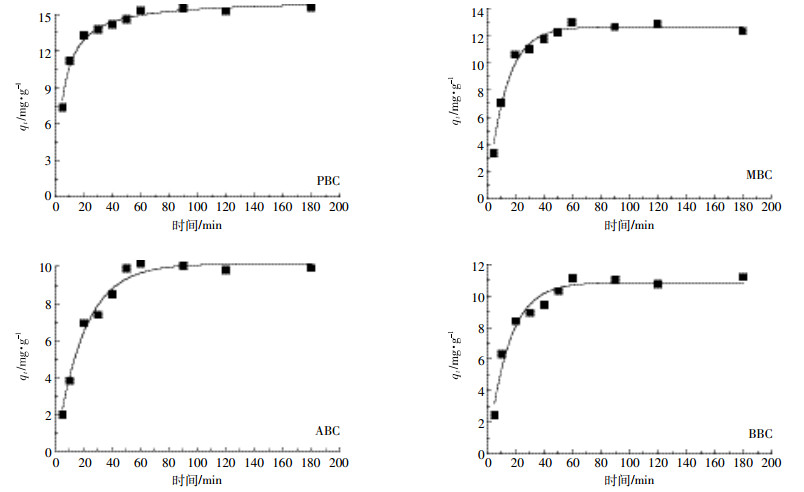
|
| 图 5 不同原料生物炭对溶液中NH4+-N的动力学吸附线 Figure 5 Kinetic adsorption lines of NH4+-N in solution of different raw materials biocar |
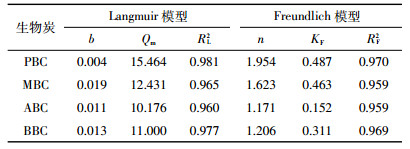
图 6为不同原料生物炭在各平衡浓度下对NH4+-N的等温吸附特征曲线。随溶液平衡浓度升高,四种原料生物炭对NH4+-N的吸附量呈逐渐增加趋势,当溶液浓度低于100 mg·L-1时,随着NH4+浓度的增加,生物炭对NH4+-N的吸附量上升幅度不明显,约为1.5~6.4 mg·g-1,当溶液浓度大于100 mg·L-1时,NH4+-N的吸附量呈现明显的上升,幅度为4.5~15.0 mg·g-1。当溶液NH4+浓度接近800 mg·L-1时,生物炭对NH4+-N的吸附量达到饱和,此时再增加溶液浓度,吸附量不再显著增加。其中PBC的饱和吸附量为15 mg·g-1,MBC为12.5 mg·g-1,ABC为9.5 mg·g-1,BBC为10.5 mg·g-1,四种生物炭对NH4+-N的吸附能力总体表现为PBC>MBC>BBC>ABC。用Langmuir模型和Freundlich模型方程分别对四种生物炭吸附NH4+-N的过程进行拟合,结果表明Langmuir模型能够更好地描述生物炭对NH4+-N的等温吸附行为(表 3),由此可以判断生物炭对NH4+-N的吸附是以单分子层的化学吸附为主导。Freundlich模型对数据的拟合回归系数RF2>0.950,达到了显著水平,且n值介于1~10,说明吸附容易进行。由此说明,各生物炭对NH4+-N的吸附存在单分子层吸附的同时也存在多分子层吸附。
|
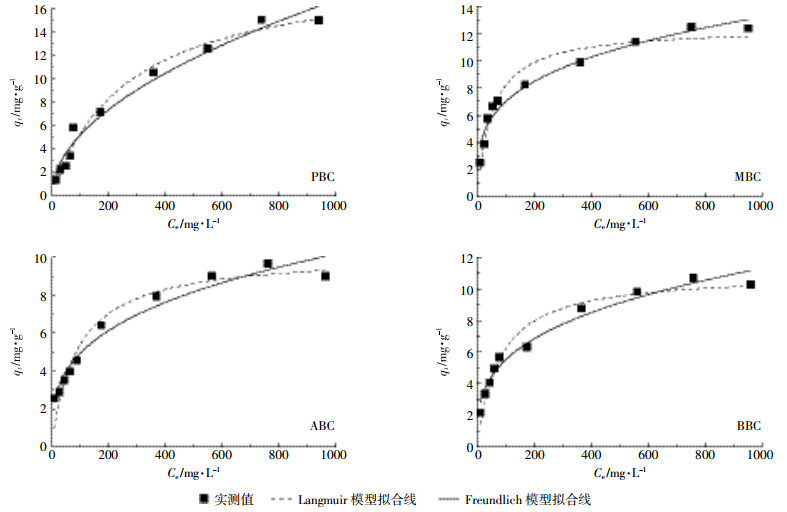
|
| 图 6 不同原料生物炭对溶液中NH4+-N的等温吸附线 Figure 6 The thermodynamic adsorption line of NH4+-N in the solution of different raw materials |
扫描电镜图能够直观地表征NH4+-N在生物炭表面的累积,对比吸附前后扫描图可以明显的看出,四种原料生物炭吸附NH4+-N后,粗糙的表面变得平滑,表面沟槽被颗粒物质填充,原有孔隙基本上被堵塞。这样的吸附特征与Uchimiya等[18]研究结果相符。结合吸附前后的傅立叶红外光谱图,NH4+-N吸附前后3800~3156、1383、1300~1000 cm-1处的羟基吸收峰均发生了改变,说明四种生物炭表面的羟基官能团在对NH4+-N的吸附中都起到了主要作用。此外,除分布的-OH、-C=O等官能团,PBC和MBC表面分布的-CH3和-CH2,及BBC表面分布的-O-也参与了对溶液中NH4+-N的吸附。这些含氧官能团,可通过形成氢键[19-21]、氧化还原反应[22]以及离子电荷[23]等作用吸附溶液中的NH4+-N。Chen等[24]、徐楠楠等[25]研究结果显示,不同生物炭材料对NH4+-N的吸附作用基团不一样,可能与不同物质吸收强度不同有关。虽然本研究所用生物炭均为500 ℃高温下制备得到,但其电导率、孔隙度等理化特征均差异显著,其参与官能团也存在显著差异。PBC和MBC表面羰基、羧基、酚羟基及甲基、醚键等含氧官能团的加入可为生物炭表面提供更多的NH4+-N吸附点位,有利于吸附进行。
生物炭对NH4+-N的吸附也会受到溶液pH值和初始浓度的影响。邵明艳[26]研究指出,生物炭吸附NH4+-N的量随溶液pH升高而增加。溶液的pH不仅会影响生物炭表面的电荷性质,而且会影响吸附质的离子化程度及存在状态,生物炭表面具有较多的官能团,当溶液的pH较高时,表面的官能团会被去质子化,呈现负电,利于阳离子吸附。本研究进一步通过零电荷点测定曲线表明,在pH>7.00的条件下,pH溶液>pHpzc生物炭,此时生物炭表面呈负电,有利于吸附NH4+-N等阳离子。加之生物炭本身呈碱性,产生利于阳离子吸附的活性位点,从而提高了对NH4+-N等阳离子的吸附容量。本研究结果还显示,所用四种生物炭(PBC、MBC、ABC和BBC)对溶液中的NH4+的吸附量都随着溶液浓度的增高而增大,当达到吸附平衡后(800 mg·L-1),吸附量不再随溶液浓度的增大而发生显著的变化,即吸附趋于饱和,该结果与翟由涛等[27]、Li等[28]相似。其机制在于,一定范围内,溶液浓度增大,物质传输驱动力更大,体系更有利于对NH4+-N的吸附,导致生物炭对NH4+-N的吸附均会随溶液浓度升高而逐渐升高[29]。
生物炭对NH4+-N的吸附在一定时间内会达到平衡,张扬等[30]研究表明生物炭对NH4+-N的吸附在60 min左右能达到吸附平衡,且与生物炭的基本理化性质有关。本研究四种生物炭达到吸附平衡的时间均为50 min左右,生物炭吸附离子达到平衡的时间与其物理化学性质有关,与生物炭表面分布的阳离子结合位点有关,结合位点多,达到吸附平衡的时间就短,反之,吸附时间就会变长。因此,伪二级动力学方程能够更好地描述生物炭对NH4+-N的动力学吸附过程,说明生物炭对NH4+-N的吸附速率主要由化学吸附决定[17]。
生物炭因其具有特殊的结构以及表面性质而对一些离子有吸附作用。生物炭对NH4+-N的吸附多数都符合准一级动力模型或者准二级动力模型[31-33],本研究四种生物炭对NH4+-N的吸附都符合准二级动力模型,说明四种生物炭对NH4+-N的吸附都是通过单分子层化学吸附作用实现。Thi等[34]通过改性玉米芯吸附水体中的NH4+-N,发现其吸附过程可以进一步用Langmuir方程进行描述,其吸附为单分子层的化学吸附,丛日环等[35]也有同样的结论。然而,Li等[28]研究发现,小麦秸秆生物炭对水体中NH4+-N的吸附可以用Freundlich模型更好地描述,认为吸附是非均一的多层物理吸附。本研究以PBC、MBC、ABC和BBC四种不同原料生物炭为研究对象,结果显示,四种生物炭对NH4+-N的吸附均符合Langmuir模型,即说明四种生物炭对NH4+-N的吸附均是由单分子层化学吸附为主导。结合SEM图和FTIR图谱,综合分析认为四种生物炭对NH4+-N吸附均是由表面所含有的官能团控制,尤其是含氧官能团的化学吸附占主导作用,而生物炭的孔隙结构并不是主要影响因素。Padhye等[36]和Chen等[37]也有类似的发现。
4 结论(1) NH4+-N通过表面累积或孔道填充吸附于生物炭上。四种生物炭表面分布的含氧官能团(-OH、-C=O、-C-O)都参与了对NH4+-N的吸附,此外,PBC和MBC表面分布的甲基(-CH3)和亚甲基(-CH2),及BBC表面分布的醚类(-O-)也参与了对溶液中NH4+-N的吸附。
(2) Langmuir方程能够较好地描述四种原料生物炭对NH4+-N的等温吸附行为。伪二级动力学方程可以较好地描述四种生物炭对NH4+-N的动力学吸附过程,四种生物炭均在50 min内达到吸附平衡。四种原料生物炭对NH4+-N的吸附均为单分子层化学吸附,且由快速反应所控制。
(3) 在溶液pH=7.00、初始浓度为800 mg·L-1的吸附体系中,四种生物炭对NH4+-N的吸附能力大小表现为PBC>MBC>BBC>ABC。PBC对NH4+-N的最大吸附量为15 mg·g-1,MBC为12.5 mg·g-1,ABC为9.5 mg·g-1;BBC为10.5 mg·g-1。四种生物炭中吸附性最好的是花生壳生物炭(PBC)。
| [1] |
Lehmann J, Joseph S. Biochar for environmental management:An introduction[M]//Lehmann J and Joseph S(Eds), Biochar for environmental management-science and technology. Earthscan Publisher, UK and USA, 2009:1-9.
|
| [2] |
Xie T, Reddy K R, Wang C W, et al. Characteristics and applications of biochar for environmental remediation:A review[J]. Critical Review in Environmental Science and Technology, 2015, 45: 939-969. DOI:10.1080/10643389.2014.924180 |
| [3] |
Liang B, Lehmann J, Solomon D, et al. Black carbon increases cation exchange capacity in soils[J]. Soil Science of America a Journal, 2006, 70(5): 1719-1730. DOI:10.2136/sssaj2005.0383 |
| [4] |
Gray M, Johnson M G, Dragila M I, et al. Water uptake in biochars:The roles of porosity and hydrophobicity[J]. Biomass and Bioenergy, 2014, 61: 196-205. DOI:10.1016/j.biombioe.2013.12.010 |
| [5] |
Hale S E, Alling V, Martinsen V, et al. The sorption and desorption of phosphate-P, ammonium-N and nitrate-N in cacao shell and corn cob biochars[J]. Chemosphere, 2013, 91(11): 1612-1619. DOI:10.1016/j.chemosphere.2012.12.057 |
| [6] |
Manolikaki I, Mangolis A, Diamadopoulos E. The impact of biochars prepared from agricultural residues on phosphorus release and availability in two fertile soils[J]. Journal of Environmental Management, 2016, 181: 536-543. DOI:10.1016/j.jenvman.2016.07.012 |
| [7] |
Kizito S, Wu S, KipkemoiKirui W, et al. Evaluation of slow pyrolyzed wood and rice husks biochar for adsorption of ammonium nitrogen from piggery manure anaerobic digestate slurry[J]. Science of the Total Environment, 2015, 505: 102-112. DOI:10.1016/j.scitotenv.2014.09.096 |
| [8] |
Yao Y, Gao B, Zhang M, et al. Effect of biochar amendment on sorption and leaching of nitrate, ammonium, and phosphate in a sandy soil[J]. Chemosphere, 2012, 89(11): 1467-1471. DOI:10.1016/j.chemosphere.2012.06.002 |
| [9] |
Bing W, Johannes L, Kelly H, et al. Adsorption and desorption of ammonium by maple wood biochar as a function of oxidation and pH[J]. Chemosphere, 2015, 138: 120-126. DOI:10.1016/j.chemosphere.2015.05.062 |
| [10] |
李卓瑞, 韦高玲. 不同生物炭添加量对土壤中氮磷淋溶损失的影响[J]. 生态环境学报, 2016, 25(2): 333-338. LI Zhuo-rui, WEI Gao-ling. Effects of different biomass additions on leaching loss of nitrogen and phosphorus in soil[J]. Journal of Eco-Environmental Science, 2016, 25(2): 333-338. |
| [11] |
王章鸿, 郭海艳, 沈飞, 等. 热解条件对生物炭性质氮和磷吸附性能的影响[J]. 环境科学学报, 2015, 35(9): 2805-2812. WANG Zhang-hong, GUO Hai-yan, SHEN Fei, et al. Effects of pyrolysis conditions on nitrogen and phosphorus adsorption properties of biochar properties[J]. Journal of Environmental Science, 2015, 35(9): 2805-2812. |
| [12] |
Kizito S, Wu S B, Wandera S M, et al. Evaluation of ammonium adsorption in biochar-fixed beds for treatment of anaerobically digested swine slurry:Experimental optimization and modeling[J]. Science of the Total Environment, 2016, 563(564): 1095-1104. |
| [13] |
刘玉学, 吕豪豪, 石岩, 等. 生物质炭对土壤养分淋溶的影响及潜在机理研究进展[J]. 应用生态学报, 2015, 26(1): 304-310. LIU Yu-xue, LÜ Hao-hao, SHI Yan, et al. Effects of biomass coke on leaching of soil nutrients and its potential mechanism[J]. Journal of Applied Ecology, 2015, 26(1): 304-310. |
| [14] |
Chatterjee S, Woo S H. The removal of nitrate from aqueous solutions by chitosan hydrogel beads[J]. Journal of Hazardous Materials, 2009, 164: 1012-1018. DOI:10.1016/j.jhazmat.2008.09.001 |
| [15] |
Hameed B H, Daud F B M. Adsorption studies of basic dye on activated carbon derived from agricultural waste:Hevea brasiliensis seed coat[J]. Chemical Engineering Journal, 2008, 139: 48-55. DOI:10.1016/j.cej.2007.07.089 |
| [16] |
Demiral H, Gunduzoglu G. Removal of nitrate from aqueous solutions by activated carbon prepared from sugar beet bagasse[J]. Bioresource Technology, 2010, 101(6): 1675-1680. DOI:10.1016/j.biortech.2009.09.087 |
| [17] |
Xie T, Reddy K R. Characteristics and applications of biochar for environmental remediation:A review[J]. Critical Review in Environmental Science and Technology, 2015, 45(9): 939-969. DOI:10.1080/10643389.2014.924180 |
| [18] |
Uchimiya M, Lima I M, Klasson K T, et a1. Immobilization of heavy metal ions(Cu Ⅱ, Cd Ⅱ, Ni Ⅱ and Pb Ⅱ) by broiler litter derived biochars in water and soil[J]. Journal of Agricultural and Food Chemistry, 2010, 28(9): 5538-5544. |
| [19] |
Bhatnagar A, Hogland W, Marques M, et al. An overview of the modification methods of activated carbon for its water treatment applications[J]. Chemical Engineering Journal, 2013, 219(3): 499-511. |
| [20] |
Hale S E, Alling V, Martinsen V, et al. The sorption and desorption of phosphate-P, ammonium-N and nitrate-N in cacao shell and corn cob biochars[J]. Chemosphere, 2013, 91(11): 1612-1619. DOI:10.1016/j.chemosphere.2012.12.057 |
| [21] |
Trakal L, Veselská V, Safarík I, et al. Lead and cadmium sorption mechanisms on magnetically modified biochars[J]. Bioresource Technology, 2016, 203: 318-324. DOI:10.1016/j.biortech.2015.12.056 |
| [22] |
Sumaraj, Lokesh P, Padhye. Influence of surface chemistry of carbon materials on their interactions with inorganic nitrogen contaminants in soil and water[J]. Chemosphere, 2017, 584: 532-537. |
| [23] |
Saleh M E, Mahmoud A H, Rashad M. Peanut biochar as a stable adsorbent for removing NH4+-N from wastewater:A preliminary study[J]. Advance Environmental Biology, 2012, 6(7): 2170-2176. |
| [24] |
Chen B L, Zhou D D, Zhu L Z, et al. Sorption characteristics and mechanisms of organic contaminant to carbonaceous biosorbents in aqueous solution[J]. Science in China Series B:Chemistry, 2008, 51(5): 464-472. DOI:10.1007/s11426-008-0041-4 |
| [25] |
徐楠楠, 林大松, 徐应明, 等. 玉米秸秆生物炭对Cd2+的吸附特性及影响因素[J]. 农业环境科学学报, 2014, 33(5): 958-964. XU Nan-nan, LIN Da-song, XU Ying-ming, et al. Adsorption characteristics and influencing factors of Cd2+ from corn stalk[J]. Journal of Agro-Environment Science, 2014, 33(5): 958-964. DOI:10.11654/jaes.2014.05.019 |
| [26] |
邵明艳. 土壤中的无机氮与重金属的相互影响[J]. 科技信息, 2009(35): 875-878. SHAO Ming-yan. Interaction between inorganic nitrogen and heavy metals in soil[J]. Technology Information, 2009(35): 875-878. DOI:10.3969/j.issn.1001-9960.2009.35.687 |
| [27] |
翟由涛, 杭小帅, 干方群. 改性高岭土对废水中磷的吸附性能及机理研究[J]. 土壤, 2012, 44(1): 55-61. ZHAI You-tao, HANG Xiao-shuai, GAN Fang-qun. Study on adsorption performance and mechanism of phosphorus in wastewater by modified Gaolin[J]. Soil, 2012, 44(1): 55-61. |
| [28] |
Li J H, Lv G H, Bai W B, et al. Modification and use of biochar from wheat straw(Triticum aestivum L.) for nitrate and phosphate removal from water[J]. Desalination and Water Treatment, 2016, 57(10): 4681-4693. |
| [29] |
Gai X P, Wang H Y, Liu J, et al. Effects of feedstock and pyrolysis temperature on biochar adsorption of ammonium and nitrate[J]. PLoS ONE, 2014, 9(12): e113888. DOI:10.1371/journal.pone.0113888 |
| [30] |
张扬, 李子富, 张琳, 等. 改性玉米芯生物碳对氨氮的吸附特性[J]. 化工学报, 2014, 65(3): 960-966. ZHANG Yang, LI Zi-fu, ZHANG Lin, et al. Adsorption characteristics of modified carbon corn bio-ammonia on ammonia nitrogen[J]. Journal of Chemical Industry, 2014, 65(3): 960-966. |
| [31] |
Ding Y, Liu Y X, Wu W X, et al. Evaluation of biochar effects on nitrogen retention and leaching in multi-layered soil columns[J]. Water Air and Soil Pollution, 2010, 213(1/2/3/4): 47-55. |
| [32] |
李瑞月, 陈德, 李恋卿, 等. 不同作物秸秆生物炭对溶液中Pb2+、Cd2+的吸附[J]. 农业环境科学学报, 2015, 34(5): 1001-1008. LI Rui-yue, CHEN De, LI Lian-qing, et al. The adsorption of Pb2+ and Cd2+ in solution by biochar of different crop straw[J]. Journal of Agro-Environment Science, 2015, 34(5): 1001-1008. DOI:10.11654/jaes.2015.05.025 |
| [33] |
Fuertes A B, Arbestain M C, Sevilla M, et al. Chemical and structural properties of carbonaceous products obtained by pyrolysis and hy-drothermal carbonization of corn stover[J]. Australian Journal of Soil Research, 2010, 48: 618-626. DOI:10.1071/SR10010 |
| [34] |
Thi M V, Van T T, Dinh P D, et al. Removing ammonium from water using modified corncob-biochar[J]. Science of the Total Environment, 2017, 579: 612-619. DOI:10.1016/j.scitotenv.2016.11.050 |
| [35] |
丛日环, 张丽, 鲁艳红, 等. 长期秸秆还田下土壤铵态氮的吸附解吸特征[J]. 植物营养与肥料学报, 2017, 23(2): 380-388. CONG Ri-huan, ZHANG Li, LU Yan-hong, et al. Adsorption and desorption characteristics of ammonium nitrogen in soil under long-term straw returning to field[J]. Journal of Plant Nutrition and Fertilizer, 2017, 23(2): 380-388. DOI:10.11674/zwyf.16307 |
| [36] |
Padhye L P, Wang P, Karanfil T, et al. Unexpected role of activated carbon in promoting transformation of secondary amines to N-Nitrosamines[J]. Environmental Science and Technology, 2010, 44(11): 4161-4168. DOI:10.1021/es903916t |
| [37] |
Chen L, Chen X L, Zhou C H, et al. Environmental-friendly montmorillonite-biochar composites:Facile production and tunable adsorption-release of ammonium and phosphate[J]. Journal of Cleaner Production, 2017, 156: 648-659. DOI:10.1016/j.jclepro.2017.04.050 |
 2018, Vol. 37
2018, Vol. 37