文章信息
- 李金阳, 郭海燕, 沈飞, 邓仕槐
- LI Jin-yang, GUO Hai-yan, SHEN Fei, DENG Shi-huai
- 水稻秸秆及其厌氧消化残渣生物炭对Cd (Ⅱ)吸附性能研究
- Removal of aqueous Cd(Ⅱ) by biochar derived from rice straw and its anaerobically digested residue
- 农业环境科学学报, 2018, 37(3): 585-591
- Journal of Agro-Environment Science, 2018, 37(3): 585-591
- http://dx.doi.org/10.11654/jaes.2017-1232
文章历史
- 收稿日期: 2017-09-10
- 录用日期: 2017-11-22
2. 国网四川省电力公司经济技术研究院, 成都 611130
2. State Grid Sichuan Power Economic Research Institute, Chengdu 611130, China
我国秸秆资源丰富,年产量高达7×109 t。随着农村能源结构改善和各类替代原料应用,加上秸秆分布零散、体积大、收集运输成本高,以及综合利用经济性差、产业化水平低等原因,秸秆出现了地区性、季节性过剩,大量资源被浪费,严重制约了农业可持续发展[1]。此外,随意焚烧秸秆,对大气环境造成了严重的影响。基于此,近年来以秸秆为原料进行生物能源转化得到了应用与推广。其中,通过厌氧消化将农作物秸秆转化为生物燃气,在有效利用废弃资源的同时,减少了化石燃料的消耗,降低了温室气体排放,是具有实际应用价值的处理方式之一[2]。但随着秸秆厌氧消化工程的快速发展,沼渣作为主要副产物之一,其产量快速增加,若处置不当,容易产生二次污染。因此,厌氧消化残渣的资源化利用已经成为秸秆厌氧消化技术推广的瓶颈之一。
通过热解制备生物炭,目前在畜禽粪便厌氧消化残余物中研究较多。热解过程可使其中含有的有机污染物、病原菌等有效去除,重金属等无机污染物也可形成较为稳定的化合物,实现了厌氧消化残余物的无害化[3]。生物炭的主要组成为无定形碳、芳香碳和灰分。因其特殊的理化性质(例如:比表面积大、偏碱性、表面官能团丰富等[4])而广泛应用于土壤修复和改良、污水处理等环境污染修复等方面[5]。因此,热解制备生物炭成为秸秆厌氧消化残余物资源化的可能性途径之一。
环境中镉污染的最主要来源是有色金属矿产开发和冶炼排出废气、废水和废渣。在废水中镉的众多处理方法中,吸附法研究较多[6]。以生物炭为原料,开发廉价的重金属吸附剂研究备受关注。Chen等[7]指出,木材或玉米秸秆制备生物炭,可以有效吸附水中的重金属铜和锌。Kong等[8]报道了大豆秸秆生物炭对水溶液中汞的去除率高达75%~87%。此外,有研究表明,畜禽粪便厌氧消化残渣制备生物炭对铅等重金属具有优异的去除性能,生物炭高灰分特征产生的表面沉淀是重金属去除机制[8]。相比于其他农作物秸秆,水稻秸秆及其厌氧消化残渣具有典型的高灰分特征,因此,其制备生物炭具有去除重金属的潜力。目前,利用水稻秸秆制备生物炭,对其理化性质及其对重金属去除能力已经有一定研究[10-11]。然而,对厌氧消化前后生物炭理化性质变化、重金属吸附潜能和吸附机制的研究较少。
本文以水稻秸秆及其厌氧消化物为原料,通过慢速热解制备2种生物炭。在对比原料及生物炭理化性质和热解行为的基础上,探讨2种生物炭用于去除溶液中Cd(Ⅱ)的可行性及潜在吸附机理,旨在明确厌氧消化作用对生物炭性质、重金属去除性能以及去除机制的影响。本研究可为水稻秸秆及其厌氧消化物的新型资源化利用提供理论参考和技术支持。
1 材料与方法 1.1 水稻秸秆及其厌氧消化物生物炭的制备水稻秸秆及其厌氧消化残余物来自农业部沼气科学研究所,经烘干、粉碎后过40目筛备用。制备生物炭前,原料在105 ℃干燥6 h。称取20.00 g干燥后原料置于管式炉(OTL-1200型,南京南大仪器厂),N2为保护气(0.1 m3·h-1),以升温速率40 ℃·min-1升温至500 ℃,并维持1 h。热解后,快速冷却至室温,并过40目筛,直接用于吸附研究。其中,水稻秸秆及其厌氧消化残余物生物炭分别命名为RS500和DRS500。
1.2 生物炭理化性质测定生物炭的产率由生物炭产量与热解前生物质质量计算获得;原料及其生物炭的热化学性质通过热重分析仪测定(Netzsch STA449,Netzsch);工业分析参照ASTM D 1762-84[12];pH和电导率由pH计(pHS-3C型,上海雷磁)和电导率仪(DDS-12DW型,上海般特)测定;生物炭主要元素组成采用元素分析仪(Vario MICRO,Elementar)测定;比表面积采用比表面积分析仪(NOVA 2200E,Quanta Chrome)测定;表面官能团利用傅里叶变换红外光谱仪(6700型Ⅱ,Thermo Fisher)测定;使用扫描电镜(SU1510,Hitachi)观察生物炭表面的形貌特征。利用X射线衍射(I-2,Nicolet,Madison,WI,USA)分析样品吸附重金属后表面矿质组成。
1.3 Cd(Ⅱ)吸附称取0.1g RS500或DRS500于150 mL三角瓶中,加入一定浓度Cd(Ⅱ)溶液50 mL。封口后,置于恒温空气浴摇床(HZQ-QX型,哈尔滨东联电子),以150 r·min-1进行吸附。按设定时间取样,样品经0.45 μm水系滤膜过滤后,用1%稀硝酸进行稀释,在火焰原子吸收分光光度计(FAAS-M6型,Thermo-Fisher)上测定Cd(Ⅱ)浓度。在考察RS500和DRS500在不同初始浓度下对吸附Cd2+的影响时,温度和时间分别控制为25 ℃和24 h,Cd2+初始浓度分别为10~1000 mg·L-1和2~200 mg·L-1;在考察RS500和DRS500在不同温度下对吸附Cd2+的影响时,时间和温度控制为24 h和15~45 ℃,初始浓度分别为200、50 mg·L-1;在考察RS500和DRS500在不同pH下对吸附Cd2+的影响时,时间和温度控制为24 h和25 ℃,初始浓度分别为200、50 mg·L-1,溶液pH为3~7;在考察RS500和DRS500在不同时间下对吸附Cd2+的影响时,初始浓度分别为200、50 mg·L-1,温度控制为25 ℃,时间为5 min~48 h。每组设置3个重复,并做2个空白对照,结果为3重复的平均值。
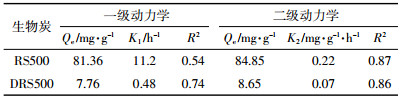
利用一级动力学模型和二级动力学模型对Cd(Ⅱ)动力学吸附试验实验结果进行拟合。
一级动力学模型:
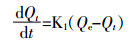 (1)
(1) 二级动力学模型:
 (2)
(2) 式中:Qt为t时刻的吸附量,mg·g-1;Qe为平衡吸附量,mg·g-1;K1为一级动力学吸附速率常数,h-1;K2为二级动力学吸附速率常数,g·mg-1·h-1。
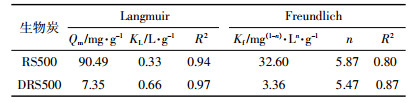
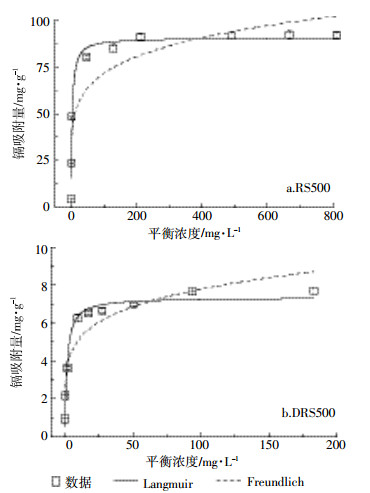
利用Langmuir等温模型和Freundlich等温模型对Cd(Ⅱ)等温吸附试验实验结果进行拟合。
Langmuir等温模型:
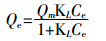 (3)
(3) Freundlich等温模型:
 (4)
(4) 式中:Qe为平衡吸附量,mg·g-1;Ce为吸附平衡时的浓度,mg·L-1;Qm为最大吸附量,mg·g-1;KL、KF为与吸附相关的常数。
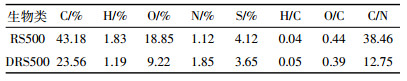
2 结果与讨论 2.1 RS500和DRS500的理化性质从表 1可以看出,DRS500与RS500相比C、H、O的含量呈下降趋势,而N的含量上升。C、H和O降低是因为厌氧消化过程中纤维素和半纤维素被大量分解。H/C反映出生物炭中脂肪烃的含量,两种生物炭的H/C数值相差很小,说明厌氧消化对生成的生物炭芳香性影响较小。O/C是评价生物炭稳定性的重要指标,DRS500的O/C比较小,说明其具有更低的极性和亲水性[13]。
由表 2可知,DRS500和RS500相比,含水率、挥发分和固定碳占比呈现下降趋势,灰分占比则增加。DRS500的灰分较高,主要由于厌氧消化后,水稻秸秆中的半纤维素、纤维素等有机物被利用[14],这也是导致DRS500的产率远高于RS500的主要原因。RS500和DRS500均呈碱性,主要是由于生物炭中富含碱金属和碱土金属;大量可溶性碱金属(Na、K)在厌氧消化时进入水相,是导致DRS500 pH较低的主要原因;此外,还与厌氧消化残余物具有较高的腐植酸含量和易分解特性有关[15]。较高pH的生物炭有利于吸附带正电荷的离子[16],因此,RS500在重金属离子的去除中可能具有更好的效果。RS500电导率明显高,说明其中可溶性盐的含量丰富,这有利于在吸附过程中与其他物质结合生成沉淀[17]。DRS500电导率较低,可能是某类矿物质在厌氧消化过程中生成不溶盐或者结晶,从而影响溶液中CO32-和PO43-等离子的释放量[16],这不利于吸附反应的发生。
相比RS500,DRS500比表面积较低,主要因为RS500具有较高的挥发分,热解过程中挥发分的溢出会残留大量孔道,具有较高比表面积的生物炭可能具有更好的吸附效果[18]。生物炭的扫描电镜结果(图 1)也显示RS500拥有更丰富的孔径,而厌氧消化后的DRS500呈板状结构,表面更加致密和光滑。此外,两种生物炭中的Cd(Ⅱ)含量较低,且Cd(Ⅱ)的释放量微小,对Cd(Ⅱ)吸附结果影响较小。

|
| 图 1 RS500和DRS500的扫描电镜图(×10 000倍) Figure 1 Scanning electron micrographs of RS500 and DRS500 (×10 000 times) |
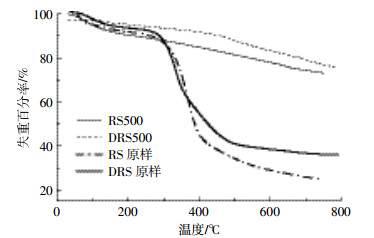
热重分析(图 2)显示,水稻秸秆原样存在3个明显的质量损失阶段,而厌氧消化物残渣在220~300 ℃没有出现明显失重峰,说明大部分半纤维素已被厌氧消化[14]。RS500和DRS500在220~450 ℃之间失重较不明显,说明生物炭制备过程热解较为完全[15]。相比之下厌氧消化残渣及DRS500的质量损失较小,说明厌氧消化后秸秆具有更高的热稳定性。
|
| 图 2 水稻秸秆及厌氧消化残渣、RS500和DRS500热重分析 Figure 2 Pyrolysis of rice straw, anaerobic digestion rice straw, RS500, and DRS500 |
图 3a和图 3b为初始浓度对RS500和DRS500吸附Cd(Ⅱ)的影响。2种生物炭对Cd(Ⅱ)的吸附量均随初始浓度的增加而逐渐增加,去除率随初始浓度增加而逐渐降低。在初始浓度较低时升高浓度使Cd(Ⅱ)的吸附量上升较快,随后继续增加Cd(Ⅱ)初始浓度,吸附量变缓趋于平衡。这与生物炭所能提供的结合位点有限有关[19]。RS500对Cd(Ⅱ)表现出较好的吸附性能,而DRS500性能下降明显,这可能由于厌氧消化过程中可溶性盐进入水相[20],且DRS500比表面积明显下降,影响了Cd(Ⅱ)的吸附效果,但仍具有一定的吸附性能,最大吸附量达到7.7 mg·g-1。

|
| a.初始浓度对RS500吸附Cd(Ⅱ)的影响;b.初始浓度对DRS500吸附Cd(Ⅱ)的影响;c.温度的影响;d.溶液pH的影响 a.Effect of initial concentrations on Cd(Ⅱ) adsorption by RS500, b.Effect of initial concentrations on Cd(Ⅱ) adsorption by DRS500, c.Effect of temperature, d.Effect of solution pH 图 3 吸附条件对RS500和DRS500吸附Cd(Ⅱ)的影响 Figure 3 Effects of adsorption conditions on Cd(Ⅱ) removal by RS500 and DRS500 |
由图 3c可见,随温度增加,2种生物炭对Cd(Ⅱ)的吸附量呈上升趋势,其主要原因在于提升温度促进Cd(Ⅱ)的无规则运动,增加Cd(Ⅱ)与生物炭表面吸附位点的碰撞几率和促进Cd(Ⅱ)在生物炭内部孔隙的扩散与迁移,从而有利于吸附的进行[21]。温度由15 ℃升高到45 ℃时,RS500吸附量变化较小,吸附量之差为4.61 mg·g-1,DRS500吸附量变化相对较大,吸附量之差为8.9 mg·g-1,这说明RS500和DRS500对Cd(Ⅱ)的吸附都为吸热主导的过程,但DRS500对Cd(Ⅱ)的吸附受温度的影响更显著。
由图 3d所示,RS500对Cd(Ⅱ)的吸附量,随pH值的增加而增加,这可能由于较低的pH值条件会阻碍部分Cd(Ⅱ)的沉淀态物质和结晶生成。pH值由3上升到4时,RS500对Cd(Ⅱ)的吸附量上升最大,可见,较高浓度的H+与Cd(Ⅱ)在生物炭表面会形成明显的竞争吸附作用导致吸附量降低[22]。而DRS500对Cd(Ⅱ)的吸附量则随pH值的增加而减小,pH由3增加到4时,对Cd(Ⅱ)的吸附量从9.53 mg·g-1下降至7.01 mg·g-1,这说明DRS500对Cd(Ⅱ)存在静电作用[23],pH较低时DRS500表面官能团质子化,DRS500与Cd(Ⅱ)之间可发生离子交换。
从图 4可知,DRS500在2θ=26.7°附近出现了一个尖锐的特征峰为Na2SiO3,而RS500中并没有该明显的特征峰,说明DRS500具有很高的硅酸盐含量,由于SiO2具有较低的等电点,在低pH值(<3.0)条件下,其表面呈现负电性,有利于吸附的进行[24]。
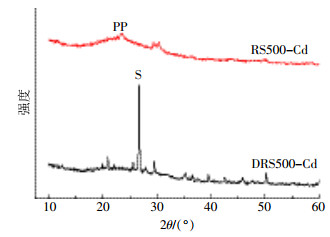
|
| 图 4 RS500和DRS500吸附Cd(Ⅱ)后的X射线衍射 Figure 4 The XRD of RS500 and DRS500 after adsorption |
2种生物炭吸附Cd(Ⅱ)动力学如图 5所示,RS500在1 h内吸附量迅速上升到76.36 mg·g-1,这可能是由于Cd(Ⅱ)与生物炭的矿物发生沉淀反应。从图 4中可以看出RS500吸附Cd(Ⅱ)后在2θ=29.2°~30.7°出现了一个明显的宽峰,归属于NaCdPO4或Cd3(PO4)2,导致其对Cd(Ⅱ)的吸附速度较快且效果较好,而DRS500吸附后并未观察到明显的镉结晶物质,这可能是厌氧消化后形成了更加稳定的结晶物质,极大地减少了PO43-等离子的释放。而随吸附时间的延长,吸附在12 h基本达到平衡。此外,RS500孔径较为疏松发达,这可能使吸附发生的速度较快。而DRS500对Cd(Ⅱ)的吸附非常缓慢,在48 h还未达到吸附平衡,从图 1中可以看出,DRS500是一种较为致密的块状堆积结构,这可能导致其对重金属的吸附位点被覆盖[25],可能造成与Cd(Ⅱ)的作用较慢。

|
| 图 5 RS500和DRS500对Cd(Ⅱ)的吸附动力学 Figure 5 Adsorption kinetics for Cd(Ⅱ) by RS500 and DRS500 |
分别利用一级动力学和二级动力学对RS500和DRS500吸附Cd(Ⅱ)的吸附数据进行拟合,拟合曲线和拟合参数分别如图 5及表 3。结果表明二级动力学能较好地拟合RS500(R2=0.87)和DRS500(R2=0.86)的实验结果,但R2均小于0.9。二级动力学得到的Qe更接近实验真实值。这也表明RS500和DRS500对Cd(Ⅱ)的吸附主要受化学吸附作用控制,由图 4和图 6可知,RS500和DRS500对重金属的吸附主要是表面官能团和矿物与重金属之间的相互作用,但同时存在着其他作用。
|

|
| 图 6 RS500、DRS500、RS500-Cd和DRS500-Cd红外分析 Figure 6 FT-IR spectra of RS500, DRS500, RS500-Cd, and DRS500-Cd |
利用Langmuir和Freundlich模型对吸附数据进行非线性拟合,拟合结果如图 7及表 4。结果表明,Langmuir模型能较好地拟合RS500和DRS500对Cd(Ⅱ)的吸附结果,R2>0.9。基于Langmuir模型假设的条件可推测,RS500和DRS500吸附Cd(Ⅱ)的过程为单层均相吸附。通过Langmuir模型拟合所得到的RS500和DRS500对Cd(Ⅱ)的最大吸附量分别为90.49 mg·g-1和7.35 mg·g-1,具有较好的吸附效果,这可能与生物炭具有较高的灰分含量和矿物成分有关,RS500吸附量显著高于DRS500是由于其表面矿物与Cd(Ⅱ)反应生成沉淀类结晶物质。另外,在Langmuir模型中,可通过Langmuir等温吸附方程得到分离因子RL。结合表 4中RS500和DRS500的参数计算可知0 < RL < 1,所以均有利于吸附Cd(Ⅱ)。
|
|
| 图 7 RS500和DRS500对Cd(Ⅱ)吸附的吸附等温线 Figure 7 Adsorption isotherms for Cd(Ⅱ) by RS500 and DRS500 |
为更好理解生物炭表面官能团对吸附的作用,图 6对比了RS500、DRS500和吸附Cd(Ⅱ)后(RS500-Cd、DRS500-Cd)的红外光谱。由图可见,RS500和DRS500官能团数量和种类较多。吸附Cd(Ⅱ)后,红外峰均发生了一定的变化。例如,RS500的-OH峰吸附后由3 428.14 cm-1偏移至3 434.27 cm-1,这是因为Cd(Ⅱ)与RS500上的-OH发生了离子交换作用。另外,RS500和DRS500伸缩振动峰C=O均发生了漂移,DRS500的C=O由1 626.95 cm-1漂移至1 622.26 cm-1,这可能是由于Cd(Ⅱ)与C=O发生络合作用[25]。1000~1100 cm-1主要是硅酸盐和磷酸根伸缩振动,在吸附Cd(Ⅱ)后DRS500在该处的峰出现了明显加强,可能是由于硅酸盐在DRS500吸附Cd(Ⅱ)中起重要作用[25]。700~800 cm-1主要是芳香官能团杂环中的C-H官能团伸缩振动[27],RS500和DRS500在该处的峰均出现了加强,表明C-H在吸附Cd(Ⅱ)的过程中也有一定作用。
3 结论(1) 水稻秸秆厌氧消化残渣所制备的生物炭(DRS500)灰分和产率较高,具有更好的热稳定性。水稻秸秆生物炭(RS500)可在12 h内实现Cd(Ⅱ)的吸附平衡,而DRS500在48 h时内仍未达到吸附平衡。较高的pH有利于RS500对Cd(Ⅱ)的去除而不利于DRS500。整体上,RS500对Cd(Ⅱ)吸附效果较好。
(2) Langmuir吸附等温模型可较好地描述RS500和DRS500对Cd(Ⅱ)的吸附。它们对Cd(Ⅱ)的吸附主要为单层均相吸附且较容易进行。二级动力学对吸附结果具有良好的拟合度,说明RS500和DRS500对Cd(Ⅱ)的吸附受化学作用的主导。其中,表面官能团(-OH、C=O、Si-O-Si和C-H等)在吸附Cd(Ⅱ)过程中起重要作用。
| [1] |
毕于运. 秸秆资源评价与利用研究[D]. 北京: 中国农业科学院, 2010. BI Yu-yun. Study on straw resources evaluation and utilization[D]. Beijing:Chinese Academy of Agricultural Sciences, 2010. |
| [2] |
杨俐苹, 王玉军, 白由路, 等. 农田施用沼气残余物研究热点与展望[J]. 中国农业科技导报, 2016(3): 171-176. YANG Li-ping, WANG Yu-jun, BAI You-lu, et al. Research focus and prospect for application of biogas residue to agricultural land[J]. Journal of Agricultural Science and Technology, 2016(3): 171-176. |
| [3] |
Lehmann J, Gaunt J, Rondon M, et al. Biochar sequestration in terrestrial ecosystems:A review[J]. Mitigation and Adaptation Strategies for Global Change, 2006, 11(2): 395-419. |
| [4] |
Xu X Y, Cao X D, Zhao L, et al. Removal of Cu, Zn, and Cd from aqueous solutions by the dairy manure-derived biochar[J]. Environmental Science and Pollution Research, 2013, 20(1): 358-368. DOI:10.1007/s11356-012-0873-5 |
| [5] |
Kameyama K, Miyamoto T, Shiono T, et al. Influence of sugarcane bagasse-derived biochar application on nitrate leaching in calcaric dark red soil[J]. Journal of Environmental Quality, 2012, 41(4): 1131-1137. DOI:10.2134/jeq2010.0453 |
| [6] |
Pereira M D G, Korn M, Santos B B, et al. Vermicompost for tinted organic cationic dyes retention[J]. Water, Air, & Soil Pollution, 2009, 200(1): 227-235. |
| [7] |
Chen X C, Chen G C, Chen L G, et al. Adsorption of copper and zinc by biochars produced from pyrolysis of hardwood and corn straw in aqueous solution[J]. Bioresource Technology, 2011, 102(19): 8877-8884. DOI:10.1016/j.biortech.2011.06.078 |
| [8] |
Kong H L, He J H, Gao Y Z, et al. Cosorption of phenanthrene and mercury(Ⅱ) from aqueous solution by soybean stalk-based biochar[J]. Journal of Agricultural & Food Chemistry, 2011, 59(22): 12116-12123. |
| [9] |
Inyang M, Gao B, Yao Y, et al. Removal of heavy metals from aqueous solution by biochars derived from anaerobically digested biomass[J]. Bioresource Technology, 2012, 110(2): 50-56. |
| [10] |
简敏菲, 高凯芳, 余厚平. 不同裂解温度对水稻秸秆制备生物炭及其特性的影响[J]. 环境科学学报, 2016, 36(5): 1757-1765. JIAN Min-fei, GAO Kai-fang, YU Hou-ping. Effects of different pyrolysis temperatures on the preparation and characteristics of biochar from rice straw[J]. Acta Scientiae Circumstantiae, 2016, 36(5): 1757-1765. |
| [11] |
Jiang J, Xu R K, Jiang T Y, et al. Immobilization of Cu(Ⅱ), Pb(Ⅱ) and Cd(Ⅱ) by the addition of rice straw derived biochar to a simulated polluted Ultisol[J]. Journal of Hazardous Materials, 2012, 229/230: 145-150. DOI:10.1016/j.jhazmat.2012.05.086 |
| [12] |
ASTM. Standard test method for chemical analysis of wood charcoal[R]. ASTM International, W. Conshohochen, PA, 2001.
|
| [13] |
Jung K, Kim K, Jeong T, et al. Influence of pyrolysis temperature on characteristics and phosphate adsorption capability of biochar derived from waste-marine macroalgae(Undaria pinnatifida roots)[J]. Bioresource Technology, 2016, 200: 1024-1028. DOI:10.1016/j.biortech.2015.10.016 |
| [14] |
Yao Y, Gao B, Inyang M, et al. Biochar derived from anaerobically digested sugar beet tailings:Characterization and phosphate removal potential[J]. Bioresource Technology, 2011, 102(10): 6273-6278. DOI:10.1016/j.biortech.2011.03.006 |
| [15] |
冯琪波. 稻田土壤水稻秸秆生物质炭稳定性研究[D]. 杭州: 浙江大学, 2013. FENG Qi-bo. Stability of rice straw-derived biochar in paddy soil[D]. Hangzhou:Zhejiang University, 2013. |
| [16] |
Cao X, Harris W. Properties of dairy-manure-derived biochar pertinent to its potential use in remediation[J]. Bioresource Technology, 2010, 101: 5222-5228. DOI:10.1016/j.biortech.2010.02.052 |
| [17] |
Bayabil H K, Stoof C R, Lehmann J C, et al. Assessing the potential of biochar and charcoal to improve soil hydraulic properties in the humid Ethiopian Highlands:The Anjeni watershed[J]. Geoderma, 2015, 243/244: 115-123. DOI:10.1016/j.geoderma.2014.12.015 |
| [18] |
Li R H, Wang J J, Zhou B Y, et al. Enhancing phosphate adsorption by Mg/Al layered double hydroxide functionalized biochar with different Mg/Al ratios[J]. Science of the Total Environment, 2016, 559: 121-129. DOI:10.1016/j.scitotenv.2016.03.151 |
| [19] |
Kılıç M; Kırbıyık Ç, Çepelioćullar Ö, et al. Adsorption of heavy metal ions from aqueous solutions by biochar, a by-product of pyrolysis[J]. Applied Surface Science, 2013, 283(14): 856-862. |
| [20] |
Vrieze J D, Saunders A M, Ying H, et al. Ammonia and temperature determine potential clustering in the anaerobic digestion microbiome[J]. Water Research, 2015, 75: 312-323. DOI:10.1016/j.watres.2015.02.025 |
| [21] |
王章鸿, 郭海艳, 沈飞, 等. 蚯蚓粪便制备生物炭及其对罗丹明B吸附的研究[J]. 环境科学学报, 2015, 35(10): 3170-3177. WANG Zhang-hong, GUO Hai-yan, SHEN Fei, et al. Production of biochar by vermicompost carbonization and its adsorption to Rhodamine-B[J]. Acta Scientiae Circumstantiae, 2015, 35(10): 3170-3177. |
| [22] |
Cheng Q, Huang Q, Khan S, et al. Adsorption of Cd by peanut husks and peanut husk biochar from aqueous solutions[J]. Ecological Engineering, 2016, 87: 240-245. DOI:10.1016/j.ecoleng.2015.11.045 |
| [23] |
周艳萍, 温蓓, 胡晓宇, 等. 全氟化合物在碳纳米管上的吸附研究[J]. 环境化学, 2011, 30(12): 2003-2008. ZHOU Yan-ping, WEN Bei, HU Xiao-yu, et al. Adsorption of perfluorinated compounds on multiwalled carbon nanotubes[J]. Environment Chemistry, 2011, 30(12): 2003-2008. |
| [24] |
Xiao X, Chen B L, Zhu L Z. Transformation, morphology, and dissolution of silicon and carbon in rice straw-derived biochars under different pyrolytic temperatures[J]. Environmental Science & Technology, 2014, 48(6): 3411. |
| [25] |
徐义亮. 生物炭的制备热动力学特性及其对镉的吸附性能和机理[D]. 杭州: 浙江大学, 2013. XU Yi-liang. Thermodynamic properties of biochar preparation and sorption characteristics and mechanisms of cadmium onto biochars[D]. Hangzhou:Zhejiang University, 2013. |
| [26] |
陈再明, 方远, 徐义亮, 等. 水稻秸秆生物炭对重金属Pb2+的吸附作用及影响因素[J]. 环境科学学报, 2012, 32(4): 769-776. CHEN Zai-ming, FANG Yuan, XU Yi-liang, et al. Adsorption of Pb2+ by rice straw derived-biochar and its influential factors[J]. Acta Scientiae Circumstantiae, 2012, 32(4): 769-776. |
| [27] |
Hossain M K, Strezov V, Chan K Y, et al. Influence of pyrolysis temperature on production and nutrient properties of wastewater sludge biochar[J]. Journal of Environmental Management, 2011, 92(1): 223-228. DOI:10.1016/j.jenvman.2010.09.008 |
 2018, Vol. 37
2018, Vol. 37