文章信息
- 王济世, 贺泽英, 徐亚平, 王璐, 彭祎, 刘潇威
- WANG Ji-shi, HE Ze-ying, XU Ya-ping, WANG Lu, PENG Yi, LIU Xiao-wei
- 自动QuEChERS方法结合液相色谱串联质谱对玉米中133种农药的多残留分析
- Multiresidue analysis of 133 pesticides in corn using automatic QuEChERS with LC-MS/MS
- 农业环境科学学报, 2018, 37(3): 605-612
- Journal of Agro-Environment Science, 2018, 37(3): 605-612
- http://dx.doi.org/10.11654/jaes.2017-1166
文章历史
- 收稿日期: 2017-08-25
- 录用日期: 2017-11-15
玉米是重要的粮食作物和重要的饲料来源。在现代农业生产中,为了减少病虫草害[1-2],保证玉米产量,不可避免地需要使用农药[3]。然而,当食用农产品中的农药残留量超过一定水平,就可能会对人类的健康造成危害[4-5]。为了保障农产品质量安全和食用者身体健康,我国明确规定了食品中的农药最高残留限量(MRLs)。快速检测农产品中农药残留是保证食品安全的重要手段,而快速、简便、灵敏的分析方法,将成为农药残留检测的主要目标[6]。
Anastassiades等[7-8]在2003年首次提出了QuEChERS(快速、简单、廉价、高效、耐用、安全)方法,并对其在农药多残留检测中的简便性和广泛适用性进行了验证,现已得到广泛认可。该方法主要分为两个步骤:提取和净化。在基质前处理过程中常用乙腈作为提取溶剂,并加入专用萃取盐包去除基质中的水分等干扰物,离心后将上清液转移至净化材料中,利用分散固相萃取技术进行净化[9]。为了使QuEChERS方法适用范围更广,研究人员不断对提取溶剂,净化材料等步骤进行改进和完善[10-13]。
目前,国外也研究开发了一些自动化比较强的QuEChERS方法,但价格昂贵。而我国本立科技公司新研发的自动QuEChERS前处理设备价格低,简单快捷,具有很好的应用前景。本研究在QuEChERS方法的基础上,借助自动QuEChERS前处理设备,建立了一个更加简单、便捷的方法--高通量自动QuEChERS方法。为保证方法的适用性,在自动QuEChERS方法建立过程中,选择了基质较复杂的谷物-玉米进行添加回收实验,结合LC-MS/MS进行检测,并对该方法的实用性进行了验证。
1 材料和方法 1.1 材料和试剂乙腈、甲醇(色谱纯,Fisher);乙酸(优级纯,中国国药集团化学试剂有限公司);实验用水为实验室一级水;EN法(欧盟标准)萃取盐包(美国Agilent公司):内含4 g无水硫酸镁、1 g氯化钠、1 g柠檬酸钠、0.5 g柠檬酸氢二钠;AOAC法(美国标准)萃取盐包(美国Agilent公司):内含6 g无水硫酸镁,1.5 g醋酸钠;陶瓷均质子(美国Agilent公司);净化材料:无水硫酸镁、N-丙基乙二胺(PSA)及C18 150 mg(美国Agilent公司);锆珠(R101、R104)和双层提取净化管(本立科技公司);针管式过滤膜(0.22 μm,美国Agilent公司)。
农药标准溶液(美国Chem Service公司和德国Dr. Ehrenstorfer公司),纯度大于98%。将133种农药标准溶液用丙酮作溶剂配成5 mg·L-1混标溶液,-20 ℃储存备用。
玉米面粉购自天津市的超市。
1.2 仪器涡旋振荡器(Thermo,美国);高速冷冻离心机(Heal Force,香港);Qtrap 4500三重四级杆质谱仪和Acquity LC100高效液相色谱仪(美国AB Sciex公司);C18色谱柱(1.8 μm,2.1 mm×100 mm)购于美国Waters公司。
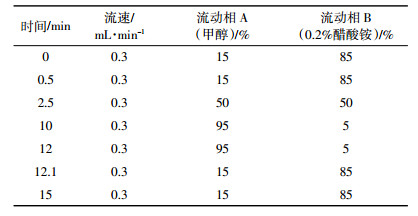
1.3 自动前处理设备自动QuEChERS前处理设备是一款自动程序控制分析样品制备的设备,利用强力立体“8”字振荡造成涡旋效果,实现提取效能;再与电机单向运动实现的离心功能相结合,来完成样品中待测成分的提取和净化。与配套提取管组合,开发出全新的自动QuEChERS处理方法,其流程示意图见图 1。
|
| 图 1 自动QuEChERS方法流程示意图 Figure 1 Diagram of automated QuEChERS method |
自动QuEChERS前处理设备专用提取管由内外两层管组成,内管侧壁开若干小孔,孔上覆有只允许提取溶剂通过的半透性微孔膜。使用时,先将样品加入外管,再加入提取剂,并放入锆珠,将装有净化材料的内管插入外管内,拧紧放入提取仪中。仪器自动顺序实现两次振荡和离心。振荡时,在锆珠的帮助下,样品与提取剂充分接触混合。当振荡提取结束,开始离心时,样品受到离心力的作用,提取液与提取残渣分离,提取液透过微孔滤膜进入到内管,迅速得到洁净的上清液,再经过二次振荡与净化剂充分作用得到净化。图 2为提取管的抑制渗透效果及对实际样品的处理效果。

|
| 图 2 提取管的抑制渗透效果图 Figure 2 Diagram of double centrifuge tubes prevent the osmosis |
柱温40 ℃,流动相A为甲醇,流动相B为0.2%醋酸铵,进样量5 μL,流速0.3 mL·min-1。梯度洗脱程序见表 1。
气帘气(CUR) 25 psi(1 psi=6.895 kPa),碰撞活化参数(CAD)中等,离子喷雾电压5.5 kV,离子源温度500 ℃,离子源气体1(GS1) 50 psi;离子源气体2(GS2) 50 psi。目标化合物的保留时间、离子对、去簇电压、碰撞能质谱条件见表 2。
EN法:(1)称取玉米样品5 g于离心管外管中,加入混标溶液(外标法),静置30 min;(2)加入10 mL水涡旋混匀,静置30 min;(3)加入10 mL乙腈,加入EN萃取盐包及10颗锆珠,拧紧内管(内含无水硫酸镁450 mg,PSA 75 mg,C18 75 mg);(4)放入自动QuEChERS前处理设备开始处理。处理结束后从内管中取清液1 mL过0.22 μm微孔滤膜,待测。
AOAC法:与EN法不同的是(3)加入10 mL乙腈(含1%乙酸),加入AOAC萃取盐包及10颗锆珠,拧紧内管(内含无水硫酸镁600 mg、PSA 200 mg、C18 200 mg);其他步骤相同。
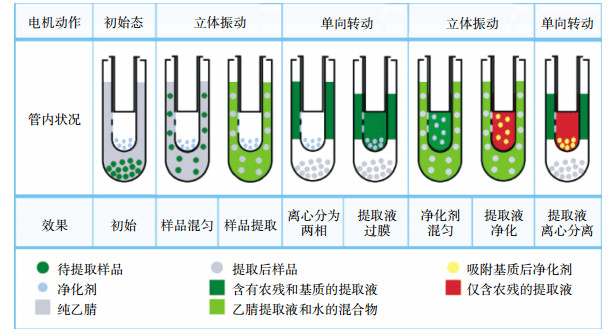
2 结果与讨论 2.1 提取时间的优化为了探索最优的提取时间,对均质分离工作站第一阶段的振荡时间进行优化比较。本实验将第一阶段振荡时间分别设置1、2、3 min进行对比,转速1000 r·min-1,保持后面三个阶段处理时间不变:第二阶段离心5 min,转速4000 r·min-1;第三阶段振荡3 min,转速1000 r·min-1;第四阶段离心3 min,转速4000 r·min-1。结果如图 3所示,当第一阶段的振荡时间为2 min和3 min时,回收率相近。基于效率最优化,第一阶段的振荡时间定为2 min。实验过程中,对第二至第四阶段离心振荡时间也进行了优化,但对结果影响不大。
|
| 图 3 不同振荡时间下玉米中133种农药的回收率比较 Figure 3 Recoveries of 133 pesticides in corn at different oscillation time |
实验对两种提取方法(EN和AOAC)进行了比较。从两种方法得到的色谱图(图 4)可以发现,两种方法提取效果差异不大。但AOAC方法提取溶剂中需加入1%的乙酸,且净化材料用量较大,所以本实验采用EN提取方法。

|
| 图 4 EN和AOAC提取方法得到的玉米提取化合物色谱图 Figure 4 The chromatogram of corn extracts using EN and AOAC method |
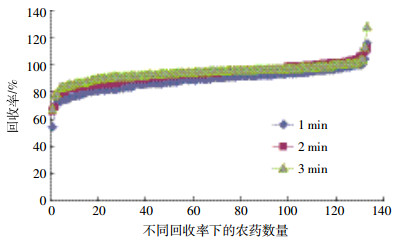
本研究将自动QuEChERS方法与传统QuEChERS方法进行了回收率的比较。传统方法步骤:准确称取5 g玉米于50 mL离心管中,加入混标溶液,静置30 min,加入10 mL水涡旋混匀,静置30 min,加入10 mL乙腈。加入EN萃取盐包及1颗陶瓷均质子,拧紧盖子,剧烈振荡1 min,于8000 r·min-1下离心5 min,取6 mL上清液到净化用离心管中,涡旋混匀1 min,于8000 r·min-1下离心5 min。取上清液1 mL过0.22 μm微孔滤膜,待测。图 5给出了两种方法在3个添加浓度下的回收率比较。从图中可以看出,自动QuEChERS方法与传统QuEChERS方法回收率相差不大,几乎所有受测农药回收率在70%~120%之间,通过两种方法的比较,进一步说明了自动QuEChERS方法在玉米农药多残留分析中的可行性和适用性。
|
| 图 5 传统方法和自动方法在3个添加水平时的回收率箱图 Figure 5 Boxplot of the recovery values obtained with the manual method and automatic method at three spiking level |
基质效应往往会对实验结果的准确性造成干扰,在目标化合物的分析中对信号产生抑制效应或增强效应[14]。通常,基质效应与目标化合物的化学性质和样品前处理密切相关。基质效应值(ME)的计算公式如下[15]:
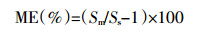
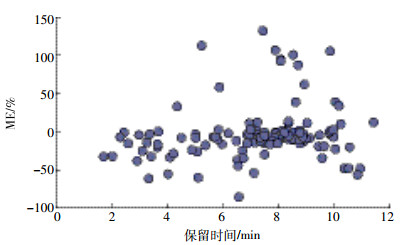
式中:Sm和Ss分别表示基质标曲和溶剂标曲的斜率,当ME为-20%~20%、-50%~-20%或20%~50%、<-50%或>50%时,分别表示轻微、中等、较强的基质效应。本研究基质效应(图 6)的评估结果表明,69%受测农药基质效应在-20%~20%,属于弱基质效应;而溴氰菊酯、苄氯菊酯等农药表现为中等或强基质效应,所以在定量分析中使用基质标准校正曲线是必要的。
|
| 图 6 在玉米基质中受测农药的基质效应 Figure 6 Matrix effects(ME) of the test pesticides in corn |
在实验中,通过回收率、线性、定量限对自动QuEChERS方法进行了验证。
待测农药3个添加浓度为20、100、500 μg·kg-1,每一浓度5个平行,得到的回收率在70%~120%,相对标准偏差低于15%。
用玉米空白基质配制8个浓度水平(2、5、10、20、50、100、200、500 μg·kg-1),通过液相色谱-串联质谱得标准工作曲线,呈现良好的线性,相关系数在0.990~0.999。
本实验以目标化合物回收率在70%~120%、相对标准偏差小于20%时的最小添加浓度为定量限,在对玉米133种农药检测结果中,有119种农药的定量限为2 μg·kg-1,相比He等[16]所报道的更低。
2.6 实际样品测定对山东省10个玉米样品(S-1~S-10),采用自动QuEChERS方法进行农药残留测定。其中S-3、S-5、S-6、S-9中未检出农药残留,S-1中莠去津、乙草胺有检出,浓度分别为20.8 μg·kg-1和10.1 μg·kg-1;S-2中乙草胺检出浓度为6.2 μg·kg-1,毒死蜱检出浓度低于检出限;S-4检出甲草胺16.2 μg·kg-1,毒死蜱2.7 μg·kg-1,S-7检出甲草胺4.2 μg·kg-1,三唑酮3.1 μg·kg-1,除虫脲2.7 μg·kg-1,克百威低于检出限;S-8中检出莠去津、氯虫苯甲酰胺浓度分别为9.8、4.6 μg·kg-1;S-10中检出3-羟基克百威2.9 μg·kg-1,莠去津8.3 μg·kg-1。结果表明,本方法适用于玉米中农药残留的测定。
3 结论(1) 在本研究中,通过对提取方法的比较、提取时间的优化,以及方法的验证,建立了自动QuEChERS结合液相色谱-串联质谱对玉米中133种农药的多残留分析方法。
(2) 通过与传统QuEChERS方法的比较,该方法耗时短、效率高,受测农药总体回收率在70%~120%之间,相对标准偏差在15%以下,符合残留检测的要求。
(3) 该方法成功应用于玉米实际样品的检测,为玉米中农药多残留检测提供方法依据。
| [1] |
Pizzutti I R, De K A, Zanella R, et al. Method validation for the analysis of 169 pesticides in soya grain, without clean up, by liquid chromatography-tandem mass spectrometry using positive and negative electrospray ionization[J]. Journal of Chromatography A, 2007, 1142(2): 123-136. DOI:10.1016/j.chroma.2006.12.030 |
| [2] |
Andreu V, Picó Y. Determination of pesticides and their degradation products in soil:Critical review and comparison of methods[J]. Trends in Analytical Chemistry, 2004, 23(10): 772-789. |
| [3] |
Fernandes V C, Lehotay S J, Geisasteggiante L, et al. Analysis of pesticide residues in strawberries and soils by GC-MS/MS, LC-MS/MS and two-dimensional GC-time-of-flight MS comparing organic and integrated pest management farming[J]. Food Additives & Contaminants Part A Chemistry Analysis Control Exposure & Risk Assessment, 2014, 31(2): 262-270. |
| [4] |
Sinha S N, Rao M V V, Vasudev K, et al. A liquid chromatography mass spectrometry-based method to measure organophosphorous insecticide, herbicide and non-organophosphorous pesticide in grape and apple samples[J]. Food Control, 2012, 25(2): 636-646. DOI:10.1016/j.foodcont.2011.11.031 |
| [5] |
Sack C, Smoker M, Chamkasem N, et al. Collaborative validation of the QuEChERS procedure for the determination of pesticides in food by LC-MS/MS[J]. Journal of Agricultural & Food Chemistry, 2011, 59(12): 6383-6411. |
| [6] |
Zhao M A, Feng Y N, Zhu Y Z, et al. Multi-residue method for determination of 238 pesticides in Chinese cabbage and cucumber by liquid chromatography-tandem mass spectrometry:Comparison of different purification procedures[J]. Journal of Agricultural & Food Chemistry, 2014, 62(47): 11449-11456. |
| [7] |
Anastassiades M, Lehotay S J, Stajnbaher D, et al. Fast and easy multiresidue method employing acetonitrile extraction/partitioning and "dispersive solid-phase extraction" for the determination of pesticide residues in produce[J]. Journal of AOAC International, 2003, 86(2): 412-431. |
| [8] |
Anastassiades M, Mastovská K, Lehotay S J. Evaluation of analyte protectants to improve gas chromatographic analysis of pesticides[J]. Journal of Chromatography A, 2003, 1015(1): 163-184. |
| [9] |
贺泽英, 刘潇威. 农产品中农药残留分析技术研究进展[J]. 农业资源与环境学报, 2016, 33(4): 310-319. HE Ze-ying, LIU Xiao-wei. Research progress on pesticide residue analysis techniques in agro-products[J]. Journal of Agricultural Resources and Environment, 2016, 33(4): 310-319. |
| [10] |
Zhang K, Wong J W, Yang P, et al. Multiresidue pesticide analysis of agricultural commodities using acetonitrile salt-out extraction, dispersive solid-phase sample clean-up, and high-performance liquid chromatography-tandem mass spectrometry[J]. Journal of Agricultural & Food Chemistry, 2011, 59(14): 7636-7646. |
| [11] |
Walorczyk S, Drożdżyński D. Improvement and extension to new analytes of a multi-residue method for the determination of pesticides in cereals and dry animal feed using gas chromatography-tandem quadrupole mass spectrometry revisited[J]. Journal of Chromatography A, 2012, 1251(2): 219-231. |
| [12] |
Lehotay S J, Kyungae S, Hyeyoung K, et al. Comparison of QuEChERS sample preparation methods for the analysis of pesticide residues in fruits and vegetables[J]. Journal of Chromatography A, 2010, 1217(16): 2548-2560. DOI:10.1016/j.chroma.2010.01.044 |
| [13] |
刘满满, 康澍, 姚成. QuEChERS方法在农药多残留检测中的应用研究进展[J]. 农药学学报, 2013, 15(1): 8-22. LIU Man-man, KANG Shu, YAO Cheng. Research progress of QuEChERS method in pesticide mult-residue analysis[J]. Chinese Journal of Pesticide Science, 2013, 15(1): 8-22. |
| [14] |
He Z Y, Chen S S, Wang L, et al. Multiresidue analysis of 213 pesticides in leek and garlic using QuEChERS-based method and gas chromatography-triple quadrupole mass spectrometry[J]. Analytical & Bioanalytical Chemistry, 2015, 407(9): 2637-2643. |
| [15] |
Rajski Ç, Lozano A, Uclés A, et al. Determination of pesticide residues in high oil vegetal commodities by using various multi-residue methods and clean-ups followed by liquid chromatography tandem mass spectrometry[J]. Journal of Chromatography A, 2013, 1304(16): 109-120. |
| [16] |
He Z Y, Wang L, Peng Y, et al. Multiresidue analysis of over 200 pesticides in cereals using a QuEChERS and gas chromatography-tandem mass spectrometry-based method[J]. Food Chemistry, 2015, 169: 372-380. DOI:10.1016/j.foodchem.2014.07.102 |
 2018, Vol. 37
2018, Vol. 37