文章信息
- 林欣, 王立立, 杨平, 李取生, 徐智敏, 魏佳, 周婷
- LIN Xin, WANG Li-li, YANG Ping, LI Qu-sheng, XU Zhi-min, WEI Jia, ZHOU Ting
- 一株溶磷菌对盐地碱蓬修复盐渍土Cd污染的促进效应
- The promoting effect of phosphorus-solubilizing bacteria on remediation of cadmium-contaminated saline soil by Suaeda salsa
- 农业环境科学学报, 2018, 37(5): 883-891
- Journal of Agro-Environment Science, 2018, 37(5): 883-891
- http://dx.doi.org/10.11654/jaes.2018-0087
文章历史
- 收稿日期: 2018-01-15
- 录用日期: 2018-03-21
2. 暨南大学生命科学技术学院, 广州 510632
2. School of Life Science and Technology, Jinan University, Guangzhou 510632, China
随着灌溉盐渍化、干旱盐渍化、城市盐渍化,以及咸水入侵等多种自然或人为的影响,全球受盐渍化影响的土壤已达8.31亿hm2[1-2]。由于施肥不当、污水灌溉、大气Cd沉降等原因,许多盐渍地又受到Cd污染[3-5]。植物修复具有成本低和环境友好等诸多优点,关于利用植物修复Cd污染土壤的应用研究卓有成效[6],而对于受Cd污染的盐渍土壤,如果采用多为非盐生植物的Cd超富集植物,将导致修复过程中修复植物受到盐分胁迫[7],使修复效率降低。盐地碱蓬是一种对盐渍土壤环境有较强适应性的盐生植物,同时其对Cd具有耐受性和富集能力[8],可实现盐分和Cd同步提取,对修复Cd污染的盐渍地具有很大的潜力。
盐渍土的特点之一就是土壤有效磷含量低[9],而根际促生溶磷菌一方面可通过将土壤中难溶态磷转换为植物可直接吸收利用的有效磷[10],缓解因土壤缺磷而制约修复植物生长这一难题,另一方面其可分泌许多物质,其中的维生素、生长素和抗生素等也可直接或间接促进植物生长,同时其分泌的有机酸、表面活性剂、铁载体等物质可活化土壤重金属[11-13],所以通过建立溶磷菌-盐地碱蓬共生体系可从增加修复植物生物量和土壤溶液中离子态Cd浓度两方面来强化植物修复。近些年不少有关溶磷菌-植物联合修复的技术已运用于实际修复工程[14],但将这类技术用于受Cd污染的盐渍土壤的报道却鲜见,因为盐渍土壤环境对微生物生长有着极大的影响,在盐分胁迫下有的根际微生物会死亡、微生物量降低以及种类减少,但也有的微生物具有很强的环境适应能力[15-16],所以本研究试图筛选出在盐渍环境下仍能正常繁殖的溶磷菌,使其与修复植物形成共生关系,促进植物生长且提高植物修复效率。
本研究收集盐地碱蓬根系分泌物作为筛选溶磷菌实验中的唯一碳源,模拟土培盐地碱蓬根际营养环境,挑选出生长最好的菌株先进行耐盐性实验,以期微生物接种到盐渍土壤后在盐分胁迫下仍能利用盐地碱蓬根系分泌物为碳源生长繁殖,最终自然定殖于其根际,发挥其溶磷和活化Cd的作用。然后利用盆栽实验进一步研究溶磷菌-盐地碱蓬对Cd污染盐渍土的联合修复效应。为未来修复受Cd污染的盐渍地提供科学参考。
1 实验材料与方法 1.1 根系分泌物收集及定性盐地碱蓬(Suaeda salsa)种子(来源于中国科学院新疆生态与地理研究所)用石英砂育苗一个月后,将幼苗移至1/4霍格兰营养液中曝气水培,定期更换营养液时逐渐添加NaCl至2%。一个月后,用去离子水和无菌水洗净根部并放入无菌水中,在曝气光照的条件下水培6 h[17-18],将水溶液过0.22 μm滤膜,先后置于-80 ℃冰箱和冷冻干燥机中冷冻干燥至0.3 L,用GC-MS(SHIMADZU AOC-20i)外标法对根系分泌物进行定性和定量[19]。
1.2 溶磷菌的筛选和耐盐实验供试的5株溶磷菌均来源于中国工业菌种保藏中心(CICC),分别是:不动杆菌(Acinetobacter,编号CICC10526)、大肠埃希菌(Escherichia,编号CICC 10527)、阴沟肠杆菌(Enterobacter,编号CICC10528)、绿针假单胞菌(Pseudomonas chlororaphis,编号CICC 21461),蜡状芽孢杆菌(Bacillus cereus,编号CICC 23701)。所需培养基:(1)富集培养基(牛肉膏蛋白胨培养基):将10 g细菌学蛋白胨、3 g牛肉膏、5 g NaCl溶于1 L水中,pH调节至7.0~7.5之间,灭菌备用。(2)根系分泌物培养基:向1 L去除葡萄糖和Ca3(PO4)2的蒙金娜液体培养基[20]添加0.256 2 g CaCl2、0.920 6 g KH2PO4,pH调节至7.0~7.5之间,灭菌后按体积比1:1加入上述收集到的根系分泌物中(培养基的碳源浓度为0.085 g·L-1),混匀备用。(3)无机磷功能培养基:将去除Ca3(PO4)2的蒙金娜液体培养基中的葡萄糖改为1 g,量取0.1 L上述溶液于装有0.066 8 g Ca3(PO4)2和0.006 0 g CdCO3的锥形瓶中,pH调节至7.0~7.5之间,灭菌备用。
用牛肉膏蛋白胨培养基将5株菌于150 r·min-1、28 ℃的恒温振荡培养箱中富集后,取菌液用高速冷冻离心机于4000 r·min-1的条件下离心10 min,弃去上层清液,加入等体积无菌水,混匀,重复3次得重悬菌液。向装有10 mL根系分泌物培养基的试管中加入0.2 mL菌悬液,加塞后放于与上述条件相同的培养箱中,每隔4 h取出一根试管用紫外分光光度计在600 nm条件下测定菌液OD值(以无菌水调零),取样测定至40 h,绘制生长曲线。用葡萄糖含量为1 g·L-1的蒙金娜液体培养基分别培养5株溶磷菌,7 d后测定溶磷与活化Cd量。依据生长曲线与溶磷、活化Cd量挑选出最优后续供试菌株。
按上述方法将挑选出的菌株富集,分别向装有100 mL的3个NaCl浓度(0.3、6、12 g·L-1)的无机磷功能培养基中加入2 mL菌悬液,每个NaCl浓度均设置不加菌的空白对照,每个处理4个重复,放于与上述条件相同的培养箱中,7 d后取出菌液用高速冷冻离心机于4000 r·min-1的条件下离心10 min,取上层清液过0.22 μm滤膜,用钼锑抗比色法[21]测定水溶性磷浓度,石墨炉原子吸收分光光度计(PE 900T)测Cd浓度,GC-MS分析[19]菌液代谢物。
1.3 盆栽实验将采集的污灌菜园土(pH为6.28,Cd平均总含量为1.37 mg·kg-1,DTPA提取态Cd含量为0.57 mg·kg-1)晒干过筛,根据土壤干重质量和所需盐分含量,将固体NaCl溶于去离子水后倒入土壤中拌匀,晒干,过筛。将育苗一个月后的盐地碱蓬幼苗以3棵·盆-1移栽至装有500 g土壤的花盆中,待植株成活后接菌,在3个盐分梯度(0、4、8 g·kg-1)下分别设计接菌、不接菌处理,每个处理3个重复。接菌方式为:将挑选出的菌株制得的重悬菌液,以10 mL·棵-1的量用移液枪打入根部土壤中,不接菌处理以相同方式加入等体积无菌水,每10 d接菌一次并定期浇水,待生长至60 d收获植株。收获的植株用自来水和去离子水洗净,置于烘箱中于75 ℃烘至恒重。称取0.3 g粉碎后的干样,加8 mL HNO3(质量分数为68%),用微波消解仪(CEM MARS6)消解,同时收集湿润的附着于根际的土壤在转速为6000 r·min-1的高速离心机中离心,取离心液过滤后用于测定根际溶液Cd含量[22],用石墨炉原子吸收分光光度计测定土壤根际溶液和植物消解样中Cd含量。
1.4 数据处理采用植物生物量、根和茎叶Cd含量作为植物对Cd污染盐渍地修复的分析指标。采用Microsoft Excel 2014和IBM SPSS statistics 19.0进行数据整理和分析,采用Origin 9绘图。
总活化量(μg·盆-1)=植物中Cd含量(μg·盆-1)+根际溶液Cd含量(μg·盆-1)
富集系数=植物地上部Cd含量(mg·kg-1)/土壤中对应形态Cd含量(mg·kg-1)
转运系数=地上部Cd含量(mg·kg-1)/根部Cd含量(mg·kg-1)
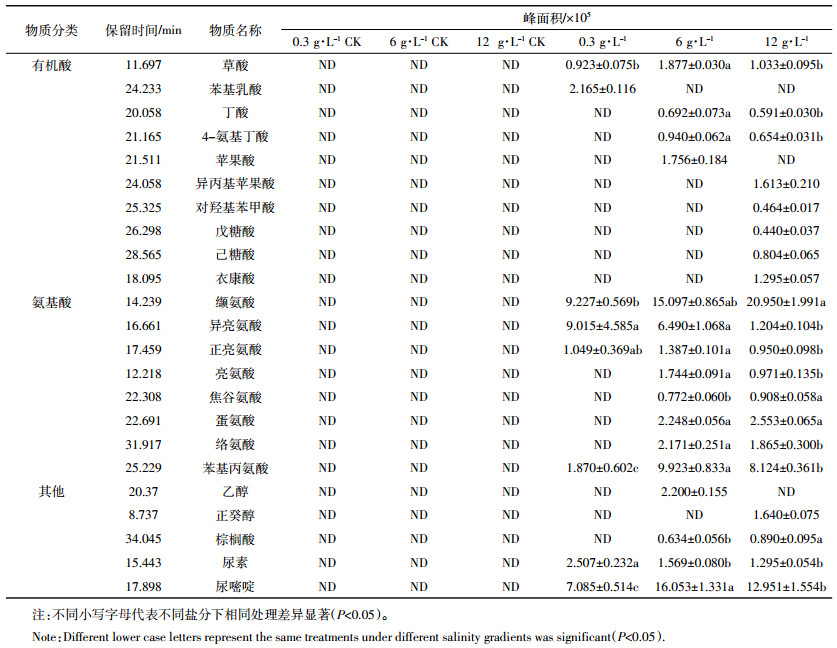
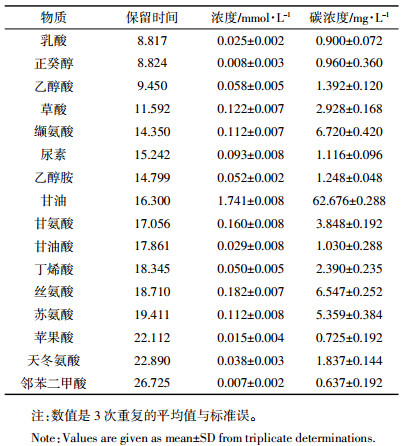
2 实验结果 2.1 盐分处理下盐地碱蓬的根系分泌物GC-MS分析盐地碱蓬根系分泌物中检测出的有机物种类和含量如表 1所示,16种物质中,甘油的浓度最高,为1.741 mmol·L-1,是其余物质的9~262倍,浓度最低的物质为邻苯二甲酸,为0.007 mmol·L-1。
|
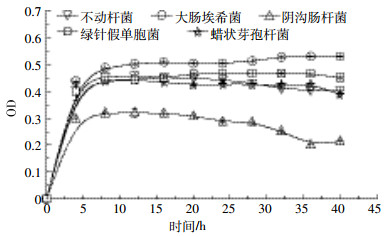
如图 1所示,5株菌都能在以盐地碱蓬根系分泌物为唯一碳源的培养基中生长,且均在10 h附近达到稳定期。大肠埃希菌稳定期的OD值最大,为0.53。阴沟肠杆菌稳定期的OD值最小,为0.32。大肠埃希菌、不动杆菌、绿针假单胞菌和蜡状芽孢杆菌生长曲线较为接近,但不动杆菌和阴沟肠杆菌的生长曲线在28 h后有下降趋势。如表 2所示,绿针假单胞菌和蜡状芽孢杆菌溶磷与活化Cd的能力显著低于其余菌株,加之大肠埃希菌溶磷和活化Cd的能力较其余菌表现出显著优势,综上所述,选择大肠埃希菌为后续供试菌株。
|
| 数值是3次重复的平均值与标准误 Values are given as mean±SD from triplicate determinations 图 1 5株溶磷菌在根系分泌物培养基中的生长曲线 Figure 1 The growth curve of five phosphate-solubilizing bacteria in culture solution with root exudates of Suaeda salsa |
|
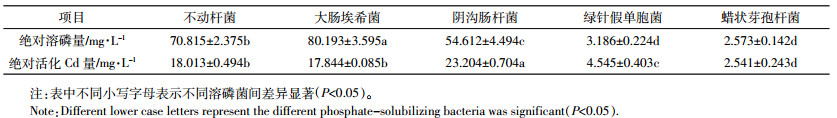
将大肠埃希菌做耐盐摇瓶实验,实验结果如图 2所示,随盐分的增加,接菌较不接菌处理下溶磷和活化Cd量均显著增加(P < 0.05),其中两个处理间溶磷量相差2.0~2.4倍,活化Cd量相差4.5~12倍。从低到高的3个盐分处理平均溶磷能力绝对值(扣除不接菌对照值)分别为80.19、78.79、77.54 mg·L-1,平均绝对活化Cd量依次为17.84、17.30、19.73 mg·L-1。综上所述,盐分不会阻碍本实验菌株的溶磷和活化Cd能力。

|
| 不同大写字母代表相同盐分下不同处理差异显著,不同小写字母代表不同盐分下相同处理差异显著(P < 0.05) Different capital letters represent the different treatments under same salinity gradients was significant, different lower case letters represent the same treatments under different salinity gradients was significant (P < 0.05) 图 2 大肠埃希菌的耐盐实验结果 Figure 2 Salinity tolerant of Escherichia |
不同盐分处理下大肠埃希菌的代谢物存在明显的差异,如表 3所示,丁酸、4-氨基丁酸、亮氨酸、焦谷氨酸、蛋氨酸、络氨酸、棕榈酸在0.3 g·L-1盐分处理下未被检测到,而在6、12 g·L-1盐分处理下均被检测到。正癸醇、衣康酸、己糖酸、戊糖酸、对羟基苯甲酸、异丙基苹果酸只在12 g·L-1盐分处理下被检测到。在0.3、6、12 g·L-1盐分处理下,大肠埃希菌分泌的有机酸分别为2、4、8种,分泌的氨基酸分别为4、8、8种,统计分泌的有机物分别为7、15、19种。
如图 3所示,总体而言,盐分含量与盐地碱蓬生物量呈正相关,一定盐分有利于其生长,这与前期研究结果一致。在接菌、不接菌处理中,3个盐分条件下植物的生物量均存在显著差异(P < 0.05),其中4 g·kg-1盐分条件下接菌处理的生物量最大。在0、4 g·kg-1盐分条件下,接菌显著促进了植物生长(P < 0.05),其地上部生物量分别是不接菌的1.36倍和1.30倍,而8 g·kg-1盐分条件下,接菌处理的生物量较不接菌处理显著减少22%(P < 0.05)。
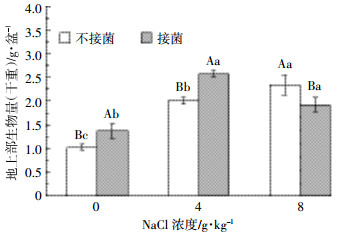
|
| 图 3 不同大写字母代表相同盐分下不同处理差异显著,不同小写字母代表不同盐分下相同处理差异显著(P < 0.05)。下同 Figure 3 Different capital letters represent the different treatments under same salinity gradients was significant, different lower case letters represent the same treatments under different salinity gradients was significant (P < 0.05). The same below |
如图 4所示,随盐分浓度的增加,不接菌条件下根际溶液Cd含量显著增加(P < 0.05)。3个盐分条件下,接菌均增加了土壤溶液中Cd含量,但只有4 g·kg-1盐分条件下,接菌与不接菌处理间存在显著差异(P < 0.05)。在所有处理中,4 g·kg-1盐分条件下接菌处理的根际溶液中Cd含量最高,是其余处理的1.41~194倍。

|
| 图 4 不同处理下盐地碱蓬根际溶液Cd含量 Figure 4 he Cd concentration in rhizosphere soil solution of Suaeda salsa under different treatments |
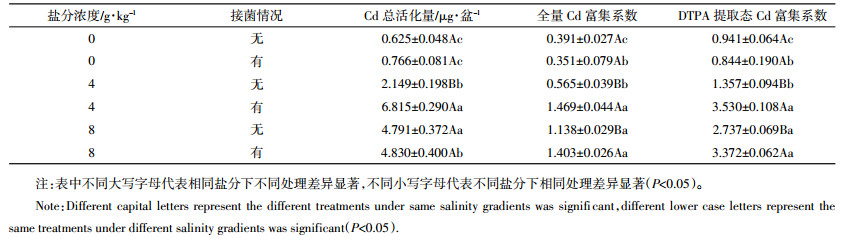
如表 4所示,接菌、不接菌处理中,根部Cd为4、8 g·kg-1盐分处理比无盐分处理显著增加(P < 0.05,图 5)。3个盐分条件下,接菌与不接菌处理间根部Cd含量无显著差异。不接菌处理中,3个盐分条件下茎叶Cd含量均有显著差异(P < 0.05),4、8 g·kg-1盐分条件下,接菌处理的茎叶Cd含量显著高于不接菌处理(P < 0.05)。4 g·kg-1盐分条件下接菌处理的根、茎叶Cd含量均为所有处理中最高,分别是其余处理的1.02~4倍和1.01~4.18倍。
|

|
| 图 5 不同处理下植物中 Cd 含量 Figure 5 The Cd concentration in Suaeda salsa under different treatments |
综上,植物体内Cd的分布差异表明Cd的吸收在不同处理间存在差异。如表 4所示,盐分促进了植物对Cd的富集,但在相同盐分条件下,接菌处理也同样促进了Cd富集。4 g·kg-1盐分条件下,接菌处理的全量Cd富集系数最大,且与不接菌的处理间存在显著差异(P < 0.05)。Cd在土壤中的生物毒性不仅与其总量有关,在很大程度上是取决于它们在土壤中的化学形态,尤其是生物有效态,实验研究了DTPA提取态Cd的富集系数,发现其均比全量Cd的富集系数高,但二者在不同处理间表现出相同的规律。4、8 g·kg-1盐分条件下,接菌处理显著提高了Cd转运系数(P < 0.05)。4、8 g·kg-1盐分条件接菌处理下Cd总活化量、全量Cd富集系数和DTPA提取态Cd富集系数均较不接菌处理高,且在所有处理中4 g·kg-1盐分条件下接菌处理的各项指标均为最高,盐分显著促进了土壤Cd的活化(P < 0.05),促进了植物对Cd的吸收累积。
3 讨论溶磷菌自然定殖于盐地碱蓬根际土壤是其促进修复Cd污染盐渍地的保障。一方面,本论文模拟盐地碱蓬根际营养环境,将5株溶磷菌在相同浓度盐地碱蓬根系分泌物为唯一碳源的培养基中培养,所供试的5株溶磷菌均能生长但呈现出不同生长趋势。出现此结果的原因可能是因为实验收集的盐地碱蓬根系分泌物中7种有机酸均属于短链低分子有机酸,容易透过细菌较薄的细胞壁和细胞膜,作为能源物质被细菌利用[23],且16种物质都含有亲水基团,不会与细胞壁结合和干扰细胞膜的通透性[24],其次,本实验所用的盐地碱蓬根系分泌物中以甘油的量最多,且远超其余物质。甘油作为一种微生物可利用的碳源[25],可合成脂肪酸,也可以进入戊糖-磷酸途径(HMP)而后进入三羧酸循环(TCA),产生能量和有用的代谢产物供给细菌生长繁殖。许多生物代谢工程研究中发现大肠埃希菌能利用甘油比较好地生长[26-27],这与本实验用甘油含量最多的盐地碱蓬根系分泌物筛选出大肠埃希菌的结果一致。另一方面,结合5株溶磷菌的溶磷和活化Cd的能力,筛选出既能利用盐地碱蓬生长较好,又具备较好溶磷和活化Cd能力的大肠埃希菌。
大肠埃希菌在3个盐分处理下(0.3、6、12 g·L-1)的溶磷和活化Cd结果显示,随盐分的增加,菌株平均绝对溶磷率依次为(扣除不接菌对照值)60.7%、60.9%、58.5%,呈先增后减的趋势,说明大肠埃希菌具有一定的耐盐性,但高浓度的盐分可能抑制细菌正常生长。因为太低的NaCl浓度可能不能满足溶磷菌对Na+的吸收,而NaCl浓度过高则会增加培养液的渗透势,从而破坏微生物细胞结构[28]。黄明达等[29]在对溶磷菌条件的优化实验中发现碳源、氮源的类型和浓度固定时,增加NaCl浓度,细菌的溶磷能力出现先增加后下降的趋势。实验中还发现,随着盐分浓度的增加,大肠埃希菌代谢产物从浓度和种类上均发生了显著变化。在6、12 g·L-1盐分胁迫下,细菌代谢氨基酸的种类均是0.3 g·L-1盐分胁迫下的2倍,其中缬氨酸和苯基丙氨酸的量随盐分增加而显著增加(P < 0.05),异亮氨酸则呈现相反的趋势。有研究表明当受到盐分胁迫时,细胞可通过诱导信号分子分泌氨基酸代谢物,增加细胞膜不饱和脂肪酸与饱和脂肪酸的比例而改变细胞膜的通透性,以此来应对NaCl胁迫后的渗透压[30]。因此,大肠埃希菌可能通过调节自身代谢途径增强氨基酸代谢通路,适应盐分胁迫环境。在6、12 g·L-1盐分胁迫下,大肠埃希菌代谢有机酸的种类分别是0.3 g·L-1盐分胁迫下的2、4倍,随盐分增强的有机酸代谢通路可能是其对盐分胁迫环境的反馈,可能因为乳酸在细胞抗高渗胁迫过程中起重要作用[31],所以随盐分的增加,较快的乳酸合成和消耗速率导致乳酸代谢途径增强,乳酸合成代谢过程中产生了更多种类的有机酸。此外,在接菌处理间碳酸镉的溶解量随盐分的增加显著增加(P < 0.05),可能是由于细菌随盐分胁迫增强而显著增加的氨基酸和有机酸增强了碳酸镉的活化。有研究表明氨基酸中天冬氨酸、组氨酸、谷氨酸对碳酸镉具有较强的活化能力[32]。虽然随着盐分的增加,接菌与不接菌的溶Cd量均显著增加(P < 0.05),但在相同的盐分处理下,接菌的处理溶Cd量依然显著高于(P < 0.05)不接菌的处理。说明在盐分胁迫下,该溶磷菌株仍能正常发挥活化Cd的作用。对挑选出的大肠埃希菌进行耐盐实验,实验结果证明其具有一定的耐盐性,可以推测接种到盐渍地的大肠埃希菌能适应盐分胁迫环境,进一步保障其能自然定殖于生长在盐渍土壤中的盐地碱蓬根际。
在将菌株接于盐地碱蓬根际的盆栽实验中,0、4 g·kg-1盐分条件下,接菌处理的生物量较不接菌处理的生物量显著增大(P < 0.05),可能接种到根际的菌株在一定程度通过溶磷或分泌生长激素等促进植物生长。根际溶液Cd活化量的增加是土培盆栽实验中盐地碱蓬Cd累积显著增加的重要原因,4 g·kg-1盐分条件下接菌处理的根际溶液Cd含量显著高于(P < 0.05)其余处理,此外8 g·kg-1盐分条件下接菌处理的生物量和根际Cd含量均没达到预期的显著效果,推测原因可能是因为土壤高浓度的盐分一方面导致土壤板结不利于植物根系生长和吸收养分,另一方面导致土壤微生物群落发生改变不利于大肠埃希菌定殖生长[33]。4、8 g·kg-1盐分条件下接菌处理的Cd总活化量、全量Cd富集系数和DTPA态Cd富集系数比不接菌处理显著增加(P < 0.05),其中4 g·kg-1盐分条件下接菌处理的Cd总活化量显著高于8 g·kg-1盐分条件下接菌处理(P < 0.05)。总体看来,即使在盐分的胁迫下具有耐盐性能的大肠埃希菌也可以在盐地碱蓬根际定殖,并通过溶磷和活化Cd的功能提高盐地碱蓬对受Cd污染盐渍土的修复效率,其中在4 g·kg-1盐分条件下效果最显著。
4 结论(1)大肠埃希菌可利用盐地碱蓬根系分泌物作为唯一碳源正常生长繁殖。
(2)大肠埃希菌具有一定的耐盐性,在盐分胁迫下仍能发挥溶磷、活化Cd的功能。
(3)大肠埃希菌可促进盐地碱蓬的生长并增强其对土壤中Cd的富集。
| [1] |
王佳丽, 黄贤金, 钟太洋, 等. 盐碱地可持续利用研究综述[J]. 地理学报, 2011, 66(5): 673-684. WANG Jia-li, HUANG Xian-jin, ZHONG Tai-yang, et al. Review on sustainable utilization of salt-affected land[J]. Acta Geographica Sinica, 2011, 66(5): 673-684. DOI:10.11821/xb201105010 |
| [2] |
李建国, 濮励杰, 朱明, 等. 土壤盐渍化研究现状及未来研究热点[J]. 地理学报, 2012, 67(9): 1233-1245. LI Jian-guo, PU Li-jie, ZHU Ming, et al. The present situation and hot issues in the salt-affected soil research[J]. Acta Geographica Sinica, 2012, 67(9): 1233-1245. DOI:10.11821/xb201209008 |
| [3] |
Gabrijel O, Davor R, Zed R, et al. Cadmium accumulation by muskmelon under salt stress in contaminated organic soil[J]. Science of the Total Environment, 2009, 407(7): 2175-2182. DOI:10.1016/j.scitotenv.2008.12.032 |
| [4] |
李婧, 周艳文, 陈森, 等. 我国土壤镉污染现状、危害及其治理方法综述[J]. 安徽农业通报, 2015, 21(24): 104-107. LI Jing, ZHOU Yan-wen, CHEN Sen, et al. Actualities, damage and management of soil cadmium pollution in China[J]. Anhui Agri Sci Bull, 2015, 21(24): 104-107. |
| [5] |
Duarte B, Caetano M, Almeida P R, et al. Accumulation and biological cycling of heavy metal in four salt marsh species, from Tagus Estuary(Portugal)[J]. Environmental Pollution, 2010, 158(5): 1661-1668. DOI:10.1016/j.envpol.2009.12.004 |
| [6] |
苏慧, 魏树和, 周启星. 镉污染土壤的植物修复研究进展与展望[J]. 世纪科技研究与发展, 2013, 35(3): 315-319. SU Hui, WEI Shu-he, ZHOU Qi-xing. Advances in phytoremediation of cadmium contaminated soil[J]. World Sci-Tech R&D, 2013, 35(3): 315-319. |
| [7] |
吴旭红, 高玉芝, 常志敏. 盐胁迫对作物形态和生理过程的影响[J]. 高师理科学刊, 2002, 22(4): 51-53. WU Xu-hong, GAO Yu-zhi, CHANG Zhi-min. Effect of the salt content coercive on morphological and physiological process of crops[J]. Journal of Science of Teachers College University, 2002, 22(4): 51-53. |
| [8] |
陈柯罕, 张科, 李取生, 等. 四种盐生植物对Cd Pb复合污染提取修复效果比较研究[J]. 农业环境科学学报, 2017, 36(3): 458-465. CHEN Ke-han, ZHANG Ke, LI Qu-sheng, et al. Remediation effects of four halophytes on Cd and Pb compound pollution[J]. Journal of Agro-Environment Science, 2017, 36(3): 458-465. DOI:10.11654/jaes.2016-1252 |
| [9] |
郝晋珉, 魏小静, 牛灵安. 盐渍土利用过程中土壤磷素的积累与应用[J]. 中国农业大学学报, 1997, 2(3): 69-72. HAO Jin-min, WEI Xiao-jing, NIU Ling-an. Accumulation and crop recovery of soil phosphorus in the use of salt-affected soil[J]. Journal of China Agricultural University, 1997, 2(3): 69-72. |
| [10] |
席琳乔, 冯瑞章. 植物根际解磷菌的研究进展[J]. 塔里木大学学报, 2006, 18(4): 57-61. XI Lin-qiao, FENG Rui-zhang. Research of plant phosphate-solubilizing microorganisms[J]. Journal of Tarim University, 2006, 18(4): 57-61. |
| [11] |
Sheng X F, He L Y, Wang Q Y, et al. Effects of inoculation of biosurfactant-producing Bacillus sp. J119 on plant growth and cadmium uptake in a cadmium-amended soil[J]. Journal of Hazardous Materials, 2008, 155(1/2): 17-22. |
| [12] |
Dimkpa C O, Merten D, SvatošA, et al. Metal-induced oxidative stress impacting plant growth in contaminated soil is alleviated by microbial siderophores[J]. Soil Biology and Biochemistry, 2009, 41(1): 154-162. DOI:10.1016/j.soilbio.2008.10.010 |
| [13] |
Li W C, Ye Z H, Wong M H. Metal mobilization and production of short-chain organic acids by rhizosphere bacteria associated with a Cd/Zn hyperaccumulating plant, Sedum alfredii[J]. Plant and Soil, 2010, 326(1/2): 453-467. |
| [14] |
马莹, 骆永明, 滕应, 等. 根际促生菌及其在污染土壤植物修复中的应用[J]. 土壤学报, 2013, 50(5): 1021-1031. MA Ying, LUO Yong-ming, TENG Ying, et al. Plant growth promoting rhizobacteria and their role in phytoremediation of heavy metal contaminated soil[J]. Acta Pedologica Sinica, 2013, 50(5): 1021-1031. |
| [15] |
Tripathi S, Kumari S, Chakraborty A, et al. Microbial biomass and its activities in salt-affected coastal soils[J]. Biology and Fertility of Soils, 2006, 42(3): 273-277. DOI:10.1007/s00374-005-0037-6 |
| [16] |
Chowdhury N, Marschner P, Burns R G. Soil microbial activity and community composition:Impact of changes in matric and osmotic potential[J]. Soil Biology and Biochemistry, 2011, 43(6): 1229-1236. DOI:10.1016/j.soilbio.2011.02.012 |
| [17] |
Luo C L, Shen Z G, Li X D. Root exudates increase metal accumulation in mixed cultures:Implications for naturally enhanced phytoextraction[J]. Water Air Soil Pollute, 2008, 193: 147-154. DOI:10.1007/s11270-008-9678-z |
| [18] |
Mike F Q, Barbara I, Cristina G, et al. Naturally-assisted metal phytoextraction by Brassica carinata:Role of root exudates[J]. Environmental Pollution, 2009, 157(10): 2697-2703. DOI:10.1016/j.envpol.2009.04.035 |
| [19] |
郭世鸿. 盐分胁迫对苋菜(Amaranthus mangostanus L. )活化和吸收土壤重金属Cd的影响机制[D]. 广州: 暨南大学, 2017. GUO Shi-hong. Effect of salt stress on soil Cd mobility and Cd uptake by edible amaranth(Amaranthus mangostanus L. ) cultivar[D]. Guangzhou: Jinan University, 2017. |
| [20] |
冯哲叶, 陈莎莎, 王文超, 等. 几株溶磷细菌的筛选和鉴定及其溶磷效果[J]. 南京农业大学学报, 2017, 40(5): 842-849. FENG Zhe-ye, CHEN Sha-sha, WANG Wen-chao, et al. Screening and identification of several phosphate-solubilizing bacteria and effect of their P-solubility[J]. Journal of Nanjing Agricultural University, 2017, 40(5): 842-849. DOI:10.7685/jnau.201612008 |
| [21] |
Ribeiro C M, Cardoso E J B N. Isolation, and characterization of root-associated growth promoting bacteria in Brazil Pine(Araucaria angustifolia)[J]. Microbiological Research, 2012, 167(2): 69-78. DOI:10.1016/j.micres.2011.03.003 |
| [22] |
Xu Z M, Li Q S, Yang P, et al. Impact of osmoregulation on the differences in Cd accumulation between two contrasting edibleamaranth cultivars grown on Cd-polluted saline soils[J]. Environmental Pollution, 2017, 224: 89-97. DOI:10.1016/j.envpol.2016.12.067 |
| [23] |
Bowere J H, Nameth S T, Riedel R M, et al. Infection and colonization of potato roots by Verticillium dahliae as affected by pratylenchus penetrans and P-crenatus[J]. Phytopathology, 1996, 86(6): 614-621. DOI:10.1094/Phyto-86-614 |
| [24] |
谈家金, 冯志新. 苯甲酸和苯乙酸对松材线虫和细菌活性的影响[J]. 南京林业大学学报(自然科学版), 2003, 27(6): 59-62. TAN Jia-jin, FENG Zhi-xin. Activity determination of benzoic acid and phenelycetic acid against Bursaphelenchus xylophilus and bacteria[J]. Journal of Nanjing Forestry University(Natural Science Edition), 2003, 27(6): 59-62. |
| [25] |
Yeounjoo K, Eunhee S, Balaji S S, et al. Metabolic engineering of Kelebsiella pneumoniae J2B for co-production of 3-hydroxypropionic acid and 1, 3-propanediol from glycerol:Reduction of acetate and other byproducts[J]. Bioresource Technology, 2017, 244: 1096-1103. DOI:10.1016/j.biortech.2017.08.099 |
| [26] |
Bryson D B, Elizabeth H K Melissa G, et al. Absolute metabolite concentrations and implied enzyme active site occupancy in Escherichia coli[J]. Nature Chemical Biology, 2009, 5(8): 593-599. DOI:10.1038/nchembio.186 |
| [27] |
Takuya M, Tsutomu T, Akihiko K. Engineering metabolic pathways in Escherichia coli for constructing a "microbial chassis" for biochemical production[J]. Bioresource Technology, 2017, 245: 1362-1368. DOI:10.1016/j.biortech.2017.05.008 |
| [28] |
冯瑞章, 姚拓, 周万海, 等. 不同生长环境和磷酸盐对4株溶磷菌溶磷能力影响[J]. 应用与环境生物学报, 2009, 15(6): 856-860. FENG Rui-zhang, YAO tuo, ZHOU Wan-hai, et al. Effects of different habitats and insoluble phosphates on phosphate solubilizing activity of four phosphate solubilizing bacteria[J]. Chin J Appl Environ Biol, 2009, 15(6): 856-860. |
| [29] |
黄达明, 李倩, 管国强, 等. 一株解磷细菌的筛选、鉴定及其溶磷培养条件的优化[J]. 生物技术报, 2015, 31(2): 173-178. HUANG Da-ming, LI Qian, GUAN Guo-qiang, et al. Selection, identification and medium optimization of a phosphate-solubilizing bacterium[J]. Biotechnology Bulletin, 2015, 31(2): 173-178. |
| [30] |
He G Q, Wu C D, Huang J, et al. Metabolic response of Tetragenococcus halophilus under salt stress[J]. Biotechnology and Bioprocess Engineering, 2017, 22(4): 366-375. DOI:10.1007/s12257-017-0015-5 |
| [31] |
刘阳, 邓静, 吴华昌, 等. 盐分胁迫对枯草芽孢杆菌发酵代谢产物的影响[J]. 食品与发酵工业, 2015, 41(7): 29-33. LIU Yang, DENG Jing, WU Hua-chang, et al. Influence of salt stress on metabolite of Bacillus subtilis[J]. Food and Fermentation Engineering, 2015, 41(7): 29-33. |
| [32] |
魏佳, 李取生, 徐智敏, 等. 多种有机酸对土壤中碳酸镉的活化效应[J]. 环境工程学报, 2017, 11(9): 5298-5306. WEI Jia, LI Qu-sheng, XU Zhi-min, et al. Mobilization effects of various organic acid on cadmium carbonate in soil[J]. Chinese Journal of Environmental Engineering, 2017, 11(9): 5298-5306. DOI:10.12030/j.cjee.201612218 |
| [33] |
周德平, 吴淑杭, 褚长彬, 等. 盐胁迫对蔬菜地土壤微生物及土壤酶活的毒害效应[J]. 农业环境科学学报, 2011, 30(8): 1602-1607. ZHOU De-ping, WU Shu-hang, CHU Chang-bin, et al. Eco-toxicological effect of salt stress on microorganisms and enzymes activities in vegetable soil[J]. Journal of Agro-Environment Science, 2011, 30(8): 1602-1607. |
 2018, Vol. 37
2018, Vol. 37