文章信息
- 舒昆慧, 张丽, 伍玲丽, 司友斌, 刘沁雪
- SHU Kun-hui, ZHANG Li, WU Ling-li, SI You-bin, LIU Qin-xue
- 纳米银对四种不同性质土壤微生物量及酶活性的影响
- Effects of silver nanoparticles on microbial communities and enzyme activity in four soils
- 农业环境科学学报, 2018, 37(5): 907-914
- Journal of Agro-Environment Science, 2018, 37(5): 907-914
- http://dx.doi.org/10.11654/jaes.2017-1325
文章历史
- 收稿日期: 2017-09-26
- 录用日期: 2017-12-14
银纳米粒子(AgNPs)是经济合作与发展组织(OECD)列出的需要优先进行安全性研究的纳米材料之一[1],因其独特的广谱抗菌性被广泛应用于生产生活中。随着含纳米银产品消费量的增加,空气、水、土壤及生物体暴露于纳米银环境的几率增加[2]。调查显示,2010年全球所生产的26万~30.9万t纳米材料有63%~91%以垃圾填埋的方式处理,剩余的排入土壤(8%~28%)、水体(0.4%~7%)和大气(0.1%~1.5%)[3]。模型预测纳米银在土壤和污泥中的浓度分别为0.02、4.4 mg·kg-1 [4-5],而美国环境保护署(EPA)在污泥中测得的银离子浓度范围为2~195 mg·kg-1,平均值为(20±22)mg·kg-1 [6]。活性污泥在被用于农田肥料、固废填埋或在废物处理厂进行焚烧的过程中会导致纳米银进入陆生系统,同时通过雨水淋洗进入下层土壤或者地下水中[7]。水生生物可能因废水中出现纳米银颗粒受到伤害[8],纳米银也会通过污泥农用影响土壤环境[9]。
最近的研究表明纳米颗粒在土壤中的积累可能影响微生物的活性和多样性。比如纳米氧化锌(ZnO)具有破坏土壤中常见细菌铜绿假单胞菌的能力[10];含Ag 140 μg·kg-1修饰的有机污泥能使土壤中柔枝莠竹(Microstegium vimeneum)的生物量降低32%[11];浓度为32 μg·kg-1和320 μg·kg-1的纳米银显著降低土壤中微生物的生物量[12]。目前,人们对纳米银的研究主要集中在微生物毒性方面,对纳米银直接作用于土壤环境的研究很少。大多数研究表明纳米银的毒性主要来自于释放的银离子和其自身的特异性效应,如氧化应激和细菌的直接作用[13]等,纳米银的反应性和杀菌性能则取决于其尺寸、形状和形态[14]。银对土壤有机物和硫醇化合物具有高亲和力,可能对土壤微生物产生直接的影响,对富含氨基酸的土壤酶产生间接影响[15]。纳米银对土壤的污染可以通过生物地球化学过程表现出来,包括营养循环和大部分微生物介导的过程。
土壤是一个由矿物、有机颗粒与液相、气相结合组成的复杂多孔体系,土壤环境(包括土壤生物、有机质等)与纳米材料相互作用,改变其表面性质,进而影响纳米材料的反应活性、稳定性、移动性、生物有效性乃至毒性[16-17]。这些复杂的相互作用显著影响了土壤生态系统中纳米材料环境行为与环境效应,增加了纳米材料生态风险评估的不确定性,亟需更深入的研究[18]。
本文通过外源添加纳米银的方式,研究纳米银对不同性质土壤中微生物数量、底物呼吸及不同种类酶活性的影响,并利用统计分析等手段进一步探究土壤特性与纳米银毒性之间的关系,为纳米银的土壤环境影响评价提供参考。
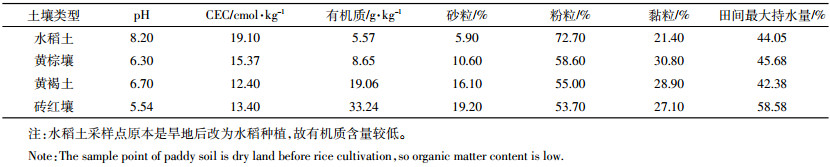
1 材料与方法 1.1 材料 1.1.1 供试材料纳米银粉末,购于南京埃瑞普纳米材料有限公司,纯度≥99%。灰色,平均粒径20~80 nm、比表面积2.5~15 m2·g-1、松装密度0.25~0.6 g·m-3,无包裹,其形态和粒径如图 1所示。
|
| 图 1 纳米银TEM图(A)和粒径分布图(B) Figure 1 TEM image (A)and distribution of particulate sizes (B)of silver nanoparticles |
土壤样品分别采自安徽合肥的水稻土、黄棕壤、黄褐土以及广东肇庆的砖红壤,采样深度为0~20 cm。采集土样后及时拣出可见植物残体、根系及土壤动物,风干后过20目筛,充分混匀装袋,备用,供试土壤基本理化性质见表 1。
根据美国EPA调查推测施用污泥农田土壤纳米银可累积到10 mg·kg-1,据此本试验设计土壤纳米银为低(10 mg·kg-1)、中(50 mg·kg-1)、高(100 mg·kg-1)3种剂量。将土壤样品置于28 ℃恒温恒湿培养箱中培育一周,培养期间称重法调节土壤含水量,使其保持一致。培养结束后,采用干混法将纳米银与少量风干土混合均匀后再加入新鲜过筛土壤,使得土壤中纳米银含量分别为10、50、100 mg·kg-1干土,不加纳米银土壤为对照,每处理3次重复。调节土壤含水量至田间最大持水量60%,置于28 ℃恒温恒湿培养箱中继续培养,按时取样。
1.2.1 土壤可培养微生物数量测定供试土壤培养7 d后,采用系列稀释平板培养法对不同剂量纳米银暴露土壤样品分别进行细菌、真菌、放线菌数量的测定,培养基分别为牛肉膏蛋白胨琼脂培养基、马丁氏培养基及改良高氏一号培养基。
1.2.2 土壤微生物多样性测定称取0.5 g培养7 d含不同剂量纳米银的黄褐土,按照FastDNA SPIN Kit for soil试剂盒进行土壤微生物总DNA的提取,利用通用引物(515F-907R)扩增土壤微生物DNA的16S rRNA基因,采用Illumina MiSeq platform测序平台对V4区进行测序[19-20]。
1.2.3 土壤诱导呼吸测定称取20.0 g(干土)不同剂量纳米银处理7 d的土壤样品,分别放入250 mL锥形瓶中,加入葡萄糖粉剂(6 mg·g-1干土),反应30 min后用密封胶将锥形瓶密封,置于25 ℃培养箱中培养2 h。培养结束后用注射器抽取5 mL气体样品采用气相色谱仪测定CO2含量。土壤诱导呼吸量为单位时间(h)内单位烘干土壤(g)释放的CO2(μL)含量[21]。
1.2.4 土壤酶活性测定供试土壤培养7 d后取样测定土壤脲酶、蔗糖酶、荧光素二乙酸酯酶(FDA酶)、过氧化氢酶活性,测定方法参见《土壤与环境微生物研究法》[21]。土壤脲酶测定采用苯酚钠-次氯酸钠比色法,其活性以每克土壤24 h酶解尿素产生铵态氮(NH4+-N)的毫克数来表示;FDA酶采用比色法测定,其活性以每克土20 min内生成的荧光素表示;蔗糖酶采用二硝基水杨酸比色法测定,其活性以37 ℃下每克土24 h后的葡萄糖量表示;过氧化氢酶采用高锰酸钾滴定法测定,其活性以每克土30 min分解H2O2的毫克数表示。
1.3 数据处理与分析利用Excel 2007处理实验数据,SPSS 18.0分析数据,以Canoco 4.5软件完成变量之间的PCA相关性分析,采用Origin 8.5绘图。
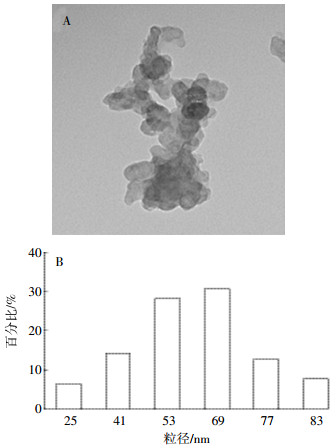
2 结果与分析 2.1 纳米银对土壤可培养微生物数量的影响纳米银对不同性质土壤中可培养微生物数量产生不同程度影响(图 2)。水稻土中细菌数量在低剂量(10 mg·kg-1)纳米银处理下显著降低,中高剂量(50、100 mg·kg-1)处理显著低于低剂量处理,但不同剂量纳米银对放线菌、真菌的影响均不显著。低剂量纳米银对黄棕壤可培养微生物影响较小,中高剂量下细菌、放线菌、真菌数量显著降低。不同剂量纳米银显著抑制黄褐土中可培养微生物的生长,随着纳米银剂量的增加抑制作用也逐渐增强。低剂量纳米处理下,黄褐土中放线菌、真菌数量分别减少86.8%和58.3%,而中高剂量下细菌、放线菌、真菌数量都减少80%以上,可见黄褐土中微生物对纳米银极为敏感。纳米银对砖红壤的影响与黄褐土相似,不同的是纳米银对砖红壤微生物的抑制强度略低于黄褐土。
|
| 图 2 纳米银对土壤微生物数量的影响 Figure 2 Effect of AgNPs on soil microbial quantity |
从结果可以看出水稻土中对纳米银最敏感的是细菌,黄棕壤中微生物对纳米银有一定的耐受力,高剂量下才会有所减少,黄褐土、砖红壤中微生物对纳米银都很敏感,尤其是高剂量纳米银处理下,微生物数量出现大幅降低。因此,供试4种土壤可培养微生物对纳米银的敏感程度为黄褐土>砖红壤>水稻土>黄棕壤。
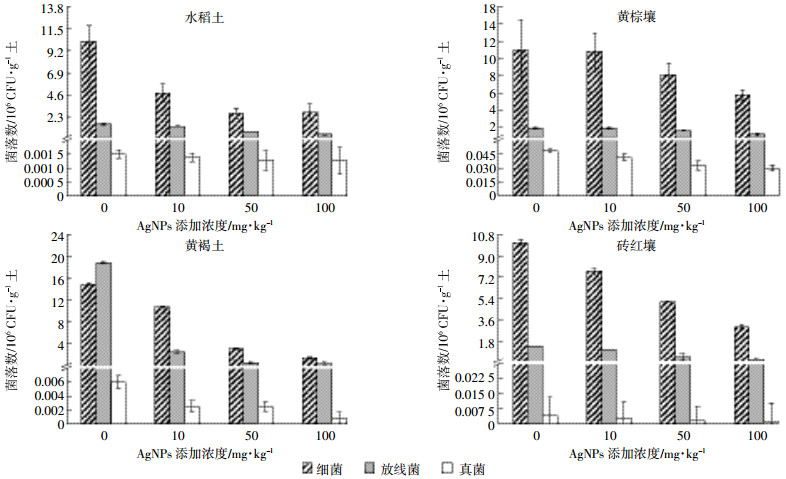
2.2 纳米银对土壤微生物多样性的影响通过对黄褐土微生物16S rRNA基因MiSeq高通量测序,得到微生物门水平的相对丰度。不同剂量纳米银对黄褐土微生物主要门类没有明显影响,但对微生物群落丰度产生影响(图 3)。纳米银暴露的土壤中变形菌门(Proteobacteria,25.4%~35.9%)、酸杆菌门(Acidobacteria,23.7%~30.1%)和放线菌门(Actinobacteria,10.3%~14.1%)为土壤的主导微生物门类,约占所有微生物总丰度的60%以上。其中螺旋菌门(Nitrospirae,1.6%~2.2%)、厚壁菌门(Firmicutes,3.7%~6.6%)、蓝菌门(Cyanobacteria,0.4%~2.6%)、放线菌门(Actinobacteria,10.3%~14.1%)、酸杆菌门(Acidobacteria,23.7%~30.1%)对纳米银敏感度较高,随着纳米银剂量增加群落丰度下降。土壤纳米银含量为50 mg·kg-1时,土壤中酸杆菌门群落相较于对照丰度下降了25.1%,而变形菌门群落相较于对照组丰度上升了41.3%。浮霉菌门(Planctomycetes)和芽孢单菌门(Gemmatimonadetes)群落丰度随纳米银含量增加而上升。同时,绿弯菌门(Chloroflexi)和拟杆菌门(Bacteroidetes)在不同纳米银含量土壤中群落丰度变化不大。
|
| 图 3 纳米银处理对黄褐土微生物群落结构的影响 Figure 3 Effect of different contents AgNPs treatment on microflora in yellow cinnamon soils |
土壤诱导呼吸量可以反映出土壤生物量的大小(图 4)。通过对纳米银暴露7 d的土壤进行底物诱导呼吸,发现4种土壤中纳米银处理组呼吸强度均低于对照组,并且随着纳米银剂量的增加,呼吸作用逐渐减弱。低剂量纳米银处理下,土壤呼吸作用没有受到显著影响,中高剂量纳米银显著抑制土壤呼吸,高剂量下水稻土、黄棕壤、黄褐土、砖红壤呼吸作用分别降低23.8%、15.9%、29.3%、14.5%。可见,纳米银的加入会减少土壤生物量,导致土壤微生物过程减弱,这与高通量测序的结果相一致。
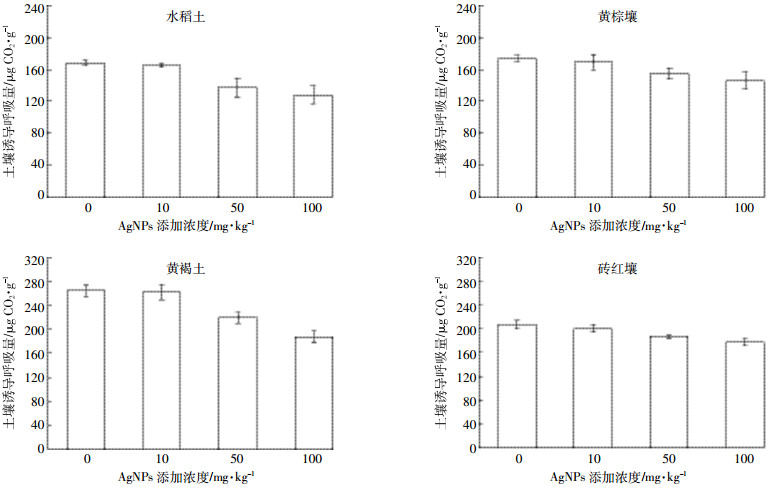
|
| 图 4 纳米银对土壤诱导呼吸量的影响 Figure 4 Effect of AgNPs on substrate induced respiration in soils |
添加不同剂量纳米银对4种土壤酶活性产生不同程度的影响(图 5)。低剂量纳米银处理下,水稻土的脲酶、FDA酶,黄棕壤的蔗糖酶活性有明显的升高;黄褐土、砖红壤酶活性降低。中剂量纳米银处理下,4种土壤脲酶、蔗糖酶活性显著降低,水稻土和黄棕壤的FDA酶、过氧化氢酶,黄褐土FDA酶活性受到轻微抑制,未达到显著影响。高剂量纳米银处理下,水稻土和黄棕壤的脲酶、蔗糖酶,黄褐土脲酶、蔗糖酶、过氧化氢酶,以及砖红壤酶活性均显著降低。说明纳米银的添加会影响土壤微生物酶过程,并且这种影响与纳米银的剂量正相关。
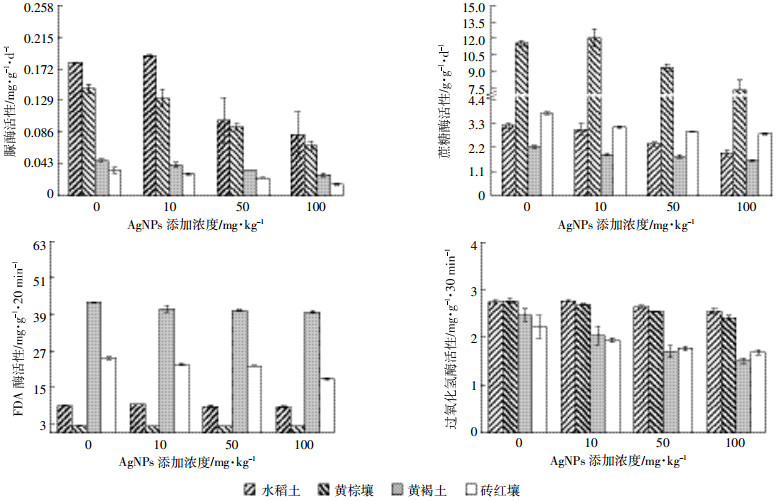
|
| 图 5 不同纳米银处理下土壤酶活性 Figure 5 Effect of different contents AgNPs on enzyme activities in soils |
此外,纳米银对不同种类酶的影响也不相同,脲酶对纳米银最为敏感,其次是蔗糖酶。高剂量下土壤脲酶活性降低41.7%~54.0%,蔗糖酶活性降低24.5% ~40.8%。虽然砖红壤FDA酶在高剂量纳米银下活性降低27.8%,但水稻土、黄棕壤、黄褐土中酶活性抑制均不显著(降低4.5%~7.2%)。纳米银对过氧化氢酶的影响在黄褐土、砖红壤中较为显著,在水稻土、黄棕壤中影响较小。
2.5 土壤环境因子与微生物性状因子之间的相关性分析加入纳米银后土壤理化性质没有发生明显变化,但纳米银在不同土壤中的微生物毒性却有着较大差异。中剂量(50 mg· kg-1)纳米银处理下土壤各微生物性状因子抑制率(与对照相比)与环境因子进行相关性分析,由表 2可知纳米银对呼吸作用的抑制与土壤pH正相关,对脲酶、蔗糖酶的抑制与土壤pH值、CEC正相关,对FDA酶、过氧化氢酶及真菌的抑制与土壤有机质、砂粒含量有一定的相关性,而对细菌、放线菌的抑制与环境因子相关性不高。土壤黏粒含量与各微生物性状因子之间的相关性不高,可能是因为供试土壤黏粒含量较为接近,在分析时无法显示出较大的差别。
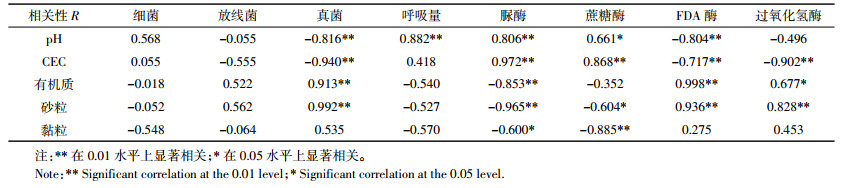
|
环境因子与微生物性状因子主成分分析如图 6所示,轴1和轴2的变量解释因子为96.5%,土壤有机质、砂粒在轴1方向上与真菌、FDA酶、过氧化氢酶等变量相关性较高;土壤pH、CEC与脲酶、蔗糖酶相关性高,这与表 2结果相似。说明纳米银在有机质、砂粒含量高的土壤中对FDA酶、过氧化氢酶的毒性作用大,而在pH、离子强度大的土壤中对脲酶、蔗糖酶及真菌的毒性大。纳米银对土壤呼吸作用的影响主要与土壤pH值相关,在pH值高的土壤中,纳米银对生物量的影响较大。
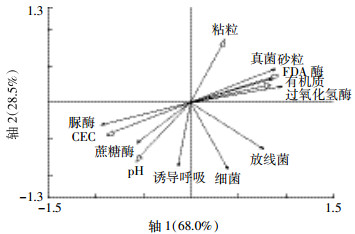
|
| 图 6 环境因子-微生物性状因子的PCA分析 Figure 6 Principal component analysis of environmental factors and microbial traits factors |
土壤微生物是维持土壤肥力和作物生产的关键因素[22],土壤生境的改变会影响微生物数量及群落结构的组成[23]。平板计数和底物诱导呼吸结果表明纳米银对土壤微生物的生长繁殖具有显著抑制作用。纳米银暴露下土壤细菌、放线菌、真菌数量显著降低,呼吸作用受到抑制,并且这种抑制在低剂量(10 mg· kg-1)下就有所表现,随着纳米银剂量的增加抑制作用逐渐增强。研究发现10 mg·kg-1纳米银可以显著降低土壤真菌的菌落数,100 mg· kg-1会显著抑制土壤细菌及放线菌的数量[24]。当纳米银含量仅为0.14 mg· kg-1时,污泥中微生物生物量与细菌群落组成显著减少[11];土壤中纳米银浓度高于20 mg· kg-1时,土壤呼吸被明显抑制,且浓度越高抑制作用越大[25]。纳米银能够破坏细菌的细胞膜,并聚集在细胞膜中,增加细胞通透性,导致细胞死亡[26];进入细胞内部的纳米银通过浓缩DNA使之失去复制能力,引起DNA降解从而抑制细菌生长繁殖[27]。
纳米银进入土壤后增加了细菌的丰富度但并没有改变土壤中主导微生物群落(变形菌门和酸杆菌门)。除主导细菌群落外,螺旋菌门、厚壁菌门、蓝菌门等随纳米银剂量增加群落丰度下降,浮霉菌门和芽孢单菌门随纳米银剂量增加群落丰度上升,绿弯菌门和拟杆菌门随纳米银剂量增加群落丰度无明显差异。说明土壤生境的变化不会改变主导细菌群落,但会引起群落丰度的变化,且不同细菌门类对纳米银的敏感程度不一样。Kumar等[28]发现,纳米银对土壤微生物群落有较高毒性,并可改变群落组成丰度,特别是植物伴生菌;Yang等[29]研究表明,纳米银会对活性污泥的微生物群落产生抑制作用,对硝化细菌群落的抑制尤为显著。
不同土壤中不同种类酶对纳米银的响应不同,但整体上土壤酶活性随着纳米银剂量的增加而降低。在测定的4种酶中,纳米银对脲酶的抑制最为显著,对蔗糖酶、FDA酶、过氧化氢酶活性也有一定程度的抑制,这与相关研究结果相似。Shin等[30]研究了纳米银对土壤6种酶活性的影响,发现脲酶对纳米银最敏感,而纳米银对FDA酶等影响较小。王秋双等[24]研究显示纳米银处理显著抑制土壤脲酶、脱氢酶活性,却对土壤过氧化氢酶与磷酸酶活性基本无影响。纳米金属的毒性可能来自于其本身,通过灭活蛋白质组或阻断酶上的结合位点来抑制酶活性[31],也可能是因其粒径小,易进入微生物内部产生氧化应激,导致生物死亡。ROS(活性氧簇)的累积可能是导致脲酶、磷酸酶活性降低的主要原因[32],而纳米颗粒本身或其溶解的离子对于土壤生态系统是明显有毒的[33]。
纳米银对土壤微生物的毒性与土壤理化性质有一定的关系,土壤pH、有机质含量、黏粒分布等都会影响纳米银在土壤中的聚合状态和稳定性。研究发现纳米ZnO的毒性是由离子释放导致的,纳米ZnO对念珠菌的毒性与土壤pH有关,在酸性土壤中毒性更强[34]。也有研究表明纳米银在酸性土壤中的毒性要强于碱性土壤[35]。这可能是因为酸性土壤表面的电负性低,对带负电的纳米银静电排斥力更小[36],易与纳米银结合,从而降低了纳米银在土壤中的迁移性,毒性作用更持久。此外,土壤天然有机质的表面吸附能够防止纳米银的氧化和银离子释放,腐植酸、富里酸能将氧化产物转化成金属从而抑制纳米银的溶解[37]。但也有研究发现用有机质修饰和未用有机质修饰的土壤中溶解Ag的浓度是相似的[38],而土壤质地越细,纳米材料的保留率会提高,其生物有效性会降低[39]。因此,纳米银进入土壤环境后不仅形态、大小会发生改变,毒性作用也会受到影响,土壤性质则可能是其毒性变化的主要原因。
虽然本研究对纳米银在不同土壤中微生物毒性进行了探讨,对纳米银的微生物毒性大小进行了测定,但是关于纳米银在土壤环境中的转化及毒性作用过程尚不清楚,有待进一步研究。
4 结论(1)纳米银能抑制土壤细菌、放线菌的数量,对真菌也有一定的抑制作用,剂量越高,抑制作用越明显。
(2)纳米银抑制土壤微生物呼吸作用,使土壤生物量减少。
(3)纳米银对不同土壤中酶活性的影响存在显著差异。纳米银显著抑制黄褐土、砖红壤中蔗糖酶、脲酶、FDA酶、过氧化氢酶活性;对水稻土、黄棕壤中脲酶影响较大,蔗糖酶、FDA酶、过氧化氢酶活性变化较小。
(4)纳米银毒性与土壤性质相关。纳米银对真菌、FDA酶、过氧化氢酶的抑制与土壤有机质、砂粒含量正相关;纳米银对脲酶、蔗糖酶、呼吸作用的抑制与土壤pH值、阳离子交换量正相关。
| [1] |
Organization for Economic Co-operation and Development(OECD). Publications in the series on the safety of manufactured nanomaterials no. 27: List of manufactured nanomaterials and list of endpoints for phase one of the sponsorship programme for the testing of manufactured nanomaterials[S]. Paris: OECD Publishing, 2010.
|
| [2] |
Ma X, Geiser L J, Deng Y, et al. Interactions between engineered nanoparticles(ENPs) and plants:Phytotoxicity, uptake and accumulation[J]. Science of the Total Environment, 2010, 408(16): 3053-3061. DOI:10.1016/j.scitotenv.2010.03.031 |
| [3] |
Keller A A, Mcferran S, Lazareva A, et al. Global life cycle releases of engineered nanomaterials[J]. Journal of Nanoparticle Research, 2013, 15(6): 1692. DOI:10.1007/s11051-013-1692-4 |
| [4] |
Mueller N C, Nowack B. Exposure modeling of engineered nanoparticles in the environment[J]. Environmental Science & Technology, 2008, 42(12): 4447-4453. |
| [5] |
Gottschalk F, Sonderer T, Scholz R W, et al. Modeled environmental concentrations of engineered nanomaterials(TiO2, ZnO, Ag, CNT, Full-erenes) for different regions[J]. Environmental Science & Technology, 2009, 43(24): 9216-9222. |
| [6] |
United States Environmental Protection Agency(US EPA). Targeted national sewage sludge survey statistical analysis[R]. Washington DC: US EPA, 2009.
|
| [7] |
Blaser S A, Scheringer M, Macleod M, et al. Estimation of cumulative aquatic exposure and risk due to silver:Contribution of nano-functionalized plastics and textiles[J]. Science of the Total Environment, 2008, 390(2/3): 396-409. |
| [8] |
Nowack B, Ranville J F, Diamond S, et al. Potential scenarios for nanomaterial release and subsequent alteration in the environment[J]. Environmental Toxicology & Chemistry, 2012, 31(1): 50-59. |
| [9] |
Schlich K, Klawonn T, Terytze K, et al. Hazard assessment of a silver nanoparticle in soil applied via sewage sludge[J]. Environmental Sciences Europe, 2013, 25(1): 1-14. DOI:10.1186/2190-4715-25-1 |
| [10] |
Vos P, Garrity G, Jones D, et al. Bergey's manual of systematic bacteriology[M]. New York: Springer Verlag, 2009.
|
| [11] |
Colman B P, Arnaout C L, Anciaux S, et al. Low concentrations of silver nanoparticles in biosolids cause adverse ecosystem responses under realistic field scenario[J]. PLoS One, 2013, 8(2): e57189. DOI:10.1371/journal.pone.0057189 |
| [12] |
Hänsch M, Emmerling C. Effects of silver nanoparticles on the microbiota and enzyme activity in soil[J]. Journal of Plant Nutrition & Soil Science, 2010, 173(4): 554-558. |
| [13] |
Morones J R, Elechiguerra J L, Camacho A, et al. The bactericidal effect of silver nanoparticles[J]. Nanotechnology, 2005, 16(10): 2346-2353. DOI:10.1088/0957-4484/16/10/059 |
| [14] |
Sotiriou G A, Pratsinis S E. Antibacterial activity of nanosilver ions and particles[J]. Environment Science & Technology, 2010, 44(14): 5649-5654. |
| [15] |
Wigginton N S, De Titta A, Piccapietra F, et al. Binding of silver nanoparticles to bacterial proteins depends on surface modifications and inhibits enzymatic activity[J]. Environment Science & Technology, 2010, 44(6): 2163-2168. |
| [16] |
Benmoshe T, Dror I, Berkowitz B. Transport of metal oxide nanoparticles in saturated porous media[J]. Chemosphere, 2011, 81(3): 387-393. |
| [17] |
Fang J, Shan X Q, Wen B. Stability of titania nanoparticles in soil suspensions and transport in saturated homogeneous soil columns[J]. Environment Pollution, 2009, 157(4): 1101-1109. DOI:10.1016/j.envpol.2008.11.006 |
| [18] |
周东美. 纳米Ag粒子在我国主要类型土壤中的迁移转化过程与环境效应[J]. 环境化学, 2015, 34(4): 605-613. ZHOU Dong-mei. Transport and transformation of nanoAg particle in soils and its environmental effects[J]. Environmental Chemistry, 2015, 34(4): 605-613. DOI:10.7524/j.issn.0254-6108.2015.04.20150107 |
| [19] |
Marteinsson V T, Runarsson A, Stefansson A, et al. Microbial communities in the subglacial waters of the Vatnajokull ice cap, Iceland[J]. ISME Journal, 2013, 7(2): 427-437. DOI:10.1038/ismej.2012.97 |
| [20] |
Caporaso J G, Lauber C L, Walters W A, et al. Ultra-high-throughput microbial community analysis on the Illumina HiSeq and MiSeq platforms[J]. ISME Journal, 2012, 6(8): 1621-1624. DOI:10.1038/ismej.2012.8 |
| [21] |
李振高, 骆永明, 滕应. 土壤与环境微生物研究法[M]. 北京: 科学出版社, 2008. LI Zhen-gao, LUO Yong-ming, TENG Ying. Soil and environmental microbiological research[M]. Beijing: Science Press, 2008. |
| [22] |
Carbone S, Vittori A L, Gaggia F, et al. Bioavailability and biological effect of engineered silver nanoparticles in a forest soil[J]. Journal of Hazardous Materials, 2014, 280: 89-96. DOI:10.1016/j.jhazmat.2014.07.055 |
| [23] |
Hansel C M, Fendorf S, Jardine P M, et al. Changes in bacterial and archaeal community structure and functional diversity along a geochemically variable soil profile[J]. Applied and Environmental Microbiology, 2008, 74(5): 1620-1633. DOI:10.1128/AEM.01787-07 |
| [24] |
王秋双, 戚兴超, 申天琳, 等. 纳米银与石墨烯对土壤微生物及土壤酶的影响[J]. 环境科学学报, 2017, 37(8): 3149-3157. WANG Qiu-shuang, QI Xing-chao, SHEN Tian-lin, et al. Effect of silver nanoparticles and graphene on soil microorganisms and enzyme activities[J]. Acta Scientiae Circumstantiae, 2017, 37(8): 3149-3157. |
| [25] |
Rahmatpour S, Shirvani M, Mosaddeghi M R, et al. Dose-response effects of silver nanoparticles and silver nitrate on microbial and enzyme activities in calcareous soils[J]. Geoderma, 2017, 285: 313-322. DOI:10.1016/j.geoderma.2016.10.006 |
| [26] |
Sondi I, Salopek-Sondi B. Silver nanoparticles as antimicrobial agent:A case study on E. coli as a model for gram-negative bacteria[J]. Journal of Colloid & Interface Science, 2004, 275(1): 177-182. |
| [27] |
谢小保, 李文茹, 曾海燕, 等. 纳米银对大肠杆菌的抗菌作用及其机制[J]. 材料工程, 2008(10): 106-109. XIE Xiao-bao, LI Wen-ru, ZENG Hai-yan, et al. Study of antimicrobial activity and mechanism of silver nanoparticles on Escherichia coli[J]. Materials Engineering, 2008(10): 106-109. DOI:10.3969/j.issn.1001-4381.2008.10.028 |
| [28] |
Kumar N, Shah V, Walker V K. Perturbation of an Arctic soil microbial community by metal nanoparticles[J]. Journal of Hazardous Materials, 2011, 190(1/2/3): 816-822. |
| [29] |
Yang Y, Quensen J, Mathieu J, et al. Pyrosequencing reveals higher impact of silver nanoparticles than Ag+ on the microbial community structure of activated sludge[J]. Water Research, 2014, 48: 317-325. DOI:10.1016/j.watres.2013.09.046 |
| [30] |
Shin Y J, Kwak J I, An Y J. Evidence for the inhibitory effects of silver nanoparticles on the activities of soil exoenzymes[J]. Chemosphere, 2012, 88(4): 524-529. DOI:10.1016/j.chemosphere.2012.03.010 |
| [31] |
Xu C, Peng C, Sun L J, et al. Distinctive effects of TiO2 and CuO nanoparticles on soil microbes and their community structures in flooded paddy soil[J]. Soil Biology & Biochemistry, 2015, 86: 24-33. |
| [32] |
Pan B, Xing B S. Manufactured nanoparticles and their sorption of organic chemicals[J]. Advances in Agronomy, 2010, 108(10): 137-181. |
| [33] |
Du W C, Sun Y Y, Ji R, et al. TiO2 and ZnO nanoparticles negatively affect wheat growth and soil enzyme activities in agricultural soil[J]. Journal of Environmental Monitoring, 2011, 13(4): 822-828. DOI:10.1039/c0em00611d |
| [34] |
Waalewijn-Kool P L, Ortiz M D, Lofts S, et al. The effect of pH on the toxicity of zinc oxide nanoparticles to Folsomia candida in amended field soil[J]. Environmental Toxicology & Chemistry, 2013, 32(10): 2349-2355. |
| [35] |
Schlich K, Hund-Rinke K. Influence of soil properties on the effect of silver nanomaterials on microbial activity in five soils[J]. Environmental Pollution, 2015, 196: 321-330. DOI:10.1016/j.envpol.2014.10.021 |
| [36] |
杜欢, 王玉军, 李程程, 等. 纳米Ag在四种不同性质土壤上的吸附行为研究[J]. 农业环境科学学报, 2015, 34(6): 1069-1075. DU Huan, WANG Yu-jun, LI Cheng-cheng, et al. Sorption of silver nanoparticles on four soils with different characteristics[J]. Journal of Agro-Environment Science, 2015, 34(6): 1069-1075. DOI:10.11654/jaes.2015.06.008 |
| [37] |
Liu J, Hurt R H. Ion release kinetics and particle persistence in aqueous nano-silver colloids[J]. Environmental Science & Technology, 2010, 44(6): 2169-2175. |
| [38] |
Peyrot C, Wilkinson K J, Desrosiers M, et al. Effects of silver nanoparticles on soil enzyme activities with and without added organic matter[J]. Environmental Toxicology & Chemistry, 2014, 33(1): 115-125. |
| [39] |
Hund-Rinke K. Fate and bioavailability of engineered nanoparticles in soils:A review[J]. Critical Reviews in Environmental Science & Technology, 2014, 44(24): 2720-2764. |
 2018, Vol. 37
2018, Vol. 37