文章信息
- 葛高飞, 张鸣帅, 姚时, 昝萱, 张芳
- GE Gao-fei, ZHANG Ming-shuai, YAO Shi, ZAN Xuan, ZHANG Fang
- 苯并芘[a]不同污染方式对黄褐土微生物区系的影响
- Effects of benzo[a]pyrene pollution over one-time and cumulative patterns on microbial flora in yellow-cinnamon soil
- 农业环境科学学报, 2018, 37(5): 941-947
- Journal of Agro-Environment Science, 2018, 37(5): 941-947
- http://dx.doi.org/10.11654/jaes.2017-1176
文章历史
- 收稿日期: 2017-08-28
- 录用日期: 2017-12-04
2. 安徽农业大学资源与环境学院, 合肥 230036
2. School of Resources and Environment, Anhui Agricultural University, Hefei 230036, China
苯并[a]芘(Benzo[a]pyrene, B[a]P)是多环芳烃(Polycyclic aromatic hydrocarbons, PAHs)中污染最广、毒性最强的有机污染物之一, 也是PAHs类污染物中致癌性最强的污染物[1-4]。B[a]P在环境中较为稳定, 不易降解; 主要通过石油开采、燃煤和汽车尾气排放以及大气沉降等方式累积进入地表而污染土壤[1]。土壤中累积的B[a]P被植物吸收, 进入食物链, 从而对人体健康造成威胁。土壤微生物作为土壤中数量最多的生物类群, 是土壤系统中物质循环与能量转换的重要组分。它们对土壤肥力、土壤团粒结构的形成, 土壤生态平衡的维持与可持续发展都具有极其重要的意义[5]。土壤微生物群落作为土壤生态系统的重要组分, 在环境条件的形成、地球化学循环和生物进化中都扮演着重要角色[6], 是反映土壤环境变化的敏感指标, 可作为衡量土壤质量及评价土壤生态系统可持续性的重要生物学指标[7]。B[a]P污染具有显著的微生物群落效应, 体现为对土壤微生物多样性、组成及生理功能的潜在影响[8-9], 反映PAHs类污染物对土壤微生物的潜在毒害效应。
目前的研究大都集中在B[a]P一次污染所产生的生态毒性, 这与土壤B[a]P以较低剂量逐步在实际土壤中累积的污染过程存在明显差异。本试验采用逐步添加的方法模拟污染物在土壤中的累积过程, 研究B[a]P累积添加对土壤微生物区系的影响, 找出B[a]P污染土壤的敏感微生物学指标, 以期为土壤PAHs类污染物的生态毒性诊断提供科学方法与理论支持。
1 材料与方法 1.1 实验材料B[a]P试剂(色谱纯)购自美国Sigma公司。试验土壤为黄褐土, 土壤样品采自安徽农业大学高新农业示范园内。土壤样品剔除植物根系和石砾后自然风干, 研磨过2 mm尼龙筛。在培养试验之前, 测定土壤的基本理化性质[10](表 1), 并将含水量调节为土壤最大持水量的50%, 置于生化培养箱中(25℃)活化培养1周(视为新鲜土壤)。
制作高浓度的B[a]P污染母土, 待溶剂(丙酮)散尽后, 磨碎过100目网筛。模拟B[a]P在土壤中的累积试验:每7 d将一定量的B[a]P污染母土按比例与供试土壤混合, 使土壤B[a]P浓度增加50 μg·kg-1。高浓度处理先进行累积污染, 18周后低B[a]P浓度处理开始进行累积污染, 到24周时B[a]P在土壤中累积浓度分别达到1200 μg·kg-1(Lb)和300 μg·kg-1(La), 同时做累积空白(CK1)。24周后土壤样品置于25℃培养箱中进行暗培养。一次性污染试验:一次性将一定量的B[a]P污染母土添加到供试土壤中, B[a]P浓度分别为0(CK2)、300 μg·kg-1(Ya)和1200 μg·kg-1(Yb), 置于25℃培养箱中进行暗培养。土壤含水量保持在土壤最大持水量的50%, 每周通气2~3次, 并于培养后的1、7、14、28、56 d取样, 测定一次和累积处理下试验土壤中可提取态和有效态的B[a]P含量, 可培养微生物(细菌、真菌和放线菌)的种群数量。
1.3 土壤B[a]P含量的提取与测定土壤中的B[a]P可提取态含量采用郑彬等[1]的方法进行提取。土壤中B[a]P有效态含量的提取参考吕正勇等[11]的方法。土壤B[a]P可提取态和有效态含量采用固相萃取法纯化。B[a]P的测定采用Supelco PAHs专用色谱柱分离(25 cm×4.6 mm×5 μm), 乙腈和超纯水梯度淋洗, HPLC-FLD(荧光检测器)检测分析。色谱条件为:在0~12 min时, 乙腈和水的流动相体积比为1:1, 12~22 min流动相为纯乙腈淋洗, 22~25 min乙腈和水的流动相体积比为1:1。流速1.5 mL·min-1, 柱温30℃, 进样量20 μL, 激发/发射波长为294 nm/430 nm, 外标法定量分析。B[a]P提取、纯化和测定方法的回收率为80%~85%, 峰面积测定的相对偏差(RSD, n=6)小于5%。
1.4 土壤微生物种群数量采用系列稀释平板培养计数法(Colony Forming Unit/CFU)对2种污染条件下的供试土壤样品中可培养微生物种类进行活菌数量测定。细菌、真菌和放线菌分别采用牛肉膏蛋白胨琼脂培养基、马丁氏培养基和改良高氏1号培养基进行选择性培养, 稀释平板法计数。根据预实验结果选定细菌、真菌和放线菌的稀释度分别为10-5、10-2和10-4, 涂布量为100 μL。
1.5 数据处理方法试验中各组数据均用Excel 2010进行处理, 采用SPSS 16.0统计分析软件进行差异显著性和相关性分析(F检验, P < 0.05为差异显著)。
2 结果与分析 2.1 累积污染对土壤B[a]P含量的影响由图 1可以看出, 累积污染与一次污染处理的土壤B[a]P可提取态和有效态含量都呈现出随培养时间的增加逐渐降低的规律。在培养前期(1~28 d), 两种污染处理的B[a]P可提取态和有效态含量下降速度较快, 后期(28~56 d)下降趋势减缓。在相同浓度处理下, 可提取态B[a]P的含量远高于有效态的含量。两种污染方式下B[a]P有效态含量差异不显著。
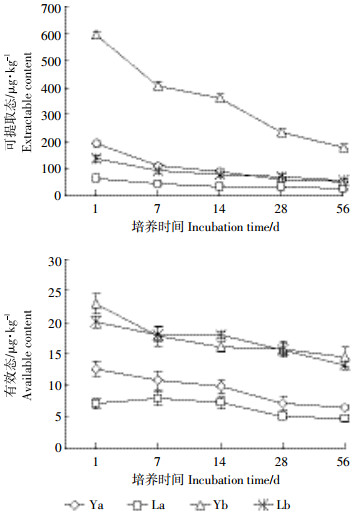
|
| 图 1 土壤中B[a]P含量随时间的变化规律 Figure 1 Changes of soil extractable and available B[a]P contents with time |
B[a]P累积和一次污染条件下土壤可培养细菌的动态变化规律如图 2所示。培养初期(1 d), 累积污染高浓度处理的细菌数量显著高于对照处理, 而一次污染两处理的细菌数量则显著低于对照处理(P < 0.05)。7 d时, 累积污染高浓度处理的细菌数量依然高于对照和低浓度处理, 而一次污染对细菌的抑制作用明显减弱, 对照与一次污染高浓度处理间的细菌数量差异不显著。14~56 d, 累积污染两个处理间的细菌数量无明显差异, 但均显著高于对照处理(P < 0.05);一次污染高浓度处理的细菌数量逐渐增加, 到28 d时显著高于对照和低浓度处理(P < 0.05), 56 d时又显著下降, 低于低浓度和对照处理。
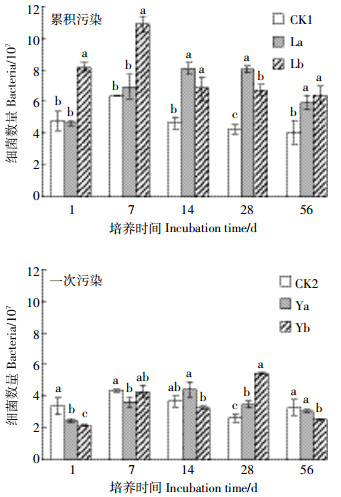
|
| 不同小写字母表示同一培养时期不同处理间存在显著性差异 (P<0.05)。下同 图 2 土壤细菌数量的动态变化 Figure 2 Dynamic changes of bacteria quantity |
从图 3可以看出, 土壤可培养真菌的动态变化规律明显不同于土壤细菌。培养初期(1 d), 累积污染处理的真菌数量低于对照处理, 而一次污染处理的真菌数量高于对照处理, 尤其是一次污染的高浓度处理显著高于对照和低浓度处理的真菌数量(P < 0.05)。7 d时, 累积污染的高浓度处理显著降低了土壤的真菌数量(P < 0.05), 而一次污染的各处理对土壤真菌数量无显著影响。14~56 d期间, 累积污染降低了土壤中的真菌数量, 且高浓度处理的降低效应显著(P < 0.05);一次污染处理对土壤真菌数量的影响有增加也有降低, 波动性明显。
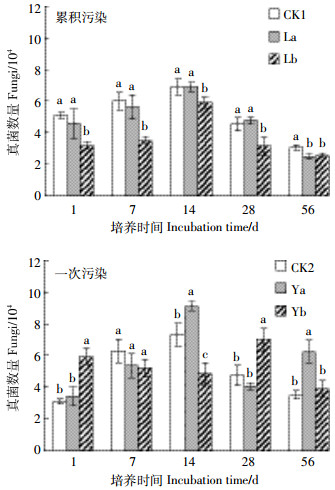
|
| 图 3 土壤真菌数量的动态变化 Figure 3 Dynamic changes of fungi quantity |
如图 4所示, 土壤中可培养放线菌数量的动态变化不同于细菌和真菌。对于累积污染处理来说, 在整个培养期内, 累积污染低浓度处理的放线菌数量与对照相比无明显差异, 而高浓度处理的放线菌数量显著低于对照和低浓度处理(P < 0.05)。对于一次污染处理而言, 在培养的前期(1~14 d), 一次污染的两个处理均显著降低了放线菌的数量(P < 0.05), 并且对放线菌的抑制程度随着B[a]P的浓度增加而加大; 28 d时, 低浓度处理的放线菌数量与对照相比无明显差异, 高浓度处理依然显著地抑制了放线菌的数量(P < 0.05);56 d时, 一次污染的两个处理对土壤放线菌均无抑制作用, 处理间差异不显著。
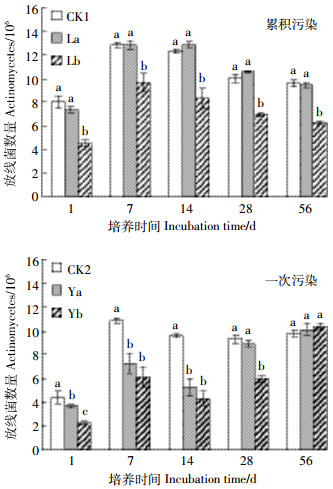
|
| 图 4 土壤放线菌数量的动态变化 Figure 4 Dynamic changes of actinomycetes quantity |
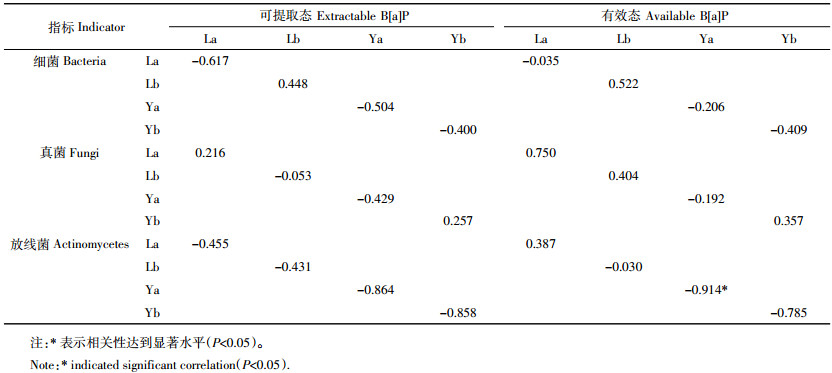
从表 2可以看出, 土壤微生物种群数量与土壤B[a]P含量表现出一定的相关性(负相关)。本研究所测定的3种微生物中, 放线菌数量与土壤B[a]P含量最为相关。与累积污染相比, 一次污染模式下B[a]P处理的相关性较大, 且低B[a]P处理的有效态含量与放线菌数量显著相关(P < 0.05)。
|
本研究结果表明, 同等浓度处理下, 可提取态B[a]P的含量远高于有效态含量, 这与葛高飞等[12]的研究一致, 说明不同提取方法得到的土壤B[a]P含量差别很大。有效态含量是溶解在土壤溶液中的B[a]P, 可提取态含量不仅包括土壤溶液中的B[a]P, 还包括土壤表面吸附的B[a]P, 故B[a]P可提取态含量显著高于有效态含量。累积污染条件下可提取态的B[a]P含量显著低于一次污染(P < 0.05), 而两种污染方式下有效态B[a]P含量差异不显著(图 1), 这与马静静等[13]和张伟等[14]的研究一致。说明污染方式对B[a]P在土壤中的有效态含量影响较小, 但对B[a]P可提取态含量具有较为显著的影响。Yang等[15]的研究表明, PAHs类污染物进入土壤中的不同方式会影响污染物的提取率。Ling等[16]也发现, 随着与土壤接触时间延长, B[a]P的解吸附量逐渐降低, 生物有效性下降。对于土壤有效态B[a]P来讲, 无论是哪种污染方式, B[a]P在土壤界面和土壤溶液间一直保持着动态平衡, 因而不同污染方式下有效态B[a]P含量差异不明显[12]。在B[a]P一次性大量地进入土壤的污染方式下, B[a]P与土壤颗粒的作用时间较短, 与土壤组分结合程度较低, 有机质固定的B[a]P量也少, 因而一次污染条件下土壤中B[a]P可提取态含量较高; 相反, 累积污染处理的污染物与土壤颗粒的作用是逐步进行的, 随着B[a]P在土壤中的逐步累积, 每次进入土壤中的B[a]P均能与土壤充分作用, 老化较为完全, 因此一次污染处理的B[a]P可提取态含量远高于累积污染处理[12], 另外, 由于长时间培养过程中微生物的共生利用也使得B[a]P的可提取量减少[1, 12]。
细菌、真菌和放线菌作为土壤微生物的三大类群是构成土壤微生物的主要生物量, 它们的类群组成和数量变化通常能反映出土壤微生物活性水平, 标识土壤中物质代谢的旺盛程度[17]。本研究中, 累积污染处理在培养初期(1 d)增加了可培养细菌数量, 而一次污染处理的细菌数量则显著低于对照处理(P < 0.05)。说明低浓度B[a]P的累积添加(50 μg·kg-1)对土壤细菌不仅没有抑制作用, 反而具有刺激作用, 少量B[a]P的添加为微生物的生长繁殖提供了碳源养料, 增加了微生物的物种丰富度; 较高浓度的B[a]P一次性地添加到土壤中会对土壤细菌产生毒害, 细菌数量被抑制现象显著(P < 0.05)。微生物由初始的被抑制到7 d后的抑制作用消失, 是细菌适应了较高浓度B[a]P的影响, 微生物活性得到恢复。可以推测, 在初期细菌可能忍耐并适应了B[a]P的加入剂量, 后来可能利用了B[a]P作为碳源和能源[12], 刺激了一些细菌生长, 从而使细菌数量增加[18-20], 物种丰富度增加, 而后或者由于B[a]P的毒性抑制细菌的生长或者由于有机物被快速消耗而导致微生物死亡, 细菌数量又有减少, 物种丰富度降低。高浓度的B[a]P的添加短时间内刺激了土壤真菌的活性, 增加了真菌的种群数量, 此结论与姜睿玲等[21]的研究相似。大量B[a]P加入土壤之初增加了有害真菌的活性和物种丰富度, 真菌数量显著增加, 后因土壤的吸附作用以及微生物的降解和利用, 可利用的B[a]P含量降低, B[a]P的刺激作用减弱, 真菌数量表现出降低的趋势, 说明逆境条件会刺激土壤真菌的活性, 增加其物种丰富度。B[a]P一次性大量污染土壤后真菌表现出较为复杂的动态变化特征[22]。累积污染条件下, B[a]P少量逐步地在土壤中增加, 真菌适应了污染物的存在, 少量B[a]P的毒性不足以刺激大量真菌的生长繁殖, 因此累积污染处理的真菌活性较低, 数量较少, 物种丰富度较低。土壤放线菌对B[a]P的添加最为敏感, 即使是少量污染物的累积加入依然对土壤放线菌产生了抑制作用(图 4), 降低了可培养放线菌的物种数量。由于放线菌的容忍限度较低, 一次污染处理在培养初期至中期都抑制了放线菌的活性, 降低了放线菌的数量。中后期, 放线菌适应了低浓度的污染环境, 但高浓度的抑制作用仍然存在。末期时, B[a]P的高低浓度对放线菌都没有明显的抑制作用, 这可能是放线菌适应了B[a]P的污染, 恢复了活性, 亦或是放线菌在培养后期能够利用B[a]P作为碳源养料维持自身的生长代谢, 也可能是由于土壤微生物对污染物的忍耐性和适应性, 以及微生物对污染物的降解作用[9, 23-24], 引起了污染物生物可利用性的改变。
4 结论(1) 累积污染是污染物以低剂量叠加的方式进入土壤, 更能真实地反映B[a]P对土壤微生物的影响, 反映现实中B[a]P的环境风险。
(2) B[a]P可提取态和有效态含量均可对土壤B[a]P污染进行风险评估, 且在低浓度B[a]P污染下, B[a]P有效态的表征度更高。
(3) 在试验土壤中, 测定的土壤3种微生物中放线菌反应最为灵敏, 其次是细菌和真菌。可培养放线菌数量与土壤B[a]P的可提取态和有效态含量相关性较大, 且较低浓度的B[a]P已造成可培养放线菌数量的显著减少, 因此放线菌可作为B[a]P污染土壤的微生物学指标。
| [1] |
郑彬, 马静静, 葛高飞, 等. B[a]P累积污染对土壤呼吸强度的影响[J]. 农业环境科学学报, 2013, 32(2): 259-266. ZHENG Bin, MA Jing-jing, GE Gao-fei, et al. Influences of benzo[a]pyrene superimposed pollution on soil respiration intensity[J]. Journal of Agro-Environment Science, 2013, 32(2): 259-266. |
| [2] |
Qiao M, Chen Y, Wang C X, et al. DNA damage and repair process in earthworm after in-vivo and in vitro exposure to soil irrigated by wastewaters[J]. Environmental Pollution, 2007, 148(1): 141-147. DOI:10.1016/j.envpol.2006.10.033 |
| [3] |
陶玉强, 张淑贞, 薛滨. 土壤中多环芳烃生物有效性及其评价方法[J]. 中国科学院研究生院学报, 2010, 27(4): 568-576. TAO Yu-qiang, ZHANG Shu-zhen, XUE Bin. Bioavailability of polycyclic aromatic hydrocarbons in soils and its evaluation method[J]. Journal of the Graduate School of the Chinese Academy of Sciences, 2010, 27(4): 568-576. |
| [4] |
刘世亮, 骆永明, 吴龙华, 等. 污染土壤中苯并[a]芘的微生物共代谢修复研究[J]. 土壤学报, 2010, 47(2): 364-369. LIU Shi-liang, LUO Yong-ming, WU Long-hua, et al. Remediation of benzo[a]pyrene-contaminated soil through its co-metabolism with soil microbes[J]. Acta Pedologica Sinica, 2010, 47(2): 364-369. |
| [5] |
Mitter B, Brader G, Afzal M, et al. Advances in elucidating beneficial interactions between plants, soil, and bacteria[J]. Advances in Agronomy, 2013, 121(1): 381-445. |
| [6] |
杨翠云, 郭淑政, 刘琪, 等. 石油污染土壤微生物多样性的研究技术及进展[J]. 安徽农业科学, 2009, 37(33): 16479-16482, 16533. YANG Cui-yun, GUO Shu-zheng, LIU Qi, et al. Research techniques and progress of oil-contaminated soil microbial diversity[J]. Jouranl of Anhui Agricultural Sciences, 2009, 37(33): 16479-16482, 16533. |
| [7] |
Wardle D A. A comparative assessment of factors which influence microbial biomass carbon and nitrogen levels in soils[J]. Biological Reviews, 1992, 67(3): 321-358. |
| [8] |
Sawulski P, Clipson N, Doyle E. Effects of polycyclic aromatic hydrocarbons on microbial community structure and PAH ring hydroxylating dioxygenase gene abundance in soil[J]. Biodegradation, 2014, 25(6): 835-847. DOI:10.1007/s10532-014-9703-4 |
| [9] |
吴宇澄, 林先贵, 朱清禾, 等. 冶炼企业周边农田土壤的多环芳烃污染及其细菌群落效应[J]. 生态毒理学报, 2016, 11(2): 484-491. WU Yu-cheng, LIN Xian-gui, ZHU Qing-he, et al. Polycyclic aromatic hydrocarbons(PAHs) pollution and their effects on bacterial community in agricultural soils near a smelting plant[J]. Asian Journal of Ecotoxicology, 2016, 11(2): 484-491. |
| [10] |
鲁如坤. 土壤农业化学分析方法[M]. 北京: 中国农业科技出版社, 2000. LU Ru-kun. Methods of soil agricultural chemistry analysis method[M]. Beijing: China Agricultural Science and Technology Press, 2000. |
| [11] |
吕正勇, 杨兴伦, 王芳, 等. Tenax提取预测老化土壤中多环芳烃的生物有效性[J]. 中国环境科学, 2011, 31(4): 647-656. Zheng yong, YANG Xing-lun, WANG Fang, et al. The Tenax extraction technique to predict the bioavailability of aged PAHs in soil[J]. China Environmental Science, 2011, 31(4): 647-656. |
| [12] |
葛高飞, 郑斌, 王景, 等. 菲不同污染方式对土壤酶活性的影响[J]. 核农学报, 2013, 27(10): 1560-1566. GE Gao-fei, ZHENG Bin, WANG Jing, et al. Effect of phenanthrene pollution with one-time and cumulative patterns on soil enzymatic activity[J]. Journal of Nuclear Agricultural Sciences, 2013, 27(10): 1560-1566. DOI:10.11869/hnxb.2013.10.1560 |
| [13] |
马静静, 张伟, 郑彬, 等. 土壤B[a]P多次叠加污染对蚯蚓体腔细胞的毒性效应[J]. 南京农业大学学报, 2014, 37(3): 77-82. MA Jing-jing, ZHANG Wei, ZHENG Bin, et al. Multiple-time addition of benzo[a]pyrene in soil declined its toxic effects on Eisenia foetida coelomocytes[J]. Journal of Nanjing Agricultural University, 2014, 37(3): 77-82. DOI:10.7685/j.issn.1000-2030.2014.03.011 |
| [14] |
张伟, 郑彬, 马静静, 等. 土壤B[a]P多次叠加污染的生物有效性及对蚯蚓体腔细胞染色体和溶酶体的毒性效应[J]. 应用与环境生物学报, 2014, 20(6): 1020-1026. ZHANG Wei, ZHENG Bin, MA Jing-jing, et al. Effect of multiple benzo[a]pyrene addition on its bioavailability and coelomocyte lysosomes and chromosomes in earthworms[J]. Chinese Journal of Applied and Environmental Biology, 2014, 20(6): 1020-1026. |
| [15] |
Yang Y, Zhang N, Xue M, et al. Impact of soil organic matter on the distribution of polycyclic aromatic hydrocarbons(PAHs) in soils[J]. Environmental Pollution, 2010, 158(6): 2170-2174. DOI:10.1016/j.envpol.2010.02.019 |
| [16] |
Ling W T, Zeng Y C, Gao Y Z, et al. Availability of polycyclic aromatic hydrocarbons in aging soils[J]. Journal of Soils and Sediments, 2010, 10(5): 799-807. DOI:10.1007/s11368-010-0187-5 |
| [17] |
Mackay J E, Cunningham S C, Cavagnaro T R. Riparian reforestation:Are there changes in soil carbon and soil microbial communities?[J]. Science of the Total Environment, 2016, 556(1): 960-967. |
| [18] |
张晶, 张惠文, 张勤, 等. 长期石油污水灌溉对东北旱田土壤微生物生物量及土壤酶活性的影响[J]. 中国生态农业学报, 2008, 16(1): 67-70. ZHANG Jing, ZHANG Hui-wen, ZHANG Qin, et al. Impact of long-time irrigation of petroleum wastewater on glebe microbial biomass and soil enzyme activities in Northeast China[J]. Chinese Journal of Eco-Agriculture, 2008, 16(1): 67-70. |
| [19] |
沈国清, 陆贻通, 洪静波, 等. 菲和镉复合污染对土壤微生物的生态毒理效应[J]. 环境化学, 2005, 24(6): 662-665. SHEN Guo-qing, LU Yi-tong, HONG Jing-bo, et al. ECO toxicological effect of phenanthrene and Cd combined pollution on soil microbe[J]. Environmental Chemistry, 2005, 24(6): 662-665. |
| [20] |
易志刚. 多环芳烃对土壤线虫和微生物生物量的影响[J]. 亚热带农业研究, 2008, 4(2): 141-145. YI Zhi-gang. Effects of polycyclic aromatic hydrocarbons on soil nematodes and soil microbial biomass[J]. Subtropical Agriculture Research, 2008, 4(2): 141-145. |
| [21] |
姜睿玲, 杨统一, 唐玉斌, 等. 多环芳烃污染对桑园土壤微生物结构及种群多样性的影响[J]. 中国环境科学, 2012, 32(9): 1655-1661. JIANG Rui-ling, YANG Tong-yi, TANG Yu-bin, et al. Effect of PAHs pollution on microbial structure and population diversity of mulberry orchard soil[J]. China Environmental Science, 2012, 32(9): 1655-1661. |
| [22] |
单平, 伍震威, 葛高飞. 外源汞添加对土壤微生物区系的影响[J]. 安徽农业大学学报, 2016, 43(2): 248-251. SHAN Ping, WU Zhen-wei, GE Gao-fei. Effect of exogenous mercury addition on soil microbial populations[J]. Journal of Anhui Agricultural University, 2016, 43(2): 248-251. |
| [23] |
Chen S C, Peng J J, Duan G L. Enrichment of functional microbes and genes during pyrene degradation in two different soils[J]. Journal of Soils and Sediments, 2015, 16(2): 417-426. |
| [24] |
Li X F, Hou L J, Liu M, et al. Abundance and diversity of polycyclic aromatic hydrocarbon degradation bacteria in urban roadside soils in Shanghai[J]. Applied Microbiology and Biotechnology, 2015, 99(8): 3639-3649. DOI:10.1007/s00253-014-6299-x |
 2018, Vol. 37
2018, Vol. 37




