文章信息
- 任欣伟, 唐景春, 于宸, 何娟
- REN Xin-wei, TANG Jing-chun, YU Chen, HE Juan
- 土壤微塑料污染及生态效应研究进展
- Advances in research on the ecological effects of microplastic pollution on soil ecosystems
- 农业环境科学学报, 2018, 37(6): 1045-1058
- Journal of Agro-Environment Science, 2018, 37(6): 1045-1058
- http://dx.doi.org/10.11654/jaes.2017-1409
文章历史
- 收稿日期: 2017-10-17
- 录用日期: 2018-01-12
2. 环境污染过程与基准教育部重点实验室, 天津 300071;
3. 天津市城市环境污染诊断与修复工程技术中心, 天津 300071
2. Key Laboratory of Pollution Processes and Environmental Criteria, Ministry of Education, Tianjin 300071, China;
3. Tianjin Key Laboratory of Environmental Remediation and Pollution Control, Tianjin 300071, China
微塑料(< 5 mm)作为一种新型污染物近年来受到国内外广泛关注[1]。微塑料粒径小、数量多、分布广,易于为生物所吞食,在食物链中积累[2],且具有一定的吸附特性,可以将污染物或微生物吸附并富集于其表面[1]。目前大多数研究集中于海洋[3-9]、海岸带潮滩[10-18]、河口[19-22]、湖泊[23-31]等水域生态系统。微塑料对海洋及淡水鱼类、鸟类等有负面作用[32-34]。作为污染物的载体,微塑料被水生动物摄食后,可对其产生毒性效应,也可以通过食物链传递[4]。
微塑料对土壤生态系统影响的研究较少,其原因可能包括以下几方面:从研究方法角度看,相较于复杂多样的土壤介质,海洋中的微塑料更易于分离和检测;从研究对象角度看,水域生态系统的滤食性动物多,使得生物有机体易于积累毒性,从而可以作为营养模式的典型范例;从生态系统的角度看,水域生态系统与陆地生态系统不同,水域生态系统的研究模式不宜应用于陆地生态系统[2]。然而,由于废弃物的填埋、工业生产、人类生活及农业技术的发展,微塑料不论是作为初生微塑料或是次生微塑料进入陆地生态系统,都会对陆地生态系统的物质循环及能量流动产生深远影响。由于其吸附特性,进入土壤的微塑料不仅可以吸附有机污染物[35],也可作为重金属载体,提高重金属的生物可利用性[36],经土壤动物的摄食,在土壤食物链中积累[37-38]。此外,微塑料可以改变土壤物理性质,在土壤中积累到一定浓度,对土壤功能及生物多样性产生影响[2]。
本文综述了土壤中微塑料的来源、分类及其迁移,微塑料的主要分离、筛选、检测方法及其存在问题,微塑料污染、吸附特性及其机理,分析其对土壤动物、土壤微生物及土壤物质循环的影响,并提出了未来的研究重点和方向,为微塑料对土壤生态效应的研究提供参考。
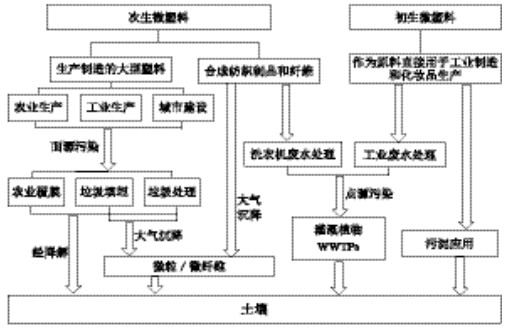
1 微塑料的分类、来源及在环境中的迁移微塑料可以分为初生微塑料和次生微塑料[4]。初生微塑料主要是指在生产中被制成微米级的微塑料颗粒,作为原料用于工业制造或化妆品生产等,如个人护理品去角质剂中添加的塑料微珠[4]。次生微塑料包括:随洗衣废水排放的合成纤维[11];用于农业生产、工业生产和城市建设的大型塑料,经光照、高温及土壤磨损等环境作用,在环境中分裂或降解,或经土壤动物的作用,成为次生微塑料颗粒[2](图 1)。
|
| 图 1 不同分类微塑料微粒进入土壤方式 Figure 1 Entering modes of different classifications of microplastics into soil |
陆地微塑料主要由人类活动产生,主要来源于点源污染及面源污染[25]。点源污染包括污水处理及污水污泥应用,进入工业废水及生活污水的初级微塑料及洗衣废水中的合成微纤维,通过污水排放、废水灌溉及污泥应用等方式进入土壤生态系统[25, 39]。农业中,废水灌溉植物(WWTPs)是微塑料进入农田生态系统的主要途径之一[26, 40-41]。生活中,洗衣过程中产生的合成微纤维及滚筒式干衣机是农田生态系统微塑料的来源之一[2, 11, 39]。面源污染指农业用膜、垃圾填埋及垃圾处理等。农业中地膜的广泛应用成为农田生态系统中次生塑料微粒的来源之一[42-43],由垃圾填埋或其他表面沉积物产生的微粒和微纤维,可由空气作为其载体,通过大气沉降作用进入陆地生态系统[2](图 1)。
食土动物如蚯蚓,食入脆性塑料废弃物后,这些废弃物在其胃囊被磨碎,从而产生次级微塑料[2, 44]。生活于垂直洞穴的深栖类蚯蚓,在土壤表层摄食后,表层的塑料碎片随之进入土壤内部,随排泄物排出体外,或沉积于其洞穴壁,或为其他土壤动物摄食,在土壤食物网中传递,也可以积累于蚯蚓体内[2, 37]。中型区系土壤动物群落如弹尾类动物或螨偶然的咀嚼或碎裂可产生次生塑料微粒,并将其转移至土壤内部[45],挖掘类哺乳动物如囊地鼠或鼹鼠也可使其进入土壤[2](详见第4部分及图 3)。鸟类等迁徙类动物也可以作为微塑料长距离运输的载体,对微塑料的迁移及扩散起到一定作用。
2 微塑料的分离与检测微塑料在土壤中的积累使其可以成为复杂有机质混合物中的一部分或矿物质取代基[46]。由于有机矿物质的相互作用,土壤有机质(SOM)可以在环境中稳定存在几百年[47]。植物凋落物和部分有机体残留于土壤,这些物质及生物有机体降解的不同阶段的物质构成了土壤SOM,因此,土壤SOM成分复杂多样[47-48]。土壤SOM组分复杂多样及微塑料自身的化学性质使得土壤微塑料难于分离和鉴定。用于分析水域生态系统沉积物中微塑料的方法,可能适用于土壤,但土壤中难熔态化合物如木质素、木栓质及鞣酸类物质含量较高,部分地区土壤含有来自生物体不完全燃烧产生的黑炭,使得土壤中的微塑料难以分离和检测[46]。
2.1 土壤微塑料的分离 2.1.1 筛分-分选-移除有机质及其他土壤成分-提取微塑料筛分是利用筛子使土壤中小于筛孔的细粒物料透过筛面,而大于筛孔的粗粒物料留在筛面上,完成粗、细粒物料分离的过程。由于各国对于细粒定义的标准不同,在微塑料筛分过程中存在移除部分微塑料和较大颗粒的问题。根据微塑料不同粒径的定义,Bläsing等[46]建议在分析微塑料样品时,土壤筛选范围为 < 5 mm和 < 1 mm。
筛分后,利用密度分离法可将土壤矿质相移除。聚钨酸钠溶液通常用于土壤不同组分的分离,因为它不仅可以分离游离态颗粒有机物(fPOM),还可以分选SOM中不同的土壤有机矿质复合体[49]。但此法尚未应用于微塑料的分离。由于SOM中有机矿质复合体的分选与微塑料留存于土壤团聚体中的程度有关,因此,在使用密度分离法前,可以采用超声处理法先打碎团聚体,对于不同粒径的土壤团聚体,使用不同的超声能量,例如,在分散粒径大于250 μm的土壤团聚体时,通常使用的超声能量值为60 J·mL-1[50]。
由于密度介于1.0~1.4 g·cm-3的有机质与部分塑料制品如PET密度相似,因此密度分离法不足以去除全部有机质[46]。为了保证微塑料辨识及量化的可靠性,需要采用酸、碱、氧化或酶处理,以去除残留有机质,或使用静电分离法去除有机碎屑[51](表 1)。Avio等[52]使用浓度为22.5 mol·L-1 HNO3对样品进行预处理,Dehaut等[53]对六种预处理方法进行了比较,分别为:浓度为10% KOH,浓度为0.063 mol·L-1 HCl,浓度为14.4 mol·L-1 HNO3,浓度为14.4 mol·L-1 HNO3和浓度为14.4 mol·L-1 HClO3按照体积比4:1混合,浓度为10 mol·L-1 NaOH,浓度为0.27 mol·L-1 K2S2O8和浓度为0.24 mol·L-1 NaOH混合液,研究结果表明,10% KOH,60 ℃消解24 h效果最佳。Cole等[54]用不同浓度的酸、碱及酶对样品进行消解,比较了浓度分别为1、2 mol·L-1及10 mol·L-1 NaOH和浓度分别为1、2 mol·L-1 HCl以及蛋白酶K的消解效果,研究结果表明,蛋白酶K对有机质的去除率大于97%,且不分解微塑料。Mintenig等[55]采用酶消解法对样品进行预处理,在加入十二烷基硫酸钠后,依次加入蛋白酶A-01(1800 U·L-1溶于pH 9 PBS)、脂肪酶FE-01(2320 U·L-1溶于pH 10.5 PBS)以及纤维素酶TXL(44 U·L-1溶于pH 5 PBS)。Nuelle等[56]将样品分别放置于30% H2O2和35% H2O2溶液中处理7 d,结果表明35% H2O2的预处理效果更好。
Fuller等[57]采用加压流体萃取法(PFE),可从土壤中分离粒径小于30 μm的塑料制品,这种方法适用于分离不同类型的塑料,包括PE、PVC、PP等。PFE技术是在亚临界温度和压力条件下,从固体中分离半挥发性有机物,在实验室,这种方法常用于从土壤、沉积物及废弃物中分离有机污染物[57]。
加压萃取仪是一个大的控制系统,主要包括:主控机箱系统、温度控制模块、高压控制模块、气缸控制系统、溶剂配比控制模块等。在样品进入萃取池后,通过溶剂混合阀,来自于高效液相泵的动力将溶剂送入萃取池,萃取池压力达到设定值后,液相泵关闭,满足设定温度后,静萃取开始。静萃取结束后,高压氮气吹扫溶剂至收集瓶中。干燥的残留物通过装有Smart iTR(多功能型衰减全反射法ATR采样附件)的Nicolet 6700智能傅立叶红外光谱仪,以确定塑料类型。
2.2 微塑料的检测傅立叶红外光谱(FT-IR)、拉曼光谱及Pyr-GC-MS热解分析法可以辨识环境中的微塑料并使之定量化。在微塑料的检测中,可以先使用显微技术进行预筛选[51, 58],或使用SEM或ESEM-EDS[59-61]进行表面形态鉴定。显微技术对于数量的估测可能存在高估或低估的问题,有时,由于技术限制,无法鉴定微塑料。SEM目前广泛应用于微生物表面形态鉴定、材料表面形态特征分析等多个领域,其特征是分辨率高,但存在电荷效应。ESEM-EDS主要用于微塑料的元素组成和表面形态的分析。
根据微塑料粒径大小及样品组分的复杂性,可选用拉曼光谱[62-63]、傅立叶红外光谱[55, 58, 64-65]、TED-GC-MS[66-67]。拉曼光谱一般与显微技术联用,可用于鉴定粒径>1 μm的塑料制品,其空间分辨率比FT-IR高,适用于大量研究,但这种方法易受到土壤有机质的自发荧光的干扰,且检测过程耗时长。傅立叶红外光谱适用于粒径>20 μm的塑料制品,相较于拉曼光谱,FT-IR不易受到土壤有机质的自发荧光的干扰,但易受到有机质干扰,且检测过程耗时长。Pyr-GC-MS用于单一形态的鉴定,相较于拉曼光谱和FT-IR,这种方法粒径限制小,但预处理耗时。TGA-solid-phase extraction与TDS-GC-MS合称为TED-GC-MS,这种方法可用于鉴别复杂土壤基质中的聚乙烯、聚丙烯和聚苯乙烯,预处理不需要耗时,但目前只在聚乙烯的定量化中应用(表 2)。
微塑料的物理化学特性决定它们对生态系统的危害远大于大型塑料垃圾。水域生态系统包括海洋生态系统、淡水生态系统及滨海湿地生态系统,微塑料对其影响包括:干扰海洋物质循环;对海洋动物以及海洋藻类的影响[3-4, 6, 8-9, 23]。很多研究将陆地和淡水环境看作海洋生态系统中微塑料的来源和运输途径,但由于大多数塑料制品被用于陆地生态系统,陆地及其邻近淡水环境也面临严峻的微塑料污染问题[25]。
3.1 微塑料自身存在的污染农田生态系统中微塑料颗粒的主要来源包括污水污泥及地膜的广泛应用。在欧洲的农田中,每千克污泥(干质量)中含有1000多甚至超过4000微塑料颗粒,在0~10 cm的土壤中,每千克土壤含有670微塑料纤维(计数)[68-69]。在德国的固废富集区,路边土壤表层塑料含量达39%,合43 454 t·a-1[70]。墨西哥菜田表土的40%~60%覆有塑料袋用于土地覆盖和洪水预防[38]。据估算,随污水和污泥进入欧洲农田的微塑料颗粒每百万居民可达125~850 t(处理和未处理的总和),进入欧洲和北美农田的微塑料总量可分别达63 000~430 000 t·a-1和44 000~300 000 t·a-1[2]。
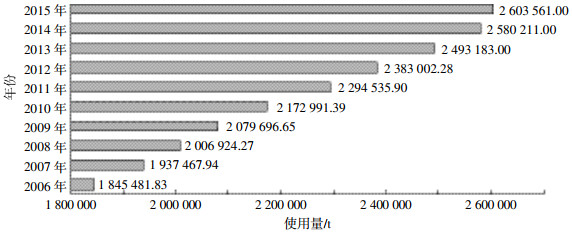
农田地膜覆盖主要用于增温、抗病虫害,促进作物根系发育,改善作物品质等[71]。来自国家统计局的数据显示[72],我国农田塑料薄膜的使用总量从2006年的1 845 481.83 t增加至2015年的2 603 561.00 t(图 2)。在作物的一个生长周期后,残留的地膜在种植新作物前的松土等过程中被分解成碎片,一部分残留于土壤表面,一部分埋入土壤内部。埋入土壤的部分,由于其受光和温度的影响较小,难于分解,可能干扰作物的根系发育,造成严重的土壤环境问题[73]。残留于土壤表面的部分经光照、高温等作用后难以从土壤中移除,高密度聚合物残留于土壤并垂直向下迁移,最终被运输到深层土壤;低密度聚合物通过风力、水力作用,水平迁移至陆地的其他地区或水体表面[25]。塑料地膜中所含有的化学物质及其变化受到诸多因素的影响,如温度、氧含量、酸/碱条件以及可溶性有机质的影响[74-75]。
塑料制品本身含有有害物质,在一定条件下,释放到土壤中。微塑料中所含有的有害物质如双酚-A、邻苯二甲酸盐(如邻苯二甲酸二酯)、PBDEs及用于着色的重金属[74, 76],其在UV辐射、温度、氧含量、土壤酸碱性及可溶性有机质含量的影响下,疏松结合于高聚合物中的有毒物质被释放到环境中[46],通过淋溶作用进入土壤[42, 74-75],对土壤生态系统构成影响,如塑料制品中所含有的邻苯二甲酸二酯是一种致癌、致突变及内分泌干扰物质[77],释放到环境中后,对土壤微生物活性有抑制作用[78],也可通过植物吸收进入食物链从而威胁人类健康[79]。
邻苯二甲酸酯(PAEs)广泛用于塑料产品、个人护理品、食品包装及医疗产品的生产[80-83],PAEs可通过塑料的生产、使用及塑料废物处理等过程进入土壤生态系统[84],农田地膜的使用及家禽粪便是土壤邻苯二甲酸酯的主要来源[85]。Wang等[85]对南京城郊集中管理的菜田土壤的六种优先PAEs的研究表明,总PAEs的范围在0.15~9.68 mg·kg-1,其中位数为1.70 mg·kg-1,其中邻苯二甲酸二丁酯(DnBP)、邻苯二甲酸二(2-乙基己基)酯(DEHP)、邻苯二甲酸二正辛酯(DnOP)三种PAEs的含量最高。Kong等[84]对天津地区城郊农田、菜地、果园和废弃土壤中六种优先PAEs进行了分析,结果表明总PAEs的范围为0.05~10.4 μg·g-1,其中位数为0.32 μg·g-1,其中DnBP和DEHP的含量最高,四种土壤中PAEs浓度依次为菜地>废弃土壤>农田>果园,农用地膜会增加土壤PAEs的含量,城郊土壤中PAEs的主要来源为化妆品、个人护理品和塑化剂,废弃土壤中PAEs的主要来源为固体废弃物。
3.2 微塑料对污染物的吸附作用微塑料可以吸附疏水性有机物(HOCs),如有机氯杀虫剂、PAHs、PCBs、PBDEs及重金属等[36, 76, 86]。由于杀虫剂在农田中的广泛应用、石油开采及陆地运输、污水排放,这些有机污染物及重金属在土壤生态系统中的种类多、浓度高,对陆地生态系统产生严重的影响[87-93]。HOCs有较高的辛醇/水分配系数(Kow),具有疏水性特征,而高分子聚合物-微塑料也具有这样的特性,加之具有比表面积大、表面粗糙及生物粘泥的形成,使二者易于彼此吸附,且可被有机质和土壤微粒吸附,成为土壤团聚体的一部分[2, 25]。
吸附作用包括物理吸附和化学吸附:物理吸附,是在范德华力作用下,吸附质和吸附剂之间的作用,主要取决于比表面积大小;化学吸附,其主要因为相较于水环境,有机污染物的疏水性与微塑料的疏水性表面有更多的相似性[8, 94]。微塑料颗粒的吸附作用与其自身特性有关,如材质、比表面积、表面吸附位点的量、疏水性。塑料是一种高分子聚合物,由重复的结构单体组成的长链分子。如(-CH2-CH2-)n代表聚乙烯(PE),n的数值不同,PE存在状态不同,其性质也不同,长链分子的范德华力更强,链之间的作用力更强,力学性能更好,如模量、强度和断裂韧性[95]。此外,微塑料的来源及其存在年限也对其吸附作用有一定影响,如陆地微塑料颗粒由于受到风化作用及紫外线辐射影响,表面粗糙且比表面积大,这使得它们比海洋中的微塑料更易于吸附有机污染物[74, 96]。不同的环境条件,如pH、盐度、金属阳离子浓度等也影响微塑料的吸附作用。
微塑料颗粒对有机污染物的吸附主要包括由比表面积和范德华力决定的表面吸附、分配作用及高分子聚合物结构的孔隙填充。CB-17为三氯PCBs,是PCBs同系物的一种。Velzeboer等[97]研究了模拟淡水、海水环境下,纳米级微塑料聚苯乙烯PS(粒径为70 nm,表面羧基基团官能化)和微米级微塑料PE(粒径为10~180 μm)对CB-17的吸附效应,其结果表明,微塑料的吸附作用与盐度相关,PE对PCBs的吸附与沉积物中有机质对其吸附作用相似,是基于线性疏水分配,而PS对PCBs的吸附是非线性的,比PE的吸附作用强,这是由于PS有更高的芳香性以及比表面积,其吸附机理为π-π键的相互作用。Rochman等[98]研究了PS与其他五种高分子聚合物(PET、HDPE、PVC、LDPE、PP)对PAHs的吸附作用,其结果表明,在第一个月中PS对PAHs的吸附量大于其他材料。非膨胀型PS为玻璃态,其基本结构单元中含有一个苯环,PE的化学式为(-CH2-CH2-)n,即将PS中苯环的位置用-H进行取代。苯环使得链段运动受阻,但增大了相邻聚合物链之间的距离,使得化学物质更易扩散到聚合物中[99],因此虽然PE的链段运动能力更强,但二者对PAHs的吸附量相似。此外,由于π-π键及强疏水性,PS泡沫塑料常用于SPE中,环境中的芳香类物质如PAHs易与PS产生吸附作用[98]。
Ashton等[100]研究了PE(粒径为4 mm)对主要金属元素(Al、Fe、Mn)及痕量金属元素(Cu、Zn、Pb、Ag、Cd、Co、Cr、Mo、Sb、Sn、U)的吸附作用,其吸附机理可能为:金属阳离子的直接吸附作用,金属离子与塑料表面的带电区或中性区域发生络合作用,与铁锰氧化物产生吸附或共沉淀作用。Kim等[101]研究了表面无添加官能团(PS)及包被羧基官能团(PS-COOH)的两种聚苯乙烯微塑料颗粒,对Ni的吸附作用及其对水蚤的毒性作用。其研究结果表明,Ni与PS共存状态下,Ni的毒性效应低于只有Ni存在时的毒性作用,说明PS对Ni的毒性有一定的拮抗作用;Ni与PS-COOH共存状态下,Ni的毒性效应高于只有Ni存在时的毒性作用,说明PS-COOH对Ni的毒性有一定的协同作用。PS及PS-COOH对Ni的吸附量差异并不显著,可能是由Ni的疏水特性决定,而不是吸附特性,因此,微塑料与污染物的相互作用与污染物自身性质及微塑料的表面官能团有关。Hodson等[102]研究了耕地土、林地土及微塑料颗粒高密度聚乙烯(HDPE)对Zn2+的吸附作用,其结果表明,吸附符合Langmuir和Freundlich方程,由于林地土含有更多的有机质,因此其吸附值最大,在蚯蚓体内,微塑料颗粒负载的Zn2+更易于解吸附,说明微塑料颗粒可以提高Zn2+的生物可利用性,颗粒大小、比表面积、表面特性影响微塑料颗粒与金属离子的吸附作用。Holmes等[103-104]研究表明,微塑料颗粒对金属的吸附符合Langmuir和Fre-undlich方程,未老化及老化塑料对金属元素的吸附均可快速达到平衡状态。二价金属离子与氧离子的相互作用、塑料表面磨损、存在带电污染物及吸附物质,均对其吸附效应有影响。通过中性金属-有机络合物和塑料表面疏水特性的非特异性结合,也可以产生吸附作用。塑料的存在年限也对其吸附作用有影响,自然条件下受到磨损的老化微塑料颗粒更易于吸附金属,老化的塑料由于其本身结构的变化,如光氧化、风化作用可以使其表面产生含氧基团,从而提高了聚合物的极性,以及表面生物膜和化学物质沉积,如含有氢沉积物的积累可以增加表面电荷、表面粗糙度、孔隙度以及亲水性,均对其吸附作用有一定影响。
微塑料表面可能形成生物膜[105],可以作为潜在病原菌或外来物种的载体,从而对土壤生物和环境构成威胁。此外,营养物质的可利用性也影响微塑料的吸附。Foulon等[106]研究了在不同介质中(Zobell培养基和人工海水)加入或未加入自然海洋骨料后,弧菌属V. crassostreae,J2-9菌株的定殖能力,研究发现,Zobell培养基中,被J2-9菌株定殖的颗粒物百分比最高,营养物质的可利用性对定殖有重要作用,可用于鞭毛和胞外多糖生产的营养物质越多,越有利于细菌的定殖作用。
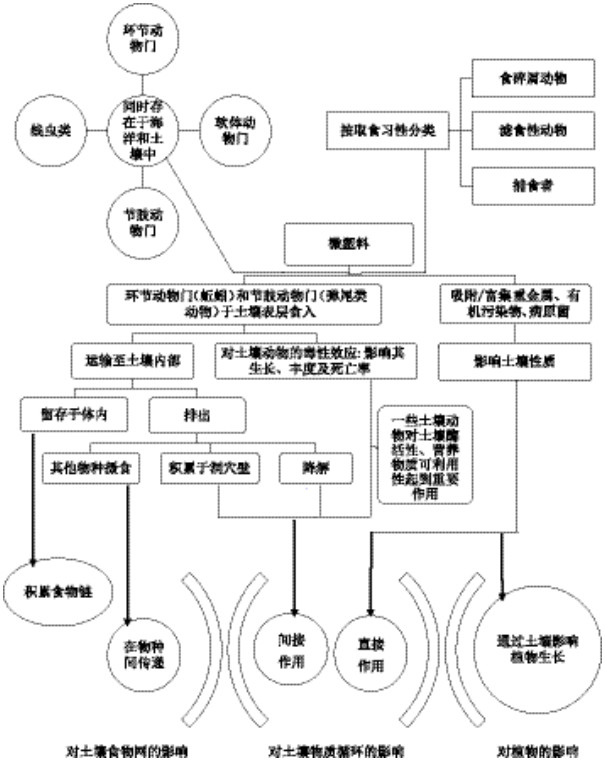
4 微塑料的生态效应 4.1 对土壤动物的影响微塑料对土壤动物影响的相关研究较少[25],目前用于研究的土壤动物包括蚯蚓[25, 37-38, 107-108]、线虫[109]及弹尾虫[45]。在研究微塑料对土壤动物的影响时,可借助其对水域生态系统动物影响的相关研究。来源于水域生态系统的土壤动物,如滤食性动物生存于土壤表面的薄层水膜中,环节动物门、软体动物门、节肢动物门及线虫等动物既存在于淡水和海洋生态系统中,也生存于土壤中,由于这些存在于不同生态系统但属于同一门类的土壤动物有相似的摄食习惯[25],因此,微塑料对海洋生物的影响,可部分适用于土壤动物[2](图 3)。
|
| 图 3 微塑料对陆地生态系统的影响 Figure 3 The effects of microplastics on terrestrial ecosystem |
微塑料影响动物的个体生长、繁殖及其多样性。微塑料进入动物体内后,可以引起器官及组织的物理撕裂,机体也会对入侵的异源物质产生炎症响应,而由于食入的微塑料替代了食物,也会引起生物的养分及能源供应不足,微塑料自身释放的有毒物质及吸附的污染物的毒性作用,会对个体本身及物种多样性产生不同程度的影响[110-111]。微塑料对动物的作用与其粒径、浓度、动物自身生理特征等诸多因素相关。
目前微塑料粒径大小对土壤动物影响方面的研究较少,但其粒径大小对不同门类的海洋生物的影响已得到广泛证实[112-114]。粒径与动物口大小的比例,影响动物对微塑料的摄食[25]。粒径小于1 mm的微塑料颗粒易于被土壤动物误食,土壤动物食入微塑料后,既可将其排泄到周围环境中,也可残存于体内[2]。研究表明,微塑料不仅比其他摄入物质更易于存留于肠道内,而且还可以穿过肠道壁,传输到生物体的其他组织中[115-116]。微塑料在动物体组织和器官中的积累、转移及其毒性效应也与粒径相关。粒径>1 mm的微塑料颗粒保留在肠道内或随排泄物排出,而小颗粒更易于转移、积累,为细胞所吞噬,这可能与细胞内吞噬小体的空间有限性有关[117]。粒径为0~80 μm的HDPE引起蓝色贻贝(Mytilus edulis)强烈的炎症反应[110],纳米级PS(粒径为30 nm)使生物的过滤活性降低[118],PS单体会造成贻贝细胞DNA损伤[119]。Lee等[113]研究了三种粒径0.05、0.5 μm和6 μm的PS,在不同浓度下对桡脚类动物(T. japonicus)的毒性效应,其研究结果表明,粒径为0.5 μm和6 μm的PS在所有浓度下均是产卵量显著下降,说明微米级和纳米级微塑料颗粒对海洋桡脚类动物有负面作用。
微塑料对生物的作用也与其浓度有关。蚯蚓分布广泛,对土壤污染胁迫比较敏感,常作为土壤质量的指示者,并作为生态毒理国际标准中推荐受试物种之一。Huerta Lwanga等[37-38]研究了不同浓度微塑料(聚乙烯,< 150 μm)对蚯蚓Lumbricus terrestris L.的生长率及丰度的作用,在聚乙烯浓度达到60%时,其死亡率最高,生长率出现负值,与对照及低浓度相比,高浓度聚乙烯(28%和45%)均对其死亡率及生长率产生不利影响。Cao等[44]研究了不同浓度微塑料(PS,58 μm)对蚯蚓(E. Foetida)的影响发现,低浓度微塑料[ < 0.5%(m/m)]对其丰度影响很小,而高浓度(1%和2%)显著抑制其生长并增加其死亡率。Rodriguez-Seijo等[107]研究不同浓度微塑料颗粒对陆地蚯蚓(E. Andrei)的毒性效应,微塑料采用PE颗粒,粒径范围为250~1000 μm,每100 mg微塑料平均颗粒数为(396±52)(STDEV),虽然不同浓度微塑料颗粒对E. Andrei的存活、数量以及28 d实验周期后其质量的影响并不显著,但对其肠道病理检测的结果表明,在微塑料浓度>125 mg·kg-1时,会造成明显的组织损伤,不同浓度微塑料颗粒也会激发不同程度的免疫反应。
微塑料对动物的影响也与动物自身的生理、行为特性相关,这种影响在海洋微塑料研究中已得到了广泛证明[3, 20]。摄食微塑料的海洋生物分布于广泛的营养级层次,有不同的取食策略,包括食碎屑动物、滤食性动物及捕食者[25]。滤食性动物易于积累毒性,在水域生态系统中作为营养模式的典型范例。微塑料在低营养级生物中积累[4, 115-116],直接作用于土壤关键动物物种从而影响食物网。中小型区系土壤动物,如弹尾类动物、螨或蚯蚓食入微塑料,将其积累在土壤碎屑食物网中[2]。蚯蚓连接了土壤圈与大气圈,沟通了土壤生物同地上生物之间的联系,鼹鼠、獾、鸟类等取食蚯蚓,使积累于蚯蚓体内的微塑料通过食物链在不同物种间传递,从而影响其他土壤动物[116, 120-121]。线虫在自然状态下以微生物为食,实验室条件下以大肠杆菌为食。Kiyama等[109]研究表明,在缺少食物的状态下,0.5 μm和1 μm的PS颗粒更易于积累于线虫(Caenorhabditis elegans)体内,在细菌与线虫的比例为1:100或1:10时,粒径为0.5 μm的PS颗粒的积累量显著下降,这可能与线虫的取食策略有关。
微塑料对土壤溶液及其周围土壤环境中的重金属、有机污染物及病原菌有吸附作用。动物在食入作为污染物载体的微塑料后,污染物的毒性作用会对动物生理产生影响,进而可以通过食物链/网的积累,对土壤生态系统构成威胁。微塑料的存留时间也对其毒性有一定影响,留存越长,其致毒作用越显著。随着留存时间的增加,微塑料受到气候(如风化、光照等)作用影响,表面性质会发生改变,使其对污染物的吸附作用增强,从而使其毒性增加。环境因子对微塑料的作用还包括使其自身有毒物质淋溶至土壤中[105, 122],淋溶至土壤内部的有毒污染物,会对土壤动物产生直接影响。
4.2 对土壤微生物的影响微塑料由土壤动物带入土壤内部,吸附于其表面的重金属、污染物及病原菌也随之进入土壤内部,对土壤微生物区系、土壤理化性质乃至植物生长均会产生不同程度的影响。当前,暂无土壤微塑料与微生物相关作用的文章,只有少量关于海洋微塑料和沿海海底沉积物与微生物相关作用的报道[5, 106, 123]。Foulon等[106]发现弧菌属V. crassostreae,J2-9菌株可定殖于颗粒物。V. crassostreae,J2-9菌株是牡蛎致病菌[124]。海洋真菌Zalerion maritimum在低营养条件下可以利用PE,从而对PE有降解作用,使PE的质量和粒径减小[5]。Harrison等[123]发现在沿海海底沉积物中,Arcobacter和Colwellia可迅速定殖于LDPE(Low-density polyethylene)上,这两种菌种在低温海水环境下与石油烃污染物降解相关。
4.3 对土壤物质循环的影响当前,有关微塑料对土壤物质循环的研究较少,因此,它们对土壤物质循环起到促进或抑制作用及其作用机理等相关问题亟待解决。由于微塑料难于降解,可以长久留存于土壤中,一旦积累至一定浓度,对土壤乃至陆地生态系统功能及生物多样性会产生影响[2]。
微塑料可以直接影响土壤的理化性质及物质循环[125]。Liu等[125]研究两种浓度梯度微塑料(聚丙烯,< 180 μm)对土壤可溶性有机碳(DOC)、可溶性有机氮(DON)、可溶性有机磷(DOP)及PO43-浓度和FDA水解酶、酚氧化酶活性的影响,在加入微塑料颗粒的第30 d,低浓度的微塑料对可溶性有机物(DOM)中的有机碳、无机氮、总磷、高分子量的腐殖质类物质及富里酸的影响很小,而高浓度微塑料显著增加了DOM中的DOC、DON、DOP、PO43-、NO3-、高分子量的腐殖质类物质及富里酸[125]。微塑料可以吸附土壤溶液中有害物质,改变土壤物理性质,如增加孔隙度、改变团粒结构或成为土壤团聚体的一部分等而起作用[2, 37-38],而这些变化可以改变微生物活性[126-127]。酶活性作为微生物活性及营养物质可利用性的代表,在土壤物质循环中起到重要作用,微生物活动的增强,使得胞外酶分泌增加,对土壤C、N、P等营养元素的释放起到推动作用,从而促进营养元素在植物-土壤间的迁移[125, 128]。
土壤动物对土壤生态系统的物质循环有极其重要的作用[69],微塑料也可能通过对土壤物种多样性的作用,影响土壤物质循环。在土壤动物对微塑料的食入-排出过程中,随排泄物排入土壤的微塑料,既可以为其他生物所摄食,也可能被降解[5, 42, 130],从而对土壤初级和次级生产力、有机质降解以及养分循环产生影响[38](图 3)。
蚯蚓在土壤形成、土壤结构和肥力保持方面有重要作用。Huerta Lwanga等[37-38]在研究中所使用的陆生蚯蚓Lumbricus terrestris L.属于深栖类蚯蚓的一种,其洞穴深度1 m、直径3~10 mm[131]。L. terrestris于土壤表面摄食,食入的微塑料经消化道排出体外沉积在其洞穴壁上[132-133],在其对微塑料的食入-排出过程中,微塑料进入土壤内部。土壤中存在的大量弹尾类动物被看作是微塑料运输的潜在媒介[134]。节肢动物门生物在土壤表层10 cm达到其最大密度,虽然活动范围相对较小[135],但它们在将土壤表面的微塑料运输到土壤内部的过程中,起到重要作用[45]。进入土壤内部的微塑料颗粒,对更多的土壤动物构成威胁[136],通过影响土壤物种多样性间接作用于土壤的物质降解及营养循环。这些微塑料颗粒也可能对土壤结构产生影响,若纳入土壤团聚体结构,其吸附的有机、无机污染物的生物可利用性会受到一定影响[2],进而影响土壤结构及物质循环(图 3)。
吸附于微塑料的污染物及微塑料自身产生的有毒物质进入动物体内后,其毒性作用对动物生理生化、生长发育繁殖产生影响,进而影响土壤物种多样性,从而影响植物生长及土壤物质循环(图 3)。Athmann等[137]研究表明,L. terrestris可以改善被植物根系所占据的底土生物孔隙,增加微生物生物量及酶活性,增加C及营养物质的输入,为植物提供更多可利用的营养物质如P,从而促进植物生长及土壤物质循环。而一旦这种在物质循环中起重要作用的土壤动物生长及数量受到影响,那么土壤及地上植物间的物质循环及能量流动会受到影响,进而影响到整个生态系统。
5 展望由于废弃物的填埋、工业生产、人类生活及农业技术的发展,微塑料不论是作为初级微塑料或是次级微塑料进入陆地生态系统,对陆地生态系统的物质循环及能量流动均会产生深远影响。但当前,微塑料对土壤生态系统的影响相关研究很少。微塑料种类多、成分复杂,其对土壤理化性质、土壤动物及土壤物质能量周转的影响受到诸多环境因素的制约。在未来的研究中,以下几方面问题亟待解决:
(1)土壤结构成分复杂,土壤中的微塑料颗粒来源广泛且部分大型塑料,如地膜经过光照、高温等作用后,分解为小型塑料,难以分离,并对土壤生态系统构成严重威胁。因此土壤微塑料的分离检测是目前亟待解决的问题。可借助海滩、沉积物及底泥微塑料颗粒目前已有的分离、检测方法尝试对土壤中微塑料颗粒进行分离和鉴定。
(2)不同来源、不同类别微塑料颗粒的环境效应不同。微塑料颗粒对土壤的改变主要包括对土壤孔隙度的改变、吸附作用等,一些大型塑料如地膜,经环境降解后,自身还会释放出有毒物质,对土壤生态系统构成威胁。因此,在研究微塑料的环境效应时,需要分别考虑不同来源微塑料颗粒的环境效应。此外,不同类别微塑料颗粒由于其基本结构不同,对污染物的吸附性不同,对土壤影响不同,因此,在实验中可选用不同类别、不同用途的微塑料,研究其环境效应。
(3)不同粒径微塑料颗粒的环境效应不同。由于不同粒径微塑料颗粒对土壤生物体的毒性效应尚不明确,需要进行毒性实验,如采用生物标记法,以确定土壤中微塑料的毒性机理。不论是初生微塑料颗粒或是次生微塑料颗粒在进入环境中后,都会继续分解成为更小的颗粒,这些小颗粒与化学物质相互作用的表面积大、被摄取的可能性大,因此,对生物体的健康构成极大威胁。当前,纳米颗粒的环境行为得到了深入的研究,由于纳米粒子具有一定的相似之处,因此,将已有检测方法和风险评价用于纳米微塑料颗粒的研究,有助于全面了解其环境行为。
(4)陆地微塑料来源广泛,生产量大,不易监管且难于估测其浓度。当前一些研究对水域塑料污染物生命周期的流通循环建立模型,也有研究通过产品的生命周期评价对水域微塑料的排放进行定量化研究,而目前尚无陆地区域微塑料留存循环模型的研究,因此可借助LCA体系对塑料制品进行环境影响评价。
(5)微塑料颗粒的污染效应还与诸多其他因素相关,如土壤结构和成分、气候及环境因素等。不同气候条件(如紫外辐射、温度等)及环境条件(如不同类型的土壤)对微塑料表面性质的改变均有不同影响,从而对其污染效应的影响不同,因此,在研究其污染效应时,需考虑不同环境条件对其污染效应的影响。
微塑料颗粒对土壤生态系统的污染效应主要包括以下几个方面:可能会增加土壤孔隙度,吸附土壤溶液中的污染物,促进酶活性,对物质周转产生影响,吸附于微塑料表面的病源菌、污染物也可能对土壤动物、微生物群落产生不利影响。目前微塑料对土壤效应的研究很少,未来,可以从微塑料对主植物的影响、对微生物及物质循环的影响以及微塑料的复合污染效应等几个方面研究微塑料颗粒的污染效应。
| [1] |
Law K L, Thompson R C. Oceans.Microplastics in the seas[J]. Science, 2014, 345(6193): 144-145. DOI:10.1126/science.1254065 |
| [2] |
Rillig M C. Microplastic in terrestrial ecosystems and the soil?[J]. Environmental Science & Technology, 2012, 46(12): 6453-6454. |
| [3] |
Auta H S, Emenike C U, Fauziah S H. Distribution and importance of microplastics in the marine environment:A review of the sources, fate, effects, and potential solutions[J]. Environment International, 2017, 102: 165-176. DOI:10.1016/j.envint.2017.02.013 |
| [4] |
Cole M, Lindeque P, Halsband C, et al. Microplastics as contaminants in the marine environment:A review[J]. Marine Pollution Bulletin, 2011, 62(12): 2588-2597. DOI:10.1016/j.marpolbul.2011.09.025 |
| [5] |
Paço A, Duarte K, da Costa J P, et al. Biodegradation of polyethylene microplastics by the marine fungus Zalerion maritimum[J]. Science of the Total Environment, 2017, 586: 10-15. DOI:10.1016/j.scitotenv.2017.02.017 |
| [6] |
Salvador Cesa F, Turra A, Baruque-Ramos J. Synthetic fibers as microplastics in the marine environment:A review from textile perspective with a focus on domestic washings[J]. Science of the Total Environment, 2017, 598: 1116-1129. DOI:10.1016/j.scitotenv.2017.04.172 |
| [7] |
Santana M F M, Moreira F T, Turra A. Trophic transference of microplastics under a low exposure scenario:Insights on the likelihood of particle cascading along marine food-webs[J]. Marine Pollution Bulletin, 2017, 121(1/2): 154-159. |
| [8] |
Wang J D, Tan Z, Peng J J, et al. The behaviors of microplastics in the marine environment[J]. Marine Environmental Research, 2016, 113: 7-17. DOI:10.1016/j.marenvres.2015.10.014 |
| [9] |
Zhang W W, Zhang S F, Wang J Y, et al. Microplastic pollution in the surface waters of the Bohai Sea, China[J]. Environmental Pollution, 2017, 231: 541-548. DOI:10.1016/j.envpol.2017.08.058 |
| [10] |
Abayomi O A, Range P, Al-Ghouti M A, et al. Microplastics in coastal environments of the Arabian Gulf[J]. Marine Pollution Bulletin, 2017, 124(1): 181-188. DOI:10.1016/j.marpolbul.2017.07.011 |
| [11] |
Browne M A, Crump P, Niven S J, et al. Accumulation of microplastic on shorelines woldwide:Sources and sinks[J]. Environmental Science & Technology, 2011, 45(21): 9175-9179. |
| [12] |
Hinata H, Mori K, Ohno K, et al. An estimation of the average residence times and onshore-offshore diffusivities of beached microplastics based on the population decay of tagged meso-and macrolitter[J]. Marine Pollution Bulletin, 2017, 122(1/2): 17-26. |
| [13] |
Ling S D, Sinclair M, Levi C J, et al. Ubiquity of microplastics in coastal seafloor sediments[J]. Marine Pollution Bulletin, 2017, 121(1/2): 104-110. |
| [14] |
Massos A, Turner A. Cadmium, lead and bromine in beached microplastics[J]. Environmental Pollution, 2017, 227: 139-145. DOI:10.1016/j.envpol.2017.04.034 |
| [15] |
Mohamed Nor N H, Obbard J P. Microplastics in Singapore's coastal mangrove ecosystems[J]. Marine Pollution Bulletin, 2014, 79(1/2): 278-283. |
| [16] |
Nel H A, Hean J W, Noundou X S, et al. Do microplastic loads reflect the population demographics along the southern African coastline?[J]. Marine Pollution Bulletin, 2017, 115(1/2): 115-119. |
| [17] |
Qiu Q X, Peng J P, Yu X B, et al. Occurrence of microplastics in the coastal marine environment:First observation on sediment of China[J]. Marine Pollution Bulletin, 2015, 98(1/2): 274-280. |
| [18] |
Yu X B, Peng J P, Wang J D, et al. Occurrence of microplastics in the beach sand of the Chinese inner sea:The Bohai Sea[J]. Environmental Pollution, 2016, 214: 722-730. DOI:10.1016/j.envpol.2016.04.080 |
| [19] |
Peng G Y, Zhu B S, Yang D Q, et al. Microplastics in sediments of the Changjiang Estuary, China[J]. Environmental Pollution, 2017, 225: 283-290. DOI:10.1016/j.envpol.2016.12.064 |
| [20] |
Vendel A L, Bessa F, Alves V E N, et al. Widespread microplastic ingestion by fish assemblages in tropical estuaries subjected to anthropogenic pressures[J]. Marine Pollution Bulletin, 2017, 117(1/2): 448-455. |
| [21] |
Zhao S Y, Zhu L X, Li D J. Microplastic in three urban estuaries, China[J]. Environmental Pollution, 2015, 206: 597-604. DOI:10.1016/j.envpol.2015.08.027 |
| [22] |
Zhao S Y, Zhu L X, Wang T, et al. Suspended microplastics in the surface water of the Yangtze Estuary System, China:First observations on occurrence, distribution[J]. Marine Pollution Bulletin, 2014, 86(1/2): 562-568. |
| [23] |
Anderson P J, Warrack S, Langen V, et al. Microplastic contamination in Lake Winnipeg, Canada[J]. Environmental Pollution, 2017, 225: 223-231. DOI:10.1016/j.envpol.2017.02.072 |
| [24] |
Horton A A, Svendsen C, Williams R J, et al. Large microplastic particles in sediments of tributaries of the River Thames, UK-Abundance, sources and methods for effective quantification[J]. Marine Pollution Bulletin, 2017, 114(1): 218-226. DOI:10.1016/j.marpolbul.2016.09.004 |
| [25] |
Horton A A, Walton A, Spurgeon D J, et al. Microplastics in freshwater and terrestrial environments:Evaluating the current understanding to identify the knowledge gaps and future research priorities[J]. Science of the Total Environment, 2017, 586: 127-141. DOI:10.1016/j.scitotenv.2017.01.190 |
| [26] |
Leslie H A, Brandsma S H, van Velzen M J M, et al. Microplastics en route:Field measurements in the Dutch river delta and Amsterdam canals, wastewater treatment plants, North Sea sediments and biota[J]. Environment International, 2017, 101: 133-142. DOI:10.1016/j.envint.2017.01.018 |
| [27] |
Nel H A, Dalu T, Wasserman R J. Sinks and sources:Assessing microplastic abundance in river sediment and deposit feeders in an Austral temperate urban river system[J]. Science of the Total Environment, 2018, 612: 950-956. DOI:10.1016/j.scitotenv.2017.08.298 |
| [28] |
Sruthy S, Ramasamy E V. Microplastic pollution in Vembanad Lake, Kerala, India:The first report of microplastics in lake and estuarine sediments in India[J]. Environmental Pollution, 2017, 222: 315-322. DOI:10.1016/j.envpol.2016.12.038 |
| [29] |
Vaughan R, Turner S D, Rose N L. Microplastics in the sediments of a UK urban lake[J]. Environmental Pollution, 2017, 229: 10-18. DOI:10.1016/j.envpol.2017.05.057 |
| [30] |
Wang J D, Peng J P, Tan Z, et al. Microplastics in the surface sediments from the Beijiang River littoral zone:Composition, abundance, surface textures and interaction with heavy metals[J]. Chemosphere, 2017, 171: 248-258. DOI:10.1016/j.chemosphere.2016.12.074 |
| [31] |
Zhang K, Su J, Xiong X, et al. Microplastic pollution of lakeshore sediments from remote lakes in Tibet plateau, China[J]. Environmental Pollution, 2016, 219: 450-455. DOI:10.1016/j.envpol.2016.05.048 |
| [32] |
Holland E R, Mallory M L, Shutler D. Plastics and other anthropogenic debris in freshwater birds from Canada[J]. Science of the Total Environment, 2016, 571: 251-258. DOI:10.1016/j.scitotenv.2016.07.158 |
| [33] |
Sanchez W, Bender C, Porcher J-M. Wild gudgeons(Gobio gobio) from French rivers are contaminated by microplastics:Preliminary study and first evidence[J]. Environmental Research, 2014, 128: 98-100. DOI:10.1016/j.envres.2013.11.004 |
| [34] |
Wright S L, Thompson R C, Galloway T S. The physical impacts of microplastics on marine organisms:A review[J]. Environmental Pollution, 2013, 178: 483-492. DOI:10.1016/j.envpol.2013.02.031 |
| [35] |
Beckingham B, Ghosh U. Differential bioavailability of polychlorinated biphenyls associated with environmental particles:Microplastic in comparison to wood, coal and biochar[J]. Environmental Pollution, 2017, 220: 150-158. DOI:10.1016/j.envpol.2016.09.033 |
| [36] |
Hodson M E, Duffus-Hodson C A, Clark A, et al. Plastic bag derived-microplastics as a vector for metal exposure in terrestrial invertebrates[J]. Environmental Science & Technology, 2017, 51(8): 4714-4721. |
| [37] |
Huerta Lwanga E, Gertsen H, Gooren H, et al. Incorporation of microplastics from litter into burrows of Lumbricus terrestris[J]. Environmental Pollution, 2017, 220: 523-531. DOI:10.1016/j.envpol.2016.09.096 |
| [38] |
Huerta Lwanga E, Gertsen H, Gooren H, et al. Microplastics in the terrestrial ecosystem:Implications for Lumbricus terrestris(Oligochaeta, Lumbricidae)[J]. Environmental Science & Technology, 2016, 50(5): 2685-2691. |
| [39] |
Zubris K A V, Richards B K. Synthetic fibers as an indicator of land application of sludge[J]. Environmental Pollution, 2005, 138(2): 201-211. DOI:10.1016/j.envpol.2005.04.013 |
| [40] |
Nizzetto L, Futter M, Langaas S. Are agricultural soils dumps for microplastics of urban origin?[J]. Environmental Science & Technology, 2016, 50(20): 10777-10779. |
| [41] |
Ziajahromi S, Neale P A, Rintoul L, et al. Wastewater treatment plants as a pathway for microplastics:Development of a new approach to sample wastewater-based microplastics[J]. Water Research, 2017, 112: 93-99. DOI:10.1016/j.watres.2017.01.042 |
| [42] |
Roy P K, Hakkarainen M, Varma I K, et al. Degradable polyethylene:Fantasy or reality[J]. Environmental Science & Technology, 2011, 45(10): 4217-4227. |
| [43] |
Steinmetz Z, Wollmann C, Schaefer M, et al. Plastic mulching in agriculture.Trading short-term agronomic benefits for long-term soil degradation?[J]. Science of the Total Environment, 2016, 550: 690-705. DOI:10.1016/j.scitotenv.2016.01.153 |
| [44] |
Cao D D, Wang X, Luo X X, et al. Effects of polystyrene microplastics on the fitness of earthworms in an agricultural soil[C]. IOP Conference Series: Earth and Environmental Science, 2017, 61: 012148.
|
| [45] |
Maaß S, Daphi D, Lehmann A, et al. Transport of microplastics by two collembolan species[J]. Environmental Pollution, 2017, 225: 456-459. DOI:10.1016/j.envpol.2017.03.009 |
| [46] |
Bläsing M, Amelung W. Plastics in soil:Analytical methods and possible sources[J]. Science of the Total Environment, 2018, 612: 422-435. DOI:10.1016/j.scitotenv.2017.08.086 |
| [47] |
Kögel-Knaber K-K, Amelung W. Dynamics, chemistry, and preservation of organic matter in soils[M]. Treatise on Geochemistry, 2nd Edition, Oxford: Elsevier, 2014, 157-215.
|
| [48] |
Lehmann J, Kleber M. The contentious nature of soil organic matter[J]. Nature, 2015, 528(7580): 60-68. DOI:10.1038/nature16045 |
| [49] |
Christensen B T. Carbon in primary and secondary organo-mineral complexes[M]. Structure and Organic Matter Storage in Agricultural Soils, Lewis Publishers, CRC Press, Boca raton, Florida, 1996: 97-165.
|
| [50] |
Kaiser M, Asefaw Berhe A. How does sonication affect the mineral and organic constituents of soil aggregates?:A review[J]. Journal of Plant Nutrition and Soil Science, 2014, 177(4): 479-495. DOI:10.1002/jpln.201300339 |
| [51] |
Hidalgo-Ruz V, Gutow L, Thompson R C, et al. Microplastics in the marine environment:A review of the methods used for identification and quantification[J]. Environmental Science & Technology, 2012, 46(6): 3060-3075. |
| [52] |
Avio C G, Gorbi S, Regoli F. Experimental development of a new protocol for extraction and characterization of microplastics in fish tissues:First observations in commercial species from Adriatic Sea[J]. Marine Environmental Research, 2015, 111: 18-26. DOI:10.1016/j.marenvres.2015.06.014 |
| [53] |
Dehaut A, Cassone A-L, Frère L, et al. Microplastics in seafood:Benchmark protocol for their extraction and characterization[J]. Environmental Pollution, 2016, 215: 223-233. DOI:10.1016/j.envpol.2016.05.018 |
| [54] |
Cole M, Webb H, Lindeque P K, et al. Isolation of microplastics in biota-rich seawater samples and marine organisms[J]. Scientific Reports, 2015, 4: 4528. DOI:10.1038/srep04528 |
| [55] |
Mintenig S M, Int-Veen I, Löder M G J, et al. Identification of microplastic in effluents of waste water treatment plants using focal plane array-based micro-Fourier-transform infrared imaging[J]. Water Research, 2017, 108: 365-372. DOI:10.1016/j.watres.2016.11.015 |
| [56] |
Nuelle M-T, Dekiff J H, Remy D, et al. A new analytical approach for monitoring microplastics in marine sediments[J]. Environmental Pollution, 2014, 184: 161-169. DOI:10.1016/j.envpol.2013.07.027 |
| [57] |
Fuller S, Gautam A. A Procedure for measuring microplastics using pressurized fluid extraction[J]. Environmental Science & Technology, 2016, 50(11): 5774-5780. |
| [58] |
Löder M G J, Gerdts G. Methodology used for the detection and identification of microplastics: A critical appraisal[M]//Bergmann M, Gutow L, Klages M. Marine Anthropogenic Litter, Springer, Cham, 2015: 201-227.
|
| [59] |
Vianello A, Boldrin A, Guerriero P, et al. Microplastic particles in sediments of Lagoon of Venice, Italy:First observations on occurrence, spatial patterns and identification[J]. Estuarine, Coastal and Shelf Science, 2013, 130: 54-61. DOI:10.1016/j.ecss.2013.03.022 |
| [60] |
Corcoran P L, Biesinger M C, Grifi M. Plastics and beaches:A degrading relationship[J]. Marine Pollution Bulletin, 2009, 58(1): 80-84. DOI:10.1016/j.marpolbul.2008.08.022 |
| [61] |
Van Cauwenberghe L, Vanreusel A, Mees J, et al. Microplastic pollution in deep-sea sediments[J]. Environmental Pollution, 2013, 182: 495-499. DOI:10.1016/j.envpol.2013.08.013 |
| [62] |
von Sperber C, Lewandowski H, Tamburini F, et al. Kinetics of enzyme-catalysed oxygen isotope exchange between phosphate and water revealed by Raman spectroscopy:Kinetics of enzyme-catalysed oxygen isotope exchange[J]. Journal of Raman Spectroscopy, 2017, 48(3): 368-373. DOI:10.1002/jrs.v48.3 |
| [63] |
Qiu Q X, Tan Z, Wang J D, et al. Extraction, enumeration and identification methods for monitoring microplastics in the environment[J]. Estuarine, Coastal and Shelf Science, 2016, 176: 102-109. DOI:10.1016/j.ecss.2016.04.012 |
| [64] |
Löder M G J, Kuczera M, Mintenig S, et al. Focal plane array detector-based micro-Fourier-transform infrared imaging for the analysis of microplastics in environmental samples[J]. Environmental Chemistry, 2015, 12(5): 563-581. DOI:10.1071/EN14205 |
| [65] |
Rocha-Santos T, Duarte A C. A critical overview of the analytical approaches to the occurrence, the fate and the behavior of microplastics in the environment[J]. Trends in Analytical Chemistry, 2015, 65: 47-53. DOI:10.1016/j.trac.2014.10.011 |
| [66] |
Dümichen E, Barthel A-K, Braun U, et al. Analysis of polyethylene microplastics in environmental samples, using a thermal decomposition method[J]. Water Research, 2015, 85: 451-457. DOI:10.1016/j.watres.2015.09.002 |
| [67] |
Dümichen E, Eisentraut P, Bannick C G, et al. Fast identification of microplastics in complex environmental samples by a thermal degradation method[J]. Chemosphere, 2017, 174: 572-584. DOI:10.1016/j.chemosphere.2017.02.010 |
| [68] |
Zubris K A V, Richards B K. Synthetic fibers as an indicator of land application of sludge[J]. Environmental Pollution, 2005, 138(2): 201-211. DOI:10.1016/j.envpol.2005.04.013 |
| [69] |
Barnes D K A, Galgani F, Thompson R C, et al. Accumulation and fragmentation of plastic debris in global environments[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2009, 364(1526): 1985-1998. DOI:10.1098/rstb.2008.0205 |
| [70] |
Hohenblum P, Liebmann B, Liedermann M. Austrian federal ministry of agriculture, forestry, environment and water management, plastic and microplastic in the environment[R]. Vienna: Umweltbundesamt GmbH, 2015.
|
| [71] |
Steinmetz Z, Wollmann C, Schaefer M, et al. Plastic mulching in agriculture.Trading short-term agronomic benefits for long-term soil degradation?[J]. Science of the Total Environment, 2016, 550: 690-705. DOI:10.1016/j.scitotenv.2016.01.153 |
| [72] |
中国国家统计局. 农业-农用塑料薄膜使用量[DB/OL]. [2015]. http://www.stats.gov.cn/. National Bureau of Statistics of the People's Republic of China. Agriculture-total use of agriculture film[DB/OL]. [2015]. http://www.stats.gov.cn/. |
| [73] |
Kasirajan S, Ngouajio M. Polyethylene and biodegradable mulches for agricultural applications:A review[J]. Agronomy for Sustainable Development, 2012, 32(2): 501-529. DOI:10.1007/s13593-011-0068-3 |
| [74] |
Teuten E L, Saquing J M, Knappe D R U, et al. Transport and release of chemicals from plastics to the environment and to wildlife[J]. Philosophical Transactions of the Royal Society B:Biological Sciences, 2009, 364(1526): 2027-2045. DOI:10.1098/rstb.2008.0284 |
| [75] |
Xu S Y, Zhang H, He P J, et al. Leaching behaviour of bisphenol A from municipal solid waste under landfill environment[J]. Environmental Technology, 2011, 32(11): 1269-1277. DOI:10.1080/09593330.2010.535175 |
| [76] |
Rochman C M, Manzano C, Hentschel B T, et al. Polystyrene plastic:A source and sink for polycyclic aromatic hydrocarbons in the marine environment[J]. Environmental Science & Technology, 2013, 47(24): 13976-13984. |
| [77] |
Erkekoglu P, Kocer-Gumusel B. Genotoxicity of phthalates[J]. Toxicology Mechanisms and Methods, 2014, 24(9): 616-626. DOI:10.3109/15376516.2014.960987 |
| [78] |
Wang J, Lv S H, Zhang M Y, et al. Effects of plastic film residues on occurrence of phthalates and microbial activity in soils[J]. Chemosphere, 2016, 151: 171-177. DOI:10.1016/j.chemosphere.2016.02.076 |
| [79] |
Sun J Q, Wu X Q, Gan J. Uptake and metabolism of phthalate esters by edible plants[J]. Environmental Science & Technology, 2015, 49(14): 8471-8478. |
| [80] |
Cai Q Y, Mo C H, Wu Q T, et al. The status of soil contamination by semivolatile organic chemicals(SVOCs) in China:A review[J]. Science of the Total Environment, 2008, 389(2/3): 209-224. |
| [81] |
Gómez-Hens A, Aguilar-Caballos M. Social and economic interest in the control of phthalic acid esters[J]. Trends in Analytical Chemistry, 2003, 22(11): 847-857. DOI:10.1016/S0165-9936(03)01201-9 |
| [82] |
van Wezel A P, van Vlaardingen P, Posthumus R, et al. Environmental risk limits for two phthalates, with special emphasis on endocrine disruptive properties[J]. Ecotoxicology and Environmental Safety, 2000, 46(3): 305-321. DOI:10.1006/eesa.2000.1930 |
| [83] |
Xia X H, Yang L Y, Bu Q W, et al. Levels, distribution, and health risk of phthalate esters in urban soils of Beijing, China[J]. Journal of Environment Quality, 2011, 40(5): 1643-1651. DOI:10.2134/jeq2011.0032 |
| [84] |
Kong S F, Ji Y Q, Liu L L, et al. Diversities of phthalate esters in suburban agricultural soils and wasteland soil appeared with urbanization in China[J]. Environmental Pollution, 2012, 170: 161-168. DOI:10.1016/j.envpol.2012.06.017 |
| [85] |
Wang J, Luo Y M, Teng Y, et al. Soil contamination by phthalate esters in Chinese intensive vegetable production systems with different modes of use of plastic film[J]. Environmental Pollution, 2013, 180: 265-273. DOI:10.1016/j.envpol.2013.05.036 |
| [86] |
Besseling E, Wegner A, Foekema E M, et al. Effects of microplastic on fitness and PCB bioaccumulation by the lugworm Arenicola marina(L.)[J]. Environmental Science & Technology, 2013, 47(1): 593-600. |
| [87] |
Agnello A C, Bagard M, van Hullebusch E D, et al. Comparative bioremediation of heavy metals and petroleum hydrocarbons co-contaminated soil by natural attenuation, phytoremediation, bioaugmentation and bioaugmentation-assisted phytoremediation[J]. Science of the Total Environment, 2016, 563/564: 693-703. DOI:10.1016/j.scitotenv.2015.10.061 |
| [88] |
Chandra S, Sharma R, Singh K, et al. Application of bioremediation technology in the environment contaminated with petroleum hydrocarbon[J]. Annals of Microbiology, 2013, 63(2): 417-431. DOI:10.1007/s13213-012-0543-3 |
| [89] |
Chen F, Tan M, Ma J, et al. Efficient remediation of PAH-metal co-contaminated soil using microbial-plant combination:A greenhouse study[J]. Journal of Hazardous Materials, 2016, 302: 250-261. DOI:10.1016/j.jhazmat.2015.09.068 |
| [90] |
Ding C, Chang W-J, Zeng H, et al. Field and modeling study of PBDEs uptake by three tree species[J]. Science of the Total Environment, 2014, 472: 923-928. DOI:10.1016/j.scitotenv.2013.11.141 |
| [91] |
Fan G, Cang L J, Fang G, et al. Electrokinetic delivery of persulfate to remediate PCBs polluted soils:Effect of injection spot[J]. Chemosphere, 2014, 117: 410-418. DOI:10.1016/j.chemosphere.2014.08.006 |
| [92] |
Robertson S J, McGill W B, Massicotte H B, et al. Petroleum hydrocarbon contamination in boreal forest soils:A mycorrhizal ecosystems perspective[J]. Biological Reviews, 2007, 82(2): 213-240. DOI:10.1111/brv.2007.82.issue-2 |
| [93] |
Sun T R, Cang L, Wang Q Y, et al. Roles of abiotic losses, microbes, plant roots, and root exudates on phytoremediation of PAHs in a barren soil[J]. Journal of Hazardous Materials, 2010, 176(1/2/3): 919-925. |
| [94] |
Teuten E L, Rowland S J, Galloway T S, et al. Potential for plastics to transport hydrophobic contaminants[J]. Environmental Science & Technology, 2007, 41(22): 7759-7764. |
| [95] |
Andrady A L. The plastic in microplastics:A review[J]. Marine Pollution Bulletin, 2017, 119(1): 12-22. DOI:10.1016/j.marpolbul.2017.01.082 |
| [96] |
Ivar do Sul J A, Costa M F. The present and future of microplastic pollution in the marine environment[J]. Environmental Pollution, 2014, 185: 352-364. DOI:10.1016/j.envpol.2013.10.036 |
| [97] |
Velzeboer I, Kwadijk C J A F, Koelmans A A. Strong sorption of PCBs to nanoplastics, microplastics, carbon nanotubes, and fullerenes[J]. Environmental Science & Technology, 2014, 48(9): 4869-4876. |
| [98] |
Rochman C M, Manzano C, Hentschel B T, et al. Polystyrene plastic:A source and sink for polycyclic aromatic hydrocarbons in the marine environment[J]. Environmental Science & Technology, 2013, 47(24): 13976-13984. |
| [99] |
Pascall M A, Zabik M E, Zabik M J, et al. Uptake of polychlorinated biphenyls(PCBs) from an aqueous medium by polyethylene, polyvinyl chloride, and polystyrene films[J]. Journal of Agricultural and Food Chemistry, 2005, 53(1): 164-169. DOI:10.1021/jf048978t |
| [100] |
Ashton K, Holmes L, Turner A. Association of metals with plastic production pellets in the marine environment[J]. Marine Pollution Bulletin, 2010, 60(11): 2050-2055. DOI:10.1016/j.marpolbul.2010.07.014 |
| [101] |
Kim D, Chae Y, An Y-J. Mixture toxicity of nickel and microplastics with different functional groups on Daphnia magna[J]. Environmental Science & Technology, 2017, 51(21): 12852-12858. |
| [102] |
Hodson M E, Duffus-Hodson C A, Clark A, et al. Plastic bag derived-microplastics as a vector for metal exposure in terrestrial invertebrates[J]. Environmental Science & Technology, 2017, 51(8): 4714-4721. |
| [103] |
Holmes L A, Turner A, Thompson R C. Adsorption of trace metals to plastic resin pellets in the marine environment[J]. Environmental Pollution, 2012, 160: 42-48. DOI:10.1016/j.envpol.2011.08.052 |
| [104] |
Holmes L A, Turner A, Thompson R C. Interactions between trace metals and plastic production pellets under estuarine conditions[J]. Marine Chemistry, 2014, 167: 25-32. DOI:10.1016/j.marchem.2014.06.001 |
| [105] |
Syberg K, Khan F R, Selck H, et al. Microplastics:addressing ecological risk through lessons learned:Microplastics ecological risk[J]. Environmental Toxicology and Chemistry, 2015, 34(5): 945-953. DOI:10.1002/etc.v34.5 |
| [106] |
Foulon V, Le Roux F, Lambert C, et al. Colonization of polystyrene microparticles by Vibrio crassostreae?:Light and electron microscopic investigation[J]. Environmental Science & Technology, 2016, 50(20): 10988-10996. |
| [107] |
Rodriguez-Seijo A, Lourenço J, Rocha-Santos T A P, et al. Histopathological and molecular effects of microplastics in Eisenia andrei Bouché[J]. Environmental Pollution, 2017, 220: 495-503. DOI:10.1016/j.envpol.2016.09.092 |
| [108] |
Rillig M C, Ziersch L, Hempel S. Microplastic transport in soil by earthworms[J]. Scientific Reports, 2017, 7(1): 1362-1368. DOI:10.1038/s41598-017-01594-7 |
| [109] |
Kiyama Y, Miyahara K, Ohshima Y. Active uptake of artificial particles in the nematode Caenorhabditis elegans[J]. Journal of Experimental Biology, 2012, 215(7): 1178-1183. DOI:10.1242/jeb.067199 |
| [110] |
von Moos N, Burkhardt-Holm P, Köhler A. Uptake and effects of microplastics on cells and tissue of the blue mussel Mytilus edulis L.after an experimental exposure[J]. Environmental Science & Technology, 2012, 46(20): 11327-11335. |
| [111] |
Wright S L, Thompson R C, Galloway T S. The physical impacts of microplastics on marine organisms:A review[J]. Environmental Pollution, 2013, 178: 483-492. DOI:10.1016/j.envpol.2013.02.031 |
| [112] |
Besseling E, Wang B, Lürling M, et al. Nanoplastic affects growth of S.obliquus and reproduction of D.magna[J]. Environmental Science & Technology, 2014, 48(20): 12336-12343. |
| [113] |
Lee K W, Shim W J, Kwon O Y, et al. Size-dependent effects of micro polystyrene particles in the marine copepod Tigriopus japonicus[J]. Environmental Science & Technology, 2013, 47(19): 11278-11283. |
| [114] |
Nasser F, Lynch I. Secreted protein eco-corona mediates uptake and impacts of polystyrene nanoparticles on Daphnia magna[J]. Journal of Proteomics, 2016, 137: 45-51. DOI:10.1016/j.jprot.2015.09.005 |
| [115] |
Browne M A, Dissanayake A, Galloway T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis(L.)[J]. Environmental Science & Technology, 2008, 45(13): 5026-5031. |
| [116] |
Farrell P, Nelson K. Trophic level transfer of microplastic:Mytilus edulis(L.) to Carcinus maenas(L.)[J]. Environmental Pollution, 2013, 177(Suppl C): 1-3. |
| [117] |
Browne M A, Dissanayake A, Galloway T S, et al. Ingested microscopic plastic translocates to the circulatory system of the mussel, Mytilus edulis(L.)[J]. Environmental Science & Technology, 2008, 42(13): 5026-5031. |
| [118] |
Wegner A, Besseling E, Foekema E, et al. Effects of nanopolystyrene on the feeding behavior of the blue mussel(Mytilus edulis L.)[J]. Environmental Toxicology and Chemistry, 2012, 31(11): 2490-2497. DOI:10.1002/etc.v31.11 |
| [119] |
Mamaca E, Bechmann R K, Torgrimsen S, et al. The neutral red lysosomal retention assay and comet assay on haemolymph cells from mussels(Mytilus edulis) and fish(Symphodus melops) exposed to styrene[J]. Aquatic Toxicology, 2005, 75(3): 191-201. DOI:10.1016/j.aquatox.2005.08.001 |
| [120] |
Van Cauwenberghe L, Janssen C R. Microplastics in bivalves cultured for human consumption[J]. Environmental Pollution, 2014, 193: 65-70. DOI:10.1016/j.envpol.2014.06.010 |
| [121] |
Watts A J R, Lewis C, Goodhead R M, et al. Uptake and retention of microplastics by the shore crab Carcinus maenas[J]. Environmental Science & Technology, 2014, 48(15): 8823-8830. |
| [122] |
Schultz C, Powell K, Crossley A, et al. Analytical approaches to support current understanding of exposure, uptake and distributions of engineered nanoparticles by aquatic and terrestrial organisms[J]. Ecotoxicology, 2015, 24(2): 239-261. DOI:10.1007/s10646-014-1387-3 |
| [123] |
Harrison J P, Schratzberger M, Sapp M, et al. Rapid bacterial colonization of low-density polyethylene microplastics in coastal sediment microcosms[J]. BMC Microbiology, 2014, 14: 232. DOI:10.1186/s12866-014-0232-4 |
| [124] |
Lemire A, Goudenège D, Versigny T, et al. Populations, not clones, are the unit of vibrio pathogenesis in naturally infected oysters[J]. The ISME Journal, 2015, 9(7): 1523-1531. DOI:10.1038/ismej.2014.233 |
| [125] |
Liu H F, Yang X M, Liu G B, et al. Response of soil dissolved organic matter to microplastic addition in Chinese loess soil[J]. Chemosphere, 2017, 185: 907-917. DOI:10.1016/j.chemosphere.2017.07.064 |
| [126] |
Arthur E, Moldrup P, Holmstrup M, et al. Soil microbial and physical properties and their relations along a steep copper gradient[J]. Agriculture, Ecosystems & Environment, 2012, 159: 9-18. |
| [127] |
Naveed M, Herath L, Moldrup P, et al. Spatial variability of microbial richness and diversity and relationships with soil organic carbon, texture and structure across an agricultural field[J]. Applied Soil Ecology, 2016, 103: 44-55. DOI:10.1016/j.apsoil.2016.03.004 |
| [128] |
Burns R G, DeForest J L, Marxsen J, et al. Soil enzymes in a changing environment:Current knowledge and future directions[J]. Soil Biology and Biochemistry, 2013, 58: 216-234. DOI:10.1016/j.soilbio.2012.11.009 |
| [129] |
Sampedro L, Jeannotte R, Whalen J K. Trophic transfer of fatty acids from gut microbiota to the earthworm Lumbricus terrestris L.[J]. Soil Biology and Biochemistry, 2006, 38(8): 2188-2198. DOI:10.1016/j.soilbio.2006.02.001 |
| [130] |
Auta H S, Emenike C U, Fauziah S H. Screening of Bacillus strains isolated from mangrove ecosystems in Peninsular Malaysia for microplastic degradation[J]. Environmental Pollution, 2017, 231: 1552-1559. DOI:10.1016/j.envpol.2017.09.043 |
| [131] |
Edwards W M, Shipitalo M, Owens L, et al. Effect of Lumbricus terrestris L.burrows on hydrology of continuous no-till corn fields[J]. Geoderma, 1990, 46(1): 73-84. |
| [132] |
Edwards W M, Shipitalo M, Traina S J. Role of Lumbricus terrestris(L.) burrows on quality of infiltrating water[J]. Soil Biology and Biochemistry, 1992, 24(12): 1555-1561. DOI:10.1016/0038-0717(92)90150-V |
| [133] |
Iribarne O, Botto F. The role of burrows of the SW atlantic intertidal crab Chasmagnathus granulata in trapping debris[J]. Marine Pollution Bulletin, 2000, 40(11): 1057-1062. DOI:10.1016/S0025-326X(00)00058-8 |
| [134] |
Hopkin S P. A key to the collembola(springtails) of Britain and Ireland[M]. Field Studies Council, Taunton, Shrewsbury: FSC, 2007, 111.
|
| [135] |
Widenfalk L A, Bengtsson J, Berggren Å, et al. Spatially structured environmental filtering of collembolan traits in late successional salt marsh vegetation[J]. Oecologia, 2015, 179(2): 537-549. DOI:10.1007/s00442-015-3345-z |
| [136] |
Rillig M C, Ziersch L, Hempel S. Microplastic transport in soil by earthworms[J]. Scientific Reports, 2017, 7(1): 1362-1368. DOI:10.1038/s41598-017-01594-7 |
| [137] |
Athmann M, Kautz T, Banfield C, et al. Six months of L.terrestris L.activity in root-formed biopores increases nutrient availability, microbial biomass and enzyme activity[J]. Applied Soil Ecology, 2017, 120: 135-142. DOI:10.1016/j.apsoil.2017.08.015 |
 2018, Vol. 37
2018, Vol. 37