文章信息
- 李江遐, 张军, 马友华, 蔡慢弟, 高飞
- LI Jiang-xia, ZHANG Jun, MA You-hua, CAI Man-di, GAO Fei
- 硅对镉胁迫条件下两个水稻品种镉亚细胞分布、非蛋白巯基物质含量的影响
- Effects of silicon on cadmium accumulation and non-protein thiol content in the seedlings of two rice varieties under cadmium stress
- 农业环境科学学报, 2018, 37(6): 1066-1071
- Journal of Agro-Environment Science, 2018, 37(6): 1066-1071
- http://dx.doi.org/10.11654/jaes.2017-0928
文章历史
- 收稿日期: 2017-07-03
- 录用日期: 2018-01-10
2. 安徽农业大学生命科学学院, 合肥 230036
2. School of Life Sciences, Anhui Agricultural University, Hefei 230036, China
污水灌溉、污泥农用以及农药和化肥的不合理施用,使农田土壤受到不同程度的重金属污染。据报道,目前我国遭受重金属污染的土地面积占灌区总面积的64.8%[1],尤以镉(Cd)污染最为普遍。我国农田Cd污染有日益加重的趋势[2]。水稻是我国第一大作物,种植面积大、产量高、分布范围广,大部分人每天以稻米为主食。研究表明,水稻是极易累积Cd的作物,Cd可以从水稻根系向地上部转运,从而导致稻米中Cd含量严重超标[3-5]。受污染的水稻所产出的稻米可以通过食物链进入人体,对人体危害很大。
目前采取施用钝化剂的方法降低污染农田土壤中重金属的生物有效性,进而阻止其对农作物的污染,使一些污染程度较低的农田可以继续生产安全的农产品。但因土壤类型、钝化剂种类不同,不同土壤上施用钝化剂的效果差别较大。硅(Si)是水稻的必需营养元素,它可提高植物对重金属毒害的耐受力和农作物的产量并改善作物品质[6]。Si通过减少植物对重金属的吸收及重金属由根向地上部的转运,增强植物对矿质元素的吸收,提高植物细胞的抗氧化能力,保护植物免受重金属的毒害[7]。对两种Cd耐受力不同的花生进行Si、Cd处理,研究表明Si可以减轻两品种花生Cd毒害。对于Cd敏感品种,Si抑制Cd由根向地上部的运输,降低叶片细胞器中的Cd含量;对于Cd耐性品种,Si主要降低茎中Cd含量同时刺激抗氧化系统以减轻Cd毒害[8]。Si对水稻幼苗Cd分布的影响研究结果表明,Si能够降低水稻根及茎中Cd的含量,但没有明显改变Cd在共质体及质外体中的分布比例[9]。
目前有关植物螯合肽(PC)对重金属的解毒机制及其在污染生态学领域的应用备受关注。Cd在水稻体内主要是以PC-Cd络合物或Cd-GSHx络合物[10]的形式运输。PC对Cd离子的螯合能力很强,在Cd累积和解毒过程中发挥重要作用[11]。
本试验采用营养液培养方法研究了不同Si浓度处理对水稻短期Cd胁迫的缓解效果,测定了水稻植株中非蛋白巯基(NPT)含量的变化及Cd的亚细胞分布特征。从微观层次揭示Si对籽粒Cd含量不同的两种水稻品种积累Cd的差异机理,以期探索Si对水稻Cd吸收积累的影响,从而为合理施用硅肥减轻土壤Cd毒害提供理论依据。
1 材料与方法 1.1 试验材料通过前期对我国南方80个栽种杂交水稻品种的筛选研究,选取籽粒含Cd量差异较大的2个杂交水稻品系:宁粳4号(籽粒低Cd含量品种,NJ4)和徽两优6号(籽粒高Cd含量品种,HY6)。两品种的生育期为(150±20)d。水稻种子由安徽省农业科学院提供。
将水稻种子经过蒸馏水浸泡24 h后,催芽48 h,用蒸馏水浇灌1周后改为1/2营养液培养。选择生长均匀健壮的幼苗移栽。调节营养液pH5.5左右,每周更换2~3次。培养4周后将水稻幼苗分别置于Si浓度为0、0.5、1.8 mmol·L-1,Cd浓度0、50 μmol·L-1的营养液中培养,处理7 d后收获。试验处理如下:CK(Cd 0 μmol·L-1,Si 0 mmol·L-1);T1(Cd 50 μmol·L-1,Si 0 mmol·L-1);T2(Cd 50 μmol·L-1,Si 0.5 mmol·L-1);T3(Cd 50 μmol·L-1,Si 1.8 mmol·L-1)。每个处理重复3次,Cd胁迫采用氯化镉(CdCl2,AR)配制,Si采用硅酸钠(Na2SiO3,AR)配制。
1.2 测定方法 1.2.1 生物量测定样品采集收获后,用去离子水清洗3次,将水稻幼苗在天平上测定生物量。先将水稻幼苗从基部剪开,至于115 ℃杀青30 min,85 ℃烘干至恒重,测定地上部和根部的干重。
1.2.2 Cd含量和转移系数的测定将预处理的水稻幼苗烘干样粉碎,然后称取粉碎样0.200 0 g于消煮管中,然后加入10 mL浓硝酸过夜。第2 d,先进行微波消煮,然后在通风橱中高温赶酸,最后将消煮液定容到50 mL的容量瓶中,用原子吸收分光光度计(AAS)测定样品中的Cd含量[12]。
1.2.3 NPT的测定NPT采用5,5′-二硫代双(2-硝基苯甲酸)(DTNB)显色法测定。称取鲜样1.00 g,加入4 mL预冷的5%磺基水杨酸,冰浴研磨,离心(Beckman-CoulterAvantiJ-25 8000×g,4 ℃)15 min,取上清液0.8 mL,依次加入3.05 mL 0.25 mol·L-1的Tris-HCl(pH 8.3)和0.15 mL 10 mmol·L-1的DTNB,室温下放置20 min,然后用分光光度计(波长412 nm)测定样品的吸光度值[13]。以等量的未加DTNB的溶液作为对照,以GSH-SH为标样制作标准曲线[7]。
1.2.4 Cd在水稻植株各器官的亚细胞分布采用差速分级离心技术分离出各器官不同细胞组分[14],称取0.200 0 g样品,加入2 mL提取剂,提取剂由0.25 mol·L-1蔗糖、50 mmol·L-1 Tris-HCl(调整pH在7.5左右)、1.0 mmol·L-1二硫赤藓糖醇和5.0 mmol·L-1抗坏血酸组成。将研钵置于碎冰块上,在研钵中将样品研磨至匀浆,转移到2 mL的离心管中,放于高速低温冷冻离心机中7000 r·min-1离心20 min,沉淀为细胞壁(F1)组分;再将上清液倒入2 mL离心管,在高速低温冷冻离心机中12 000 r·min-1离心40 min,此时得到的上清液用于细胞可溶性组分(F2)Cd含量测定,沉淀用于细胞器组分(F3)Cd含量测定,全部操作均在4 ℃下进行[5]。获得的上清液及沉淀分别用浓硝酸移入50 mL三角瓶中,放置过夜后于电热板上消煮,少量多次地加入共5 mL混合酸(硝酸:高氯酸=4:1,体积比)消煮至澄清[14],过滤并定容至50 mL,用石墨炉-原子吸收法测定Cd含量。
1.3 数据分析方法采用Excel 2003对数据进行处理和SPSS Statistics 17.0软件对数据进行统计分析。
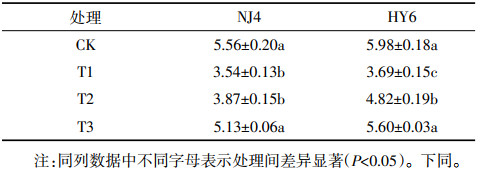
2 结果与分析 2.1 Si对Cd胁迫下两种水稻生物量的影响Si对Cd胁迫下两种水稻生物量的影响见表 1。结果表明,单独Cd处理时(T1),NJ4和HY6两种水稻的生长受到明显抑制,生物量较CK分别下降36.3%和38.3%(P<0.05)。加入Si后Cd对水稻的胁迫有所缓解,表现为生物量较T1处理时上升,即:T2处理时,NJ4和HY6生物量相比T1处理分别增加了9.3%和30.62%,其中HY6水稻品种达显著差异(P<0.05);T3处理时NJ4和HY6生物量分别增加了44.9%和51.8%(P<0.05)。实验结果表明,单独Cd处理时两个水稻品种的生物量较CK显著下降,分别加入0.5、1.8 mmol·L-1 Si后,两种水稻生物量明显升高。
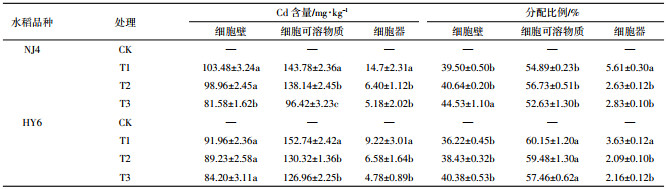
不同处理下两种水稻Cd含量及转移系数见表 2。CK处理由于未加Cd,因此含量非常低,未检出。由表 2可知在不同处理下,NJ4和HY6都表现为根部Cd含量高于地上部。加Si处理(T2、T3)NJ4水稻根部Cd含量高于T1单独Cd处理,但地上部Cd含量较T1处理下降;HY6表现为根部Cd含量与T1处理无显著差异,地上部Cd含量较T1处理下降。
转移系数常以地上与地下重金属元素含量的比值(S/R)来表示,可以反映重金属在体内吸收、运输和分配情况。表 2结果表明,两种水稻Cd的转移系数随Si浓度的升高较单独Cd处理明显下降,即T2、T3处理较T1处理Cd的转移系数明显下降。随Si浓度的升高,Si能进一步促进Cd在根中的积累,Cd的转移系数下降。表明施Si可以改变Cd在水稻幼苗茎叶和根中的分配比例。Si可以抑制Cd向上运输,从而降低了茎叶中Cd的含量,减轻了Cd对水稻地上部的毒害,进而可能降低Cd在水稻籽粒中的积累。但不同品种水稻对Si的敏感性不同。
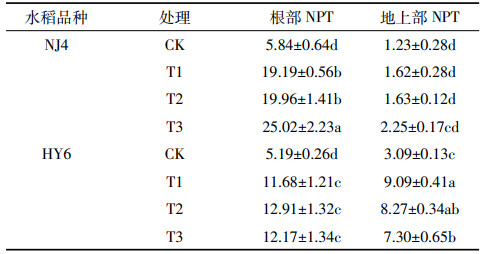
2.3 Si对Cd胁迫下两种水稻根和叶中NPT含量的影响表 3结果表明,两种水稻不同Si、Cd处理下的根中NPT含量均高于地上部。T1处理,NJ4及HY6品种水稻根部及地上部NPT含量较CK均显著增加。
|
NJ4品种水稻T2较T1处理根中NPT含量无显著差异,T3较T1处理显著升高。T1较T2、T3处理地上部NPT含量无显著差异。HY6品种水稻根NPT含量较T1处理升高,地上部NPT含量较T1处理下降。实验结果表明,同样Cd胁迫下,NJ4根中的NPT含量高于HY6,能够结合更多Cd离子,减少向地上部的运输。NJ4品种水稻细胞内更多的NPT用于各种解毒过程,NJ4水稻对Cd胁迫的解毒能力更强。添加Si使NJ4根中NPT含量增加,但地上部NPT含量差异不明显,HY6根中NPT含量增加,地上部NPT含量下降。
2.4 Si对Cd胁迫下两种水稻体内Cd的亚细胞分布外源添加Si对两种水稻根亚细胞组分中Cd含量的影响如表 4所示。结果表明,不同处理条件下Cd在水稻根部亚细胞水平上分布规律一致,Cd在细胞可溶物质中含量高于细胞壁,细胞器上含量最少。T3处理时,细胞壁、细胞可溶物质及细胞器中Cd较T1明显降低。T3较T1处理两品种水稻根部亚细胞各组分中细胞壁中Cd的分配比例明显升高,细胞器中Cd的比例明显降低。NJ4品种水稻细胞器中Cd含量高于HY6品种。
不同Si浓度对两种水稻地上部(茎叶)亚细胞组分中Cd含量的影响如表 5所示。结果表明,不同处理条件下Cd在水稻茎叶亚细胞水平上分布规律一致,Cd主要积累在细胞壁上,其次积累在细胞可溶物质中,而细胞器上含量最少。外源Si的添加会改变两品种水稻亚细胞中Cd的分配比例,T3处理NJ4品种水稻根中细胞壁Cd的比例增加,细胞器中Cd的分配比例下降;HY6品种水稻添加Si后根中细胞壁Cd的分配比例没有变化,但细胞器中Cd的分配比例明显下降。NJ4品种水稻地上部细胞壁Cd的分配比例变化不明显,T3处理细胞器中Cd的分配比例增加;HY6品种水稻T3处理时地上部细胞壁Cd的分配比例增加,细胞器中镉的分配比例变化不明显。
Si是水稻的必需营养元素,研究表明Si可以有效缓解重金属胁迫[4]。对Si减轻水稻Cd毒害的研究表明,Si减轻Cd的毒害效应主要表现在植物生长、光合作用、元素平衡以及其他一些生化指标。Si可以减轻Cd毒害引起的元素不平衡。提供Si 48 h后光合作用正常,同时显著增强抗坏血酸谷胱甘肽系统,有效激活防御功能。转录水平进一步分析表明,Cd胁迫下水稻根中与Cd胁迫相关的植物螯合肽合成酶基因,转录因子AP2/Erf020、Hsf31和NAC6表达明显增强,但供给Si后这些基因表达明显下调[16]。本试验结果表明,在单独的Cd胁迫下水稻的生长受到抑制,生物量降低。施加Si后两品种水稻生物量较单独Cd处理明显增加,有效缓解了Cd的毒害作用;地上部的Cd含量小于根部的Cd含量;两个品种转移系数不同,NJ4小于HY6。研究表明,Si结合蛋白通过诱导Si在水稻根的内皮层及纤维层细胞附近沉积,进而影响Cd的运输,抑制Cd向地上部转运[5]。
NPT在植物的重金属解毒方面发挥重要作用,它由含有巯基的物质组成,巯基具有结合Cd离子、减少细胞内自由态Cd的能力,从而达到减轻毒害的目的[11]。已有研究表明,Cd胁迫能促进植物体内NPT的合成,根部NPT增加尤为显著,根部NPT与Cd结合并钝化在液泡内,从而限制了Cd的移动性,降低了Cd向地上部的转运[17]。
本实验结果表明,在50 μmol·L-1 Cd浓度胁迫下,NJ4品种水稻根中NPT含量都显著高于HY6,NJ4增强了根部对Cd的滞留能力,减少Cd从根部向地上部的转移。同样50 μmol·L-1 Cd浓度胁迫下,加入1.8 mmol·L-1 Si后,两品种水稻根及叶片NPT含量较对照明显增加。研究表明,Mn胁迫下,施Si后水稻敏感品种根系的NPT含量没有显著变化,而耐性品种ZLY的NPT含量显著升高。高Mn胁迫下,敏感品种叶片的NPT含量显著降低,而耐性品种却略有增加。施Si处理无论是在正常Mn浓度还是高Mn浓度下都增加了两个品种叶片的NPT活性[18]。Si对Cd胁迫下水稻体内NPT含量的变化与Si对Mn胁迫下水稻体内NPT含量的变化一致,Cd和Mn都是重金属,Si缓解水稻Cd、Mn重金属毒害的机制可能是相似的。
本试验结果表明,两品种水稻根部Cd主要积累在细胞可溶物质上,其次是细胞壁中,细胞器上含量最少(表 4)。地上部Cd主要积累在细胞壁上,其次是细胞可溶物质中,细胞器上含量最少(表 5)。该分布趋势与以往报道[7]一致。水稻根细胞将Cd积累在细胞可溶物质中,而不是积累在进行生物代谢活动的细胞器上,是水稻应对Cd毒性的一种方式;同时水稻地上部细胞可以将Cd吸附于细胞壁上,使其被阻挡在细胞质之外,这是水稻对Cd耐性的一种体现[19]。Li等[20]研究发现,在小麦根部的亚细胞水平上,Cd更倾向于与细胞可溶物质组分中的热稳固蛋白(HSP)结合,因此能降低Cd的移动性,减小Cd对细胞的危害。外源Si的加入会降低植株各部分Cd含量,减少Cd的毒害。Se对水稻Cd毒性的影响及其机制的研究结果表明,Cd、Se复合处理会导致水稻地下部非蛋白巯基含量增加,同时改变Cd在地下部的亚细胞分布,使细胞壁组分的Cd含量上升,细胞可溶物质组分和细胞器组分的Cd含量下降,从而减少Cd向茎叶的转运,降低地上部的膜脂过氧化程度[21]。Se是对植物有益的元素,Si是水稻必需营养元素,Se对Cd缓解机制是否与Si相似有待进一步研究。
4 结论(1)两种籽粒Cd含量不同的水稻品种(宁粳4号和徽两优6号)受到Cd胁迫时生物量都明显下降,加入外源Si后同样Cd胁迫条件下两种水稻生物量较对照无明显差异;外源Si加入能降低水稻根向地上部对Cd的转运。
(2)外源Si可以提高水稻根细胞NPT含量,促进Cd与NPT的络合。
(3)外源Si加入可以降低细胞壁、细胞可溶物质及细胞器中Cd含量。相同处理间两品种无显著差异。
| [1] |
丁真真. 中国农田土壤重金属污染与其植物修复研究[J]. 水土保持研究, 2007, 14(3): 19-20. DING Zhen-zhen. Farmland soil heavy metal pollution in our country and plant repair research[J]. Research of Soil and Water Conservation, 2007, 14(3): 19-20. |
| [2] |
李志涛, 王夏晖, 刘瑞平, 等. 耕地土壤镉污染管控对策研究[J]. 环境与可持续发展, 2016(2): 21-23. LI Zhi-tao, WANG Xia-hui, LIU Rui-ping, et al. Control strategy research of cadmium pollution in cultivated soils[J]. Environment and Sustainable Development, 2016(2): 21-23. |
| [3] |
安志装, 王校常, 严蔚东, 等. 镉硫交互处理对水稻吸收积累镉及其蛋白巯基含量的影响[J]. 土壤学报, 2004, 41(5): 728-733. AN Zhi-zhuang, WANG Xiao-chang, YAN Wei-dong, et al. Effects of sulfate and cadmium interaction on cadmium accumulation and content of nonprotein thiols in rice seedling[J]. Acta Pedologica Sinica, 2004, 41(5): 728-733. |
| [4] |
宫海军, 陈坤明, 王锁民, 等. 植物硅营养的研究进展[J]. 西北植物学报, 2004, 24(12): 2385-2392. GONG Hai-jun, CHEN Kun-ming, WANG Suo-min, et al. Advances in silicon nutrition of plants[J]. Acta Botanica Boreali-Occidentalia Sinica, 2004, 24(12): 2385-2392. DOI:10.3321/j.issn:1000-4025.2004.12.034 |
| [5] |
史新慧, 王贺, 张福锁. 硅提高水稻抗镉毒害机制的研究[J]. 农业环境科学学报, 2006, 25(5): 1112-1116. SHI Xin-hui, WANG He, ZHANG Fu-suo. Research on the mechanism of silicon improving the resistance of rice seedlings of Cd[J]. Journal of Agro-Environment Science, 2006, 25(5): 1112-1116. |
| [6] |
龚金龙, 张洪程, 龙厚元, 等. 水稻中硅的营养功能及生理机制的研究进展[J]. 植物生理学报, 2012, 48(1): 1-10. GONG Jin-long, ZHANG Hong-cheng, LONG Hou-yuan, et al. Progress in research of nutrition functions and physiological mechanisms of silicon in rice[J]. Plant Physiology Journal, 2012, 48(1): 1-10. |
| [7] |
黄秋婵, 黎晓峰, 沈方科, 等. 硅对水稻幼苗镉的解毒作用及其机制研究[J]. 农业环境科学学报, 2007, 26(4): 1307-1311. HUANG Qiu-chan, LI Xiao-feng, SHEN Fang-ke, et al. Cadmium resistance improved by silicon and corresponding mechanisms in Oryza sativas L.seedlings[J]. Journal of Agro-Environment Science, 2007, 26(4): 1307-1311. |
| [8] |
Shi G R, Cai Q S, Liu C F, et al. Silicon alleviates cadmium toxicity in peanut plants in relation to cadmium distribution and stimulation of antioxidative enzymes[J]. Plant Growth Regulation, 2010, 61(1): 45-52. DOI:10.1007/s10725-010-9447-z |
| [9] |
Shi X H, Zhang C C, Wang H, et al. Effect of Si on the distribution of Cd in rice seedlings[J]. Plant and Soil, 2005, 272(1/2): 53-60. |
| [10] |
邬飞波, 张国平. 植物螯合肽及其在重金属耐性中的作用[J]. 应用生态学报, 2003, 14(4): 632-636. WU Fei-bo, ZHANG Guo-ping. Phytochelatin and its function in heavy metal tolerance of higher plants[J]. Chinese Journal of Applied Ecology, 2003, 14(4): 632-636. |
| [11] |
胡朝华, 张蕾, 朱端卫. 植物螯合肽生物合成和解毒机制及其在重金属修复中的应用前景[J]. 华中农业大学学报, 2006, 25(5): 575-580. HU Chao-hua, ZHANG Lei, ZHU Duan-wei. Biosynthesis and detoxcification mechanism of phytochelatin and its application prospect in remediation of heavy metal[J]. Journal of Huazhong Agricultural University, 2006, 25(5): 575-580. |
| [12] |
鲍士旦. 土壤农化分析[M]. 北京: 中国农业出版社, 2011, 112-114. BAO Shi-dan. Soil analysis in agricultural chemistry[M]. Beijing: China Agricultural Press, 2011, 112-114. |
| [13] |
Hissin P J, Hilf R. A fluorometric method for determination of oxidized and reduced glutathione in tissues[J]. Analytical Biochemistry, 1976, 74(1): 214-226. DOI:10.1016/0003-2697(76)90326-2 |
| [14] |
Wang X, Liu Y G, Zeng G M, et al. Subcellular distribution and chemical forms of cadmium in Bechmeria nivea L.Gaud[J]. Environmental and Experimental Botany, 2008, 62(3): 389-395. DOI:10.1016/j.envexpbot.2007.10.014 |
| [15] |
王芳, 丁杉, 张春华, 等. 不同镉耐性水稻非蛋白巯基及镉的亚细胞和分子分布[J]. 农业环境科学学报, 2010, 29(4): 625-629. WANG Fang, DING Shan, ZHANG Chun-hua, et al. Non-protein thiols, subcellular and molecular distribution of cadmium in two rice cultivars with difference tolerance[J]. Journal of Agro-Environment Science, 2010, 29(4): 625-629. |
| [16] |
Muhammad A F, Amelie D, Stephan C, et al. Silicon-induced reversibility of cadmium toxicity in rice[J]. Journal of Experimental Botany, 2016, 67(11): 3573-3585. DOI:10.1093/jxb/erw175 |
| [17] |
李鹏, 葛滢, 吴龙华, 等. 两种籽粒镉含量不同水稻的镉吸收转运及其生理效应差异初探[J]. 中国水稻科学, 2011, 25(3): 291-296. LI Peng, GE Ying, WU Long-hua, et al. Uptake and translocation of cadmium and its physiligical effects in two rice cultivars differed in grain cadmium concentration[J]. Chinese Journal Rice Science, 2011, 25(3): 291-296. |
| [18] |
李萍. 硅提高水稻抗锰毒害的生理和分子机制[D]. 北京: 中国农业科学院, 2012: 31-32. LI Ping. The physiological and mocular mechanisms of silicon-enhanced resistance to high manganese stress in rice[D]. Beijing: Chinese Academy Agricultural Science, 2012: 31-32. |
| [19] |
史静, 潘根兴. 外加镉对水稻镉吸收、亚细胞分布及非蛋白巯基含量的影响[J]. 生态环境学报, 2015, 24(5): 853-859. SHI Jing, PAN Gen-xing. Effects of Cd-spiking treatment on Cd accumulation, subcellular distribution and content of nonprotein thiols in rice[J]. Ecology and Environmental Sciences, 2015, 24(5): 853-859. |
| [20] |
Li D D, Zhou D M, Wang P, et al. Subcellular Cd distribution and its correlation with antioxidant enzymatic activities in wheat(Triticum aestivum) roots[J]. Ecotoxicology and Environmental Safety, 2011, 74(4): 874-881. DOI:10.1016/j.ecoenv.2010.12.006 |
| [21] |
庞晓辰, 王辉, 吴泽嬴, 等. 硒对水稻镉毒性的影响及其机制的研究[J]. 农业环境科学学报, 2014, 33(9): 1679-1685. PANG Xiao-chen, WANG Hui, WU Ze-ying, et al. Alleviation by selenium of cadmium toxicity to rice and its mechanisms[J]. Journal of Agro-Environment Science, 2014, 33(9): 1679-1685. DOI:10.11654/jaes.2014.09.002 |
| [22] |
Heather A C, Carole C P. Silica in plants:Biological, biochemical and chemical studies[J]. Annals of Botany, 2007, 100(7): 1383-1389. DOI:10.1093/aob/mcm247 |
 2018, Vol. 37
2018, Vol. 37