文章信息
- 卞威乐斯, 闫家普, 崔良, 张磊
- BIAN Wei-le-si, YAN Jia-pu, CUI Liang, ZHANG Lei
- 施硒对花生镉吸收与抗性及化学形态的影响
- The effect of selenium on cadmium accumulation, chemical forms and the resistance of peanuts
- 农业环境科学学报, 2018, 37(6): 1094-1101
- Journal of Agro-Environment Science, 2018, 37(6): 1094-1101
- http://dx.doi.org/10.11654/jaes.2017-1436
文章历史
- 收稿日期: 2017-10-20
- 录用日期: 2018-01-26
2. 青岛市环保局城阳分局, 山东 青岛 266109
2. Chengyang Branch, Qingdao Environmental Protection Bureau, Qingdao 266109, China
Cd是毒性最强的重金属元素之一,可造成重大环境污染,且具有较高的积累性和生物迁移性,易被植物吸收富集。过量Cd积累会使植物Cd含量超标,影响植物生长,甚至通过食物链危害人体健康[1]。花生富含优质的脂肪、蛋白质及其他微量元素,是世界上重要的油料作物之一,更是中国植物油和植物蛋白的重要来源,花生安全问题与人体健康息息相关[2]。然而近年来随着工业的发展,我国农田土壤Cd污染严重,花生Cd含量超标已成为人体健康和出口贸易面临的重要威胁之一,如何解决花生Cd污染问题越来越受到人们的关注[3]。
Se是人体必需的微量元素,缺Se或过量Se都会对人体产生损害。适量Se不但对人体健康有益,对植物的生长也有重要的作用[4-5]。国内外部分学者研究认为,适量施Se对于植物生长、缓解Cd胁迫、抑制Cd吸收、增强植物抗逆性有着重要的意义[6-7]。施Se与富Se产品的生产已经成为培育优质农作物的重要方法。
目前,对于Se、Cd交互作用的研究报道大多集中在水稻、小麦、油菜等作物[8-10],关于Se影响花生Cd吸收抗性及植株中Cd形态的研究鲜有报道。本研究采用盆栽试验分析Cd胁迫下不同施Se浓度对花生Cd吸收积累、生长发育与逆境生理特性等,并通过花生植株体内Cd形态分析,来进一步阐释施Se对花生植株中Cd吸收转运的影响机理及解毒机制,以期为花生籽粒的Cd污染防控提供科学依据。
1 材料与方法 1.1 实验材料根据前期研究,花生品种选择富Se品种花育22号。供试土样理化性状为pH值8.17,有机质含量14.55 g·kg-1,全氮0.4 g·kg-1,速效磷6.65 mg·kg-1,速效钾60.56 mg·kg-1,土壤Cd含量 < 0.005 mg·kg-1,Se含量0.014 mg·kg-1。
1.2 实验处理将3CdSO4·8H2O用蒸馏水溶解配成稀溶液,均匀混于土壤中,静止熟化时间50 d,期间保持土壤水分含量60%左右。为探究低浓度Cd条件下花生植株内Cd的迁移及高浓度Cd对花生的胁迫作用,设定3个Cd浓度分别为0.00、3.00、30.00 mg·kg-1,以分别模拟对照、低Cd污染与高Cd胁迫条件。土壤风干粉碎过20目筛,添加外源Se(Na2SeO3·5H2O配制的Se溶液)使土壤Se浓度为0、0.25、0.5、1.0 mg·kg-1。实验设12个交互组,每组6个重复,共72盆。Cd、Se浓度分别为Cd0+Se0、Cd3+Se0、Cd30+Se0、Cd0+Se0.25、Cd3+Se0.25、Cd30+Se0.25、Cd0+Se0.5、Cd3+Se0.5、Cd30+Se0.5、Cd0+Se1.0、Cd3+Se1.0、Cd30+Se1.0。选择籽粒饱满、大小均匀的花生种子洗净晾干,放入0.3% H2O2溶液浸泡30 min,然后置于智能人工气候箱中28 ℃下保湿催芽,待种子发芽后,选取4株长势相近的花生幼苗移植于塑料盆中,每盆添加900 g土壤,培养35 d。培养条件为玻璃温室自然光下培养。白天温度(30~35)℃,晚上温度(20~25)℃;湿度控制在70%左右。
1.3 指标测定 1.3.1 干质量的测定所采样品在120 ℃下杀青30 min,然后在75 ℃下烘干24 h至恒质量,测定地上部和根部干质量。
1.3.2 细胞膜透性的测定取0.20 g叶肉样品,剪碎放入20 mL刻度试管中,加入15 mL蒸馏水,置真空干燥器中抽气20 min后,测定浸出液的电导值,再煮沸40 min,测定电导值,以相对电导率(煮沸前外渗液电导值/煮沸后外渗液电导值×100%)表示细胞膜透性。
1.3.3 丙二醛(MAD)含量的测定取0.20 g叶肉样品,加5%三氯乙酸(TCA)5 mL,研磨后在3000 r·min-1下离心10 min。取上清液2 mL,加0.67%硫代巴比妥酸(TBA)2 mL,混合水浴煮沸30 min,冷却后再离心。分别测定上清液在波长450、532、600 nm处的吸光度值,按公式C=6.45×(A532-A600)-0.56×A450算出丙二醛浓度。
1.3.4 植物样中Cd含量的测定将烘干植物样品粉碎,称取0.50 g样品放入聚四氟乙烯内罐中,加4 mL HNO3,放反应釜经高压釜法120~130 ℃消解4 h,冷至室温,赶酸至1~2 mL后,转移并定容到10 mL。用石墨炉原子吸收分光光度计(AA-7000 Shimadzu Japan)进行测定。
1.3.5 植物样中Cd的化学形态分析采用化学试剂逐步提取法。准确称取鲜样2.0 g,加入20 mL提取剂研磨匀浆后转入50 mL的塑料离心管中,提取剂为:80%乙醇、去离子水、1 mol·L-1的氯化钠、2%醋酸和0.6 mol·L-1盐酸。在25 ℃恒温振荡22 h后,5000 r·min-1离心10 min,倒出上清液,再加入10 mL提取剂,25 ℃恒温振荡1 h,5000 r·min-1离心10 min,倒出上清液。合并2次的上清液于50 mL的三角瓶中。为研究Cd污染条件下Cd化学形态的变化,本文选取Cd 3、30 mg·kg-1两个浓度处理进行比较分析。
1.3.6 光合特性的测定于上午8:00—10:30采用美国PP Systems公司生产的CIRAS-3便携式光合仪测定花生第三完全展开叶片的净光合速率(Pn)、蒸腾速率(Tr)、气孔导度(Gs)、胞间CO2浓度(Ci)。测定时,叶室配备LED光源,设定红、绿、蓝、白四种光源的比例分别为90%、0%、5%、5%,辐射强度设定为1000 μmol·m-2·s-1,CO2浓度定为400 μmol·mol-1,叶室温度设为27 ℃,相对湿度设为65%。
1.4 数据处理与统计数据为3次重复的平均值±标准差。Excel 2007进行数据处理及图表制作;应用SPSS 19.0统计软件对试验数据进行统计分析,5%水平下LSD多重比较检验各处理平均值之间的差异显著性。
1.5 质量保证为测定结果的准确性,减小误差,在测定Cd及各形态Cd时,每组实验均设置3个空白及平行实验。所用试剂均为优级纯,所用玻璃器皿均用1:3硝酸浸泡过夜。用国家标准物质GBW 10049(GSB-17)进行质量控制,加标回收率范围87.3%~98.5%。
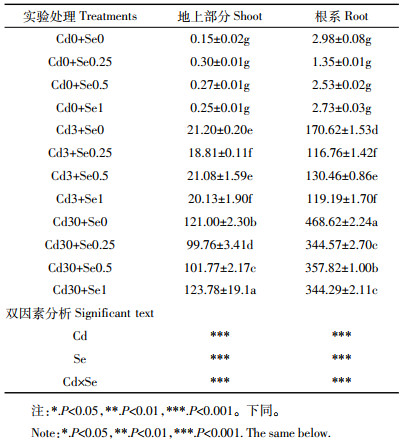
2 结果与分析 2.1 花生生物量不同Cd浓度条件下施Se对花生生物量的影响如图 1所示。无Cd添加条件下施Se使花生生物量显著增加,Cd污染条件下,随施Se浓度增加,花生地上部分生物量呈先增高后降低的趋势。根系生物量低Cd条件下施Se生物量呈增加趋势,高Cd条件下呈先增加后减少的趋势。在Cd浓度为3 mg·kg-1时,施加0.25 mg·kg-1 Se花生地上部分生物量达到最大值,相比于对照增加了23.15%。Cd浓度为30 mg·kg-1施加0.25 mg·kg-1 Se则使花生根系生物量达到最大。
|
| 不同小写字母表示处理间差异显著(P<0.05)。下同 The different lowercase letters indicate significant difference among(P < 0.05). The same below 图 1 花生地上部分和根系生物量 Figure 1 Biomass of shoots and roots of peanut |
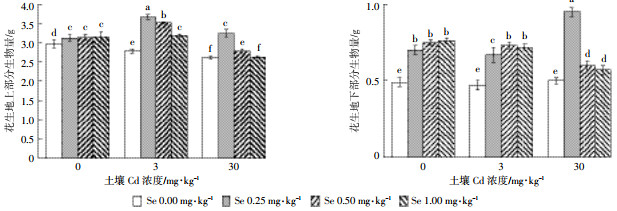
细胞膜透性常用来表征植物细胞受伤害的程度。当植物受到不良环境胁迫后,细胞质膜结构和功能会发生变化,电导率越大表明细胞质受损越严重。由图 2A可以看出,在Cd浓度为0 mg·kg-1时施Se无影响。单一Cd胁迫下,随着Cd浓度的增加,电导率增大,说明Cd对花生产生毒害作用。施加外源Se显著降低了叶片电导率,缓解了Cd的毒害作用。在施Se浓度为0.25 mg·kg-1时效果最显著,在Cd浓度为3 mg·kg-1时电导率下降了15.95%;Cd浓度为30 mg·kg-1时电导率下降了22.65%。低Cd条件下,施Se浓度大于0.25 mg·kg-1细胞膜透性呈递增趋势,高Cd条件下则呈先高后低的趋势。

|
| 图 2 花生叶片相对电导率和丙二醛含量 Figure 2 Relative electrolytic leakage and MDA content of shoots of peanut |
Cd胁迫会造成植物的自由基过氧化损伤,加剧植物体内膜脂过氧化作用,导致植物中MDA的含量增加,MDA积累越多表明植物的保护能力越弱。由图 2B可以看出,施Se对植物MDA有显著影响,且不同浓度效果存在差异。低Cd条件下施Se对花生MDA积累影响不显著。当Cd浓度为30 mg·kg-1,Se浓度为0 mg·kg-1时,花生叶片MDA含量显著上升。高Cd条件下,随着施Se浓度增加,MDA含量呈先降低后升高的趋势,MDA含量分别下降了33.15%、23.12%和15.71%。
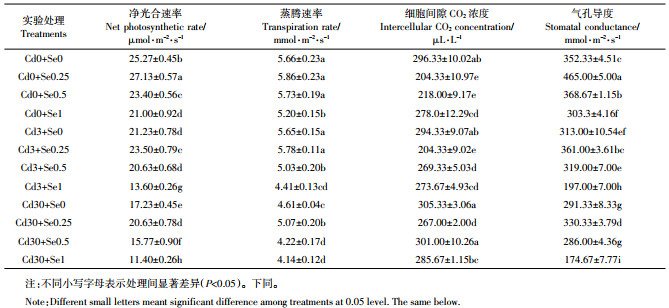
2.4 花生的光合特性Cd胁迫下施Se对花生光合特性的影响如表 1所示。由表 1可以看出,单一Cd浓度条件下,随着Cd浓度的增大花生的净光合速率呈递减的趋势。与对照相比Cd3和Cd30处理组分别降低了15.99%和31.82%。不同Cd浓度条件下,随着施Se浓度增加花生净光合速率均呈先增高后降低的趋势,且在Se浓度为0.25 mg·kg-1时花生净光合速率提升最显著。低Cd条件下施加0.25 mg·kg-1 Se花生净光合速率提升了10.69%,高Cd条件下提升了19.73%。低Cd胁迫对花生蒸腾速率无显著影响,高Cd胁迫显著降低了花生叶片的蒸腾速率。低Cd及高Cd条件下,随施Se浓度增加,蒸腾速率均呈现先增高后降低的趋势,且在Se浓度为0.25 mg·kg-1时蒸腾效率最高。低Cd对细胞间CO2浓度无显著影响,施Se后呈先降低后升高的趋势,当Se浓度为0.25 mg·kg-1时细胞间CO2浓度最低。Cd胁迫降低了花生的气孔导度,施Se后呈先升高后降低的规律,且在Se浓度为0.25 mg·kg-1时效果最显著。
|
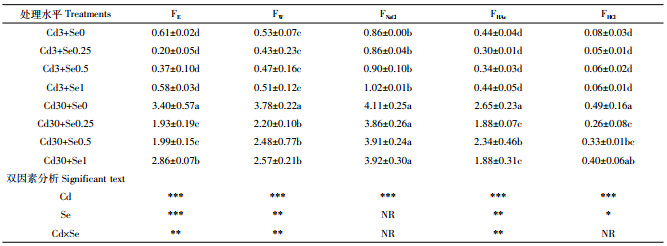
由表 2可以看出,花生根系Cd含量高于地上部分。施Se可以显著减低花生地上部分及根系中的Cd含量,且Se浓度为0.25 mg·kg-1时效果最显著。低Cd条件下施加0.25 mg·kg-1 Se使花生地上部分及根系Cd含量分别下降了12.71%和46.13%;高Cd条件下则分别下降了21.29%和36.00%。Cd浓度为30 mg·kg-1时,随着施Se量增加,花生叶片Cd含量呈先降低后升高的趋势,根系则在Se浓度为0.25 mg·kg-1和1 mg·kg-1时显著下降。双因素分析表明,单独Cd处理,单独Se处理及Cd与Se交互均对花生植株内Cd含量有极显著的影响。
植物对重金属的耐受程度及重金属在植物体内的迁移特性通常与重金属的化学形态关系密切。结果显示(表 3),花生地上部分大体呈现出FNaCl态含量最高,FW、FHAc、FE次之,FHCl最低的规律。根系在无Cd和低Cd条件下FNaCl态最高,FW和FE次之,随后FHAc、FHCl含量最低(表 4)。而高Cd条件下根系FHAc含量显著上升。各形态Cd含量远高于叶片。随着Cd浓度的上升,不同形态Cd含量均有所升高。通过双因素分析可以看出,对于花生叶片中FNaCl主要受Cd浓度变化影响,而单独Se浓度及Se、Cd交互处理对其均无显著影响。此外,Se、Cd交互对FHCl影响不显著。对于花生根系而言,不同处理对根系中的各形态Cd含量均有极显著影响(P<0.001)。
|
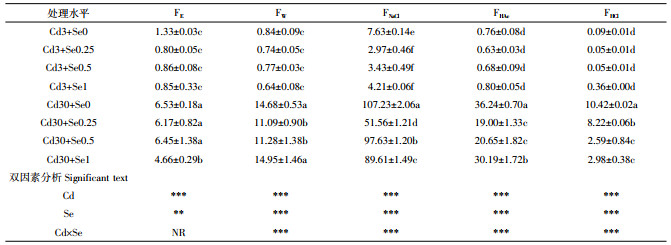
|
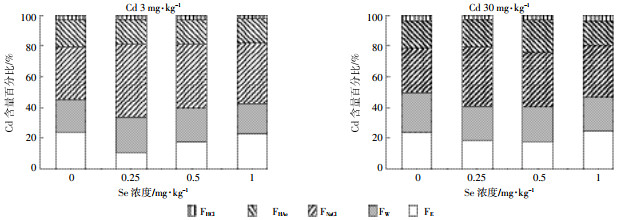
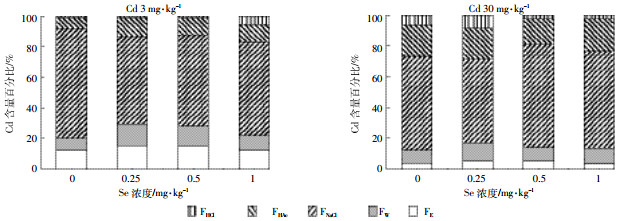
由图 3可以看出,在Cd3处理组,随着Se浓度的增加,花生叶片FNaCl所占百分比从34.32%上升至46.92%、42.25%、39.68%。在Cd30处理组,花生叶片FNaCl所占百分比从26.68%上升至38.24%、35.39%、33.64%。由图 4可以看出,在不同Cd浓度下,随施Se浓度增加,叶片FNaCl呈现先增加后降低的趋势,而根系则先降低后升高。当根系中FNaCl降低时,FHAc分配比例上升。其他形态Cd分配比例变化不大。这说明不同Cd浓度条件下,施硒增加叶片中惰性Cd,减少Cd的迁移。而根系中除FNaCl影响较大外,FHAc也是影响花生根系Cd含量的重要因素。
|
| 图 3 花生叶片内不同化学形态Cd含量百分比 Figure 3 Percent distribution of different chemical forms of Cd in leaves of peanut |
|
| 图 4 花生根系内不同化学形态Cd含量百分比 Figure 4 Percent distribution of different chemical forms of Cd in roots of peanut |
研究表明,Cd会对植物造成毒害,施Se可以提升植物抗逆性,缓解Cd胁迫。在本研究中,施Se后花生叶片生物量呈先升高后下降的趋势,且在低Cd浓度下施加0.25 mg·kg-1 Se效果最显著。低Cd条件下根系生物量呈递增趋势,而高Cd浓度下,根系生物量则呈先升高后降低的趋势,且在Se浓度为0.25 mg·kg-1时生物量达到最大值。这与王海男等[11]的研究一致,即施加微量Se可以促进作物生长。Cd胁迫的毒害作用往往体现为对细胞膜的损害,生成过量自由基。丙二醛是膜脂过氧化的产物,其含量可表征细胞膜受害程度[12]。本实验结果表明,Cd胁迫对花生产生了毒害作用,施Se显著降低了叶片电导率;高Cd浓度下,随着施Se浓度增加MDA含量先降低后升高,这说明低浓度Se缓解了Cd的毒害作用。但高浓度Se反而增强了叶片的过氧化,这可能是由于施Se提高了花生叶片中CAT、SOD和POD等酶的活性,且增加了谷胱甘肽过氧化物酶,从而减少因自由基过氧化引起的细胞膜的损害[13]。另外,不合理施加Se及作物Se耐受性的不同也可导致高浓度Se对作物造成损害[14]。
光合作用是植物生长的基础。适量施Se可以缓解Cd对光合作用的抑制作用[15]。这可能是Se提高了部分酶抗氧化能力,从而增强了植物的抗逆性[16-17]。有研究表明,逆境胁迫下使植物光合作用受阻可能由气孔限制和非气孔限制两种因素导致。Farquhar等[18]认为,当气孔导度下降时,细胞间CO2浓度下降,才表明光合作用受到气孔限制的影响。本研究显示,在低Cd和高Cd条件下,随施Se浓度的增加,花生净光合速率呈先升高后下降的趋势。施加Se 0.5 mg·kg-1和1.0 mg·kg-1,气孔导度与细胞间CO2浓度变化呈相反的趋势,这说明它们光合效率是受非气孔限制因素的影响。
适量施Se可以降低重金属含量。有研究表明施Se可以降低小麦体内砷含量和大蒜体内汞含量[19-20]。本实验研究结果表明,不同Cd条件下施加0.25 mg·kg-1 Se对花生Cd含量有显著影响。这可能是由于施Se诱导产生特殊蛋白,与花生体内Cd螯合,或是增加了惰性态Cd的含量,从而降低了植物体内Cd的含量[21]。植物体内重金属含量分布常与其化学形态密切相关。重金属在植物体内分为活性态和非活性态两种形态。活性态有水溶性态、离子交换态等。非活性态有氯化钠态、盐酸盐态、醋酸盐态、残渣态等[22]。氯化钠主要提取活性较低与蛋白结合的重金属[23]。本实验中花生地上部分及根系中Cd主要以氯化钠态存在,乙酸态、水提取态次之。这表明有相当一部分Cd形成了活性较低的难溶性化合物,自由态的Cd含量相对较低,以致它的毒害作用变小[24]。低Cd及高Cd条件下,施Se使叶片内FNaCl含量呈先生高后降低的趋势,施加适量Se使更多的Cd固定于叶片的细胞壁中。此外,液泡储存重金属也被认为是植物耐受性的重要机制[25]。研究表明,施Se后根系中FW百分含量先上升后下降,说明根系中还有部分Cd固定于液泡中。Cd污染条件下施加适量Se可以使花生体内Cd的迁移能力降低,减少细胞膜过脂化作用,增强光合速率,缓解Cd的胁迫作用。
4 结论(1)Cd胁迫会影响花生的生长发育。施Se可以缓解Cd胁迫对光合作用的抑制,减小对生物量的影响,降低叶片细胞膜透性和丙二醛含量。
(2)低Cd条件下,施Se显著降低了花生叶片及根系Cd含量,高Cd条件下,随施Se浓度增加叶片呈先降低后升高的趋势,根系则呈现降低趋势。
(3)土壤中加入Se溶液,花生根系中活性、毒性较高的乙醇提取态和水提取态Cd比例减少,而活性较弱、毒性较低的Cd提取态比例增加,这有利于降低Cd对花生植株的相对毒性。因此,Se对Cd化学形态转化可能是花生施硒后应对Cd胁迫的重要机制之一。
| [1] |
Burger J. Assessment and management of risk to wildlife from cadmium[J]. Science of the Total Environment, 2008, 389(1): 37-45. DOI:10.1016/j.scitotenv.2007.08.037 |
| [2] |
李娟, 史衍玺. 富Se花生中Se的赋存形态研究[J]. 食品科学, 2012, 33(21): 57-59. LI Juan, SHI Yan-xi. Analysis of selenium speciation in Se-rich peanuts[J]. Food Science, 2012, 33(21): 57-59. |
| [3] |
王凯荣, 张磊. 花生Cd污染研究进展[J]. 应用生态学报, 2008, 19(12): 2757-2762. WANG Kai-rong, ZHANG Lei. Research advances in cadmium pollution of peanut[J]. Chinese Journal of Applied Ecology, 2008, 19(12): 2757-2762. |
| [4] |
Lenz M, Lens P N L. The essential toxin:the changing perception of selenium in environmental sciences[J]. Science of the Total Environment, 2009, 407(12): 3620-3633. DOI:10.1016/j.scitotenv.2008.07.056 |
| [5] |
Paul D, Dey S. Selenium content and uptake in crops as affected by soil selenium content and implications on human health[J]. Communications in Soil Science and Plant Analysis, 2014, 45(4): 429-436. DOI:10.1080/00103624.2013.872251 |
| [6] |
彭玲, 贾芬, 田小平, 等. 硒对油菜根尖镉胁迫的缓解作用[J]. 环境科学学报, 2015, 35(8): 2597-2604. PENG Ling, JIA Fen, TIAN Xiao-Ping, et al. The role of selenium in alleviating cadmium stress on root tip of rape seedlings[J]. Acta Scientiae Circumstantiae, 2015, 35(8): 2597-2604. |
| [7] |
Qing X J, Zhao X H, Hu C X, et al. Selenium alleviated chromium toxicity by preventing oxidative stress in cabbage(Brassica campretris L.ssp.Pekinessis) leaves[J]. Ecotoxicology and Environmental Safety, 2015, 114: 179-189. DOI:10.1016/j.ecoenv.2015.01.026 |
| [8] |
刘春梅, 罗盛国. 硒对镉胁迫下寒地水稻镉含量与分配的影响[J]. 植物营养与肥料学报, 2015, 21(1): 190-199. LIU Chun-mei, LUO Sheng-guo. Effects of Se on Cd content and distribution in rice plant under Cd stress in cold climate[J]. Journal of Plant Nutrition and Fertilizer, 2015, 21(1): 190-199. DOI:10.11674/zwyf.2015.0121 |
| [9] |
宋敏, 徐文竞. 外源脯氨酸对镉胁迫下小麦幼苗生长的影响[J]. 应用生态学报, 2013, 24(1): 129-134. SONG Min, XU Wen-jing. Effects of exogenous proline on the growth of wheat seedlings under cadmium stress[J]. Chinese Journal of Applied Ecology, 2013, 24(1): 129-134. |
| [10] |
吕选忠, 宫象雷. 叶面喷施锌或硒对生菜吸收镉的拮抗作用研究[J]. 土壤学报, 2006, 43(5): 868-870. LÜ Xuan-zhong, GONG Xiang-lei. Antagonistic effect of foliar application of Se or Zn on absorption of Cd in lettuce[J]. Acta Pedologica Sinica, 2006, 43(5): 868-870. |
| [11] |
王海南, 刘汉湖. 硒对油菜镉中毒缓解作用的研究[J]. 山东农业科学, 2012, 44(4): 62-64. WANG Hai-nan, LIU Han-hu. Research on alleviation of cadmium pollution to rape by selenium[J]. Shandong Agricultural Sciences, 2012, 44(4): 62-64. |
| [12] |
Li Y H, Sun H F, Li H R, et al. Dynamic changes of rhizosphere properties and antioxidant enzyme responses of wheat plants(Triticum aestivum L.) grown in mercury-contaminated soils[J]. Chemosphere, 2013, 93(6): 972-977. DOI:10.1016/j.chemosphere.2013.05.063 |
| [13] |
翁伯琦, 黄东风, 熊德忠, 等. 施用硒肥对圆叶决明生长、酶活性及其叶肉细胞超显微结构的影响[J]. 生态学报, 2004, 24(12): 2810-2817. WENG Bo-qi, HUANG Dong-feng, XIONG De-zhong, et al. Effects of selenium on plant growth, enzyme activity and blade cell submicro-structure of Chamaecrista rotundifolia[J]. Acta Ecologica Sinica, 2004, 24(12): 2810-2817. DOI:10.3321/j.issn:1000-0933.2004.12.021 |
| [14] |
Feng R W, Wei C Y. Antioxidative mechanisms on selenium accumulation in Pteris vittata L.a potential selenium phytoremediation plant[J]. Plant Soil Environ, 2012, 58(3): 105-110. DOI:10.17221/PSE |
| [15] |
Pagliano C, Raciolo M, Vecchia F D, et al. Evidence for PS Ⅱdonor-side damage and photoinhibition induced by cadmium treatment on rice(Oryza sativa L.)[J]. Journal of Photochemistry and Photobiology B:Bioligy, 2006, 84(1): 70-78. DOI:10.1016/j.jphotobiol.2006.01.012 |
| [16] |
Kumar M, Bijo A J, Baghel R S, et al. Selenium and spermine alleviate cadmium induced toxicity in the red seaweed Gracilaria dura by regulating antioxidants and DNA methylation[J]. Plant Physiology and Biochemistry, 2012, 51: 129-138. DOI:10.1016/j.plaphy.2011.10.016 |
| [17] |
Malik J A, Goel S, Kaur N, et al. Selenium antagonises the toxic effects of arsenic on mungbean(Phaseolus aureus Roxb.) plants by restricting its uptake and enhancing the antioxidative and detoxification mechanisms[J]. Environmental and Experimental Botany, 2012, 77: 242-248. DOI:10.1016/j.envexpbot.2011.12.001 |
| [18] |
Farquhar G D, Sharkey TD. Stomatal conductance and photosynthesis[J]. Annu Review of Plant Physiology, 1982, 33: 317-345. DOI:10.1146/annurev.pp.33.060182.001533 |
| [19] |
Hu Y, Huang Y Z, Liu Y X, et al. Interactive effects of different inorganic As and Se species on their uptake and translocation by rice(Oryza sativa L.) seedlings[J]. Environmental Science and Pollution Research, 2014, 21: 3955-3962. DOI:10.1007/s11356-013-2321-6 |
| [20] |
Zhao J T, Gao Y X, Li Y F, et al. Selenium inhibits the phytotoxicity of mercury in garlic(Alhum sativum)[J]. Environmental Research, 2013, 125: 75-81. DOI:10.1016/j.envres.2013.01.010 |
| [21] |
He J Y, Ren Y F, Zhu C, et al. Effects of cadmium stress on seed germination, seedling growth and seed amylase activities in rice(Oryza sativa)[J]. Rice Science, 2008, 15(4): 319-325. DOI:10.1016/S1672-6308(09)60010-X |
| [22] |
熊仕娟, 刘俊, 徐卫红, 等. 外源硒对黄瓜抗性、镉积累及镉化学形态的影响[J]. 环境科学, 2015, 36(1): 286-294. XIONG Shi-juan, LIU Jun, XU Wei-hong, et al. Effect of exogenous selenium on accumulation and chemical forms of cadmium in cucumber(Cucumis satiuus L.)[J]. Environmental Science, 2015, 36(1): 286-294. |
| [23] |
周小勇, 仇荣亮, 李清飞, 等. 锌对长柔毛委陵菜中铅的分布和化学形态的影响[J]. 环境科学学报, 2008, 28(10): 2064-2071. ZHOU Xiao-yong, QIU Rong-liang, LI Qing-fei, et al. Effects of zinc on distribution and chemical form of lead in Potentilla griffithii var.velutina[J]. Acta Scientiae Circumstantiae, 2008, 28(10): 2064-2071. DOI:10.3321/j.issn:0253-2468.2008.10.021 |
| [24] |
Zembala M, Filek M, Walas S, et al. Effect of selenium on macro-and microelement distribution and physiological parameters of rape and wheat seedlings exposed to cadmium stress[J]. Plant and Soil, 2009, 329(1/2): 457-468. |
| [25] |
Da -Rosa -Correa A X, Rorig L R, Verdinelli M A, et al. Cadmium phytotoxicity:Quantitative sensitivity relationships between classicalendpoints and antioxidative enzyme biomarkers[J]. Science of the Total Environment, 2006, 357(1/2/3): 120-127. |
 2018, Vol. 37
2018, Vol. 37