文章信息
- 张弦, 王宇晖, 赵晓祥, 沙懿
- ZHANG Xian, WANG Yu-hui, ZHAO Xiao-xiang, SHA Yi
- 微电场人工湿地系统对水中重金属CdZn和Cu去除效果的研究
- The removal effect of Cd, Zn, and Cu using a micro-electric field constructed wetland system
- 农业环境科学学报, 2018, 37(6): 1211-1218
- Journal of Agro-Environment Science, 2018, 37(6): 1211-1218
- http://dx.doi.org/10.11654/jaes.2017-1410
文章历史
- 收稿日期: 2017-10-18
- 录用日期: 2018-01-08
重金属污染是水体污染中危害最大的问题之一。由于重金属具有难降解、富集性强和污染持续时间长的特点,严重威胁着人类与水体生物的生存[1]。目前,处理水体重金属污染的方法可以分为三大类。一是物理处理法,包括离子交换法、吸附法、膜分离法、蒸发和凝固法、电渗析法等。二是化学治理法,是通过化学反应使重金属元素与其他物质结合,沉积下来,从而阻断其传播,达到治理污染的目的,包括化学沉淀法、化学还原法、电化学还原和高分子重金属捕集剂法等。三是生物修复法,是通过微生物和植物的吸收、富集、积累等作用去除废水中重金属的方法,包括生物吸附、生物絮凝、生物膜和植物修复法等[2-3]。
根据各种重金属处理方法去除机理的不同,对重金属废水处理的效果和应用范围也存在很大的差异。传统的物理、化学方法处理重金属废水虽然操作方法简单,但运行费用高、投资大、易造成二次污染,处理对象主要是高浓度重金属废水[4-5]。生物处理法虽然具有效率高、成本低、二次污染少、有利于生态环境的改善等优点,但微生物培养和驯化时间长,抗污负荷能力有限,对于高浓度废水的长期净化效果不佳[6]。因此,在实际处理重金属废水的应用中,单一的处理方法不能达到令人满意的去除效果,多种污水处理技术联用成为一个新型的研究切入点,如高效藻塘藻菌共生系统与人工湿地联用,已成为低成本水处理技术的重要选择之一[7];微生物与电化学反应联用,形成微生物电化学系统(BES)[8]。
近年来,人工湿地处理重金属废水成为国内外研究的热点。人工湿地具有低能耗、低投入、低管理费用和强抗冲击力等优点,是一种集环境效益、经济效益及社会效益为一体的污水处理技术[9-10]。人工湿地利用基质、微生物及动植物群落的物理、化学和生物的相互作用,通过基质的吸附、沉淀和离子交换,微生物分解和植物吸收富集等过程,实现对废水中重金属离子的去除[11]。传统电解法能够实现重金属废水的处理和资源化,且具有工艺成熟、自动化程度高、运行成本低、占地面积小、无二次污染等优点[12]。鉴于人工湿地与电解法对重金属废水处理有着各自的优势,本次研究考虑将二者结合,构建微电场-人工湿地耦合系统,即在人工湿地的基础上施加一定强度的直流电场,通过二者间相互作用达到更佳的重金属去除效果。本文通过模拟实验研究不同运行条件下人工湿地对重金属的去除效果,寻找处理重金属废水的最佳条件。
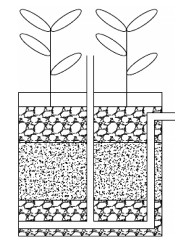
1 材料与方法 1.1 试验装置与运行试验选择水葱(S. tabernaemontani)和灯芯草(J. roemerianus)作为湿地植物,每个人工湿地装置中种植30株共350 g左右、高0.8 m的湿地植物,植物生长两周后开始进行试验。单个人工湿地试验装置如图 1所示,由一个直径20 cm、高20 cm的黑色塑料桶组成,底层铺有4 cm深、直径4~6 mm的砾石,中间铺设10 cm厚、直径0.5~1 mm的砂石,最上层铺有4 cm深、直径4~6 mm的砾石,整个装置平均孔隙率为32.3%。装置底部安装一根内径8 mm的硬塑料管,表面均匀分布了12个圆孔用于收集试验用水。为保持湿地系统始终处于水饱和状态,出水口设置在距桶底15 cm处。湿地用水从人工湿地填料表面流入湿地,渗透至装置底部,经由装置底部塑料管的收集,在水压作用下由出水口排出。装置内部紧靠桶壁两侧设置两根长20 cm的石墨电极棒,电源采用安泰信APS3005Si型直流稳压电源。
|
| 图 1 试验装置示意图 Figure 1 Experimental set-up |
水葱和灯芯草人工湿地生态系统装置分别由15个这样的人工湿地装置组成,试验装置分为5组,每组包含3个平行样,分别为不加电极不种植物的空白组和种植物施加电压分别为0、1、2 V和4 V的实验组。重金属废水储存于一个300 L的黑色不透光塑料桶中,在兰格BT100-1L的16通道蠕动泵的作用下依次传输进入各个人工湿地中。考虑到不同水力停留时间对人工湿地去除废水中重金属效率的影响,本试验还设计了5个水力停留时间(0.5、1、2、4 d和5 d),用蠕动泵调节进水流速,每调整一次水力停留时间,人工湿地系统需进行3次水力停留时间的稳定期再进行试验。整个试验在实验室内进行,人工湿地上方2 m处架设补光灯,弥补室内试验造成的植物光照量的不足。
1.2 试验用水试验用水采用人工模拟重金属废水,用去离子水进行配制,所用试剂及重金属废水浓度如表 1所示。废水pH=6.3~6.6,调节pH所用试剂为盐酸、氢氧化钠溶液。试验所用有机污水由葡萄糖、氯化铵、硝酸钾、磷酸二氢钾配制。污水中COD浓度为60 mg·L-1,总氮浓度为20 mg·L-1,总磷浓度为1.5 mg·L-1。
出水水样通过0.45 μm滤膜过滤,弃去初始的50 mL溶液,收集50 mL体积滤液后加硝酸酸化,调节其pH<2,用聚乙烯瓶存储,用ICP-MS测定水样中各种重金属浓度。
1.3.2 植物样本预处理整个试验结束后,将植物取出用自来水和去离子水反复冲洗,晾干后将植物的根与茎叶分离,分别剪碎并于80 ℃烘箱中干燥24 h,粉碎。分别称取1 g植物样品于250 mL锥形瓶中,加V(硝酸):V(高氯酸)为4:1的混合酸消化液20~30 mL,静置过夜,置于电热板上加热消化至无色透明为止,加5 mL去离子水,加热去除多余硝酸。待锥形瓶中液体剩余2~3 mL时,取下冷却并转移至25 mL比色管中,去离子水定容至刻度。用ICP-MS测定重金属浓度。
1.3.3 植物重金属富集系数与转移系数的计算[13]重金属富集系数(Bioconcentration Factor,BCF)是指植物某一部位的重金属元素浓度与人工湿地进水水溶液中同一种重金属元素浓度的比值。其计算公式为:

式中:C植物体为植物体内某一部位(根、茎、叶)的重金属元素浓度,mg·kg-1;C水溶液为人工湿地进水中对应的重金属元素浓度,mg·L-1。
重金属转移系数(Transfer Factor,TF)是指植物地上部位的重金属浓度与相应重金属在植物地下部位的浓度之比。其计算公式为:
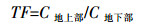
式中:C地上部为植物地上部位(茎和叶)的重金属元素浓度,mg·kg-1;C地下部为植物地下部位(根)相应重金属元素浓度,mg·kg-1。
1.4 数据统计分析采用Microsoft Excel 2013对数据进行初步处理和绘图,采用SPSS 22进行数据的统计分析,主要分析数据的标准误差以及水力停留时间和电压的主体间效应检验。
2 结果与分析 2.1 两种植物对不同重金属的去除效率 2.1.1 重金属Cd的去除率在不同电压下,种植水葱的微电场人工湿地对重金属Cd的去除率随水力停留时间的增加而逐渐增加(图 2A)。在水力停留时间为0.5 d时,Cd的去除率仅为16.7%~39%;当水力停留时间增加到5 d时,Cd的去除率达到了41.1%~74%。可见,水力停留时间对重金属Cd的去除效果影响显著(F=7.13,P<0.05)。另外,随着人工湿地施加电压的增加,湿地对重金属Cd的去除率也有变化,总体呈现先上升后下降的趋势,且在2 V左右的电压条件下重金属去除率最高(图 2A)。不施加电压时,种植水葱的人工湿地对重金属Cd的去除率仅为16.7%~41.1%;而施加电压为2 V时,重金属Cd的去除率提升至42.6%~73.7%。因此,施加电压可以显著增加Cd的去除效果(F=31.185,P<0.05)。水力停留时间和电压的改变对种植灯芯草的人工湿地去除Cd的效果的影响与种植水葱的人工湿地相比略有不同(图 2B)。随水力停留时间的增加,种植水葱的微电场人工湿地对Cd的去除效率也有所增加,但增加幅度不大,最多增加了23.1%,且水力停留时间为2 d以上时,水力停留时间的增加对重金属Cd的去除率的增加并无明显的促进作用。另外,施加电压后灯芯草湿地对Cd的去除也有一定程度的增强,且在2~4 V电压之间表现最强。

|
| 图 2 两种湿地在不同电压与水力停留时间条件下对Cd的去除率 Figure 2 The removal rate of Cd in two types of wetlands under different voltage and hydraulic retention time |
种植水葱的微电场人工湿地与种植灯芯草的微电场人工湿地在不同水力停留时间的条件下对重金属Zn的去除率有所不同,但总体表现为逐渐上升的趋势(图 3)。其中种植水葱的微电场人工湿地对Zn的去除从20.4%~61.6%提升至45.7%~80.1%,而种植灯芯草的微电场人工湿地则是从8.7%~26.1%升至23.2%~41.6%。可见,水力停留时间对种植两种植物的微电场人工湿地的Zn去除率都有所增强,但对种植水葱的人工湿地的促进作用更加显著(F=18.617,P<0.05)。电压对两种微电场人工湿地去除重金属Zn的影响有所不同。随着电压的增加,种植水葱的人工湿地对重金属Zn的去除率也在增加(图 3A),最大去除率出现在施加4 V电压时,去除率达到45.7%~80.1%(F=19.279,P<0.05)。而种植灯芯草的人工湿地则表现为随施加电压的增加去除率先上升后下降的趋势(图 3B),最高去除率出现在2 V,去除率达到了23.2%~41.6%,相对不施加电压时平均增加了14.02%,去除效果显著(F=13.71,P<0.05)。所以水力停留时间与电压对水葱人工湿地去除Zn均有促进作用且促进程度相当,但施加电压对灯芯草人工湿地去除Zn有更明显的促进作用。种植水葱的微电场人工湿地比种植灯芯草的微电场人工湿地对重金属Zn有更高的去除效率。
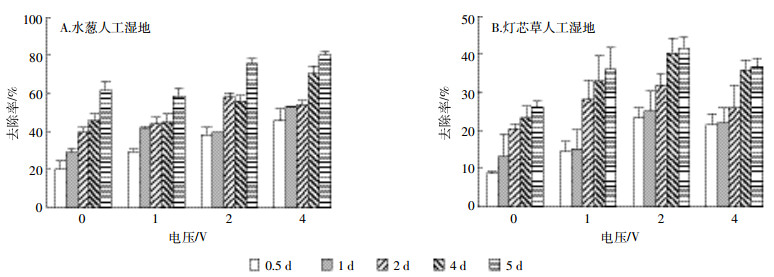
|
| 图 3 两种湿地在不同电压与水力停留时间条件下对Zn的去除率 Figure 3 The removal rate of Zn in two types of wetlands under different voltage and hydraulic retention time |
种植两种植物的微电场人工湿地对重金属Cu的去除都保持在较高水平(图 4)。种植水葱的微电场人工湿地对重金属Cu的去除效率均在80%以上,且水力停留时间和电压对人工湿地去除Cu无明显的促进作用(对种植水葱的微电场人工湿地的Cu去除率进行了两因素方差分析,两种因素P值均大于0.05)。种植灯芯草的微电场人工湿地对Cu的去除率比种植水葱的微电场人工湿地要低,但也都保持在55%以上。与种植水葱的人工湿地不同,种植灯芯草的人工湿地对Cu的去除受电压影响较大(图 4B)(P<0.05)。随施加电压的增加,种植灯芯草的人工湿地对Cu的去除率呈先上升后下降的趋势,并在2 V左右去除率最高,从不加电压的55%~64.9%升高至64.6%~77.1%。但水力停留时间对增强种植灯芯草的微电场人工湿地去除重金属Cu无显著影响。
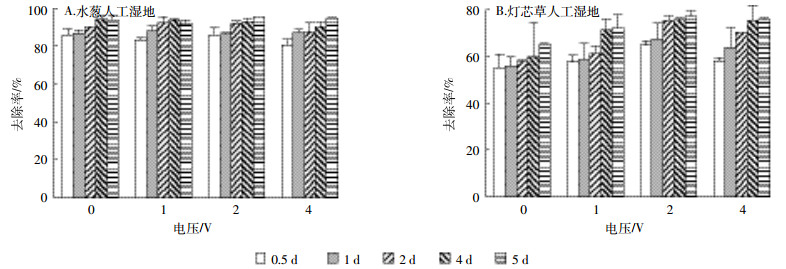
|
| 图 4 两种湿地在不同电压与水力停留时间条件下对Cu的去除率 Figure 4 The removal rate of Cu in two types of wetlands under different voltage and hydraulic retention time |
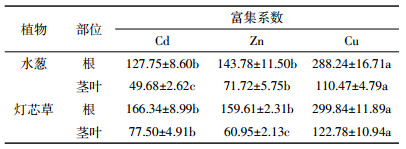
两种植物体内不同重金属含量存在较大的差异,其结果见表 2。由表 2可知,两种植物体内各种重金属含量表现为Zn>Cu>Cd。比较两种植物不同部位的重金属(Cd、Zn、Cu)含量发现,重金属含量存在较大的差异。灯芯草的根部对Cd、Zn、Cu 3种重金属的富集能力最高,其值分别为16.86、634.31、589.13 mg·kg-1,而水葱的茎部对Cd的富集能力最弱,其值为5.04 mg·kg-1。灯芯草比水葱对这3种重金属有更强的吸收能力。

|
植物对重金属的富集能力可以用富集系数来表示[14],富集系数是植物根组织或茎叶组织中重金属的富集浓度与水体中重金属浓度的比,它是衡量植物对重金属积累能力大小的一个重要指标,富集系数越大,表示植物对该元素从土壤迁移到植物体内的能力越强,其富集能力越强[15-16]。
由表 3的根茎叶富集系数可以看出,两种水生植物对Cd、Zn、Cu的富集能力都很强,根茎叶的富集系数都大于1。不同植物对同一重金属的富集能力有所差异,灯芯草对Cd的富集能力较水葱强,其根部富集系数为166.34,茎叶富集系数为77.50。两种植物对Zn的富集表现与对Cd的略有不同,虽然水葱根部的富集能力比灯芯草的较弱,富集系数仅是灯芯草的0.90倍,但是水葱茎叶的富集能力却高于灯芯草,富集系数是灯芯草的1.18倍。两种植物对Cu的富集能力都很强,根部富集系数都高于200,茎叶富集系数也都高于100。但相对来说,灯芯草的富集能力较水葱略强。同种植物对不同重金属的富集能力亦有着明显的差异,从两种植物对3种重金属富集系数比较的结果中可以看出,水葱和灯芯草对Cu的富集能力明显高于Cd和Zn。就根部富集系数来说,水葱对Cu的富集系数是Cd的2.26倍,是Zn的2.00倍,灯芯草根部对Cu的富集系数是299.84,远高于对Cd(166.34)和Zn(159.61)的富集系数。水葱对3种重金属富集能力按从强到弱依次是Cu>Zn>Cd,而灯芯草对3种重金属富集能力则是Cu>Cd>Zn。从同种植物的茎叶和根部重金属富集系数来看,水葱和灯芯草两种植物的根部富集系数都大于茎叶富集系数,这可能是因为植物将水体中重金属滞留在根部,是植物对重金属的一种适应[17]。
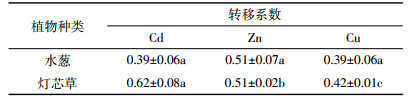
转移系数是植物体内地上部分重金属含量与地下部分该重金属含量之比[18]。它能够体现植物从地下部分向地上部分运输重金属的能力和分配情况。
由表 4两种植物对3种重金属的转移系数比较发现,水葱和灯芯草对3种重金属的转移能力都很弱,转移系数都小于1。同种植物对不同重金属的转移能力有所不同,水葱对Zn的转移能力较大,转移系数为0.51,对另外两种金属的转移系数均小于0.4,差异不显著。灯芯草对3种重金属的转移能力相差较大,转移系数从大到小依次是Cd>Zn>Cu,差异显著。
人工湿地主要利用基质、微生物及动植物群落的物理、化学和生物的相互作用,通过基质的吸附、沉淀和离子交换,微生物分解和植物吸收富集等过程,实现对废水中重金属离子的去除。
水力停留时间的增加,能够增加湿地生态系统与水体中重金属离子发生反应的时间,达到重金属去除的目的。研究[19]表明,水平流人工湿地停留时间为7 d时,重金属Pb、Cd和Cu的去除率仅在30%左右;当超过150 d时,去除效率均达到了99%[20]。但是,随着湿地内基质吸附、反应能力渐趋饱和,各种物理、化学、生物反应完全,水力停留时间的加长并不能对重金属的去除起到促进作用。
人工湿地植物对重金属具有富集与转移作用。植物体对重金属的去除机制主要包含3个方面:①直接对重金属的吸收、富集。植物生长过程中根系向基质中分泌低分子量有机酸,其能与重金属形成可溶性络合物,并通过根系吸收、富集。Sunghyun等[21]发现稗草根系的吸收累积在重金属去除过程中占主导作用,并在快速生长期出现累积峰值。②改善根区环境,促进重金属稳定和沉积。通过植物输氧和根区释氧作用,利于根区好氧微生物群落絮体的形成,促进对重金属的吸附稳定[22]。③植物根系能与微生物形成共生关系,对人工湿地基质起疏松所用,为微生物生长创造有利环境。微生物转化过程中产生的腐殖质能与重金属产生螯合作用,从而起到稳定去除效果[23]。不同水生植物对重金属的富集和转移能力有明显的差异,这与植物本身对各种重金属的吸收和储存能力有关。植物对重金属富集量的多少不仅与植物的种类有关,更与重金属的种类、元素价态、物质结构和溶解度等有关[24]。
3.2 微电场对人工湿地重金属修复效果的影响施加电压对人工湿地去除重金属有促进作用,这可能是因为电压既能够影响植物的生长发育和微生物活性,又可以影响人工湿地系统内微电场分布与电流密度,进而加强重金属离子的去除效果。有研究表明[25],对人工湿地施加一定的直流电能够增强基质流体传质,强化离子定向迁移,并且,适宜的电场能对微生物的代谢进行调节。同时,电流能够促进重金属元素被植物根系吸收,进而达到去除重金属的目的。已有研究表明电场能增加植物细胞表面持有的负电荷,从而提高细胞活性,促进细胞繁殖。Costanzo[26]研究电场对大豆种子发芽过程的影响,发现电场对植株细胞核的分裂和膜透性产生影响,适宜的电场能提高细胞分裂速度、缩短分裂周期,加速植株生长。赵剑等[27]对植物组织培养进行电场刺激实验,发现电场能够明显促进苜蓿叶片愈伤组织的发生和形成。
然而,过高的电压会对微生物活性产生抑制作用,降低植物体内生物酶活性,进而阻碍根系吸收金属离子[28]。电压越高,对湿地生物系统产生的副作用越大,重金属去除率也会随之降低。试验结果中不同重金属去除效果随电压变化有不同的表现,可能是因为不同种类的微生物代谢受电压影响的程度不同。
4 结论(1) 两种湿地在不同水力停留时间和电压条件下对3种重金属的去除效率从高到低依次为Cu>Zn>Cd,且水葱湿地对3种重金属有更好的去除效果。
(2) 人工湿地对重金属的去除效率随水力停留时间的增加有所提高,但随着湿地内基质吸附、反应能力渐趋饱和,水力停留时间的加长并不能对重金属的去除起到促进作用。
(3) 电压对系统处理重金属废水的处理效果影响显著,随电压升高,重金属去除率均呈先增后减的变化趋势,电压为2 V时去除效果较佳。
(4) 两种水生植物对3种重金属的富集能力有所差异,灯芯草的根和茎叶部分对3种重金属的吸收量都大于水葱。水葱对3种重金属富集系数按从大到小依次是Cu>Zn>Cd,而灯芯草对3种重金属富集系数则是Cu>Cd>Zn。灯芯草对3种重金属的吸收量比水葱多,其中灯芯草根部的吸收量最高。二者对这3种重金属的转移系数都小于1。
| [1] |
Begum A, Amin M N, Kaneco S, et al. Selected elemental composition of the muscle tissue of three species of fish, Tilapia nilotica, Cirrhina mrigala and Clarius batrachus, from the fresh water Dhanmondi Lake in Bangladesh[J]. Food Chemistry, 2005, 93(3): 439-443. DOI:10.1016/j.foodchem.2004.10.021 |
| [2] |
Ma Q. Advances in new technology for heavy metal wastewater treatment at home and abroad[J]. Chinese Journal of Environmental Engineering, 2007, 1(7): 10-14. |
| [3] |
白雁斌, 王天娇, 赵晓玉. 重金属废水处理技术研究进展[J]. 污染防治技术, 2013(3): 36-40. BAI Yan-bin, WANG Tian-jiao, ZHAO Xiao-yu. Research progress of heavy metal wastewater treatment technology[J]. Pollution Control Technology, 2013(3): 36-40. |
| [4] |
胡海祥. 重金属废水治理技术概况及发展方向[J]. 中国资源综合利用, 2008, 26(2): 22-25. HU Hai-xiang. Overview and development of heavy metal wastewater treatment technology[J]. China Resources Comprehensive Utilization, 2008, 26(2): 22-25. |
| [5] |
付丰连. 物理化学法处理重金属废水的研究进展[J]. 广东化工, 2010, 37(4): 115-117. FU Feng-lian. Research progress on treatment of heavy metal wastewater by physical chemistry[J]. Guangdong Chemical Industry, 2010, 37(4): 115-117. |
| [6] |
张兆伯, 解秀祥, 虢新利. 微生物法处理重金属废水[J]. 现代制造技术与装备, 2003(5): 30-30. ZHANG Zhao-bo, XIE Xiu-xiang, GUO Xin-li. Treatment of heavy metal sewage with micro-biological method[J]. Modern Manufacturing Technology and Equipment, 2003(5): 30-30. |
| [7] |
李宏伟. 高效藻塘与复合型人工湿地耦合系统处理重金属废水的研究[D]. 上海: 东华大学, 2015. LI Hong-wei. Study on treatment of heavy metal wastewater by coupling system of high efficiency algal pond and compound constructed wetland[D]. Shanghai: Donghua Univercity, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10255-1015032647.htm |
| [8] |
赵欣. SMFC-SMEC耦合系统去除废水中铜与镍离子的研究[D]. 哈尔滨: 哈尔滨工业大学, 2015. ZHAO Xin. Removal of Copper and nickel in wastewater by SMFC-SMEC coupling system[D]. Harbin: Harbin Institute of Technology, 2015. http://cdmd.cnki.com.cn/Article/CDMD-10213-1015982810.htm |
| [9] |
吴长淋. 人工湿地处理含重金属废水的研究现状及展望[J]. 化学工程师, 2009, 23(3): 38-41. WU Chang-lin. Recent research anti prospect of treating waste water containing heavy metals in constructed wetlands[J]. Chemical Engineer, 2009, 23(3): 38-41. |
| [10] |
Khan S, Ahmad I, Shah M T, et al. Use of constructed wetland for the removal of heavy metals from industrial wastewater[J]. Journal of Environmental Management, 2009, 90(11): 3451-3457. DOI:10.1016/j.jenvman.2009.05.026 |
| [11] |
周丽. 人工湿地污水处理技术研究和应用现状[J]. 工业用水与废水, 2016, 47(5): 8-12. ZHOU Li. Research and application of sewage treatment technology of constructed wetland[J]. Industrial Water & Wastewater, 2016, 47(5): 8-12. |
| [12] |
李洪伟, 安俊菁, 聂文斌. 电化学技术在有色冶金含重金属废水处理的运用与实践[J]. 云南冶金, 2015, 44(6): 74-78. LI Hong-wei, AN Jun-jing, NIE Wen-bin. The application and practice of electrochemical techniques on waste water with heavy metals in non-ferrous metallurgy[J]. Yunnan Metallurgy, 2015, 44(6): 74-78. |
| [13] |
Asheesh K Y, Rouzbeh A, Naresh K, et al. The removal of heavy metals in wetland microcosms:Effects of bed depth, plant species, and metal mobility[J]. Chemical Engineering Journal, 2012, s211/212(22): 501-507. |
| [14] |
Salt D E, Blaylock M, Kumar N P, et al. Phytoremediation:A novel strategy for the removal of toxic metals from the environment using plants[J]. Biotechnology, 1995, 13(5): 468-474. |
| [15] |
李庚飞. 4种植物对3种重金属的吸收研究[J]. 东北农业科学, 2013, 38(3): 86-88. LI Geng-fei. Studies on absorption of three kinds of heavy metal by four plant species[J]. Journal of Jilin Agricultural Sciences, 2013, 38(3): 86-88. |
| [16] |
尹士君, 汤金如. 人工湿地中植物净化作用及其影响因素[J]. 煤炭技术, 2006, 25(12): 115-118. YIN Shi-jun, TANG Jin-ru. Function of plants in artificial wetland[J]. Coal Technology, 2006, 25(12): 115-118. DOI:10.3969/j.issn.1008-8725.2006.12.056 |
| [17] |
Liu A F, Wu X H, He F, et al. Effect of different combination system of constructed wetland on zooplankton community structure[J]. Environmental Science, 2007, 28(2): 309-314. |
| [18] |
陈明利, 张艳丽, 吴晓芙, 等. 人工湿地植物处理含重金属生活废水的实验研究[J]. 环境科学与技术, 2008, 31(12): 164-168. CHEN Ming-li, ZHANG Yan-li, WU Xiao-fu, et al. Characteristics of selected wetland plant species for removal of Zn2+/Cd2+ from wastewater[J]. Environmental Science & Technology, 2008, 31(12): 164-168. DOI:10.3969/j.issn.1003-6504.2008.12.042 |
| [19] |
Cheng S, Grosse W, Karrenbrock F, et al. Efficiency of constructed wetlands in decontamination of water polluted by heavy metals[J]. Ecological Engineering, 2002, 18(3): 317-325. DOI:10.1016/S0925-8574(01)00091-X |
| [20] |
Khan S, Ahmad I, Shah M T, et al. Use of constructed wetland for the removal of heavy metals from industrial wastewater[J]. Journal of Environmental Management, 2009, 90(11): 3451-3457. DOI:10.1016/j.jenvman.2009.05.026 |
| [21] |
Sunghyun K, Hyewon L, Insook L. Enhanced heavy metal phytoextraction by Echinochloa crus-galli using root exudates[J]. Journal of Bioscience and Bioengineering, 2010, 109(1): 47-50. DOI:10.1016/j.jbiosc.2009.06.018 |
| [22] |
Iris V, Antoine V, Markus D, et al. Impact of plants on the microbial activity in soils with high and low levels of copper[J]. European Journal of Soil Biology, 2008, 44(1): 92-100. DOI:10.1016/j.ejsobi.2007.12.001 |
| [23] |
Isabel G, Amparo C, Alexander N, et al. Biodegradable chelate enhances the phytoextraction of copper by Oenothera picensis grown in copper-contaminated acid soils[J]. Chemosphere, 2011, 84(4): 490-496. DOI:10.1016/j.chemosphere.2011.03.015 |
| [24] |
周宁晖. 应用水生植物去除水中氮、磷及重金属的研究[D]. 南京: 南京理工大学, 2012. ZHOU Ning-hui. Study on the removal of nitrogen, phosphorus and heavy metal in water by using hydrophytes[D]. Nanjing: Nanjing University of Science and Technology, 2012. http://cdmd.cnki.com.cn/Article/CDMD-10288-1012319561.htm |
| [25] |
Rajnicek A M, Mccaig C D, Gow N A. Electric fields induce curved growth of Enterobacter cloacae, Escherichia coli, and Bacillus subtilis cells:Implications for mechanisms of galvanotropism and bacterial growth[J]. Journal of Bacteriology, 1994, 176(3): 702-713. DOI:10.1128/jb.176.3.702-713.1994 |
| [26] |
Costanzo E. The influence of an electric field on the growth of soy seedlings[J]. Journal of Electrostatics, 2008, 66(7): 417-420. |
| [27] |
赵剑, 马福荣. 静电场对芷苜蓿愈伤组织抗寒能力的影响[J]. 生物物理学报, 2000, 16(2): 406-412. ZHAO Jian, MA Fu-rong. Effects of high vorostatic fleld on cold acclimating ability of alfalfa(Medicago sativa L.) leaf callus[J]. Acta Biophysica Sinica, 2000, 16(2): 406-412. |
| [28] |
卢守波, 宋新山, 张涛. 微电场-人工湿地耦合工艺去除重金属研究[J]. 环境工程, 2011(增刊): 353-356. LU Shou-bo, SONG Xin-shan, ZHANG Tao. Study on heavy metal removal by micro-electric field constructed wetland[J]. Environmental Engineering, 2011(Suppl): 353-356. |
 2018, Vol. 37
2018, Vol. 37